
- •1. Механическое движение. Траектория, путь, перемещение. Система отсчета.
- •2. Равномерное и неравномерное прямолинейное движение. Скорость и ускорение.
- •1. ≠Const
- •3. Равномерное движение тела по окружности. Угловая и линейная скорость. Центростремительное ускорение.
- •4. Законы Ньютона.
- •5. Закон Всемирного тяготения.
- •6. Силы упругости. Виды сил упругости. Деформация. Закон Гука для упругодеформированного тела.
- •7. Силы трения. Виды сил трения.
- •8. Импульс тела и импульс силы. Второй закон Ньютона.
- •9. Закон сохранения импульса. Реактивное движение.
- •10. Работа сил.
- •11. Механическая энергия. Закон сохранения и превращения энергии в механике.
- •12. Основные положения м-к т., их опытное обоснование.
- •5. Молекулы одного и того же вещества в разных агрегатных состояниях одинаковы по своим химическим свойствам, а разных веществ – различны.
- •13. Строение твердых тел, жидкостей и газов.
- •14. Идеальный газ в м-к.Т. Основные уравнения м-к.Т.
- •15. Температура. Абсолютная температура. Шкала температур.
- •1. Шкала Цельсия. T˚с
- •2. Шкала Фаренгейта. Т˚f
- •16. Уравнение состояния идеального газа. Уравнение Менделеева-Клайперона.
- •17. Газовые законы.
- •18. Испарение и кипение. Насыщенный и ненасыщенный пар.
- •1.Испарение.
- •2.Высыхание влажных поверхностей.
- •2.Кипение.
- •19. Кристаллические и аморфные тела. Анизотропия и изотропия кристаллов
- •20. Влажность воздуха. Измерение влажности воздуха.
- •21. Упругая и пластичная деформация. Закон Гука.
- •22.Внутренняя энергия и способы ее изменения. Работа газа в изопроцессах.
- •26. Электризация тел. Закон сохранения электрического заряда. Закон Кулона. Правило квантования заряда.
- •29. Диэлектрики в электрическом поле.
- •30. Конденсаторы. Назначение, устройство и виды конденсаторов. Электроемкость. Энергия заряженного конденсатора.
- •31. Электрический ток. Действие тока. Условия существования тока. Электрическое напряжение. Электрическое сопротивление проводников. Удельное сопротивление. Закон Ома для участка цепи.
- •33. Работа и мощность эл.Тока. Закон Джоуля-Ленца.
- •36.Эл.Ток в полупроводниках
- •37.Эл.Ток в вакууме. Диод.
- •Ионизация газа-
- •39. Магнитное поле и его характеристика
- •40.Сила Лоренца. Траектория движения зар.Частиц.
- •41. Явление эл.Индукции. Правило Ленца.
- •42. Самоиндукция. Индуктивность
- •43.Гармонические колебания. Превращение энергии при колеб-ом движение. Резонанс.
- •44.Колебатльный контур.
- •Переме́нный ток — электр. Ток, который периодич изменяется по модулю и направлению.
15. Температура. Абсолютная температура. Шкала температур.
Равновесное состояние – состояние, при котором число молекул в определенном интервале скоростей остается постоянным. Это состояние газа характеризуется температурой.
Т – абсолютная t˚ - мера средней кинетической энергии движения молекул.
Формула, позволяющая перевести t˚ из энергетической меры в градусную: (m ²)/2=3/2*kT.
В системе СИ - t˚ выражают в градусах Кельвина.
Шкалы t˚:
1. Шкала Цельсия. T˚с
Опорные точки: 0˚С - t˚ замерзания воды или таяния льда; 100˚С - t˚ кипения воды при нормальном атмосферном давлении.
Водяные и спиртовые термометры показывают одинаковую t˚ только в опорных точках. Это связано с нелинейным увеличение объема при нагревании.
2. Шкала Фаренгейта. Т˚f
Опорные точки: 0˚F – наименьшая t˚, которую Фаренгейту удалось получить при замерзании смеси воды, льда и соли; 96˚F – нормальная t˚ тела человека.
Т˚F=32+1,8* t˚C
3. Шкала Кельвина. ТК – основная шкала, для измерения t˚в системе СИ.
Опорная точка: 0К - t˚ абсолютного нуля - t˚, при которой прекращается тепловое движение молекул.
ТК= t˚С+273
t˚С= -273˚С=0К
16. Уравнение состояния идеального газа. Уравнение Менделеева-Клайперона.
Пользуясь этим уравнение можно рассчитать массу газа в произвольном объеме.
Это уравнение связывает макроскопические параметры газа (Р, V, T, m) с микроскопическими параметрами, которые характеризуют не газ в целом, а каждую молекулу (mo, Vo, Po…).
Вывод уравнения:
p=nkT, n=N/V → p=(NkT)/V
υ=N/Na, υ=m/M → N/Na=m/M
N=(Na*m)/M
p=(Na*mkT)/MV
Na*k=R=8,314 Дж/моль*К – универсальная газовая постоянная.
p=( mTR)/MV
PV=m/M* RT → PV= υRT - уравнение Менделеева-Клайперона. Произведение давления газа на его объем прямопропорционально абсолютной температуре при постоянной массе газа.
1мм.р.ст.=133Па
Из уравнения Менделеева-Клайперона вытекает объединенный газовый закон:
PV/T=const, при m=const. Отношение произведения давления газа на его объем к абсолютной температуре есть величина постоянная при постоянной массе газа.
Н.у.
газа: Po=![]() Па,
То=273К
Па,
То=273К
17. Газовые законы.
Изопроцесс в газе - это процесс при котором один из макроскопических параметров(Р,V,T) остается постоянным, при постоянной массе газа.
1)Изотермический - это процесс в газе при постоянной температуре и массе.
Уравнение процесса:P*V=const- это уравнение Бойля Мариотта.(произведение давления газа на его объем есть величина постоянная, при постоянной температуре и массе газа. Зависимость между давлением и объемом обратная)
Графически этот процесс изображается изотермой - это линия, где в каждой точке Т=const.
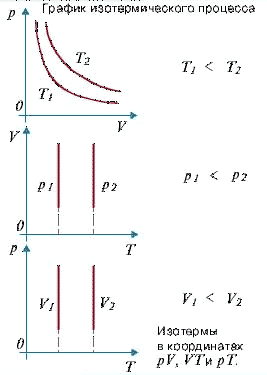
Объяснение закона с точки зрения М-к-т:
При уменьшении объема увеличивается число ударов молекул о стенки сосуда, т.к. при постоянной температуре скорость молекул остается постоянной.
2)Изобарический - это процесс в газе при постоянном давлении и массе.
Уравнение
процесса:
![]() =const
- это закон Шарля (отношение объема газа
к абсолютной температуре есть величина
постоянная при постоянном давлении и
массе газа. Зависимость между объемом
и температурой прямая)
=const
- это закон Шарля (отношение объема газа
к абсолютной температуре есть величина
постоянная при постоянном давлении и
массе газа. Зависимость между объемом
и температурой прямая)
Графически этот процесс изображается изобарой - это линия, где в каждой точке р=const.

Объяснение согласно М-к-т:
При постоянном давлении число ударов молекул о стенки сосуда сохраняется. Если мы увеличим объем, а число ударов молекул оставим тем же, то их скорость должна увеличиться. Следовательно, температура возрастает.
3)Изохорический - это процесс в газе при постоянном объеме и массе.(V=const,m=const)
Уравнение:![]() =const-
это закон Гей-Люссак(отношение давления
газа к абсолютной температуре есть
величина постоянная при постоянном
объеме и массе газа. Зависимость между
давлением и абсолютной температурой
прямая)
=const-
это закон Гей-Люссак(отношение давления
газа к абсолютной температуре есть
величина постоянная при постоянном
объеме и массе газа. Зависимость между
давлением и абсолютной температурой
прямая)
Графически этот закон изображается изохорой - это линия где в каждой точке V=const.
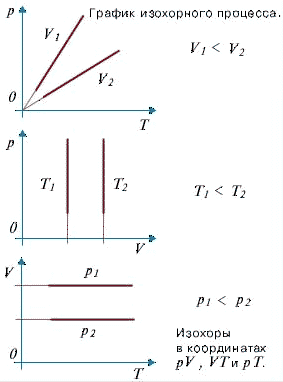
Объяснение согласно М-к-т:
При увеличении температуры увеличивается скорость молекул, т.к. объем постоянный. Число ударов молекул о стенки сосуда возрастает, давление увеличивается.
