
- •1.Метод и законы термодинамики. Основные понятия и определения термодинамики.
- •2.Параметры состояния и уравнения состояния.
- •3.Термодинамическая работа. Координаты р-V.
- •4. Потенциальная работа. Координаты р-V. Распределение работы.
- •5. Истинная и средняя теплоемкости веществ.
- •6.Смеси жидкостей, паров и газов, расчет характеристик смеси веществ.
- •7. Схемы смешения. Закон Дальтона.
- •8. Определение температуры смеси. Теплоемкость смеси.
- •9. Термодинамические условия фазовых переходов
- •10. Критические параметры чистого вещества и смесей газов.
- •11. Теория соответственных состояний. Коэффициент сжимаемости.
- •12. Постулат и математическое выражение 1 начала термодинамики.
- •13. Первое начало термодинамики в аналитическое форме.
- •14. 1 Начало термодинамики для идеального газа.
- •15. Принцип существования энтропии идеального газа.
- •1 6. Изобарный процесс изменения состояния простого тела. Уравнение процесса, изображение в координатах p-V, связь между параметрами, работа и теплообмен, изменение функций состояния.
- •17. Изобарный процесс изменения состояния идеального газа. Уравнение процесса, изображение в координатах t-s, связь между параметрами, работа и теплообмен, изменение функций состояния.
- •18. Изохорный процесс изменения состояния простого тела. Уравнение процесса, изображение в координатах р-V, связь между параметрами, работа и теплообмен, изменение функций состояния.
- •19. Изохорный процесс изменения состояния идеального газа. Уравнения процесса, изображение в координатах t-s, связь между параметрами, работа и теплообмен, изменение функции состояния.
- •20. Изопотенциальный процесс изменения состояния простого тела. Уравнение процесса, изображение в координатах р-V, связь между параметрами, работа и теплообмен, изменение функций состояния.
- •31. Теплопроводность. Закон Фурье. Коэффициент теплопроводности.
- •32. Ду теплопроводности. Условия однозначности.
- •33. Теплопроводность через однослойные и многослойные плоские стенки.
- •34. Теплопроводность через однослойные и многослойные цилиндрические стенки.
- •35. Теплоотдача. Уравнение Ньютона. Коэффициент теплоотдачи.
- •36. Критериальные уравнения, физический смысл критериев подобия.
- •37. Последовательность расчетов конвективного теплообмена в в условиях свободной конвекции.
- •38. Последовательность расчетов конвективного теплообмена в условиях вынужденной конвекции.
- •39. Теплообмен излучением. Основные законы.
- •40. Теплообмен излучением между телами.
- •41. Коэффициент лучистого теплообмена. Уравнение Ньютона-Рихмана.
- •42. Сложный теплообмен. Эффективный коэффициент теплопроводности.
- •43. Теплопередача. Основное уравнение теплопередачи. Коэффициент теплопередачи.
- •44. Теплопередача через плоские однослойные и многослойные стенки.
- •45. Теплопередача через криволинейные однослойные и многослойные стенки.
- •46,(47).Оптимизация процессов теплопередачи. Способы интенсификации теплопередачи(Методы снижения теплового потока).
- •48. Теплопередача при переменных температурах. Средняя разность температур.
- •49. Тепловой баланс и уравнение теплопередачи теплообменного аппарата.
- •50. Средняя разность температур для сложных схем теплообмена.
- •51. Обобщенные уравнения теплопередачи при переменных температурах.
- •52. Последовательность расчета теплообменных аппаратов 1 рода.
- •53. Последовательность расчетов теплообменного аппарата 2 рода
- •54. Круговые процессы, кпд и холодильный коэффициент
- •55. Обратимый цикл Карно, прямой и обратный процесс. Теорема Карно.
- •56. Математическое выражение второго начала термостатики. Основные следствия.
- •57. Математическое выражение второго начала термодинамики. Основные следствия.
- •58. Истечение жидкостей и газов. Основные расчетные соотношения. Истечение несжимаемой жидкости.
- •59.Особенности истечения сжимаемой жидкости. Кризис истечения. Режимы истечения.
- •60. Переход через критическую скорость. Сопло Лаваля, определение геометрических размеров.
- •61. Особенности истечения через каналы переменного сечения, сопло и диффузор.
- •62. Дросселирование. Эффект Джоуля-Томсона. Основные понятия
- •63. Процессы парообразования, определение параметров насушенного пара, диаграмма h-s.
- •64.Классификация циклов тепловых двигателей:
- •65. Схема, рабочий процесс и тд цикл Брайтона. Кпд.
- •66. Схема, рабочий процесс и тд цикл Гемфри. Кпд.
- •67. Сопоставление тд циклов Брайтона и Гемфри по эффективности.
- •68. Схема, рабочий процесс и тд цикл Отто, кпд.
- •69. Схема, рабочий процесс и тд цикл Дизеля. Кпд
- •71. Сопоставление тд циклов двс по эффективности.
- •72. Схема, рабочий процесс и цикл паросиловой установки, цикл Ренкина, методы повышения кпд
- •73.Схема, рабочий процесс и цикл паросиловой установки с промежуточным перегревом
- •74. Схема, рабочий процесс и цикл паросиловой установки с регенерацией.
- •75. Схема, рабочий процесс и цикл паровой компрессионной холодильной машины.
- •77,78. Рабочий процесс двухтактного(и четырехтактного) двигателя внутреннего сгорания.
- •79. Индикаторные и эффективные характеристики двигателей внутреннего сгорания.
6.Смеси жидкостей, паров и газов, расчет характеристик смеси веществ.
Термодинамическая
смесь
– система, состоящая из
химически невзаимодействующих друг с
другом компонентов.
Состав
смеси задаётся либо массовой концентрацией
компонентов -
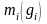 ,
либо молярным составом -
,
либо молярным составом -
 (объёмный).
(объёмный).
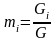 ,
где
,
где
 - масса одного компонента смеси,
- масса одного компонента смеси,
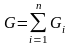 - масса всей смеси.
- масса всей смеси.
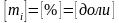 ,
,
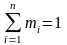
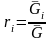 ,
где
,
где
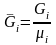 - число киломолей вещества,
- число киломолей вещества,
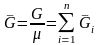 - число киломолей смеси,
- число киломолей смеси,
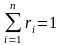
Для
смеси нужно уметь определять среднюю
молекулярную массу
 и среднюю газовую постоянную
и среднюю газовую постоянную
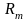 :
:
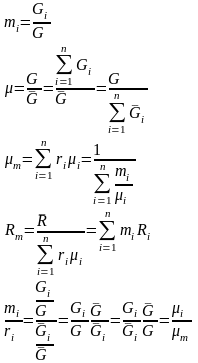
Если
смесь является идеальным газом, то
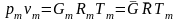 .
.
Если
смесь является реальным газом, то
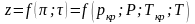 .
.
Псевдокритические параметры:
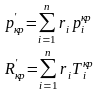
7. Схемы смешения. Закон Дальтона.
Схемы смешивания газов:
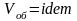 ,
следовательно
,
следовательно
 .
.
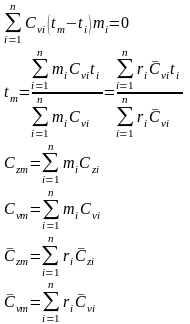
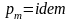 ,
следовательно
,
следовательно
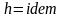 .
.
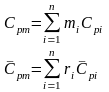
Закон Дальтона: давление смеси равно сумме парциальных давлений компонентов.
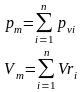
Парциальное давление.
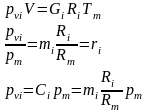
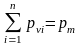
8. Определение температуры смеси. Теплоемкость смеси.
Внутренняя
энергия и энтальпия идеального газа -
функции только температуры, исходными
соотношениями для определения средней
температуры смеси идеальных газов
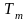 служат следующие соотношения:
служат следующие соотношения:
при
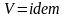
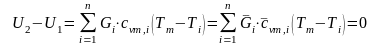 ;
;
при
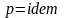
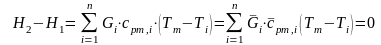 .
.
С учетом соотношений (1.39), (1.40) получаем обобщенное выражение по определению средней температуры смеси идеальных газов для различных схем смешения
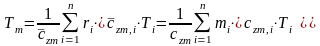
г
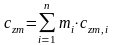 де
де
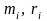 – массовая и молярная концентрации
i-го
компонента смеси;
– массовая и молярная концентрации
i-го
компонента смеси;
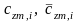 –
средние удельные массовая и молярная
теплоемкости i-го
компонента смеси в процессах
–
средние удельные массовая и молярная
теплоемкости i-го
компонента смеси в процессах
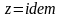 (
( );
);
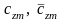 – средние удельные массовая и молярная
теплоемкости смеси,
– средние удельные массовая и молярная
теплоемкости смеси,
9. Термодинамические условия фазовых переходов
Различают три агрегатных состояния простых систем: твердое, жидкое и газовое.
С помощью фазовой диаграммы можно проследить переход тела из одного агрегатного состояния в другое.
Фазами
системы
называются области, ограниченные
поверхностями раздела. На линиях фазовых
превращений существует однозначная
зависимость между давлением и температурой.
Эти линии пересекаются в тройной точке,
где вещество одновременно находится в
трех агрегатных состояниях. Параметры
тройной точки принадлежат к термодинамическим
константам вещества. Энергетической
границей между жидкостью и паром является
теплота
испарения,
а между твердым телом и жидкостью –
теплота
плавления.
Так как процессы испарения и плавления
протекают при постоянной температуре,
то теплоты испарения, плавления и
сублимации есть теплоты изотермических
превращений. Теплота
фазового перехода
обозначается символом
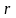 .
.
Возгонка – переход вещества из твёрдого состояния в газообразное.
Сублимация – переход вещества из газообразного состояния в твёрдое.
Испарение – переход вещества из жидкого состояния в газообразное.
Конденсация – переход вещества из газообразного состояния в жидкое.
Кристаллизация – переход вещества из жидкого состояния в твёрдое.
Плавление – переход вещества из твёрдого состояния в жидкое.
Д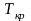 ля
совершения перехода 1-2 в точке
ля
совершения перехода 1-2 в точке
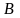 нужно подвести тепло, что бы совершить
работу.
нужно подвести тепло, что бы совершить
работу.
Прямой процесс -
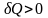 - нужно подвести тепло. Обратный процесс
-
- нужно подвести тепло. Обратный процесс
-
 - нужно отвести тепло.
- нужно отвести тепло.и
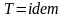 .
.
Теплота фазового перехода - .
Точка
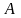 - точка термодинамического равновесия
– тройная точка.
- точка термодинамического равновесия
– тройная точка.
Точка
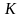 - критическая точка – точка, в которой
исчезают термодинамические различия
между фазами, то есть
- критическая точка – точка, в которой
исчезают термодинамические различия
между фазами, то есть
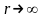 .
.
