
- •1. Привести общую классификацию материалов, используемых в электронной
- •2. Каковы основные виды химической связи в материалах и чем они обусловлены?
- •3. В чем различия между монокристаллами, поликристаллическими и аморфными веществами?
- •4. Привести примеры точечных и протяженных дефектов структуры в реальных кристаллах.
- •5. Каковы особенности строения твердых тел. Индексы Миллера?
- •6. Охарактеризовать явление полиморфизма. Привести примеры полиморфных веществ, "оловянная чума".
- •7. Почему при образовании твердого тела энергетические уровни атомов расщепляются в энергетические зоны?
- •8 . От чего зависит ширина разрешенной зоны и число уровней в ней?
- •9.Чем различаются зонные структуры проводника, полупроводника и диэлектрика?
- •10.Какие основные виды проводников электрического тока вам известны?
- •11. Каков физический смысл уровня Ферми?
- •12. Какими свойствами обладает «электронный газ» в состоянии вырождения?
- •13. Почему удельное сопротивление металлов растет с повышением температуры?
- •14. Что называют температурным коэффициентом удельного сопротивления? Является ли он константой для данного металла?
- •15. Как влияют примеси на удельное сопротивление металлов? в чем заключается правило Маттиссена?
1. Привести общую классификацию материалов, используемых в электронной
технике.
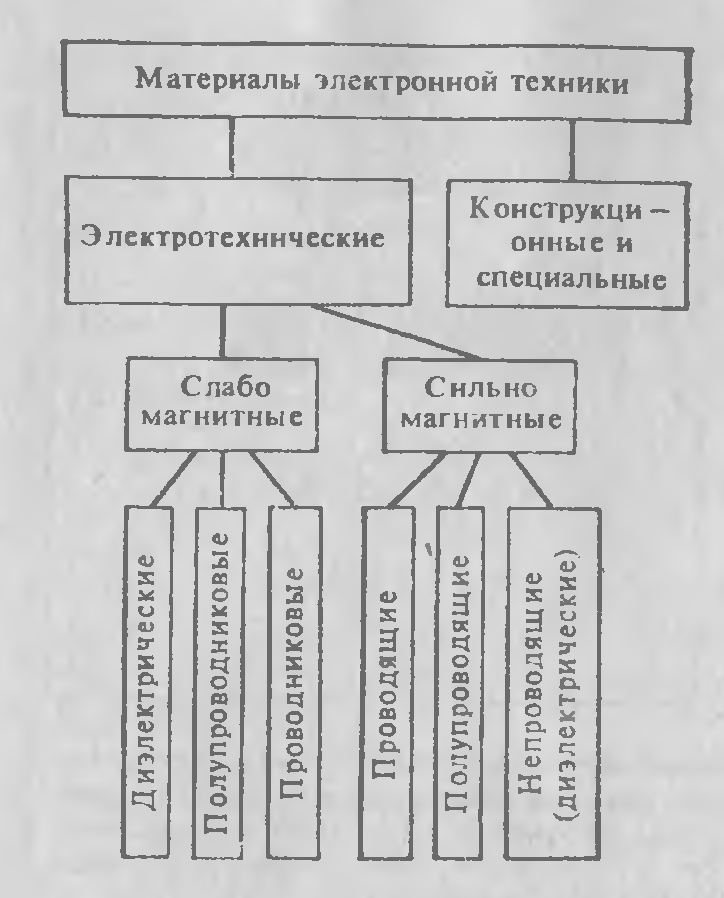
Электротехническими называют материалы, характеризуемые определенными свойствами по отношению к электромагнитному полю и применяемые в технике с учетом этих свойств.
Проводниками называют материалы, основным электрическим свойством которых является сильно выраженная электропроводность. Их применение в технике обусловлено в основном этим свойством, определяющим высокую удельную электрическую проводимость при нормальной температуре.
Полупроводниковыми называют материалы, являющиеся по удельной проводимости промежуточными между проводниковыми и диэлектрическими материалами и отличительным свойством которых является сильная зависимость удельной проводимость от концентрации и вида примесей или различных дефектов, а также в большинстве случаев от внешних энергетических воздействий.
Диэлектриками называю материалы, основным электрическим свойством которых является способность к поляризации и в которых возможно существование электрического поля.
2. Каковы основные виды химической связи в материалах и чем они обусловлены?
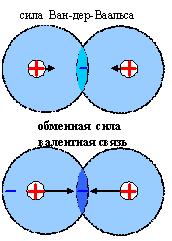
Ван-дер-ваальсовы силы — силы межмолекулярного (и межатомного) взаимодействия с энергией 0,8 — 8,16 кДж/моль. Ван-дер-Ваальсовы силы межатомного взаимодействия инертных газов обусловливают возможность существования агрегатных состояний инертных газов. К ван-дер-ваальсовым силам относятся взаимодействия между диполями.

 При
практических расчетах широко используется
модельный потенциал Ленард – Джонса.
При
практических расчетах широко используется
модельный потенциал Ленард – Джонса.
Ионная связь — прочная химическая связь, образующаяся между атомами с большой разностью электроотрицательностей, при которой общая электронная пара полностью переходит к атому с большей электроотрицательностью.Это притяжение ионов как разноименно заряженных тел. Примером может служить соединение CsF
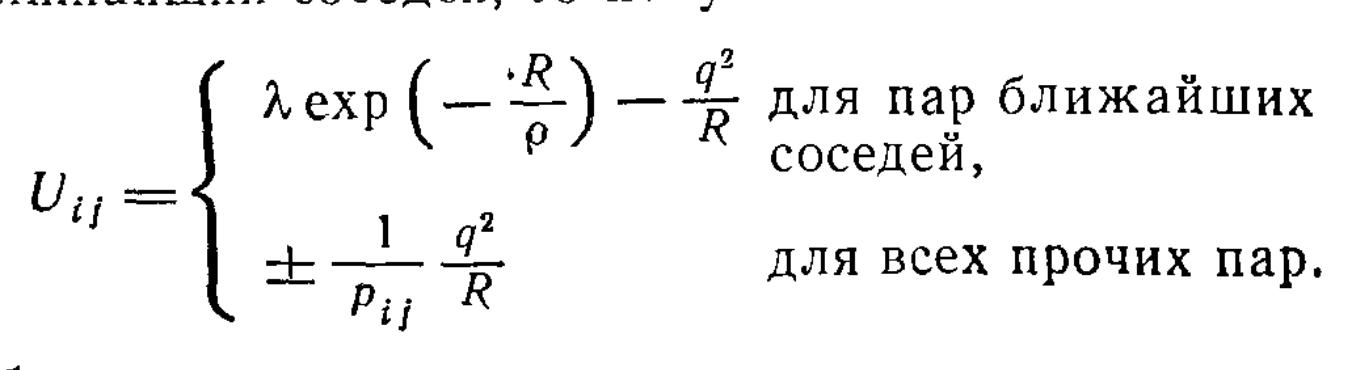
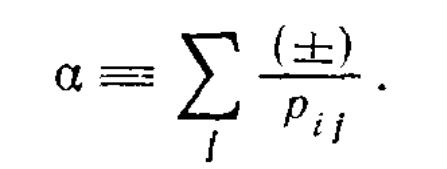 Постоянная
Маделунга
Постоянная
Маделунга
Ковалентная связь — химическая связь, образованная перекрытием (обобществлением) пары валентных электронных облаков. Обеспечивающие связь электронные облака (электроны) называются общей электронной парой. Характерные свойства ковалентной связи:
Направленность связи обусловлена молекулярным строением вещества и геометрической формы их молекулы. Углы между двумя связями называют валентными.
Насыщаемость — способность атомов образовывать ограниченное число ковалентных связей. Количество связей, образуемых атомом, ограничено числом его внешних атомных орбиталей.
Полярность связи обусловлена неравномерным распределением электронной плотности вследствие различий в электроотрицательностях атомов. По этому признаку ковалентные связи подразделяются на неполярные и полярные.
Поляризуемость связи выражается в смещении электронов связи под влиянием внешнего электрического поля, в том числе и другой реагирующей частицы. Поляризуемость определяется подвижностью электронов. Полярность и поляризуемость ковалентных связей определяет реакционную способность молекул по отношению к полярным реагентам.
Электроны тем подвижнее, чем дальше они находятся от ядер. Ковалентная связь это когда два атома делятся электронами и держатся вместе.
Металлическая связь — это одновременное существование положительно заряженных атомов и свободного электронного газа. Во всех узлах кристаллической решётки расположены положительные ионы. Между ними беспорядочно движутся валентные электроны, отцепившиеся от атомов при образовании ионов. Эти электроны удерживают вместе положительные ионы. Электроны удерживаются ионами в пределах кристаллической решётки и не могут её покинуть. Силы связи не локализованы и не направлены.
Водородная связь — форма ассоциации между электроотрицательным атомом и атомом водорода H, связанным ковалентно с другим электроотрицательным атомом. В качестве электроотрицательных атомов могут выступать N, O или F. Водородные связи могут быть межмолекулярными или внутримолекулярными.
