
- •1. Особенности кристаллического строения твёрдых тел. Монокристаллы.
- •2. Правило фаз Гиббса. Однокомпонентная система.
- •3. Уравнение Клайперона – Клаузиуса. Анализ уравнения.
- •7. Диаграммы плавкости бинарных систем с химическими соединениями в твердой фазе.
- •8. Кристалло- физические методы получения сверхчистых металлов.
- •12. Термоэлектрические явления в проводниках.
- •18. Поляризация диэлектрических материалов. Механизмы.
- •19. Сегнетоэлектрики. Классификация. Применение. Свойства.
- •20. Пьезоэлектрики. Пьезоэлектрический эффект. Применение.
- •Физическая химия.
- •1. Элементы точечной симметрии кристаллов.
- •2.Элементы симметрии внутреннего строения кристаллов. Простые и сложные решетки.
- •3.4. Образование металлов и диэлектриком в схеме зонной теории. 4.Образование полупроводников в схеме зонной теории. Приместные полупроводники.
- •5. Теплоемкость кристалла. Зависимость теплоемкости от температуры.
- •6. Двойное лучепреломление и поляризация света в кр-лах. Оптические св-ва кристаллов и их применение.
- •7. Дефекты по Шоттки. Температурная зависимость концентрации дефектов. Дефекты по Френкелю. Температурная зависимость концентрации дефектов
- •8. Беспорядок в кристалле обусловленный нарушениями стехиометрии. Температурная зависимость концентрации дефектов нестихеометрии.
- •9. Беспорядок в кристалле обусловленный посторонними примесями. Неизбежность присутствия примесей в кристалле.
- •10.Факторы, обуславливающие явления переноса. Хаотический и направленный перенос.
- •11.Механизмы диффузии в кристаллах. Хаотическая самодиффузия. Коэффициент хаотической самодиффузии.
- •12. Направленная диффузия. 1 и 2 законы Фика.(взято из интернета).
- •13.Электрическая проводимость кристалла. Электрохимический перенос. Электрохимический потенциал.
- •14. Особенности и стадии протекания твердофазных реакций. 15.Формальное ур-е кинетики твердофазных реакций.
- •Физ. Электроника
- •Термоэлектронная эмиФссия
- •Термоэлектронная эмиссия с поверхности полупроводников
- •Термокатоды
- •2. Фотоэлектронная эмиссия
- •3. Вторичная электронная эмиссия
- •4. Движение электронов в вакууме в режимеобъемного заряда.
- •5. Триоды
- •Многоэлектродные лампы
- •6. Электронная оптика.
- •Электронные линзы
- •Электростатические линзы
- •Магнитные линзы
- •Электронно-оптические системы электронно-лучевых приборов
- •7. Приемные электронно-лучевые трубки
- •8. Электровакуумные приборы диапазонасверхвысоких частот Особенности движения электронов в свч полях
- •9. Типы столкновения электронов с тяжелыми частицами.
- •Упругие соударения электронов с атомами и молекулами газа
- •Неупругие соударения электронов с атомами и молекулами
- •11. Понятие газового усиления.
- •12. Виды самостоятельных разрядов
- •13. Газоразрядная плазма
- •15. Механизмы пробоя n-р перехода
- •16. Биполярные транзисторы
- •17. Полевые транзисторы с изолированным затвором (мдп-транзисторы)
Материаловедение.
1. Особенности кристаллического строения твёрдых тел. Монокристаллы.
Все твёрдые тела делятся на кристаллы (при нагревании остаются твёрдыми до определённой температуры) и аморфные тела (при нагреве размягчаются в большом температурном интервале, становятся вязкими).
Кристаллическое
состояние ТВ. Тела обладает меньшим
термодинамическим потенциалом и более
стабильно, чем аморфные тела. Аморфное
состояние можно рассматривать как
переохлаждённую жидкость с сильно
пониженной подвижностью частиц. Его
можно фиксировать при охлаждении
некоторых органических веществ. Примером
перехода может служить помутнение
стёкол при нагреве, цветение оптиеи при
длительном использовании. В природе
встречаются крупные кристаллы с визуально
– различными гранями. Такие тела называют
монокристалл. Упорядоченность расположения
составляющих монокристалл частиц
распространяется по всему объёму тела
(дальний порядок). Более распространены
в природе тела, состоящие из хаотически
ориентированных монокристаллов от
 до 1 мкм. Такие тела, состоящие из ещё
более мелких, нахывают аморфными.
до 1 мкм. Такие тела, состоящие из ещё
более мелких, нахывают аморфными.
Все физико – химические свойства тел разделяют на: скаляр и вектор. Скаляр. Свойства не зависят от рассматриваемого направления и характеризует тв. тело в целом. Вектор. Свойства могут различаться для разных направлений в тв. теле. Если векторное свойство во всех направлениях и в любой точке одинаково, то такое тело называют изотропным. В поликристалле и аморфных телах анизотропия отсутствуют. Но при определённых условиях можно в поликристалле добиться анизотропии созданием преимущественно одинаковой ориентировки многих зёрен в том или ином направлении (Текстура). В металлах текстуры образуются в итоге деформации и отжига деформированных образцов с последующей обработкой в электро – магнитных полях. Фактическое существование различных кристаллических решёток у одного элемента в различных температурных областях называется полиморфизмом. Пример – превращение графита в алмаз.
2. Правило фаз Гиббса. Однокомпонентная система.
Компонентами (точнее, независимыми компонентами) термодинамической системы называются различные вещества, наименьшее число которых достаточно для образования всех фаз системы.
Фазой называется однородная часть системы, отделенная от остальных ее частей поверхностью раздела, при переходе через которую свойства изменяются скачкообразно.
Числом степеней свободы системы называется число параметров (температура, давление, концентрация), которые можно произвольно изменять без изменения числа фаз системы.
Правило фаз Гиббса: Ф=К+П-С , где К- число компонентов,
П- число внешних параметров, С- число степеней свободы,
Ф- число фаз. Для однокомпонентной системы К = 1. С = 3-Ф.
В пределах одной фазы система бивариантна. Независимо можно менять и температуру и давление в пределах одной фазы.
3. Уравнение Клайперона – Клаузиуса. Анализ уравнения.
 .
Равновесие
системы при плавлении:
.
Равновесие
системы при плавлении:
 -
из твёрдой фазы в жидкую (ΔH>
0).
-
из твёрдой фазы в жидкую (ΔH>
0).
1)
 ,
т. е. с ↑ р – t
(пл) ↓.
,
т. е. с ↑ р – t
(пл) ↓.
2)
 ,
т. е. с ↑ р – t
(пл) ↑.
,
т. е. с ↑ р – t
(пл) ↑.
Равновесие ж. – пар, ТВ. – пар.
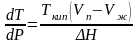 ;
(ΔH>
0). V
(п) >V(ж)
– всегда. с ↑ р – t
(пл) ↑.
;
(ΔH>
0). V
(п) >V(ж)
– всегда. с ↑ р – t
(пл) ↑.
Если
V
(п) >>V(ж),
то V
(п) - V(ж)
= V
(п).
 ;
;
 .
.
Для
сублимации:
 .
В небольшом интервале температур ΔH
не зависит от температуры:
.
В небольшом интервале температур ΔH
не зависит от температуры:

5. Диаграмма плавкости бинарных систем без твердых растворов
Если в бинарной системе компоненты А и В неограниченно растворимы друг в друге в жидком состоянии и полностью нерастворимы в твердом, то нет расслоения жидкой фазы, и при кристаллизации из нее выпадают раздельно чистые кристаллы Ати Вт. Следовательно, твердое состояние представляет собой поликристалл — двухфазную систему в виде смеси мелких кристаллов А"* и Вт. Диаграммы плавкости бинарных систем с неограниченным твердым раствором
Пусть вещества А и В, кроме полной взаимной растворимости в жидком состоянии, также неограниченно растворимы друг в друге в твердой фазе с образованием непрерывного твердого раствора, В этом случае принципиально возможны три типа диаграмм плавкости которые часто называются диаграммами типа «сигара», «сигара с максимумом» и «сигара с минимумом».

Рис. 1

Выше линии ликвидуса существует жидкий раствор ж, ниже линии солидуса — твердый раствор α.
Рассмотрим
процесс кристаллизации жидкого раствора,
который соответствует фигуративной
точке 1 с начальным составом
 (рис.1а).При
охлаждении системы
этот состав сохраняется неизменным
вплоть до температуры Т1в
точке l1на
линии ликвидуса.
В этот момент начинают выпадать первые
порции твердого раствора α
состава,
отвечающего точке S1на
линии солидуса. Кристаллы S1беднее
компонентом, В, чем
жидкий раствор l1.
При их осаждении жидкая фаза обогащается
компонентом
В. И по мере дальнейшего охлаждения
жидкого раствора его состав изменяется
вдоль линии ликвидуса в направлении
стрелки. Соответственно
этому, состав твердого раствора α при
равновесной кристаллизации
меняется вдоль линии солидуса от точки
S1
к
S2и
далее к точке Sk.
Кристаллизация
полностью
заканчивается при температуре Тk.
(рис.1а).При
охлаждении системы
этот состав сохраняется неизменным
вплоть до температуры Т1в
точке l1на
линии ликвидуса.
В этот момент начинают выпадать первые
порции твердого раствора α
состава,
отвечающего точке S1на
линии солидуса. Кристаллы S1беднее
компонентом, В, чем
жидкий раствор l1.
При их осаждении жидкая фаза обогащается
компонентом
В. И по мере дальнейшего охлаждения
жидкого раствора его состав изменяется
вдоль линии ликвидуса в направлении
стрелки. Соответственно
этому, состав твердого раствора α при
равновесной кристаллизации
меняется вдоль линии солидуса от точки
S1
к
S2и
далее к точке Sk.
Кристаллизация
полностью
заканчивается при температуре Тk.
В процессе кристаллизации система сохраняется двухфазной и моновариантной (С = 1) и не возникает площадки нонвариантности. Выделение теплоты кристаллизации замедляет темп охлаждения и наклон кривой охлаждения отличается от наклона на начальном участке, так как теплоемкости жидкого и твердого растворов различны.
. Диаграммы плавкости бинарных систем с ограниченными твердыми растворами.
Часто компоненты, полностью взаимно растворимые в жидкой фазе, имеют ограниченную взаимную растворимость в твердом состоянии.
Принципиальная разница между процессами кристаллизации в системах с эвтектикой и перитектикой состоит в следующем. В системах с эвтектикой в эвтектической точке одновременно выпадают две твердые фазы. В системах с перитектикой в перитектической точке одна твердая фаза выпадает, а другая растворяется.

Диаграмма эвтектического типа

Диаграмма перитектического типа
