
16. Образование кристаллических зародышей
и стеклование. Гомогенный и гетерогенный механизмы зародышеобразования
Кристаллизация – фазовый переход первого рода, результатом которого является переход атомов (или молекул) из неупорядоченного состояния (пар, жидкость) в упорядоченное.
Движущей силой любого фазового превращения, в том числе кристаллизации, является стремление системы к уменьшению ее свободной энергии. Кристаллизация происходит только в системах с пересыщением (переохлаждением), то есть находящихся в метастабильном состоянии. При этом кристаллизация (например, при затвердевании расплава или конденсации пара) обычно не протекает однородно во всем объеме метастабильной фазы. В начале процесса в разных местах исходной фазы образуются центры кристаллизации, которые затем разрастаются благодаря процессам тепло- и массопередачи. Создание пересыщения (переохлаждения) для кристаллизации исходной фазы необходимо для сообщения системе дополнительной энергии, требуемой для образования поверхности зародышей новой фазы.
На рис. 3.1 показана зависимость свободной энергии для твердой и жидкой фаз от температуры. При Т < Тпл создается переохлаждение ДТ = Тпл – Т, при котором система уменьшает свободную энергию на ДG = GЖ – GК.
Механизм образования зародышей новой фазы может быть гомогенным, когда в исходной фазе отсутствуют какие-либо твердые частицы или поверхности, стимулирующие образование на них центров, а гетерогенным, когда они присутствуют.
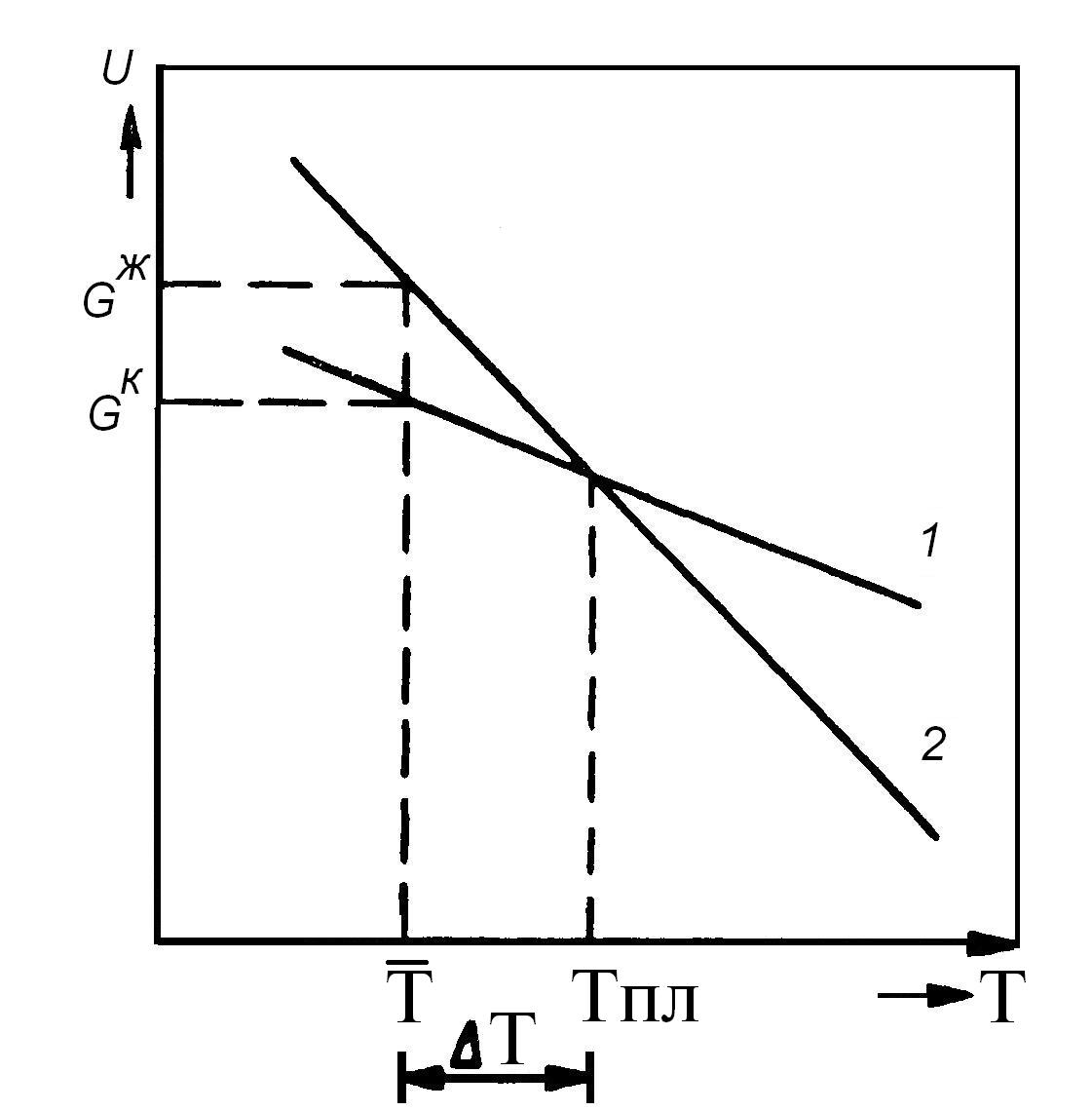
Рис. 3.1. Зависимость свободной энергии от температуры
для твердой (1) и жидкой (2) фаз
Рассмотрим основные параметры, определяющие условия фазового превращения при гомогенном образовании центров кристаллизации.
Изучим зарождение жидких капель из пересыщенного пара.
Возникновение небольшой капли радиусом r при давлении пересыщенного пара Р (характеризующегося равновесным давлением Р0 при температуре Т) сопровождается изменением свободной энергии системы ДG, состоящей из двух составляющих:
ДG = ДGоб + ДGпов, (3.1)
где ДGоб – изменение свободной энергии пара при его конденсации; ДGпов – изменение свободной энергии за счет работы, затраченной на образование поверхности раздела жидкость – пар.
Исходя из изменения молярной свободной энергии идеального газа при его изотермическом сжатии
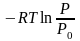 ,
(3.2)
,
(3.2)
для сферической капля радиуса r получаем
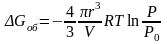 .
(3.3)
.
(3.3)
где R – универсальная газовая постоянная; V – мольный объем жидкости.
Вклад ДGпов для сферического зародыша составляет
ДGпов = 4рr2γжп, (3.4)
где γжп – удельная свободная энергия поверхности раздела жидкость – пар.
Подставляя (3.3) и (3.4) в (3.1), получаем
 . (3.5)
. (3.5)
Анализ выражения (3.5) показывает (рис. 3.2), что при малых r преобладает второе слагаемое и ДG положительна; при больших r основную роль играет первое слагаемое и тогда ДG отрицательна. Из условия максимума (3.5) относительно r
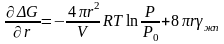 , (3.6)
, (3.6)
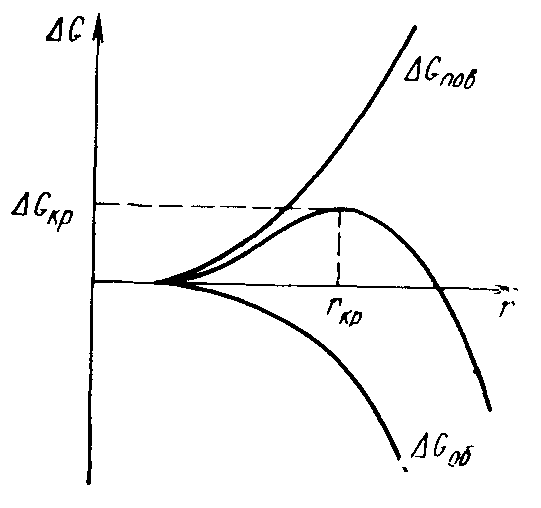
Рис. 3.2. Зависимость изменения свободной энергии
от радиуса зародыша новой фазы
откуда критический радиус rкр равен
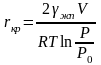 . (3.7)
. (3.7)
Подставляя (3.7) и (3.5), получаем изменение свободной энергии, сопровождающее образование капельки критического размера, то есть энергию активации зарождения
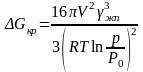 . (3.8)
. (3.8)
Капелька с радиусом r < rкр будет испаряться, с r > rкр – будет расти, так как это способствует уменьшению свободной энергии ΔG.
Капельки радиусом меньше критического (или в общем случае участки новой фазы размером меньше критического) называют зародышами, а больше критического – центрами новой фазы (или в случае кристаллизации – центрами кристаллизации).
Если Р/Р0 ≤ 1, то ДG возрастает с увеличением r и капельки любых размеров, возникающие в результате гетерофазных флуктуаций, будут проявлять тенденцию к испарению.
Таким образом, зародыш новой фазы может появиться и расти только в условиях, когда свободная энергия вещества в новой фазе меньше свободной энергии того же вещества в исходной фазе: паровой, растворе или расплаве. Поскольку свободная энергия не может быть непосредственно измерена, для определения условий образования зародышей и их дальнейшего роста пользуются понятиями пересыщения и переохлаждения. Для зарождения и роста кристаллов необходимо, чтобы исходная фаза была пересыщена или переохлаждена по отношению к возникающей в ней твердой фазе. При данной температуре газовую фазу называют пересыщенной, если ее давление Р превышает давление Р0 насыщенных паров жидкости или твердой фазы. Пересыщение выражается при этом одним из следующих способов:
– ΔР = Р – Р0 – абсолютное пересыщение (величина его зависит, очевидно, от выбранных единиц давления);
– σ = ΔР/Р0 – относительное пересыщение (часто выражаемое в процентах);
– α = Р/Р0 – коэффициент пересыщения.
Пересыщение можно также характеризовать величиной δ = ln(Р/Р0), которая, будучи помноженной на энергетический коэффициент kT, дает разность свободных энергий атома или молекулы в двух фазах (или разность химических потенциалов двух фаз Δμ):
Δμ = kTln(Р/Р0). (3.9)
Для растворов (жидких и твердых) пересыщение выражают аналогичным образом:
– ΔС = С – С0 – абсолютное пересыщение;
– σ = ΔС/С0 – относительное пересыщение;
– α = С/С0 – коэффициент пересыщения (С ‑ концентрация кристаллизуемого компонента в растворе; С0 – его равновесная концентрация при температуре процесса кристаллизации).
Расплавы характеризуются переохлаждением
ΔТ = Тпл – Т, (3.10)
где Тпл – температура плавления вещества; Т – температура переохлажденного расплава (рис. 3.1).
Рассчитаем скорость зарождения центров новой фазы в газовой фазе в зависимости от пересыщения, будем считать, что она равна скорости, с какой зародыши критического размера увеличивают свой размер. Обозначим концентрацию критических зародышей пкр. Скорость зародышеобразования I в единице объема газовой фазы:
I = ωкрпкр, (3.11)
где ωкр – частота, с которой критические зародыши захватывают атомные частицы и становятся центрами новой фазы.
Используя статистику Больцмана, получаем
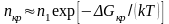 , (3.12)
, (3.12)
где п1 = Р/(kT) – концентрация частиц в газовой фазе.
Выражая ωкр через rкр и ΔGкр и введя в формулу для скорости значение пересыщения , получим зависимость , изображенную на рис. 3.3.
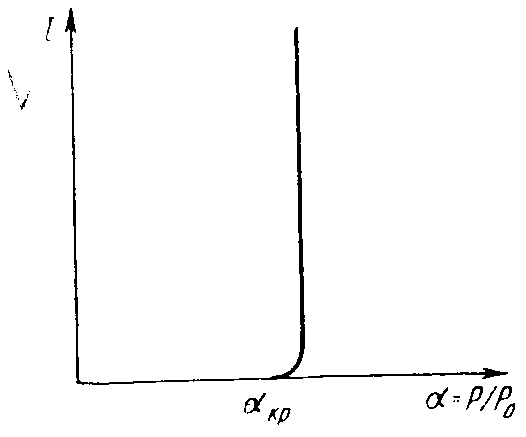
Рис. 3.3. Зависимость скорости зарождения жидких капель в паре от коэффициента пересыщения
Начиная с некоторого пересыщения наблюдается резкий рост скорости зарождения новой фазы от пересыщения. Это пересыщение называется критическим αкр.
Рассмотрим гомогенное зародышеобразование в жидкой фазе. Изменение свободной энергии соответствует выражению (3.1). Пусть объем зародыша твердой фазы Vʹ, площадь поверхности s, удельная поверхностная энергия границы раздела жидкость – твердое тело γжт.
Объемная и поверхностная составляющие свободной энергии в этом случае имеют вид
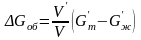 ,
(3.13)
,
(3.13)
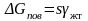 ,
(3.14)
,
(3.14)
где
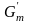 и
и
 – молярная свободная энергия твердой
и жидкой фаз. Так как расплав переохлажден,
то
<
.
– молярная свободная энергия твердой
и жидкой фаз. Так как расплав переохлажден,
то
<
.
Определим критический размер зародыша rкр и энергию его образования ДGкр. Будем считать, что форма зародыша остается неизменной в процессе его роста до значения rкр и заменим s в (3.14) на
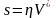 ,
(3.15)
,
(3.15)
где η – коэффициент, учитывающий форму зародыша.
Тогда
 .
(3.16)
.
(3.16)
Максимальное значение изменения свободной энергии, равное ΔGкр, найдем, продифференцировав ΔG по Vʹ и приравняв производную нулю:
 ,
(3.17)
,
(3.17)
откуда
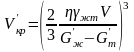 . (3.18)
. (3.18)
Подставляя (3.18) в (3.16), получаем
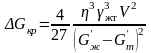 . (3.19)
. (3.19)
Полученные выражения не дают в явном виде зависимости rкр и ΔGкр от величины переохлаждения ΔТ, равной разности между температурой плавления (равновесной температурой фазового превращения) и фактической температурой кристаллизации ΔТ = Тпл – Т, однако ее можно получить следующим образом.
Изменение молярной свободной энергии ΔG при образовании твердой фазы из жидкой при температуре равновесного фазового перехода Тпл равно
ΔG = ΔH – TплΔS = 0, (3.20)
где ΔH и ΔS – изменения молярной энтальпии и энтропии в ходе превращения.
При температуре кристаллизации Т, отличающейся от Тпл,
ΔG = ΔH – TΔS ≠ 0. (3.21)
Пренебрегая слабой температурной зависимостью ΔH и ΔS из (3.20) и (3.21), получаем
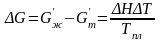 , (3.22)
, (3.22)
где ΔТ – переохлаждение.
При анализе процессов теплопереноса, сопровождающих рост кристаллов, вместо ΔH используют термохимическую характеристику – скрытую молярную теплоту кристаллизации L, отличающуюся от ΔH только знаком (при затвердевании L положительна).
Подставляя (3.22) в (3.18) и (3.19), окончательно получим
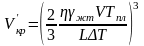 , (3.23)
, (3.23)
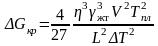 . (3.24)
. (3.24)
Рассчитаем скорость гомогенного зародышеобразования в жидкости
I = ν1 пкр, (3.25)
где ν1 – частота, с которой атом преодолевает энергетический барьер U на границе между жидкой фазой и кристаллическим зародышем.
ν1 = ν0 exp(–U/kT), (3.26)
где н0 – частота основных колебаний атомов.
С учетом этого скорость образования центров кристаллической фазы в единице объема в общем виде равна
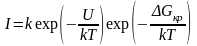 ,
(3.27)
,
(3.27)
где k – слабо меняющаяся с температурой постоянная.
С ростом переохлаждения расплава вероятность возникновения центра кристаллической фазы, определяемая ΔGкр, растет. Но при этом снижается подвижность атомов, определяемая U, особенно в вязких жидкостях (стеклах, полимерах) – рис. 3.4, что уменьшает скорость зародышеобразования даже при больших переохлаждениях.
Каждая вязкая жидкость обладает оптимальным переохлаждением, при котором скорость возникновения центров кристаллической фазы максимальна. В невязких жидкостях максимума скорости образования центров может не наблю-
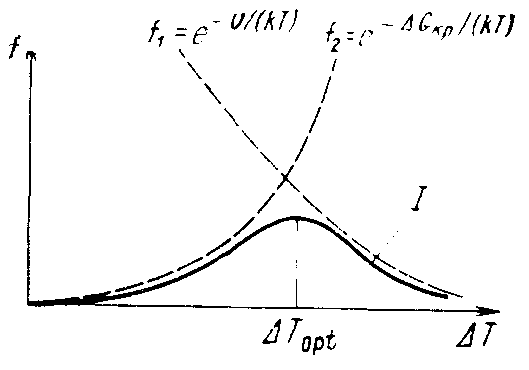
Рис. 3.4. Зависимость от переохлаждения расплава величин, определяющих скорость гомогенного зародышеобразования
в жидкой фазе
даться, так как при некотором критическом переохлаждении ΔТкр идет резкое увеличение скорости, после чего весь объем расплава кристаллизуется (рис. 3.5).
В вязких расплавах при реальных переохлаждениях число центров кристаллизации мало, расплав затвердевает как переохлажденная жидкость (например, в SiO2). Этот процесс называется стеклованием, а температура перехода стекла в хрупкое состояние называется температурой стеклования Tg.
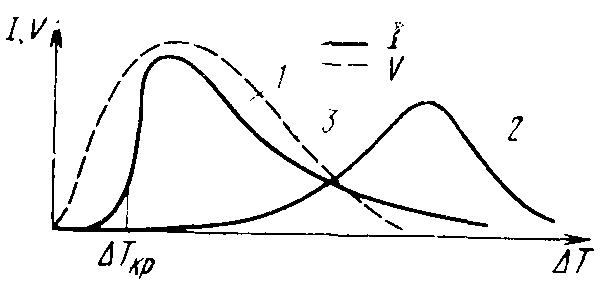
Рис. 3.5. Зависимость скорости гомогенного образования
центров кристаллической фазы: 1 – для невязких расплавов;
2 – для вязких расплавов
Аморфное твердое тело – стекло, характеризуется как и жидкость, отсутствием дальнего порядка. Создать большие переохлаждения (чтобы появилось много центров кристаллизации) трудно из-за низкой теплопроводности.
Наоборот, для материалов с низкой вязкостью сложно получить стеклообразное состояние (трудно за короткое время создать большее переохлаждение, которое подавило бы образование центров кристаллизации, необходимые для этого скорости охлаждения 105 – 106 град/с).
Таким образом, переход вещества из расплава в твердую фазу может идти двумя путями: вещество или кристаллизуется при фиксированной температуре Тпл, или идет стеклование в определенном температурном интервале, при этом свойства вещества изменяются плавно.
Для гомогенного образования центров новой фазы из расплавов требуется переохлаждение ΔТкр = 0,2Тпл, при конденсации из газовой фазы α = Р/Р0 = 10. Реальные величины пересыщений намного меньше. Это связано с уменьшением ΔGпов, что снижает и ΔGкр и критические пересыщения.
ΔGпов уменьшается при наличии в системе поверхностно-активных примесей, при наличии готовых поверхностей раздела за счет присутствия в системе твердых частиц, на поверхности которых образуются зародыши. Таким образом, механизм зародышеобразования – гетерогенный.
Кристаллизация на затравках, на подложках при эпитаксии, на твердых частицах имеет гетерогенную природу.
Рассмотрим конденсацию пересыщенного пара на плоской подложке.
Так как свободная поверхностная энергия жидкости изотропна, то зародыш, образующийся на плоской подложке и находящийся в равновесном состоянии, в общем случае будет иметь форму шарового сегмента с радиусом кривизны поверхности r либо форму многослойного диска (рис. 3.6). При этом равновесный угол смачивания θ определяется из условия равновесия натяжений трех поверхностей раздела
γпт = γжт + гжпcosθ, (3.28)
где γпт, γжт и γжп – удельные свободные поверхностные энергии границ раздела пар – твердое, жидкость – твердое и жидкость – пар соответственно.
Изменение свободной энергии при образовании на подложке куполообразного зародыша с радиусом кривизны r состоит из двух слагаемых: ΔGоб и ΔGпов.
Объемная составляющая для ΔG зародыша объемом
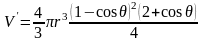 (3.29)
(3.29)
с учетом (3.2) равна
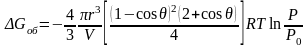 .
(3.30)
.
(3.30)
Поверхностная составляющая изменения свободной энергии записывается в виде
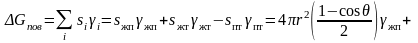
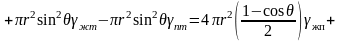
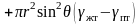 . (3.31)
. (3.31)


Рис. 3.6. Зависимость формы зародыша жидкой фазы и изменения свободной энергии системы при гетерогенном зарождении от равновесного угла смачивания
Согласно (3.28), γжт – γпт = –γжпcosθ, подставляя которое в (3.31), получаем
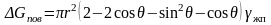 (3.32)
(3.32)
или после преобразований
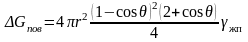 . (3.33)
. (3.33)
Подставляя (3.30) и (3.33) в (3.1), получаем изменение свободной энергии системы при гетерогенном образовании зародыша:
 .
(3.34)
.
(3.34)
Выражение (3.34) отличается от (3.5) для гомогенного образования зародышей только множителем
 ,
(3.35)
,
(3.35)
откуда следует, что выражение для rкр при гетерогенном зарождении будет иметь такой же вид, как и при гомогенном образовании зародышей (3.7), а после подстановки (3.7) в (3.34) с учетом (3.8) получаем
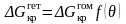 . (3.36)
. (3.36)
На рис. 3.7 показан график изменения f(θ) от угла θ. Используя этот график, рассмотрим частные случаи.
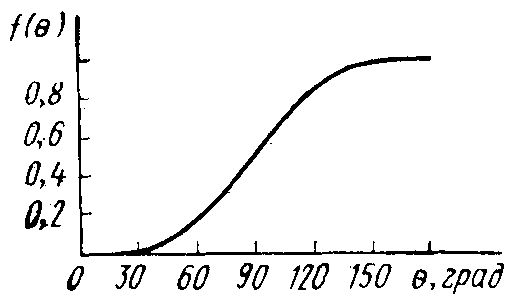
Рис. 3.7. График зависимости функции f(θ) от равновесного угла смачивания θ
Случай
θ
= 180° (Рис. 3.6. а)
соответствует полной несмачиваемости
подложки жидкостью, что возможно, когда
взаимодействие между атомами или
молекулами этих материалов мало по
сравнению с их взаимодействием в
жидкости. В этом случае, согласно (3.36)
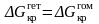 ,
то есть нет никакого энергетического
выигрыша и, следовательно, подложка не
оказывает каталитического действия на
процесс зародышеобразования.
,
то есть нет никакого энергетического
выигрыша и, следовательно, подложка не
оказывает каталитического действия на
процесс зародышеобразования.
В
случае θ
= 0° (Рис. 3.6. в)
новая фаза полностью смачивает подложку
и, согласно (3.36),
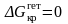 .
Этот случай имеет место, когда
взаимодействие между атомами или
молекулами зародыша и подложкой
значительно превосходит взаимодействие
между атомами или молекулами в зародыше.
При этом на подложке будут образовываться
двумерные зародыши, равновесной формой
которых в простейшем случае является
монослойный диск. В этом случае имеется
максимальный выигрыш в работе образования
зародыша, однако эта работа не может
стать равной нулю, как это следует из
(3.36), так как при выводе (3.36) пренебрегали
работой образования линейного контура
зародыша.
.
Этот случай имеет место, когда
взаимодействие между атомами или
молекулами зародыша и подложкой
значительно превосходит взаимодействие
между атомами или молекулами в зародыше.
При этом на подложке будут образовываться
двумерные зародыши, равновесной формой
которых в простейшем случае является
монослойный диск. В этом случае имеется
максимальный выигрыш в работе образования
зародыша, однако эта работа не может
стать равной нулю, как это следует из
(3.36), так как при выводе (3.36) пренебрегали
работой образования линейного контура
зародыша.
Случай
0° ≤ θ
< 180° (рис. 3.6, б)
всегда энергетически более выгоден,
чем случай гомогенного зарождения.
Здесь rкр
и
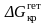 тем меньше, чем меньше угол и,
и подложка, таким образом, является
катализатором процесса зародышеобразования.
тем меньше, чем меньше угол и,
и подложка, таким образом, является
катализатором процесса зародышеобразования.
Если зародыш развивается в углублении на подложке, то sжт >> sжп (рис.3.8), то даже при малой разности (γпт – γжт) будет значительной уменьшение ΔGпов. Поэтому на ступенях скорость зародышеобразования повышается.
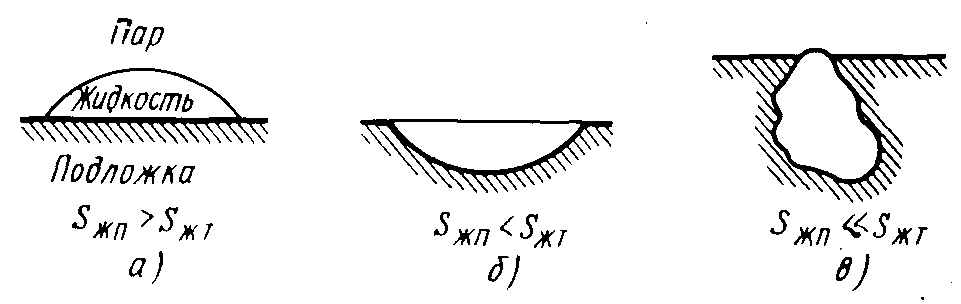
Рис. 3.8. Изменение площади межфазной границы
куполообразного зародыша на плоскости (а)
и в плоскости (б, в)
Сравним
зависимости скорости зародышеобразования
от пересыщения для гетерогенного и
гомогенного механизмов (рис. 3.9). Из
сравнения видно, что

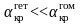 .
.
Рассмотрим гетерогенное образование кристаллических зародышей. В расчете ΔGгет требуется учет формы зародыша. Свободная энергия межфазной границы подложка – зародыш, а также резко анизотропны и имеют локальные минимумы при ориентациях с хорошим соответствием параметров решеток. При зарождении на инородной подложке снятие несоответствия периодов решеток Δа идет за счет деформации зародыша и подложки. Если Δа небольшое, то деформация
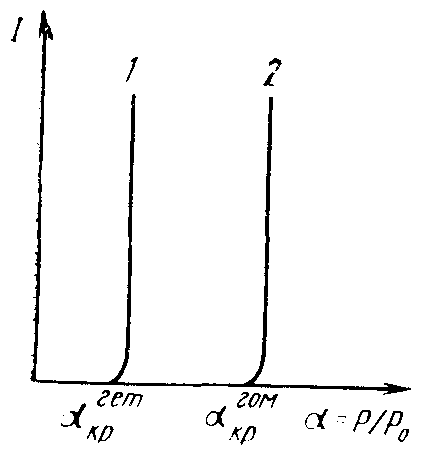
Рис. 3.9. Графики зависимостей скоростей гетерогенного (1)
и гомогенного (2) зарождения центров жидкой фазы
от коэффициента пересыщения
упругая, а межфазная граница когерентная. При бульших несоответствиях граница содержит области малого локального несоответствия и области концентрированных деформаций (например, пограничные дислокации), граница будет полукогерентной. Если Δа велико, граница некогерентная, характеризуется большой свободной энергией (это приводит к росту rкр и ).
При небольших несоответствиях образуются такие зародыши, ориентация которых снижает Δа, при больших Δа образуются зародыши с другими ориентациями.
Самые малые кристаллические образования являются структурно совершенными. Если в кристалле есть структурные нарушения, то они образуются на стадии слияния различно ориентированных зародышей.
Чтобы зародыши были параллельно ориентированы, надо, чтобы свободная межфазная энергия поверхности раздела подложка – зародыш для определенных ориентаций была бы меньше, чем для других. В этом случае скорость ориентированного образования зародышей будет максимальной.
Пусть Iэ – скорость образования зародышей с благоприятной ориентацией, Iп – с произвольной ориентацией, тогда условие ориентированного образования зародышей
Iэ/Iп >> 1. (3.37)
При кристаллизации однокомпонентного материала ориентированному образованию способствуют высокие температуры подложки и низкие пересыщения.
