
- •Квантовые св-ва света. Фотоны и их свойства.
- •Давление света.
- •29 Причины давления.
- •Давл. Света согл. Квантовым предст.
- •27 Фотоэлектрический эффект
- •Вольт-амперная характеристика (вах) внешнего фотоэффекта
- •Закономерности Столетова.
- •Квантовое объяснение Фотоэффекта.
- •Законы внешнего фотоэффекта.
- •Эффект Комптона.
- •20 Тепловое излучение.
- •20 Характеристики теплового излучения.
- •Характеристики теплового поглащения
- •22 Закон Кирхгофа
- •21 Распределение энергии в спектре ч.Т.
- •23 Модуль Релея-Джинса. Ультрофиалетовая катастрофа.
- •24 Квант. Гипотеза Планка. Ф-ла Планка.
- •30 Спектральные серии
- •Обобщённая формула Бальмера
- •31 Опыты Франка и Греца
- •32 Модель атома Томсона
- •Потсулаты Бора
- •Теория Бора для атома водорода и водородоподобных систем
- •31 Энергетическая диаграмма атома водорода по Бору
- •Происхождение спектральных серий согласно теории Бора
- •Определение постоянной Ридберга
- •Значение и недостатки теории Бора
- •Волновые свойства частиц. Гипотеза де Бройля. Формулы де Бройля
- •32 Эксперим. Док-ва гипотезы де Бройля. Опыты Дэвиссона и Джермера.
- •35 Общее (временное) ур-ние Шредингера
- •Своеобразие микромира. Кв-мех. Принцип причинности.
- •Теорема Эренфеста. Вычисл. Средних значений термодинамических величин.
- •Соотношения неопред. Гейзенберга
- •41 Закон Мозли:
- •Элементы зонной теории твёрдых тел
- •Образование молекулы водорода. Расщепление энергетических уровней изолированниго атома
- •Возникновение энергетических зон в твёрдом теле. Ширина зон.
- •Адиабатное приближение уравнения Шредингера
- •Одноэлектронное приближение уравнения Шредингера
- •Решение одноэлектронного приближения ур-ния Шредингера
- •42 Металлы, диэлектрики и полупроводники по зонной теории.
- •47 Состав ядер. Нуклоны.
- •Характеристики атомных ядер
- •Размеры ядер и нуклонов. Плотность ядерного вещества.
- •48 Деффект массы. Энергия связи ядра.
- •49 Ядерные силы
- •Модель атомного ядра
- •51 Виды радиоактивных излучений и их характеристики
- •50 Закон радиоактивного распада
- •Биол. Действие радиоакт. Излучения
- •Элементарные частицы. Античастицы. Аннигиляция.
- •Косимическое излучение (ки)
- •Виды взаимодействий
- •Классификация элементарных частиц. Понятие о кварках.
31 Энергетическая диаграмма атома водорода по Бору
Энерг. диаграмма
- совокупность дискретных (разрешённых)
значений энергии, изображаемых в виде
определённого графика. Найдём значения
энергии атома водорода.
![]()
E1=13,55эВ - min; E2=3,39эВ;
E3=1,51эВ; E4=0,85эВ; n E 0-max
Уровнем энергии наз. определённое дискретное значение энергии на разрешённой стационарной орбите.
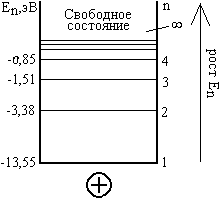
Состояние 1 - устойчивое равновесие, соответствующее минимуму полной энергии, т.н. нормальное стационарное состояние.
При n=2,3,4... - полняи энергия не соответствует устойчивому равновесию, т.н. возбуждённое стационарное состояние.
переход эл-на с состояния n=1 в n=2 наз. первым возбуждением. Энергия, сообщённая эл-ну наз. энергией первого возбуждения.
в первом возб. состоянии эл-н не может находится долго. Он возвращается на n=1, испуская квант энергии.
Поглощение энергии происходит при переходе с ближней к ядру орбиты на дальнюю, испускание э/м волн происходит с дальних на ближние. h=E.
Переход эл-на из нормальноно состояния в возбуждённое называется ионизацией атома. Ионизация - отрыв эл-на от атома.
Энергия ионизации (nj=, ni=1):
![]() эВ
эВ
В любом стац. состоянии эл-н способен выйти из него. Энергия, которую нужно сообщить эл-ну, находящемуся в возб. состоянии для его выхода из атома называют энергией связи электрона.
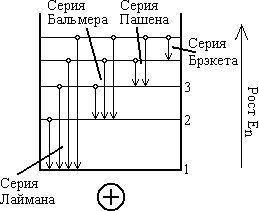
Происхождение спектральных серий согласно теории Бора
Согласно теории Бора, спектральные закономерности объясняются излучением электромагнитных волн при переходе от дальних орбит к ближним.
n
![]()
Происхождение серий объясняется переходом электрона на один уровень с различных уровней.
Определение постоянной Ридберга
![]() ,
покажем что это значение можно получить
теоретически. Рассм. переход с nj
на ni,
согласно постулату Бора при таком
переходе квант энергии
,
покажем что это значение можно получить
теоретически. Рассм. переход с nj
на ni,
согласно постулату Бора при таком
переходе квант энергии
![]() - разность энергии эл-на в стацион.
состояниях.
- разность энергии эл-на в стацион.
состояниях.
![]() ;
;
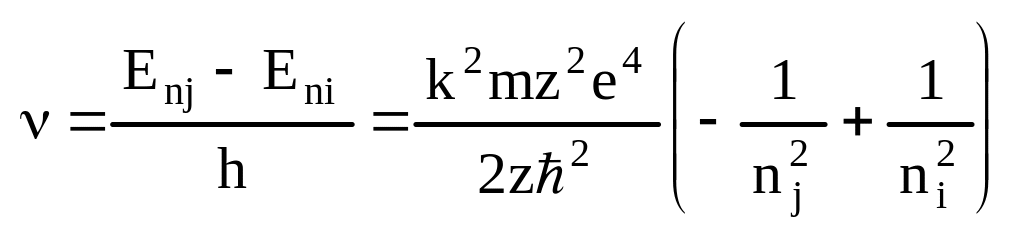 ;
;
![]() ;
;
![]() ;
;
![]()
z=1:
![]() ;
;
![]()
Для неводородоподобных атомов (z1):
![]()
Значение и недостатки теории Бора
1) Теория Бора смогла объяснить спектральные закономерности для атома водорода.
2) Теория дала возможность теоретически расчитать постоянную Ридберга, введённую Бальмером, при этом теория сошлась с экспериментом.
3) Теория Бора была прогрессивной - введены элементы квантования. Благодаря новизне квантования тоерия Бора послужила базой для создания новой физики, называемой квантовой механикой.
4) Простейшие модельные представления.
Недостатки:
1) Теория Бора нестрого последовательна (полуклассическая и полуквантовая). Одновременно с применением классических законов физики Бор предложил элементы квантования.
2) Теория Бора справедлива только для атома водорода и водородоподобных ионов. Атом гелия отдыхает.
3) Теория Бора не объясняет спектральных линий.
4) Теория бора не объясняет дуплетность спектральных линий.
5) Никаких понятий и спине теория Бора не включает.
