
- •Глава 1. Геометрические основы изображения диаграмм состояния тройных систем......................4
- •3.1. Пространственная диаграмма
- •Глава 1. Геометрические основы изображения диаграмм состояния тройных систем
- •1.1. Изображение составов тройных сплавов
- •1.2. Правило рычага и центра тяжести треугольника
- •1.3. Классификация диаграмм состояния тройных систем
- •Глава 2. Диаграмы состояния тройных систем с неограниченной растворимостью компонентов в твердом и жидком состоянии (с бивариантным равновесием)
- •Глава 3. Диаграмма состояния с неограниченной растворимостью компонентов в жидком состоянии и отсутствием взаимодействия в твердом состоянии (с образованием двойной и тройной эвтектики)
Московский
государственный технический университет
им. Н. Э. Баумана
Калужский филиал
Л. А. Московских
Методическое
пособие по курсу «Материаловедение»
«Диаграммы
состояния трехкомпонентных систем»
Под редакцией
проф. В. В. Лебедева.
Калуга 2004
УДК
669.01
ББК 30.3. М82
Данное
методическое пособие издается в
соответствии с учебным планом
специальности 200100. «Микроэлектроника
и твердотельная электроника»
Методическое
пособие рассмотрено и одобрено: кафедрой
«Материаловедение», ЭИУ4-КФ
Протокол № _______
от ___________
_______________
Зав. каф. д.т.н., проф. В.Г. Косушкин
методической
комиссии факультета «Электроника,
информатика и управление», ЭИУК.
Протокол № _______
от ___________
Председатель
методической
____________________
комиссии М.Ю. Адкин
методической
комиссией Калужского филиала МГТУ им.
Н.Э. Баумана
Протокол № _______
от ___________
Председатель
методической
___________________
комиссии А.В. Максимов
Рецензент
___________________ к.т.н., доцент Винокурова
Н.А.
Автор
___________________ к.х.н., доцент Московских
Л.А.
Аннотация
Методическое
пособие содержит:
геометрические
основы изображения диаграмм состояния
тройных систем;
анализ диаграмм
состояния с бивариантным равновесием;
с образованием двойной и тройной
эвтектики;
контрольные
вопросы и пример варианта контроля.
Калужский
филиал МГТУ им. Н.Э. Баумана
Московских
Л.А.
СОДЕРЖАНИЕ
ИЗОБРАЖЕНИЕ
СОСТАВОВ ТРОЙНЫХ СПЛАВОВ.....4
ПРАВИЛО
РЫЧАГА И ЦЕНТРА ТЯЖЕСТИ
ТРЕУГОЛЬНИКА..................................................................8
КЛАССИФИКАЦИЯ
ДИАГРАММ СОСТОЯНИЯ ТРОЙНЫХ
СИСТЕМ..........................................................10
ГЛАВА
2. ДИАГРАМЫ СОСТОЯНИЯ ТРОЙНЫХ СИСТЕМ С
НЕОГРАНИЧЕННОЙ РАСТВОРИМОСТЬЮ
КОМПОНЕНТОВ В ТВЕРДОМ И ЖИДКОМ СОСТОЯНИИ
(с бивариантным
равновесием)...................................................................................11
2.1.
ПРОСТРАНСТВЕННАЯ ДИАГРАММА
СОСТОЯНИЯ.......................................................................11
2.2.
КРИСТАЛЛИЗАЦИЯ ТРОЙНЫХ СПЛАВОВ –
ТВЕРДЫХ
РАСТВОРОВ....................................................13
2.3.
ИЗОТЕРМИЧЕСКИЕ РАЗРЕЗЫ И ИХ
СВОЙСТВА.......16
2.4.
ПОЛИТЕРМИЧЕСКИЕ РАЗРЕЗЫ И ИХ СВОЙСТВА...21
ГЛАВА
3. ДИАГРАММА СОСТОЯНИЯ С НЕОГРАНИЧЕННОЙ
РАСТВОРИМОСТЬЮ КОМПОНЕНТОВ В ЖИДКОМ
СОСТОЯНИИ И ОТСУТСТВИЕМ ВЗАИМОДЕЙСТВИЯ
В ТВЕРДОМ СОСТОЯНИИ (с образованием
двойной и тройной
эвтектики).............................23
СОСТОЯНИЯ.......................................................................23
3.2.
КРИСТАЛЛИЗАЦИЯ СПЛАВОВ И ИХ СТРУКТУРА...25
3.3.
ИЗОТЕРМИЧЕСКИЕ
РАЗРЕЗЫ........................................27
3.4.
ПОЛИТЕРМИЧЕСКИЕ
РАЗРЕЗЫ....................................29
Контрольные
вопросы...................................................................32
Пример
варианта
контроля...........................................................33
Список
литературы........................................................................34
ДИАГРАММЫ
СОСТОЯНИЯ ТРЕХКОМПОНЕНТНЫХ СИСТЕМ
В
настоящем пособии рассматриваются
диаграммы состояния трехкомпонентных
систем, отражающие зависимость состава
и числа фаз в равновесных системах от
исходного состава сплава и от температуры
при
постоянном давлении.
При
построении диаграммы состояния состав
сплава изображают на плоскости, а в
направлении перпендикулярном плоскости
откладывают температуру.
Геометрической
фигурой, на плоскости которой обычно
изображают составы тройных сплавов,
является равносторонний концентрационный
треугольник, рис. 1.
Рис. 1. Концентрационный
треугольник
Вершины
этого треугольника отвечают чистым
компонентам
а)
Метод
Гиббса.
Метод
основан на свойстве равностороннего
треугольника: сумма длин перпендикуляров,
опущенных из любой точки равностороннего
треугольника на каждую из сторон равна
высоте треугольника. Если принять, что
длина высоты концентрационного
треугольника равна
Длина
перпендикуляров оценивается с помощью
сетки, покрывающей треугольник. Сетка
состоит из двух групп линий, причем
прямые каждой из групп проведены
перпендикулярно соответствующей высоте
треугольника и делят эту высоту на
(или
При
отыскании на плоскости треугольника
фигуративной точки тройной системы по
заданному ее химическому составу
поступают так: к двум сторонам
треугольника, например
Рис. 2. Определение
фигуративной точки трехкомпонентного
сплава по методу Гиббса
б)
Метод
Розебома.
В
этом методе за весь сплав
Рис. 3. Определение
фигуративной точки тройного сплава по
методу Розембома
Отрезки
,
,
нанесены пунктиром на рис. 1. Чтобы,
определить концентрацию компонентов
в тройном сплаве, через данную точку
проводят линии, параллельные сторонам
треугольника. Длина отрезка линии,
доведенной до одной из сторон треугольника,
определяет концентрацию того компонента,
который отвечает вершине треугольника,
противолежащей этой стороне (т.е. по
отрезку, доведенному до стороны
,
определяет процентное содержание
компонента
и т.д.).
При
отыскании фигуративной точки тройного
сплава по методу Розебома проводят
построение, аналогичное предыдущему.
На двух сторонах треугольника, например,
-
и
-
,
рис. 3, от вершин
и
в одном направлении (например, по ходу
часовой стрелки) откладывают отрезки
с)
Более простой способ определения
концентрации 3х
компонентного сплава – способ,
предложенный Ю. А. Геллером.
По
этому способу из рассматриваемой точки
проводят до пересечения с основанием
треугольника две линии, параллельные
двум другим сторонам треугольника,
рис. За.
Рис. 3а. Определение
концентрации тройного сплава по методу
Геллера:
Длина
отрезка
Особенности
химического состава сплавов.
Анализ
концентрационного треугольника
показывает что:
Вершины, треугольника
изображают чистые компоненты.
На сторонах
треугольника лежат точки, отвечающие
двойным сплавам;
Точки внутри
треугольника изображают тройные
сплавы.
Сплавы,
которые изображаются точками, лежащими
на линии параллельной стороне
треугольника, имеют постоянную
концентрацию, того компонента, который
находится в вершине треугольника,
противолежащей этой прямой. На рис. 3
Сплавы,
которые находятся на линии, проходящей
через какую-либо вершину треугольника,
характеризуется постоянным отношением
концентраций двух компонентов, которые
изображаются вершинами треугольника
по обе стороны от этой линии.
На
рис. 3 для сплавов, составы которых лежат
на линии
Процесс
кристаллизации тройных сплавов
подчиняется тем же правилам, что и
кристаллизация двойных сплавов, т.е.
правилу фаз и правилу рычага, только
применение последнего затруднено из-за
более сложного пространственного
изображения систем. Для тройных систем,
максимальное число фаз (при
Тройной сплав в
зависимости от условий взаимодействия
компонентов может быть одно, двух, трех
или четырехфазовым.
Относительные
количества равновесных фаз в 2-х фазной
области определяются с помощью известного
правила рычага и для этого определения
необходимо знать только химические
составы фаз.
Пусть
точки
и
изображают соответственно составы
двух равновесных фаз в тройном сплаве
т.
Рис. 4. Иллюстрация
правила отрезков в тройной системе
Геометрическим
образом равновесия этих двух фаз служит
конода
Сделаем
построение: соединим точки
,
,
,
линиями, построив, таким образом,
конодный треугольник
Рис. 5. Иллюстрация
правила центра тяжести треугольника
Это условие
механического равновесия рычага в виде
плоскости. Важно помнить:
Точка
всегда располагается внутри конодного
треугольника.
Точка
всегда центр тяжести конодного
треугольника и положение ее зависит
от количества сосуществующих фаз.
Если
,
,
– составы структурных составляющих,
то можно оценить их относительные
количества.
Классификация
диаграмм возможна по разным признакам,
но как и для двойных систем наиболее
удобна, классификация по характеру
взаимодействия компонентов в жидком
и твердом состоянии. Можно выделить
диаграммы состояния систем:
С
неограниченной растворимостью
компонентов в жидком и твердом состоянии;
С
неограниченной растворимостью
компонентов в жидком состоянии и
отсутствием взаимодействия в твердом;
С
неограниченной растворимостью в жидком
состоянии и граничными твердыми
растворами;
С неограниченной
растворимостью в жидком состоянии и
различными промежуточными фазами;
С полиморфными
компонентами;
С ограниченной
растворимостью компонентов в жидком
состоянии.
В настоящем пособии
рассмотрим в общих чертах процессы,
кристаллизации в простейших тройных
системах, где компоненты:
неограниченно
растворяются в жидком и твердом
состоянии;
не
взаимодействуют в твердом состоянии,
неограниченно растворяются в жидком
состоянии.
Такие
диаграммы простейшие, встречаются
редко. Условие образования непрерывных
твердых растворов между тремя компонентами
,
,
,
аналогичны условиям образования
непрерывных двойных твердых растворов.
2.1.
ПРОСТРАНСТВЕННАЯ ДИАГРАММА СОСТОЯНИЯ
Для
изображения фазовых равновесий в
тройных сплавах системы
-
-
при разных температурах плоскости
концентрационного треугольника
недостаточно, поэтому приходится
строить пространственные диаграммы
состояния в координатах состав –
температура. Такая диаграмма представляет
собой прямоугольную трехгранную призму,
основанием которой служит концентрационный
треугольник
-
-
,
а гранями – диаграммы состояния двойных
систем
-
;
-
и
-
.
Очевидно,
строение пространственной диаграммы
состояния тройной системы определяется
характером диаграмм состояния двойных
систем на ее боковых гранях. При
отсутствии на кривых ликвидуса и
солидуса в двойных системах
-
;
-
и
-
экстремальных точек (максимума или
минимума) пространственная диаграмма
состояния тройной системы
-
-
с непрерывными рядами жидких
Рис. 6. Диаграмма
состояния 3-х компонентной системы с
неограниченной растворимостью
компонентов в жидком и твердом состоянии
Через
кривые ликвидуса диаграмм состояния
двойных систем
-
;
-
и
-
в
пространственной диаграмме проходит
поверхность ликвидуса (начала
кристаллизации), а через кривые солидуса
- поверхность солидуса (конца
кристаллизации) тройных
– твердых растворов. Эти поверхности
пересекаются, только на ординатах
компонентов
,
При
всех температурах выше поверхности
ликвидуса сплавы рассматриваемой
системы
-
-
находятся в жидком состоянии и
представляют собой ненасыщенные
(относительно
– кристаллов) жидкие растворы
.
При температурах ниже поверхности
солидуса все сплавы, наоборот, находятся
в твердом состоянии и представляют
собой ненасыщенные твердые
– растворы. Только в интервале температур
между поверхностями ликвидуса и солидуса
(т. е. в интервале кристаллизации или
плавления) сплавы состоят из двух фаз
– жидкости
и
– кристаллов.
В
зависимости от химического состава
разные сплавы – растворы имеют различный
интервал кристаллизации (плавления).
Узкий интервал характерен для сплавов,
расположенных около вершин концентрационного
треугольника, а широкий, наоборот, для
сплавов из средней части системы.
Из
термодинамической теории растворов
следует, что поверхность ликвидуса в
пространственной диаграмме состояния
своей выпуклостью обычно обращена в
сторону более высоких температур (т.
е. объема жидких растворов
),
а поверхность солидуса – в сторону
более низких температур (объема
– твердых растворов), хотя из этой
закономерности возможны исключения.
2.2.
КРИСТАЛЛИЗАЦИЯ ТРОЙНЫХ СПЛАВОВ –
ТВЕРДЫХ
РАСТВОРОВ
Кристаллизация
тройных
– твердых растворов напоминает
кристаллизацию двойных сплавов –
растворов, но имеет свои особенности.
Согласно правилу фаз кристаллизующийся
тройной сплав – раствор имеет две
степени свободы (
Таким
образом, разница между двойными и
тройными сплавами-растворами выявляется
при сравнении их путей кристаллизации,
т. е. кривых, по которым изменяются
составы жидкости и
–
кристаллов в интервале кристаллизации.
В качестве примера рассмотрим
кристаллизацию тройного сплава –
раствора
(см. рис. 6). Заметим, что в рассматриваемой
системе
-
-
самым тугоплавким является компонент
,
самым легкоплавким – компонент
,
а компонент
имеет промежуточную температуру
плавления, т.е.
Кристаллизация
сплава
начнется при температуре
Положение
первой коноды
При
понижении температуры ниже
состав выпадающих из жидкости
–
кристаллов
не остается постоянным; он изменяется
по пространственной кривой
О
полноте кристаллизации сплава
при температуре
можно судить по отношениям отрезков,
измеряющим относительные количества
жидкости
и
Кристаллизация
сплава
закончится при температуре
Подводя
итог, отметим, что пространственные
кривые
и
на поверхностях ликвидуса и солидуса
не лежат в какой-либо одной вертикальной
плоскости, о чем свидетельствуют их
проекции
и
на плоскости, концентрационного
треугольника. При кристаллизации сплава
коноды, соединяющие точки составов
жидкости
и
–
кристаллов,
перемещаются в сторону более низких
температур и, сохраняя горизонтальное
положение, поворачиваются вокруг
фигуративной прямой (или точки) сплава.
При этом одним концом они «скользят»
по поверхности ликвидуса, описывая на
ней кривую
,
а другим концом – по поверхности
солидуса, описывая вторую кривую
.
Нетрудно
видеть, что при понижении температуры
коноды вращаются вокруг фигуративной
прямой (или точки) сплава
в том же направлении, в котором понижаются
температуры плавления компонентов
2.3.
ИЗОТЕРМИЧЕСКИЕ
РАЗРЕЗЫ И ИХ СВОЙСТВА
Если
пространственную диаграмму состояния
(рис. 6) рассечь несколькими горизонтальными
плоскостями, параллельными плоскости
концентрационного треугольника, то
получим горизонтальные или изотермические
разрезы.
Предположим,
что в рассматриваемой системе
-
-
компоненты
,
и
,
плавятся соответственно при температурах
Рис. 7. Изотермический
разрез при
Поверхность
ликвидуса горизонтальная плоскость
Очевидно,
кривизна этих изотерм определяется
характером поверхностей ликвидуса и
солидуса. Обычно изотерма ликвидуса
своей выпуклостью обращена в сторону
области жидких растворов
,
а изотерма солидуса
,
наоборот, – в сторону области
– твердых растворов (рис. 8).
Рис. 8. Проекции ликвидуса и солидуса
на плоскость концентрационного
треугольника
Все
сплавы, расположенные на одной изотерме
ликвидуса, начинают кристаллизоваться
при одинаковой температуре. Например,
кристаллизация сплавов, расположенных
на изотерме ликвидуса
Обычно
при исследовании диаграмм состояния
тройных систем изотермы ликвидуса и
солидуса проектируют на плоскость
концентрационного треугольника
приписывая этим кривым соответствующие
температуры. В зависимости от числа
изотермических разрезов (или их «шага»
по температуре) число проектируемых
изотерм может быть различным. Чтобы
избежать путаницы, проекции изотерм
ликвидуса и солидуса изображают отдельно
– каждые на своем концентрационном
треугольнике (рис. 9, а и б). Шаг между
отдельными изотермами может быть
различным (на рис. 9 он равен
Рис. 9. Проекция
изотерм на плоскость концентрационного
треугольника (a
– проекции ликвидуса, б
– проекции солидуса)
На
рис. 9а видно, что изотермы ликвидуса
своей выпуклостью обращены в направлении
– понижения температуры на поверхности
ликвидуса, а изотермы солидуса рис. 9б,
наоборот, – в направлении повышения
температуры на поверхности солидуса.
Подобно тому, как сгущение или разрежение
горизонталей на географической карте
свидетельствует о крутизне подъема
(или спуска) на местности, так и на
проекциях поверхностей ликвидуса и
солидуса сгущение или разрежение
изотерм указывает на большую или меньшую
кривизну этих поверхностей.
Имея
концентрационные треугольники с
изотермами ликвидуса и солидуса, всегда
можно ответить на вопрос о температурах
начала и конца кристаллизации любого
тройного сплава. Например, сплав
,
фигуративная точка которого располагается
между изотермами ликвидуса при
Изотермы
ликвидуса и солидуса, построенные при
одной и той же температуре (см. рис. 8),
изображают также составы жидкости
Как
и в пространственной диаграмме состояния
(рис. 7), коноду
можно принять за рычаг, а фигуративную
точку сплава
– за его точку опоры. Тогда относительные
количества жидкости
Из
изложенного следует, что полностью
построенный изотермический разрез
(изотермы ликвидуса и солидуса, плюс
коноды) при
позволяет указать не только составы
равновесных фаз в любом тройном сплаве,
но и определить (с помощью правила
рычага) их относительные количества,
если сплав находится в двухфазной
области (
).
Отсюда вытекает, что изотермические
разрезы данной тройной системы (и других
систем) характеризуют фазовые равновесия
в тройных сплавах как в качественном,
так и количественном отношении.
По
существу сведения о тройных сплавах,
получаемые с помощью изотермических
разрезов, аналогичны сведениям о двойных
сплавах, получаемых из диаграмм состояния
двойных систем. Разница между
изотермическими разрезами и диаграммами
состояния двойных систем состоит лишь
в том, что диаграмма состояния двойной
системы позволяет судить о фазовых
равновесиях в различных сплавах в
широком интервале температур, а
изотермический разрез диаграммы
состояния тройной системы – лишь при
одной температуре. Выход из этого
положения, очевидно, заключается в
построении не одного, а нескольких
изотермических разрезов при всех
требуемых температурах, что обычно и
делают на практике.
2.4.
ПОЛИТЕРМИЧЕСКИЕ РАЗРЕЗЫ И ИХ СВОЙСТВА
Рассмотренные
свойства изотермических разрезов
особенно четко выявляются при сравнении
их со свойствами политермических
разрезов, которые можно построить,
рассекая пространственную диаграмму
состояния вертикальными плоскостями
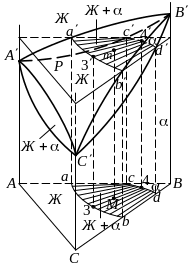
(рис. 10а). Кривые
Рис. 10. Политермические разрезы
По
аналогии кривые
Как
и на диаграммах состояния двойных
систем, интервал температур между
кривыми ликвидуса и солидуса на
политермических разрезах
и
называют интервалом кристаллизации
(или плавления). Все сплавы разрезов
и
в интервале кристаллизации состоят из
жидкости
и
– кристаллов.
Подобно
поверхностям ликвидуса и солидуса в
пространственной диаграмме состояния
(рис. 6), кривые ликвидуса (солидуса) на
политермических разрезах своей
выпуклостью обычно (но не всегда)
обращены соответственно в сторону
жидкой фазы (твердых
– растворов). Нетрудно заметить, что
политермические разрезы
и
внешне похожи на диаграммы состояния
двойных систем
-
,
-
или
-
,
хотя двойные сплавы
С
помощью политермического разреза
нельзя проследить за тем, как изменяются
составы равновесных жидкости
и
– кристаллов в интервале кристаллизации
заданного тройного сплава, и определять
их относительные количества, поскольку
точки изображающие составы равновесных
фаз, в общем случае не находятся в
плоскости того или иного политермического
разреза.
Политермические
разрезы позволяют прослеживать только
за изменением фазового состояния
тройных сплавов в зависимости от их
состава и температуры, т. е. судить о
фазовых превращениях, протекающих в
различных сплавах в условиях, которые
не сильно отличаются от равновесных.
Следовательно, по своим свойствам
политермические разрезы отличаются
от диаграмм состояния двойных систем,
а также от изотермических разрезов,
которые исчерпывающе описывают фазовые
равновесия соответственно в двойных
и тройных сплавах.
Несмотря на это,
политермические разрезы также широко
используют в металловедческой практике,
дополняя сведения о тройных сплавах,
получаемые с помощью изотермических
разрезов. По диаграмме состояния
политермического разреза судят о числе
и природе критических точек в тройных
сплавах. Особенно велика роль
политермических разрезов в обосновании
технологии производства сплавов,
поскольку от знания температур
критических точек и их природы зависит
выбор оптимальных режимов плавки,
литья, горячей обработки давлением и
термической обработки сплавов.
3.1.
ПРОСТРАНСТВЕННАЯ ДИАГРАММА СОСТОЯНИЯ
Эта диаграмма
описывает процесс кристаллизации в
том случае, когда из расплава выделяются
только чистые кристаллические компоненты
системы (рис. 11). Боковые поверхности
объемной диаграммы представляют собой
три диаграммы состояния бинарных систем
с эвтектикой. Температуры кристаллизации
эвтектики различны. В развернутом виде
такая диаграмма показана, на рис. 12.
В пространственной
диаграмме, рис. 11, можно выделить две
поверхности: поверхность ликвидуса и
поверхность солидуса.
1)
Ликвидус, совокупность температур,
отвечающих началу выделения кристаллов
компонента
,
либо
,
либо
из трехкомпонентных сплавов разного
состава,
Если
спроектировать линии
,
,
на основание диаграммы (концентрационный
треугольник), рис. 11, то их проекции
Рис. 11. Диаграмма
состояния трехкомпонентной системы
-
-
,
компоненты которой не взаимодействуют
в твердом состоянии
Точка
Схема
эвтектического превращения:
2)
Солидус – совокупность температур
конца кристаллизации сплавов в
зависимости от их состава, представляет
собой горизонтальную плоскость,
параллельную плоскости основания и
проходящую через точку эвтектики
.
Рис. 12. Развертка диаграммы, общий вид
которой дан на рис. 11.
3.2.
КРИСТАЛЛИЗАЦИЯ
СПЛАВОВ И ИХ СТРУКТУРА
Последовательность
процессов кристаллизации без установления
температур фазовых превращений можно
определить по плоскостному изображению
диаграммы, рис. 12.
Рассмотрим
процесс кристаллизации сплава состава
точки
на рис. 12. При достижении температуры
ликвидуса (несколько ниже ее) начинается
процесс кристаллизации компонента
.
(
Структура
трехкомпонентных сплавов, природа
первичных кристаллов и двойной эвтектики
будет зависеть от того, в какой области
диаграммы находятся концентрационная
точка сплава:
В
сплавах, лежащих на линиях двойных
эвтектик (
,
,
)
не будет первичных кристаллов чистых
компонентов. В этих сплавах кристаллизация
начнется сразу с выделения двойной
эвтектики.
Сплавы,
лежащие на линиях, соединяющих точку
эвтектики и вершину треугольника, не
будут иметь в структуре двойной
эвтектики. Применяя правило прямой
линии, приходим к выводу, что в таких
сплавах после выделения чистого
компонента жидкость примет концентрацию
точки
и тогда начнется кристаллизация тройной
эвтектики.
Сплав,
отвечающей точке
состоит только из тройной эвтектики.
В данной системе это самый легкоплавкий
сплав. Процесс кристаллизации его
начинается при температуре эвтектики
(точки
)
с одновременным выделением кристаллов
всех трех компонентов.
В
области
В
области
В
области
В
области
В
области
В
области
Рис. 13. Общий вид
кривой охлаждения сплава точки
3.3.
ИЗОТЕРМИЧЕСКИЕ РАЗРЕЗЫ
Рассекая
объемную диаграмму состояния
изотермическими плоскостями при разных
температурах, мы получим на поверхности
ликвидуса кривые, отвечающие этим
температурам. Проекции этих кривых на
основание диаграммы образуют сеть
горизонталей, позволяющую судить о
рельефе поверхности ликвидуса; определять
последовательность выделения различных
фаз при кристаллизации, а также состав
и относительные количества фаз,
образующихся при определенной
температуре.
Рис. 14. Сечение
диаграммы состояния изотермической
при
Рассмотрим
сечение, соответствующее температуре
на
рис. 14. Линия
– след сечения. Сплавы, составы, которых
лежат на линии
Рис. 15. Сечение
объемной диаграммы состояния
изотермической плоскостью при
При
температуре
отношение между количеством твердой
фазы и расплава находится по правилу
рычага.
(количество
твердой фазы
/
количество расплава) =
Сечение
объемной диаграммы плоскостью, отвечающей
температуре более низкой, чем температуры
плавления чистых компонентов, но более
высокой, чем точка затвердевания
эвтектики (например, плоскостью,
отвечающей
)
представлено на рис. 15. Сплав состава
точки
(общее
количество кристаллов / количество
расплава) =
Зная общее
количество кристаллов, найдем количество
каждого кристаллического компонента:
(количество
/ количество
)
=
В справочной
литературе помимо общего вида диаграммы
состояния приводится плоскостная
проекция (концентрационного треугольника)
с нанесенными проекциями изотерм при
различных температурах. По положению
фигуративной точки сплава оценивают
приблизительно температуры фазовых
превращений, а также состав и относительное
количество фаз так, как это сделало
выше для диаграммы с неограниченной
растворимостью компонентов в твердом
состоянии.
3.4.
ПОЛИТЕРМИЧЕСКИЕ РАЗРЕЗЫ
Политермические
разрезы анализируемой диаграммы,
состояния оказываются более сложными
по сравнению с аналогичными разрезами
диаграммы состояния с непрерывными
рядами жидких и твердых растворов, т.к.
в большинстве сплавов помимо первичных
кристаллов
,
,
– выделяется двойная эвтектика; тройная
эвтектика. В связи с этим полезно назвать
этапы построения политермического
разреза:
а)
нанесение
на линию разреза (или плоскость
концентрационного треугольника)
характерных сплавов, отвечающих точкам
пересечения разреза с проекциями
различных кривых и прямых, т.е. разделения
разреза на отдельные участки;
б)
построение
кривой ликвидуса, т.е. следов от сечения
вертикальной плоскостью разреза
поверхностей начала кристаллизации
компонентов;
в)
построение
кривой солидуса, т.е. следов от сечения
вертикальной плоскостью разреза
поверхности тройной эвтектики;
г)
построение
промежуточных кривых между кривыми
ликвидуса и солидуса, т.е. кривых начала
кристаллизации двойных эвтектик.
Рекомендуемая
методика построения политермических
разрезов показана на примере разрезов,
На
разрезе
– можно отметить один характерный
сплав состава точки
На
рис. 17 след от сечения вертикальной
плоскостью поверхности ликвидуса
Рис. 16. Концентрационный
треугольник пространственной диаграммы
рис. 11,
,
– следы политермических разрезов
Рис. 17. Политермический
разрез по линии
На
этом разрезе, рис. 18, можно выделить два
характерных сплава. Сплав точки 2: его
кристаллизация начинается с выделения
кристаллов двойной эвтектики
Рис. 18. Политермический
разрез по линии
рис. 16.
Верхняя
линия на разрезе – ликвидус, след
сечения плоскостью разреза поверхности
ликвидус, нижняя линия – солидус, след
от сечения поверхностью разреза
поверхности солидус. Между линией
ликвидуса и солидуса расположена линия,
показывающая начало выделения двойных
эвтектик. Сплав точки 2 в соответствии
с построенным
разрезом имеет 2 критических точки и
структуру
Контрольные
вопросы
Для защиты темы
- диаграммы состояния тройных систем
- необходимо:
Определять состав
сплава в любой точке концентрационного
треугольника. Уметь нанести состав
заданного сплава на плоскости
концентрационного треугольника.
Знать особенности
химического состава сплавов, составы
которых лежат в вершине треугольника;
на сторонах его; внутри; на линиях,
проходящих через его вершину.
Уметь применять
правило рычага и центра тяжести
треугольника.
Рассматривать
процесс кристаллизации любого сплава,
приводя кривую охлаждения, схемы
происходящих превращений, структуру
сплава; количественное соотношение
фаз и структурных составляющих.
Уметь рисовать:
Изотермические
разрезы диаграмм и с их помощью
определять составы равновесных фаз
и их относительные количества.
Политермические
разрезы диаграмм, определяя с их
помощью критические точки сплавов.
Пример варианта
контроля:
Обозначить
на плоскости концентрационного
треугольника
Какова
особенность химического состава
сплавов, изображенных точками на
линии
Нарисовать
изотермический разрез при
При
Построить
политермический разрез по линии
Построить
изотермический разрез при
Список литературы
Захаров
A.M.
Диаграммы состояния двойных и тройных
систем, М. Металлургия, 1978. – 292 с.
Лахтин
Ю.М., Леонтьева B.П.,
Материаловедение,
М. Машиностроение, 1990. – 528 с.
Материаловедение:
Учебник для вузов / Арзамасов Б.Н.,
Макарова В.И., Мухин Г.Г. и др. под общей
редакцией Арзамасова Б.Н, 3-е изд. М.:
Изд-во МГТУ им. Н.Э. Баумана, 2001, 648с.
Научные
основы материаловедения: Учебник для
вузов / Арзамасов Б.Н., Крашенинников
А.И., Пастухова Ж.П., Рахштадт А.Г. М.:
Изд-во МГТУ им. Н.Э. Баумана, 1994, 366с.
Глава 1. Геометрические основы изображения диаграмм состояния тройных систем......................4
3.1. Пространственная диаграмма
Глава 1. Геометрические основы изображения диаграмм состояния тройных систем
1.1. Изображение составов тройных сплавов

![]() ,
,
![]() и
и
![]() ,
соответственно. Три равные стороны
позволяют описать составы, двухкомпонентных
систем
-
;
-
;
-
.
Точки, лежащие внутри треугольника
изображают составы тройных систем
-
-
.
Для определения состава трехкомпонентной
системы есть два способа:
,
соответственно. Три равные стороны
позволяют описать составы, двухкомпонентных
систем
-
;
-
;
-
.
Точки, лежащие внутри треугольника
изображают составы тройных систем
-
-
.
Для определения состава трехкомпонентной
системы есть два способа:![]() весовым (или мольным) процентам, то
состав тройной системы можно выразить
с помощью длин вышеупомянутых
перпендикуляров. При этом содержанию
данного компонента будет отвечать
длина перпендикуляра, опущенного на
сторону, противоположную соответствующей
вершине треугольника. Так например,
точка
весовым (или мольным) процентам, то
состав тройной системы можно выразить
с помощью длин вышеупомянутых
перпендикуляров. При этом содержанию
данного компонента будет отвечать
длина перпендикуляра, опущенного на
сторону, противоположную соответствующей
вершине треугольника. Так например,
точка
![]() отвечает составу:
отвечает составу:
![]() компонента
(отрезок
компонента
(отрезок
![]() ),
),
![]() компонента
(отрезок
компонента
(отрезок
![]() )
и
)
и
![]() компонента
(отрезок
компонента
(отрезок
![]() ).
).![]() )
частей.
)
частей.![]() и
и
![]() ,
рис. 2, в произвольных точках
,
рис. 2, в произвольных точках
![]() и
и
![]() восстанавливают перпендикуляры, на
которых в определенном масштабе
откладывают отрезки
восстанавливают перпендикуляры, на
которых в определенном масштабе
откладывают отрезки
![]() и
и
![]() отвечающие концентрациям компонентов
и
.
Через полученные точки
отвечающие концентрациям компонентов
и
.
Через полученные точки
![]() и
и
![]() ,
проводят прямые
,
проводят прямые
![]() и
и
![]() ,
параллельные названным сторонам
треугольника. Точка
,
параллельные названным сторонам
треугольника. Точка
![]() пересечения этих прямых будет изображать
состав искомого тройного сплава.
пересечения этих прямых будет изображать
состав искомого тройного сплава.
![]() принимают сторону концентрационного
треугольника. Используется свойство:
если через заданную точку
,
лежащую внутри равностороннего
треугольника, провести прямые,
параллельные сторонам, то расходящиеся
из точки
под углом
принимают сторону концентрационного
треугольника. Используется свойство:
если через заданную точку
,
лежащую внутри равностороннего
треугольника, провести прямые,
параллельные сторонам, то расходящиеся
из точки
под углом
![]() отрезки
отрезки
![]() ,
,
![]() ,
,
![]() ,
в сумме равны стороне треугольника,
т.е.
,
в сумме равны стороне треугольника,
т.е.
![]() .
.
![]() и
и
![]() характеризующие
в избранном масштабе концентрации
компонентов
и
.
Затем через точки
характеризующие
в избранном масштабе концентрации
компонентов
и
.
Затем через точки
![]() и
и
![]() проводят прямые
и
,
параллельные сторонам треугольника
и
.
Искомый тройной сплав будет в точке
пересечения этих прямых, (т.
).
проводят прямые
и
,
параллельные сторонам треугольника
и
.
Искомый тройной сплав будет в точке
пересечения этих прямых, (т.
).
![]() – содержание
;
– содержание
;![]() – содержание
;
– содержание
;![]() – содержание
– содержание
![]() покажет содержание компонента
,
расположенного в противоположенной
вершине; длина отрезка
покажет содержание компонента
,
расположенного в противоположенной
вершине; длина отрезка
![]() ,
прилегающего к компоненту
,
определит содержание
.
Содержание компонента
определится
отрезком
.
,
прилегающего к компоненту
,
определит содержание
.
Содержание компонента
определится
отрезком
.
![]() ,
следовательно, для всех сплавов прямой
,
следовательно, для всех сплавов прямой
![]() постоянное содержание
(
постоянное содержание
(![]() ).
).![]() ,
отношение
,
отношение
![]() .
В
сплавах, составы, которых лежат на
высоте треугольника одинаково содержание
двух компонентов, которые находятся в
вершинах треугольника по обе стороны
от высоты. На рис. 3 для сплавов, отвечающих
точкам на линии
.
В
сплавах, составы, которых лежат на
высоте треугольника одинаково содержание
двух компонентов, которые находятся в
вершинах треугольника по обе стороны
от высоты. На рис. 3 для сплавов, отвечающих
точкам на линии
![]() ,
,
![]() .
.1.2. Правило рычага и центра тяжести треугольника
![]() давлении) равно 4 (нонвариантное
равновесие):
давлении) равно 4 (нонвариантное
равновесие):![]() .
.![]() при некоторой заданной температуре,
рис. 4.
при некоторой заданной температуре,
рис. 4.
![]() ,
проходящая через фигуративную точку
сплава т.
,
проходящая через фигуративную точку
сплава т.
![]() и соединяющая точки
и
.
Коноду
можно рассматривать и как рычаг, а
фигуративную точку сплава, т.
– как точку опоры этого рычага. Отсюда
относительное весовое количество фазы
(о.в.к.
)
можно определить:
и соединяющая точки
и
.
Коноду
можно рассматривать и как рычаг, а
фигуративную точку сплава, т.
– как точку опоры этого рычага. Отсюда
относительное весовое количество фазы
(о.в.к.
)
можно определить:
![]() ,
а относительное весовое количество
второй фазы,
,
(о.в.к.
):
,
а относительное весовое количество
второй фазы,
,
(о.в.к.
):
![]() .Соотношение
количества фаз
и
в сплаве определится отношением отрезков
.Соотношение
количества фаз
и
в сплаве определится отношением отрезков
![]() .
Если
,
– составы структурных составляющих,
то можно определить их относительное
количество. Если тройной сплав
при заданных условиях (
.
Если
,
– составы структурных составляющих,
то можно определить их относительное
количество. Если тройной сплав
при заданных условиях (![]() )
состоит из трех равновесных фаз
,
,
)
состоит из трех равновесных фаз
,
,
![]() (рис. 5), то для определения их относительных
количеств пользуются правилом центра
тяжести.
(рис. 5), то для определения их относительных
количеств пользуются правилом центра
тяжести.![]() .
Через вершины конодного треугольника
и точку, изображающую сплав, т.
,
проведем прямые до пересечения с
противоположными сторонами этого
треугольника.
Тогда: относительное весовое количество
(о.в.к.) фазы
.
Через вершины конодного треугольника
и точку, изображающую сплав, т.
,
проведем прямые до пересечения с
противоположными сторонами этого
треугольника.
Тогда: относительное весовое количество
(о.в.к.) фазы
![]() ;
о.в.к. фазы
;
о.в.к. фазы
![]() ;
о.в.к. фазы
;
о.в.к. фазы
![]() .
.
1.3. Классификация диаграмм состояния тройных систем
Глава 2. Диаграмы состояния тройных систем с неограниченной растворимостью компонентов в твердом и жидком состоянии (с бивариантным равновесием)
![]() и твёрдых
и твёрдых
![]() – растворов выглядит несложно (рис.
6).
– растворов выглядит несложно (рис.
6).
![]() и
в точках
и
в точках
![]() ,
,
![]() и
и
![]() ,
отвечающих температурам кристаллизации
(плавления) компонентов.
,
отвечающих температурам кристаллизации
(плавления) компонентов.![]() ).
Это значит, во-первых, что тройные сплавы
– растворы кристаллизуются в интервале
температур (между поверхностями
ликвидуса и солидуса). Во-вторых,
кристаллизация тройного сплава-раствора
сопровождается изменениями составов
жидкости и
– кристаллов. Однако, если кристаллизация
двойных сплавов – растворов протекает
в вертикальной плоскости (т. е. плоскости
диаграммы состояния), когда состав
жидкости изменяется по плоской
кривой ликвидуса, а
состав выпадающих из нее кристаллов –
по аналогичной кривой солидуса, то
тройные сплавы – растворы кристаллизуются
в трехмерном
пространстве (т.
е. в пространственной диаграмме
состояния), в котором составы жидкости
и
– кристаллов изменяются по пространственным
кривым, расположенным соответственно
на
поверхностях ликвидуса и солидуса.
).
Это значит, во-первых, что тройные сплавы
– растворы кристаллизуются в интервале
температур (между поверхностями
ликвидуса и солидуса). Во-вторых,
кристаллизация тройного сплава-раствора
сопровождается изменениями составов
жидкости и
– кристаллов. Однако, если кристаллизация
двойных сплавов – растворов протекает
в вертикальной плоскости (т. е. плоскости
диаграммы состояния), когда состав
жидкости изменяется по плоской
кривой ликвидуса, а
состав выпадающих из нее кристаллов –
по аналогичной кривой солидуса, то
тройные сплавы – растворы кристаллизуются
в трехмерном
пространстве (т.
е. в пространственной диаграмме
состояния), в котором составы жидкости
и
– кристаллов изменяются по пространственным
кривым, расположенным соответственно
на
поверхностях ликвидуса и солидуса.![]() .
.![]() ,
когда его фигуративная точка (точка
,
когда его фигуративная точка (точка
![]() )
окажется
на поверхности ликвидуса или, иначе
говоря, когда жидкость
)
окажется
на поверхности ликвидуса или, иначе
говоря, когда жидкость
![]() станет
насыщенной относительно
– кристаллов. Состав первых
–
кристаллов, выделяющихся из жидкости
,
очевидно, определится точкой
станет
насыщенной относительно
– кристаллов. Состав первых
–
кристаллов, выделяющихся из жидкости
,
очевидно, определится точкой
![]() ,
расположенной на поверхности солидуса.
На
плоскости концентрационного треугольника
составы жидкости и
–
кристаллов в начальный момент
кристаллизации изобразятся соответственно
точками
и
,
расположенной на поверхности солидуса.
На
плоскости концентрационного треугольника
составы жидкости и
–
кристаллов в начальный момент
кристаллизации изобразятся соответственно
точками
и
![]() .
.![]() (или
(или
![]() )
таково, что она должна быть направлена
в сторону самого тугоплавкого компонента
.
Другими словами, как и при кристаллизации
двойных сплавов – растворов, первые
)
таково, что она должна быть направлена
в сторону самого тугоплавкого компонента
.
Другими словами, как и при кристаллизации
двойных сплавов – растворов, первые
![]() –
кристаллы в сплаве
должны быть обогащены компонентом,
повышающим его температуру солидуса.
Начальную стадию кристаллизации сплава
можно записать как
–
кристаллы в сплаве
должны быть обогащены компонентом,
повышающим его температуру солидуса.
Начальную стадию кристаллизации сплава
можно записать как
![]() (или
(или
![]() ).
).![]() на поверхности солидуса, а состав
кристаллизующейся жидкости –
соответственно по пространственной
кривой
на поверхности солидуса, а состав
кристаллизующейся жидкости –
соответственно по пространственной
кривой
![]() на поверхности ликвидуса (на плоскости
концентрационного треугольника кривые
на поверхности ликвидуса (на плоскости
концентрационного треугольника кривые
![]() и
и
![]() ).
При некоторой промежуточной температуре
).
При некоторой промежуточной температуре
![]() в интервале кристаллизации жидкость
в интервале кристаллизации жидкость
![]() (состава точки
(состава точки
![]() )
оказывается в равновесии с
–
кристаллами
(состава точки
)
оказывается в равновесии с
–
кристаллами
(состава точки
![]() ).
Конода
).
Конода
![]() ,
соединяющая точки
и
,
должна проходить через фигуративную
прямую
,
соединяющая точки
и
,
должна проходить через фигуративную
прямую
![]() нашего сплава (на плоскости концентрационного
треугольника конода
нашего сплава (на плоскости концентрационного
треугольника конода
![]() проходит через фигуративную точку
).
проходит через фигуративную точку
).![]() – кристаллов. В нашем примере количества
жидкости
и
– кристаллов примерно равны (
– кристаллов. В нашем примере количества
жидкости
и
– кристаллов примерно равны (![]() или
или
![]() ).
Следовательно, к рассматриваемому
моменту сплав
закристаллизуется примерно наполовину.
).
Следовательно, к рассматриваемому
моменту сплав
закристаллизуется примерно наполовину.![]() ,
когда все
–
кристаллы,
изменив свой состав по кривой
в направлении от точки
к точке
,
когда все
–
кристаллы,
изменив свой состав по кривой
в направлении от точки
к точке
![]() ,
примут состав исходного сплава. В этот
момент в сплаве, согласно правилу
рычага, должны исчезнуть последние,
следы жидкости
,
примут состав исходного сплава. В этот
момент в сплаве, согласно правилу
рычага, должны исчезнуть последние,
следы жидкости
![]() (состава точки
(состава точки
![]() ).
Конечную стадию кристаллизации сплава
запишем как
).
Конечную стадию кристаллизации сплава
запишем как
![]() (или
(или
![]() ).
При охлаждении до комнатной температуры
в сплаве
не происходит никаких фазовых превращений.
На кривой охлаждения этот сплав имеет
две критические точки (перегибы),
отвечающие температурам начала (
)
и конца (
)
его кристаллизации. Весь процесс
кристаллизации сплава
можно записать как
).
При охлаждении до комнатной температуры
в сплаве
не происходит никаких фазовых превращений.
На кривой охлаждения этот сплав имеет
две критические точки (перегибы),
отвечающие температурам начала (
)
и конца (
)
его кристаллизации. Весь процесс
кристаллизации сплава
можно записать как
![]() (или
(или
![]() ).
).![]() ,
и
,
и
![]() ,
следовательно, температура на поверхностях
ликвидуса и солидуса (см. выше). При этом
– кристаллы, будучи сначала обогащенными
тугоплавким компонентом
,
постепенно обогащаются более легкоплавкими
компонентами
и
.
Аналогично изменяется состав жидкости,
но если состав
– кристаллов постепенно приближается
к составу исходного сплава (точка
),
то состав жидкости, обогащающейся более
легкоплавкими компонентам
и
,
все время от него удаляется. Описанные
изменения составов жидкости и
– кристаллов сопровождаются увеличением
количества
– кристаллов и уменьшением количества
жидкости (во избежание нарушения
материального баланса по компонентам
в этих фазах). Аналогично сплаву
кристаллизуются другие тройные
сплавы-растворы.
,
следовательно, температура на поверхностях
ликвидуса и солидуса (см. выше). При этом
– кристаллы, будучи сначала обогащенными
тугоплавким компонентом
,
постепенно обогащаются более легкоплавкими
компонентами
и
.
Аналогично изменяется состав жидкости,
но если состав
– кристаллов постепенно приближается
к составу исходного сплава (точка
),
то состав жидкости, обогащающейся более
легкоплавкими компонентам
и
,
все время от него удаляется. Описанные
изменения составов жидкости и
– кристаллов сопровождаются увеличением
количества
– кристаллов и уменьшением количества
жидкости (во избежание нарушения
материального баланса по компонентам
в этих фазах). Аналогично сплаву
кристаллизуются другие тройные
сплавы-растворы.![]() ,
,
![]() и
и
![]() .
Тогда один из изотермических разрезов,
например, при
.
Тогда один из изотермических разрезов,
например, при
![]() можно построить, как показано на рис.
7.
можно построить, как показано на рис.
7.
![]()
![]() пересекает по кривой
пересекает по кривой
![]() ,
которую называют изотермой поверхности
ликвидуса (или просто изотермой
ликвидуса). Аналогично, кривую
,
которую называют изотермой поверхности
ликвидуса (или просто изотермой
ликвидуса). Аналогично, кривую
![]() или след от сечения горизонтальной
плоскостью разреза поверхности солидуса
называют изотермой поверхности солидуса
(или изотермой солидуса).
или след от сечения горизонтальной
плоскостью разреза поверхности солидуса
называют изотермой поверхности солидуса
(или изотермой солидуса).
![]() (рис. 8), начинается при
(рис. 8), начинается при
![]() ,
т. е. при той температуре, при которой
построена данная изотерма. Аналогично,
все сплавы, с одной и той же температурой
начала кристаллизации (ликвидуса)
должны иметь одинаковые температуры
конца кристаллизации (солидуса), и
наоборот, сплавы с одной и той же
температурой конца кристаллизации –
одинаковые температуры начала
кристаллизации.
,
т. е. при той температуре, при которой
построена данная изотерма. Аналогично,
все сплавы, с одной и той же температурой
начала кристаллизации (ликвидуса)
должны иметь одинаковые температуры
конца кристаллизации (солидуса), и
наоборот, сплавы с одной и той же
температурой конца кристаллизации –
одинаковые температуры начала
кристаллизации.![]() ).
).
![]() и
и
![]() ,
начинает кристаллизоваться при
температуре около
,
начинает кристаллизоваться при
температуре около
![]() (рис. 9, а), а заканчивает при температуре
около
(рис. 9, а), а заканчивает при температуре
около
![]() ,
поскольку его фигуративная точка лежит
между изотермами солидуса при
,
поскольку его фигуративная точка лежит
между изотермами солидуса при
![]() и
и
![]() (рис. 9, б).
(рис. 9, б).![]() и
– кристаллов, находящихся в равновесии
друг с другом в сплавах двухфазной
области
и
– кристаллов, находящихся в равновесии
друг с другом в сплавах двухфазной
области
![]() .
Для любого тройного сплава из области
.
Для любого тройного сплава из области
![]() на изотерме ликвидуса
можно показать точку, изображающую
состав жидкости, а на изотерме солидуса
на изотерме ликвидуса
можно показать точку, изображающую
состав жидкости, а на изотерме солидуса
![]() – вторую точку, изображающую состав
– кристаллов, которые находятся в
равновесии при заданной температуре.
Например, в сплаве
состав жидкости при
изображается точкой
– вторую точку, изображающую состав
– кристаллов, которые находятся в
равновесии при заданной температуре.
Например, в сплаве
состав жидкости при
изображается точкой
![]() ,
а
– кристаллов – точкой
,
а
– кристаллов – точкой
![]() .
Конода
,
соединяющая точки составов равновесных
фаз, обязательно проходит через
фигуративную точку этого сплава.
.
Конода
,
соединяющая точки составов равновесных
фаз, обязательно проходит через
фигуративную точку этого сплава.![]() и
– кристаллов в сплаве
при температуре
определятся отношениями отрезков
и
– кристаллов в сплаве
при температуре
определятся отношениями отрезков
![]() и
и
![]() .
Аналогичные коноды, характеризующие
равновесие жидкости и
– кристаллов, соединяют точки составов
равновесных фаз в других тройных сплавах
двухфазной области
.
Аналогичные коноды, характеризующие
равновесие жидкости и
– кристаллов, соединяют точки составов
равновесных фаз в других тройных сплавах
двухфазной области
![]() .
.![]() и
и
![]() (рис. 10, б - в) или следы от сечения
вертикальными плоскостями
(рис. 10, б - в) или следы от сечения
вертикальными плоскостями
![]() и
и
![]() поверхности
ликвидуса называют кривыми ликвидуса
(или просто ликвидусом) политермических
разрезов
поверхности
ликвидуса называют кривыми ликвидуса
(или просто ликвидусом) политермических
разрезов
![]() и
и
![]() .
Эти кривые изображают температуры
начала кристаллизации сплавов –
растворов, расположенных на разрезах
и
,
в зависимости от их состава.
.
Эти кривые изображают температуры
начала кристаллизации сплавов –
растворов, расположенных на разрезах
и
,
в зависимости от их состава.
![]() и
и
![]() или следы от сечения вертикальными
плоскостями
и
поверхности
солидуса называют кривыми солидуса
(или солидусом) политермических разрезов.
Очевидно, эти кривые изображают
температуры конца кристаллизации
сплавов – растворов на разрезах
и
.
или следы от сечения вертикальными
плоскостями
и
поверхности
солидуса называют кривыми солидуса
(или солидусом) политермических разрезов.
Очевидно, эти кривые изображают
температуры конца кристаллизации
сплавов – растворов на разрезах
и
.![]() ,
,
![]() и
и
![]() в отличие от компонента
кристаллизуются (или плавятся) в
интервале температур. Однако, это
сходство только внешнее. На самом деле
политермические разрезы по своим
свойствам принципиально отличаются
от диаграмм состояния двойных систем.
Кривые ликвидуса и солидуса политермических
разрезов в общем случае не являются
сопряженными и не изображают составов
равновесных фаз в интервале кристаллизации.
Следовательно, политермические разрезы
не характеризуют фазовых равновесий
в тройных сплавах.
в отличие от компонента
кристаллизуются (или плавятся) в
интервале температур. Однако, это
сходство только внешнее. На самом деле
политермические разрезы по своим
свойствам принципиально отличаются
от диаграмм состояния двойных систем.
Кривые ликвидуса и солидуса политермических
разрезов в общем случае не являются
сопряженными и не изображают составов
равновесных фаз в интервале кристаллизации.
Следовательно, политермические разрезы
не характеризуют фазовых равновесий
в тройных сплавах.Глава 3. Диаграмма состояния с неограниченной растворимостью компонентов в жидком состоянии и отсутствием взаимодействия в твердом состоянии (с образованием двойной и тройной эвтектики)
![]() .Эта
поверхность может быть разделена на
три:
.Эта
поверхность может быть разделена на
три:
![]() ,
,
![]() ,
,
![]() сопрягающихся по линиям
сопрягающихся по линиям
![]() ,
,
![]() ,
,
![]() .
Линии
,
,
– являются линиями двойных эвтектик:
-
;
-
;
-
соответственно. (Вспомните, точка
.
Линии
,
,
– являются линиями двойных эвтектик:
-
;
-
;
-
соответственно. (Вспомните, точка
![]() соответствует
эвтектической точке в бинарной системе
-
и линия, исходящая из этой точки,
,
будет показывать изменение температуры
эвтектики в системе
-
под влиянием добавок компонента
).
соответствует
эвтектической точке в бинарной системе
-
и линия, исходящая из этой точки,
,
будет показывать изменение температуры
эвтектики в системе
-
под влиянием добавок компонента
).![]() ,
,
![]() ,
,
![]() разобьют треугольник на три области.
Из сплавов состав, которых отвечает
области
разобьют треугольник на три области.
Из сплавов состав, которых отвечает
области
![]() в первую очередь при кристаллизации
из жидкой фазы выделяются кристаллы
компонента
,
в сплавах области
в первую очередь при кристаллизации
из жидкой фазы выделяются кристаллы
компонента
,
в сплавах области
![]() кристаллы
,
а в области
кристаллы
,
а в области
![]() кристаллы
.
кристаллы
.
![]() отвечает температуре кристаллизации
тройной эвтектики во всех сплавах
тройной системы. (
отвечает температуре кристаллизации
тройной эвтектики во всех сплавах
тройной системы. (![]() ;
;
![]() ;
).
;
).![]() ,
,![]() – проекция
эвтектической точки тройной системы
на плоскости концентрационного
треугольника.
– проекция
эвтектической точки тройной системы
на плоскости концентрационного
треугольника.
![]() ).
Жидкая фаза обедняется компонентом
и состав ее изменяется по поверхности
ликвидуса. Проекция этой линии на
плоскости концентрационного треугольника
(рис. 12) – линия
).
Жидкая фаза обедняется компонентом
и состав ее изменяется по поверхности
ликвидуса. Проекция этой линии на
плоскости концентрационного треугольника
(рис. 12) – линия
![]() .
Когда состав жидкой фазы придет в точку,
лежащую на линии двойной эвтектики
,
начинается кристаллизация двойной
эвтектики и состав жидкой фазы будет
обогащаться компонентом
.
Двойная эвтектика кристаллизуется до
тех пор, пока жидкая фаза не примет
состав отвечающего точке
.
Жидкая фаза точки
при постоянной температуре кристаллизуется
с образованием трехкомпонентной
эвтектики:
.
На
рис. 12.
.
Когда состав жидкой фазы придет в точку,
лежащую на линии двойной эвтектики
,
начинается кристаллизация двойной
эвтектики и состав жидкой фазы будет
обогащаться компонентом
.
Двойная эвтектика кристаллизуется до
тех пор, пока жидкая фаза не примет
состав отвечающего точке
.
Жидкая фаза точки
при постоянной температуре кристаллизуется
с образованием трехкомпонентной
эвтектики:
.
На
рис. 12.
![]() – проекция линии, показывающей изменение
состава жидкой фазы при кристаллизации.
Схематически кривая охлаждения сплава
состава т.
дана на рис. 13.
– проекция линии, показывающей изменение
состава жидкой фазы при кристаллизации.
Схематически кривая охлаждения сплава
состава т.
дана на рис. 13.
![]() структура
структура
![]() .
.![]() структура
структура
![]() .
.![]() структура
структура
![]() .
.![]() структура
структура
![]() .
.![]() структура
структура
![]() .
.![]() структура
структура
![]() .
.

![]() концентрационного треугольника,
начинают, кристаллизацию при температуре
(несколько
ниже
).
Все сплавы, составы которых находятся
в области
концентрационного треугольника,
начинают, кристаллизацию при температуре
(несколько
ниже
).
Все сплавы, составы которых находятся
в области
![]() при температуре
состоят из 2-х фаз: жидкой фазы и кристаллов
компонента
.
Все остальные сплавы однофазны, состоят
из жидкой фазы.
при температуре
состоят из 2-х фаз: жидкой фазы и кристаллов
компонента
.
Все остальные сплавы однофазны, состоят
из жидкой фазы.
![]()
![]() содержит три фазы: кристаллы
,
и жидкость. Состав жидкой фазы отвечает
точке K.
Соотношение между количеством жидкой
фазы и количеством кристаллов определяется
по правилу рычага. Проведя прямую
содержит три фазы: кристаллы
,
и жидкость. Состав жидкой фазы отвечает
точке K.
Соотношение между количеством жидкой
фазы и количеством кристаллов определяется
по правилу рычага. Проведя прямую
![]() до пересечения со стороной
до пересечения со стороной
![]() в точке
в точке
![]() ,
найдем:
,
найдем:![]()
![]()
![]() и
и
![]() ,
рис. 16.
,
рис. 16.![]() .
Кристаллизация этого сплава начинается
с выделения кристаллов компонента
,
а затем идет кристаллизация тройной
эвтектики при постоянной температуре.
Сплав должен иметь 2 критических точки
и после кристаллизации его структура
.
Кристаллизация этого сплава начинается
с выделения кристаллов компонента
,
а затем идет кристаллизация тройной
эвтектики при постоянной температуре.
Сплав должен иметь 2 критических точки
и после кристаллизации его структура
![]() .
Политермический разрез по линии
приведен на рис. 17.
.
Политермический разрез по линии
приведен на рис. 17.![]() ;
от сечения поверхности солидуса
;
от сечения поверхности солидуса
![]() .
Линия между ликвидусом и солидусом –
начало выделения двойных эвтектик.
Характерный сплав точки
имеет 2 критические точки и структуру
.
Линия между ликвидусом и солидусом –
начало выделения двойных эвтектик.
Характерный сплав точки
имеет 2 критические точки и структуру
![]() .
Разрез по линии
дан на рис. 18.
.
Разрез по линии
дан на рис. 18.

![]() ,
затем кристаллизуется тройная эвтектика,
,
затем кристаллизуется тройная эвтектика,
![]() при постоянной температуре. Сплав точки
3 начинает кристаллизацию с выделения
избыточных кристаллов компонента
,
затем кристаллизуется тройная эвтектика.
На политермическом разрезе, рис. 18,
нанесены, составы характерных сплавов
т. 2 и т. З.
при постоянной температуре. Сплав точки
3 начинает кристаллизацию с выделения
избыточных кристаллов компонента
,
затем кристаллизуется тройная эвтектика.
На политермическом разрезе, рис. 18,
нанесены, составы характерных сплавов
т. 2 и т. З.
![]() ;
сплав точки 3 имеет 2 критических точки,
а структура его после кристаллизации
;
сплав точки 3 имеет 2 критических точки,
а структура его после кристаллизации
![]() .
.
![]() сплав состава:
сплав состава:
![]() ;
;![]() ;
;
![]() ?
?
![]() для трех компонентной диаграммы с
бивариантным равновесием (
для трех компонентной диаграммы с
бивариантным равновесием (![]() плавления
плавления
![]() ;
;
![]() ;
;
![]() ).
Рассмотреть процесс кристаллизации
сплавов т.
,
т.
).
Рассмотреть процесс кристаллизации
сплавов т.
,
т.
![]() .
.![]() сравнить фазовый состав, структуру
сплавов, изображённых точками
и
на плоскости концентрационного
треугольника
.
сравнить фазовый состав, структуру
сплавов, изображённых точками
и
на плоскости концентрационного
треугольника
.
![]() диаграммы, приведённой в п. 4.
диаграммы, приведённой в п. 4.![]() для диаграммы в п. 4.
для диаграммы в п. 4.
2
3
34
4
33
5
32
6
31
7
30
8
29
9
28
10
27
11
26
12
25
13
24
14
23
15
22
16
21
17
20
18
19
