
- •Часть I
- •Введение
- •Номенклатура и классификация неорганических соединений Вводная часть
- •Номенклатура неорганических соединений июпак
- •Традиционные названия сложных соединений
- •Классификация неорганических веществ
- •Вопросы к семинару
- •Техника безопасности Общие правила работы в химической лаборатории
- •Общие правила работы с химическими реактивами
- •Ядовитые и вредные вещества
- •Химические ожоги
- •Меры по предупреждению пожаров, возгораний и взрывов
- •Поражение электрическим током
- •Искусственное дыхание
- •Наружный массаж сердца
- •Меры первой помощи при кровотечениях от порезов
- •Меры предосторожности при мытье посуды
- •Вопросы к семинару
- •Правила оформления отчета по лабораторным работам
- •Т ехника лабораторных работ
- •1. Работа со стеклом и пробками
- •2. Взвешивание
- •3. Определение концентрации раствора. Фильтрование
- •Вопросы к семинару
- •Эквивалент
- •Лабораторная работа «Определение мольной массы эквивалентов»
- •Вопросы к семинару
- •Способы выражения состава раствора
- •Лабораторная работа «Приготовление растворов»
- •Вопросы к семинару
- •Термохимия
- •Лабораторная работа «Определение тепловых эффектов»
- •Вопросы к семинару
- •Химическое равновесие
- •Лабораторная работа «Равновесие»
- •Вопросы к семинару
- •Скорость химических реакций
- •Лабораторная работа «Скорость химических реакций»
- •Вопросы к семинару
- •Вопросы к коллоквиуму I
- •Задачи к коллоквиуму I
- •Растворимость электролитов
- •Лабораторная работа «Растворимость и пр»
- •Вопросы к семинару
- •Электролитическая диссоциация
- •Лабораторная работа «Электролитическая диссоциация»
- •Вопросы к семинару
- •Методика решения задач
- •Гидролиз солей
- •Лабораторная работа «Гидролиз солей»
- •Вопросы к семинару
- •Коллоидные растворы
- •Лабораторная работа «Коллоидные растворы»
- •Вопросы к семинару
- •Редокс-процессы
- •Лабораторная работа «овр»
- •Вопросы к семинару
- •Электрохимия
- •Лабораторная работа «Электрохимия»
- •Ряд напряжений. Перенапряжение
- •Вопросы к семинару
- •Комплексные соединения
- •Лабораторная работа «Получение и свойства кс»
- •Вопросы к семинару
- •Вопросы к коллоквиуму II
- •Лабораторная работа «Очистка веществ»
- •Вопросы к семинару
- •Библиографический список
- •Оглавление
Задачи к коллоквиуму I
1. Исходя из данных:
![]() ,
,
![]() и
и
![]() (кДж/моль),
– рассчитать изменение энтальпии
реакций:
(кДж/моль),
– рассчитать изменение энтальпии
реакций:
а) ![]() ,
б)
,
б) ![]() ,
– и вычислить теплоту образования
озона из молекулярного кислорода.
,
– и вычислить теплоту образования
озона из молекулярного кислорода.
2. Вычислить
процессов: а)
![]() ,
б)
,
б)
![]() .
.
Возможно ли осуществление их в стандартных условиях?
3. При повышении температуры на 500С скорость реакции возросла в 1200 раз. Рассчитать температурный коэффициент Вант-Гоффа.
4. Найти коэффициент
Вант-Гоффа, если константа скорости
реакции при 1200С
составляет
![]() ,
а при 1700С
равна
,
а при 1700С
равна
![]() (моль/(л∙с)).
(моль/(л∙с)).
5. Вычислить процент
разложения молекулярного хлора на
атомы, если Ка
=
![]() ,
а исходная концентрация хлора 0,04 моль/л.
,
а исходная концентрация хлора 0,04 моль/л.
6. Исходные данные:
![]() моль/л,
моль/л,
![]() моль/л
для реакции:
моль/л
для реакции:
![]() .
Во сколько раз изменится скорость
процесса по сравнению с первоначальной,
когда прореагирует половина количества
NO?
.
Во сколько раз изменится скорость
процесса по сравнению с первоначальной,
когда прореагирует половина количества
NO?
7. Две реакции имеют одинаковый порядок и предэкспоненциальный множитель, но их различаются на 100 кДж/моль. Во сколько раз константа скорости одной реакции будет больше константы скорости второй при 500 К? при 1000 К?
8. Константа
равновесия процесса:
![]() ,
– при некоторой температуре равна 6.
Найти равновесные концентрации всех
веществ, если исходные С каждого из
реагентов и продуктов по 1 моль/л.
,
– при некоторой температуре равна 6.
Найти равновесные концентрации всех
веществ, если исходные С каждого из
реагентов и продуктов по 1 моль/л.
9. Константа равновесия реакции: , – при некоторой температуре равна 6. Рассчитать равновесные концентрации веществ, если исходные данные: 2 моль СО, 2 моль Сl2, 8 моль СОСl2?
10. Вычислить
константу равновесия системы:
,
если
![]() моль/л,
моль/л,
![]() ,
а
,
а
![]() моль/л.
моль/л.
11. Определить выход
NO в процентах (по объему),
если исходные газы взяты из воздуха в
объемном отношении 4:1, а
![]() .
.
12. Найти равновесную
концентрацию Н2
в системе:
![]() ,
если исходная
,
если исходная
![]() равна 0,05 моль/л, а
равна 0,05 моль/л, а
![]() .
.
13. Сколько молей
HZ образуется в системе:
![]() из одного моля Z2
и двух молей H2,
если
из одного моля Z2
и двух молей H2,
если
![]() ?
?
14. При сгорании
1 л (н.у.) С2Н2
выделилось 58,2 кДж.
Вычислить
![]() (С2Н2),
если
(СО2)
= –393, а
(
(С2Н2),
если
(СО2)
= –393, а
(![]() )
= –286 (кДж/моль).
)
= –286 (кДж/моль).
Растворимость электролитов
Произведение
растворимости.
Электролиты – это соединения, растворы
которых проводят ток. Абсолютно
нерастворимых веществ нет, поэтому в
растворе над осадком даже малорастворимого
электролита, всегда находится некоторое
количество его ионов. Причем концентрация
насыщенного
раствора (т.е. находящегося в равновесии
с осадком) считается растворимостью (s)
данного электролита1.
А произведение активностей ионов осадка
в его насыщенном растворе называется
произведением
растворимости [8].
Например, между малорастворимым
соединением
![]() и его водным раствором устанавливается
равновесие:
и его водным раствором устанавливается
равновесие:
![]() и
и ![]() ,
,
или менее строго (т.е. если вместо активностей брать концентрации):
![]() .
.
Проводя
анализ раствора, равновесного с данным
осадком при стандартных условиях
(ст.у.), определяют его s
(например, в моль/л). В соответствии с
уравнением растворения:
![]() ,
,
![]() ,
а, следовательно:
,
а, следовательно:
![]()
Примеры решения задач.
Задача №1. Растворимость AgCl при 250С составляет 0,0018 г/л. Вычислить произведение растворимости хлорида серебра.
Решение:
![]() ;
;
![]() .
Выразим растворимость через моль/л.
Поскольку
.
Выразим растворимость через моль/л.
Поскольку
![]() г/моль,
то имеем:
г/моль,
то имеем:
![]() моль/л.
моль/л.
При
переходе в раствор 1 моль
AgCl образует по 1 моль
![]() и
,
следовательно, если растворилось
и
,
следовательно, если растворилось
![]() моль/л,
то над осадком:
моль/л,
то над осадком:
![]() моль/л,
моль/л,
поэтому:
![]() .
.
Задача №2. Рассчитать
массу AgCl в 100 мл
его насыщенного раствора, если
![]() 1,56.10–10.
1,56.10–10.
Решение:
![]() .
И поскольку в данном случае s
(см. задачу №1) равна
концентрации каждого из ионов осадка
AgCl, а они равны между
собой, следовательно:
.
И поскольку в данном случае s
(см. задачу №1) равна
концентрации каждого из ионов осадка
AgCl, а они равны между
собой, следовательно:
![]() .
.
![]() г/моль,
т.е. 143,5 г составляет
1 моль,
г/моль,
т.е. 143,5 г составляет
1 моль,
а
X г –
![]() моль.
моль.
Решая
данную пропорцию, получим:
![]() (г)
– это масса AgCl, содержащегося
в 1 л раствора или в
1000 мл; а при расчете
на 100 мл:
(г)
– это масса AgCl, содержащегося
в 1 л раствора или в
1000 мл; а при расчете
на 100 мл:
![]() (г).
(г).
Задача №3. Вычислить,
в каком объеме раствора содержится 1 г
сульфата стронция, если его
![]() равно
равно
![]() .
.
Решение:
![]() .
Пусть
.
Пусть
![]() ,
тогда и
,
тогда и
![]() ,
,
а
![]() ;
откуда
;
откуда ![]() моль/л.
моль/л.
![]() г/моль;
значит,
г/моль;
значит,
![]() г
SrSO4.
г
SrSO4.
Итак, 0,1039 г SrSO4 находится в 1 л раствора,
а 1 (г) будет содержаться в Y л раствора.
Решая
пропорцию, получим:
![]() .
.
Влияние различных факторов на s и ПР. Произведение растворимости (ПР) является термодинамической константой равновесия для процесса растворения, т.е. его значение не зависит от состава раствора (в отличие от s), а лишь от температуры, модификации данного осадка и природы растворителя. (Чем полярнее молекулы последнего, тем больше скорость прямого процесса (растворения), но меньше обратного (осаждения), и, следовательно, выше концентрация насыщенного раствора, т.е. больше величины s и ПР.)
Влияние температуры
на s
и ПР. Согласно принципу
Ле-Шателье, если растворение соли
является экзопроцессом,
то ее растворимость, а, значит, и ПР с
ростом Т уменьшаются
[8]. Для большинства солей растворение
– это эндопроцесс,
и величина их s и ПР при
повышении температуры растут,
причем тем резче, чем больше эндоэффект.
Н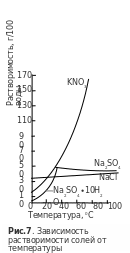 апример,
нитрат калия KNO3
растворяется со значительным поглощением
тепла (
апример,
нитрат калия KNO3
растворяется со значительным поглощением
тепла (![]() кДж/моль),
поэтому с ростом Т его растворимость
резко увеличивается (рис. 7).
Теплота растворения хлорида натрия
тоже положительна, но мала по величине
(
кДж/моль),
поэтому с ростом Т его растворимость
резко увеличивается (рис. 7).
Теплота растворения хлорида натрия
тоже положительна, но мала по величине
(![]() кДж/моль),
как следствие, s(NaCl)
мало меняется с изменением Т Более
сложный вид имеет температурная
зависимость s сульфата
натрия. До 320С
кривая поднимается; далее при 320С
происходит ее излом,
после чего она несколько снижается.
Это объясняется тем, что ниже 320С
в равновесии с насыщенным раствором
находится вещество
,
растворение которого идет с эндоэффектом.
Но при 320C
это соединение, обезвоживаясь, переходит
в продукт, который растворяется с
выделением
тепла.
кДж/моль),
как следствие, s(NaCl)
мало меняется с изменением Т Более
сложный вид имеет температурная
зависимость s сульфата
натрия. До 320С
кривая поднимается; далее при 320С
происходит ее излом,
после чего она несколько снижается.
Это объясняется тем, что ниже 320С
в равновесии с насыщенным раствором
находится вещество
,
растворение которого идет с эндоэффектом.
Но при 320C
это соединение, обезвоживаясь, переходит
в продукт, который растворяется с
выделением
тепла.
Ненасыщенные и
пересыщенные растворы.
Раствор может быть ненасыщенным, когда
произведение активностей ионов
электролита(![]() )
в растворе меньше величины его ПР
(
<ПР)
и тогда, естественно, осадок не
образуется.
)
в растворе меньше величины его ПР
(
<ПР)
и тогда, естественно, осадок не
образуется.
Раствор может быть также пересыщенным ( >ПР). Это состояние является неравновесным и должно приводить к выпадению осадка (приход к равновесию!). Если же этого не происходит, то лишь из-за кинетического фактора, а именно: тормозится стадия образования зародышей (это агрегаты частиц электролита достаточно устойчивые, чтобы они могли быть центрами формирования осадка). Поэтому, когда стадия образования зародышей перестает быть лимитирующей (например, при внесении кристаллика в раствор), то выпадает осадок, и система становится равновесной, т.е. пересыщенный раствор переходит в насыщенный.
Влияние одноименного иона на растворимость. Если в равновесную систему «осадок-раствор» вводят растворимый электролит содержащий ионы, входящие в состав осадка, то это называют введением одноименных ионов. При их введении раствор становится пересыщенным ( >ПР), поэтому из него дополнительно выпадает осадок, что снижает концентрации ионов этого осадка в растворе. А поскольку значение ПР не зависит от состава раствора, то увеличение концентрации одного из одноименных ионов (действием извне!) приводит к уменьшению концентрации другого в такой степени, чтобы произведение их активностей ( ) снова стало равным ПР. Итак, введение в раствор одноименных ионов уменьшает растворимость осадка. (Максимальная s наблюдается в отсутствии в растворе избытка каждого из ионов, входящих в его состав.)
Отметим, что, добавляя к ненасыщенному раствору ( <ПР) одноименные ионы, можно превратить его в насыщенный ( =ПР), затем в пересыщенный ( >ПР) и таким образом вызвать образование осадка.
Влияние посторонних
ионов на растворимость. Солевой эффект.
В растворе над осадком концентрация
электролита мала (менее
![]() М),
т.е. катионы и анионы удалены друг от
друга, и значит, слабо взаимодействуют,
следовательно, их активности практически
будут равны концентрациям.
М),
т.е. катионы и анионы удалены друг от
друга, и значит, слабо взаимодействуют,
следовательно, их активности практически
будут равны концентрациям.
Однако при добавлении к подобной системе достаточного количества хорошо растворимого электролита, не содержащего одноименных ионов, (т.е. соли с «посторонними» ионами) электростатическое взаимодействие частиц в растворе становится значительным и приводит к тому, что каждый ион окружает себя ионами противоположного знака. Из-за этого активность ионов осадка снижается, т.е. раствор становится ненасыщенным ( <ПР), поэтому часть осадка растворяется (s увеличивается). Такое явление называется солевым эффектом.
Однако если концентрация «посторонней» соли будет слишком высокой, то наблюдается обратный процесс – высаливание, т.е. снижение величины s в результате связывания молекул воды ионами добавленной соли в гидраты.
Переосаждение.
Растворение осадка.
Если к раствору, находящемуся в равновесии
с осадком, например,
![]() добавить электролит
добавить электролит
![]() ,
содержащий анионы, которые с катионами
данного осадка образуют менее
растворимое соединение
,
содержащий анионы, которые с катионами
данного осадка образуют менее
растворимое соединение
![]() (табл. 12), то относительно
последнего раствор становится
пересыщенным, поэтому образуется этот
новый
осадок. В результате чего из-за снижения
концентрации
(табл. 12), то относительно
последнего раствор становится
пересыщенным, поэтому образуется этот
новый
осадок. В результате чего из-за снижения
концентрации
![]() получим:
получим:
![]() .
Поэтому растворится часть исходного
осадка, что опять повысит концентрацию
,
т.е. снова:
.
Поэтому растворится часть исходного
осадка, что опять повысит концентрацию
,
т.е. снова:
![]() ,
и новая порция
выпадет в осадок. И так продолжится до
практически полного перехода
в
.
Такое явление называется переосаждение.
(Самостоятельно с учетом данных,
приведенных в таблице 2, рассмотрите
случай, когда к осадку
добавляется раствор
,
и новая порция
выпадет в осадок. И так продолжится до
практически полного перехода
в
.
Такое явление называется переосаждение.
(Самостоятельно с учетом данных,
приведенных в таблице 2, рассмотрите
случай, когда к осадку
добавляется раствор
![]() .)
.)
Рассуждая аналогично,
получим, что если ионы осадка связываются
в достаточно
прочное1
малодиссоциирующее вещество, то можно
вызвать полное растворение
осадка. Например,
![]() растворяется в щелочи из-за снижения
активности
растворяется в щелочи из-за снижения
активности
![]() над осадком в результате образования
слабодиссоциирующего комплекса
над осадком в результате образования
слабодиссоциирующего комплекса
![]() ,
а также в кислотах (например, в
,
а также в кислотах (например, в
![]() )
вследствие перехода ионов
в устойчивые димеры1
)
вследствие перехода ионов
в устойчивые димеры1
![]() ,
не осаждающие Pb(II).
,
не осаждающие Pb(II).
