
- •660025, Г. Красноярск, ул. Вавилова, 66 а
- •1.1.Распространение в природе и получение
- •1.2 Физические свойства
- •Химические свойства
- •Соединения s – металлов
- •1.6.Применение
- •Элементы іііа – группы
- •Распространение в природе и получение
- •Физические свойства
- •Химические свойства
- •Соединения металлов
- •2.1.4. Применение
- •Глава 3. Химия переходных металлов
- •В периоде с ростом z восстановительные свойства металлов уменьшаются, достигая минимума у элементов iв группы (табл.3.1.). Тяжелые металлы viiiв и iв групп за свою инертность названы благородными.
- •3.1. Элементы 1в группы
- •3.1.1. Распространение в природе и получение
- •3.1.2.Физические свойства
- •3.1.3. Химические свойства
- •3.1.4. Соединения металлов
- •3.1.5.Применение
- •3.2. Элементы подгруппы II a
- •3.2.1.Распространение в природе и получение
- •3.2.2.Физические свойства
- •3.2.3. Химические свойства По химическим свойствам Zn и его аналоги менее активны, чем подгруппа Са. В ряду от Zn к Hg-химическая активность металлов уменьшается (см. Табл.3.3.).
- •3.2.4. Соединения металлов
- •3.2.5. Применение
- •3.3. Элементы подгруппы iiia
- •3.3.1. Способы получения
- •3.3.2.Физические и химические свойства
- •3.3.3. Соединения металлов
- •3.3.4. Применение
- •3.4. Элементы подгруппы ivb
- •3.4.1.Распространение в природе и получение
- •3.4.2.Физические свойства
- •3.4.3. Химические свойства
- •3.4.4. Соединения металлов
- •3.4.5. Применение
- •3.5. Элементы подгруппы vb
- •3.5.1.Распространение в природе и получение
- •3.5.1.Физические свойства
- •3.5.2. Химические свойства
- •3.5.4. Cоединения металлов
- •3.5.5.Применение
- •3.6. Элементы подгруппы viв
- •3.6.1. Распространение в природе и получение
- •В промышленности чистый хром получают из хромистого железняка:
- •Вольфрам, молибден получают из соответствующих оксидов, например:
- •3.6.2.Физические свойства
- •3.6.3. Химические свойства
- •3.6.4. Соединения металлов
- •3.6.5. Применение
- •3.8. Элементы подгруппы VII b
- •3.8.1. Распространение в природе и получение
- •3.8.2.Физические свойства
- •3.8.4. Химические свойства
- •3.8.5.Соединения металлов
- •3.8.6. Применение
- •3.9.2. Физические свойства
- •3.9.3. Химические свойства
- •3.9.4.Соединения металлов
- •3.9.5. Применение
- •3.9. Элементы VIII в группы (платиновые металлы)
- •3.9.1. Распространение в природе и получение
- •В виде соединений находятся в Си- Ni сульфидных рудах.
- •3.9.2. Физические свойства
- •3.9.3. Химические свойства
- •3.9.4.Соединения металлов
- •3.9.5.Применение
- •Глава 4. Лантаноиды и актиноиды
- •4.1. Электронные конфигурации атомов лантаноидов и актиноидов и их свойства.
- •4. 1.1.Монотонно изменяющиеся
- •4.1.2.Периодически изменяющиеся свойства
- •4.2.Распространение f - элементов в природе и получение
- •4.3.Разделение смеси соединений лантаноидов (актиноидов)
- •4.3.1.Ионообменная хроматография
- •4. 3.2.Жидкостная экстракция
- •4.3.3.Разделение по изменению степени окисления
- •4.4.Физические свойства
- •4.5.Химические свойства
- •4.6.Соединения f-металлов
- •4.7.Применение
2.1.4. Применение
Элементы ІІІА – группы и их соединения – компоненты многих современных материалов. Алюминий основа легких сплавов, его применяют для производства фольги, проволоки, различных емкостей, в алюмотермии. Очень важным является применение Аl для алитирования- насыщения поверхности стальных или чугунных изделий алюминием при 900 0С. Соединения Аl2О3 и АlN применяют в огнеупорных диэлектриках и конденсаторах, в производстве специальных стекол, керамике, огнестойких покрытий.
Корунд служит абразивным материалом, Al2(SO4)3 применяют для очистки воды, K Al(SO4)2 * 12Н2О – для дубления кожи, при окраске тканей, АlН3 – компонент твердого ракетного топлива.
Использование Ga, Jn и Tl связано с радиоэлектроникой, полупроводниковой промышленностью. Соединения GaP и GaAs - высокотемпературные полупроводниковые материалы. Легкоплавкие сплавы на основе галлия находят применение в терморегуляторах и высокотемпературных термометрах. Сплавы, содержащие индий, применяют в качестве припоев для соединения металлов, стекла и керамики. Из индия изготавливают высококачественные зеркала прожекторов.
Наибольшая часть добываемого таллия применяется в электронике, использующей ИФ – излучение. Монокристаллы TlBr и TlJ используют в приборах для обнаружения теплового излучения, Tl2S – для изготовления фотоэлементов.
Вопросы и упражнения
Определите, может ли самопроизвольно протекать при 298 К и 1000 К процесс WO3 + 2Al = W + Al2O3?
Напишите электронно-графическую формулу иона Al3+ и покажите вакантные орбитали, которые участвуют в образовании донорно-акцепторной связи в молекулах Al2Cl6 и NаAlF6.
Почему Аl2S3 получают прямым синтезом твердых алюминия и серы, а не из водного раствора?
Определите, не прибегая к расчету, одинаковой или разной будет растворимость (моль/л) солей - Tl2SО4 и TlСNS, если они имеют одинаковое значение ПР.
Вычислите растворимость Tl2CrO4, если значение ПР этой соли при 20 0С равно 9,8 * 10-13.
Почему алюминий вытесняет водород из воды только в щелочном растворе? Напишите уравнение соответствующей реакции.
Опишите работу гальванического элемента
Al / 0,01М Al2(SO4)3 // Cr2(SO4)3 / Cr
Рассчитайте значение ЭДС при стандартных условиях.
Какая масса нитрида алюминия необходима для получения 3л аммиака (условия нормальные)?
Алюминий растворяется в щелочном растворе нитрата калия с выделением аммиака. Напишите уравнение реакции.
При пропускании СО2 через растворы алюмината калия выпадает осадок Al(ОН)3. О каких свойствах алюминиевой кислоты это свидетельствует? Напишите молекулярное и ионное уравнения реакции.
Глава 3. Химия переходных металлов
d- и f- металлы расположены в больших периодах между s- и p- элементами, т.е. осуществляют переход между типичными металлами и типичными неметаллами, за что их называют переходными элементами (переходными металлами, так как для них присущи свойства металлов). Это элементы побочных подгрупп (IIIВ–VIIIВ, IВ, IIВ).
Из 109 элементов периодической системы 40 относятся к d-элементам; из них последние 7 радиоактивны и входят в незавершенный седьмой период.
Таблица 3.1.

Атомы d-элементов характеризуются общей электронной формулой (n – 1)d1–10ns0–2. В образовании химической связи d-элементов участвуют валентные электроны внешнего (s-) и предвнешнего слоя (d-). При переходе к каждому последующему элементу от скандия 4s23d1 до цинка 4s23d10 идет заполнение внутреннего (3d) электронного слоя. Аналогичное явление наблюдается при переходе от Y39 (5s2 4d1) до Cd48 (5s2 4d10) и от La57 (6s2 5d1) до Hg80 (6s2 5d10).
Поэтому в периоде слева направо происходит некоторое уменьшение атомного радиуса элементов. Это обусловлено сближением энергий (n – 1)d- и ns-орбиталей и усилением межэлектронного взаимодействия к концу периода. Такое распределение электронов обосновано спектроскопическими данными (см. табл. 3.1).
Увеличение числа электронов иногда сопровождается немонотонностью заселения d-орбиталей. Например, для хрома (Сr24) и ванадия (V23), а так же для иридия (Ir77), платины (Pt78) происходит увеличение числа электронов на d-орбитали не на один, а сразу на два электрона. Палладий является единственным d-элементом с незаполненным s-уровнем. Это объясняется тем, что для d -элементов существует два наиболее устойчивых состояния электронов: d10- это характерно для Zn, Cd, Hg и d5 (Mn, Мо, Re). По-видимому, это является причиной «перескока» одного электрона из s-подуровня на d-подуровень.
Атомный радиус в побочных подгруппах несколько уменьшается или остается практически неизменным за счет «лантаноидного сжатия», которое из-за монотонного уменьшения радиусов при заполнении 4f-орбиталей приводит к практическому совпадению радиусов циркония и гафния, ниобия и тантала, молибдена и вольфрама, технеция и рения.
Элементы этих пар очень близки по физическим и особенно по химическим свойствам; первые шесть элементов встречаются в одних рудных месторождениях, трудно разделяются; их иногда называют элементами-близнецами.
В побочных подгруппах сверху вниз (кроме III В) активность металлов уменьшается, а в главных подгруппах наоборот. Например:
п одгруппа
IB
VIIB
IIB
одгруппа
IB
VIIB
IIB
Cu Mn Zn уменьшение металлических свойств
Ag Tc Cd усиление окислительных свойств
Au…. Re Hg возрастание энергии ионизации
Следует отметить, что у d-элементов при нарастании относительной электроотрицательности усиливаютcя кислотные и неметаллические свойства. Поэтому в периоде с увеличением атомной массы металлические свойства элементов уменьшаются (см. табл. 3.1.).
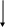

группа IV V VI VII VIII I
(3d) Ti V Cr Mn Fe Co Ni Cu
(4d) Zr Nb Mo Tc Ru Rh Pd Ag
(5d) Hf Ta W Re Os Ir Pt Au
уменьшение металлических свойств
Металлы, стоящие за лантаноидами, благодаря сжатию имеют сильно пониженную активность и большие потенциалы ионизации. Поэтому 3d-элементы по химическим свойствам (более активны) существенно отличаются от 4d- и 5d-элементов.
Так элементы 4-го периода (3d) практически все растворимы в кислотах, а элементы 5-го и особенно 6-го периодов химически инертны: тантал, вольфрам, рений, осмий, устойчивы по отношению к кислотам и растворяются лишь в смеси азотной и плавиковой кислот, расплавленных щелочах в присутствии сильного окислителя.
Как известно, восстановительная способность металла определяется не только его энергией ионизации (М – ne– → Мn+; +∆Hиониз), но и энтальпией гидратации образовавшегося катиона (Мn+ + mH2O → Мn+·mH2O; –∆Hгидр). Энергии ионизации d-элементов в сравнении с другими металлами велики, но они компенсируются большими энтальпиями гидратации их ионов. Вследствие этого электродные потенциалы большинства d-элементов отрицательны (табл. ПРИЛОЖ.).
