
- •060108 «Фармация», 2 курс, III семестр
- •Организация занятия 15 мин
- •1.1.Реакции окисления восстановления.
- •1.2. Окислительно-восстановительные потенциалы
- •1.3. Константа равновесия реакций окисления – восстановления
- •1.4. Скорость реакций окисления – восстановления.
- •1.5. Аналитические реакции катионов IV группы.
- •1.5.1. Общая характеристика группы
- •1.5.2. Значение катионов четвертой группы и их соединений в медицине.
- •1.5.6. Аналитические реакции катиона олова (II).
- •1.5.7. Аналитические реакции катиона олова (IV).
- •1.5.8. Аналитические реакции мышьяка (III) и мышьяка(V) . Соединения мышьяка ядовиты!!!!!!!
- •Арсин очень ядовит! Реакции проводят только под тягой!
- •1.6. Анализ смеси катионов четвертой аналитической группы.
- •1.Предварительные наблюдения и испытания.
- •Систематический ход анализа.
- •2.1. Равновесия комплексообразования.
- •Аналогично для ступенчатых констант нестойкости Кн1, Кн2
- •2.2. Влияние различных факторов на процессы комплексообразования.
- •2.3. Применение комплексных соединений в химическом анализе.
- •2.4. Аналитические реакции катионов V группы.
- •2.4.1. Общая характеристика группы.
- •2.4.2. Значение катионов пятой аналитической группы и их соединений в медицине.
- •2.5. Анализ смеси катионов V аналитической группы.
- •II Систематический анализ.
- •Вопросы для самоподготовки
- •Вопросы для самоконтроля
- •Основная литература
1.3. Константа равновесия реакций окисления – восстановления
Изменение [Н+] или [ОН-] может привести к резкому изменению величины Е, что, в конечном итоге, может привести даже к изменению направления реакции, протекающей в кислой среде по уравнению:
АsО43- +2I- +2Н+ АsО33- +I2 + Н2О
![]()
![]()
Если реакцию вести
в присутствии NаНСО3,
связывающей ионы водорода, рН
устанавливается порядка
![]() 8, т.е. [Н+] = 10-8. Тогда
для полуреакции:
8, т.е. [Н+] = 10-8. Тогда
для полуреакции:
АsО43- +2е + 2Н+ ↔ АsО33- + Н2О

Если [АsО43-] =
[АsО33-],
то
![]()
Так как 0,1068 < 0,54, реакция пойдет в противоположном направлении:
АsО33- + I2 + Н2О → АsО43- + 2I- + 2Н+
Вывод. Если ионы Н+ потребляются при реакции, ее нужно вести в кислой среде. Наоборот, если они образуются в результате течения реакции, их нужно связывать прибавлением щелочи, или веществ, подобных NаНСО3. С возможностью изменения направления реакции на противоположное приходится особенно считаться тогда, когда соответствующие пары имеют близкие по величине стандартные потенциалы.
Из сказанного выше ясно, что реакции окисления - восстановления обратимые, следовательно, к ним применим закон действия масс, а поэтому можно рассчитать константу равновесия:
Sn2+ + 2Fе3+ ↔ Sn4+ + 2Fе2+
![]()
![]()
По мере течения реакции концентрации
[Sn2+] и [Fе3+]
уменьшаются, а [Sn4+]
и [Fе2+] возрастают.
Это приводит к изменению
окислительно-восстановительных
потенциалов пар:
![]() увеличивается,
а
уменьшается.
В конце концов, эти потенциалы сравняются
по величине. Следовательно, будет
отсутствовать разность потенциалов, а
значит, прекратится переход электронов,
и наступит равновесие:
увеличивается,
а
уменьшается.
В конце концов, эти потенциалы сравняются
по величине. Следовательно, будет
отсутствовать разность потенциалов, а
значит, прекратится переход электронов,
и наступит равновесие:
![]()
![]()
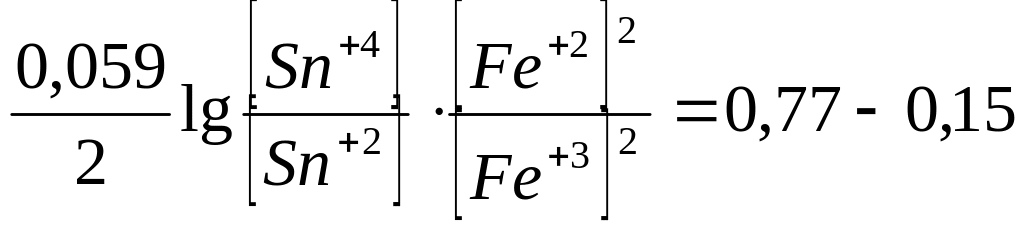
![]() Кp=1021
Кp=1021
Высокое числовое значение константы равновесия показывает, что данная реакция практически протекает до конца, т.е. [Sn+4] [Fе+2] в 1021 раз больше [Sn+2] [Fе+3]. Кравн. тем больше, чем больше разность стандартных потенциалов реагирующих пар.
1.4. Скорость реакций окисления – восстановления.
Согласно закону действия масс скорость реакций в гомогенной среде прямо пропорциональна произведению концентраций реагирующих веществ в степенях, соответствующих их стехиометрическим коэффициентам:
2I- + Н2О2 + 2Н+ ↔ I2 + 2Н2О,
и скорость для данной реакции должна быть равна:
V=k1 [I-]2 [Н2O2] [Н+]2
при условии, что [I-] = [Н2О2] = [Н+] = С, получим V = k1С5
Однако доказано, что скорость этой реакции пропорциональна квадрату концентрации - V=k1С2. Такие кажущиеся отклонения от закона действия масс характерны для многих реакций окисления-восстановления. Это объясняется тем, что реакции окисления-восстановления, как правило, протекают очень сложно через ряд промежуточных стадий, каждая из которых характеризуется определенной скоростью.
Указанная реакция является суммарной реакцией следующих стадий:
а) I- + Н2О2 ↔ IO- + Н2О самая медленная стадия;
б) IO- + Н+ ↔ НIO
в) H+ + HIO +I- ↔ I2 + Н2О
Скорость сложной реакции определяется скоростью наиболее медленно протекающей промежуточной стадии. Стадия (а) - это биомолекулярная реакция, и ее скорость пропорциональна квадрату концентраций (при равенстве концентраций реагирующих веществ).
Увеличить скорость реакции окисления-восстановления можно повышением температуры, увеличением концентраций реагирующих веществ, применением катализаторов (последний ускоряет скорость самой медленной промежуточной стадии).
Оценить скорость окислительно-восстановительной реакции можно и с помощью принципа Шеффера:
быстрее, как правило, протекают те реакции, в ходе которых окислитель и восстановитель обмениваются равным числом электронов
1) ок1 + ne → вос1 2) ок1 + me → вос1
вос2 – ne → ок2 вос2 –ne → ок2
m ≠ n
В случае 1) вероятно более быстрое протекание реакции.
Для реакций, протекающих с положительным или отрицательным автокатализом, принцип Шеффера не применим.
