
- •Хімічний зв’язок і взаємний вплив атомів в органічних молекулах
- •1.1 Природа хімічного зв’язку
- •Ковалентний зв΄язок – це зв΄язок, що утворюється між атомами внаслідок успільнення їх зовнішніх валентних електронів (з обов΄язковим зменшенням енергії молекули).
- •1.2 Типи ковалентних зв’язків
- •Гібридизація атомних орбіталей
- •Прості й кратні ковалентні зв’язки
- •Основні характеристики ковалентного зв’язку
- •2.1 Взаємний вплив атомів в молекулах Будова та реакційна здатність органічних сполук
- •2.1.1 Індуктивний ефект Це зміщення електронної густини в -зв’язках, що виникає внаслідок різниці електронегативностей атомів.
- •2.1.2 Кон’юґовані системи та мезомерний ефект
- •Ефект гіперкон΄юґації або надспряження.
Хімічний зв’язок і взаємний вплив атомів в органічних молекулах
Згадаємо будову атома – ядро, навколо якого обертаються електрони, які мають різні орбіталі.
Атомна орбіталь – це елемент простору, в якому ймовірність знаходження електрону дорівнює 95%.
Зручно зображувати орбіталі у вигляді електронних “хмар” (цю електронну хмарку можна уявити собі, як нечітку фотографію електрону, що швидко рухається). Форма та розмір атомної орбіталі визначається квантовими числами: n, l, m, s.
n – головне квантове число, характеризує рівень енергії орбіталі та приблизно визначає розмір електронної хмари (відстань електрону від ядра);
l - орбітальне квантове число, визначає форму атомних орбіталей;
m – магнітне квантове число – визначає розташування електронних орбіталей у просторі (орієнтацію одної відносно іншої);
s – спінове квантове число – характеризує напрямок обертання електрону навколо власної вісі.
Електрони, з однаковим значенням головного квантового числа (n), утворюють електронний шар (оболонку), наприклад, п=1 – перший електронний шар, п=2 – другий електронний шар і т. д. Чим більшим є значення п, тим більша енергія електронів.
Якщо l=0, атомна орбіталь має сферичну форму й зветься s-орбіталлю. Орбітальному квантовому числу l=1 відповідає р-орбіталь, яка має форму гантелі або об’ємної вісімки. При l=2 електронна орбіталь позначається символом d і має форму чотирьох об’ємних пелюсток:
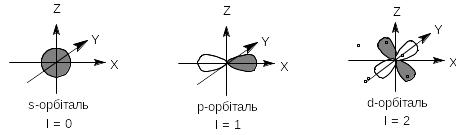
В органічній хімії ми маємо справу тільки з s, p i d-орбіталями першого, другого та третього електронних шарів (1s, 2s, 2p, 3s, 3p, 3d). Перший електронний шар містить тільки два s-електрони (1s2). Другий містить вісім електронів на орбіталях:2s, 2px, 2py, 2pz.
Чим більшим є радіус s-орбіталі, тим більшою є енергія електронів, які розташовані на ній.
Три атомні р-орбіталі мають однакову енергію, проте відрізняються розташуванням у просторі:
 Як заповнюються електронами атомні
орбіталі?
Як заповнюються електронами атомні
орбіталі?
.
Правило Ф. Хунда: При заповненні атомних орбіталей з однаковою енергією на кожній з них розташовується по одному електрону з паралельними спінами, і тільки після цього починається заповнення іншими електронами з протилежними спінами.
Згідно з принципом Паулі: на одній атомній орбіталі не може бути розташовано більше двох елементів з протилежними спінами (s=+1/2; s=-1/2). Тобто атом не може містити два електрони з однаковими значеннями чотирьох квантових чисел
З
 гідно
із зростанням їх енергетичних рівнів:
1s<2s<2p<3s<3p<4s<3d і так далі. (принцип
черговості) правило В. Клечковського
гідно
із зростанням їх енергетичних рівнів:
1s<2s<2p<3s<3p<4s<3d і так далі. (принцип
черговості) правило В. Клечковського
1.1 Природа хімічного зв’язку
Це центральне питання в теоретичній хімії. Ще в 1916 році Дж. Льюїс запропонував так звану октетну теорію, в якій припустив, що хімічний зв’язок утворюється за рахунок електронної пари, причому хімічна поведінка атому визначається будовою зовнішньої електронної оболонки (валентними атомами). Тобто при утворенні хімічного зв’язку кожен атом прагне добудувати свою зовнішню електронну оболонку до октету шляхом успільнення електронних пар, які водночас належать обом атомам.
Такий зв’язок, що здійснюється за рахунок одної або кількох успільнених електронних пар, має назву ковалентного. Це основний тип хімічного зв’язку в органічних сполуках.
