
- •Учебно-методический комплекс по дисциплине «органическая химия»
- •Предисловие
- •Содержание
- •Раздел I Основы строения и реакционная способность органических соединений…………………………………………………………………………...7
- •Раздел II Насыщенные, ненасыщенные и ароматические ув……………15
- •Раздел III Производные ув…………………………………………………30
- •Содержание дисциплины «органическая химия»
- •Краткий курс лекций
- •Раздел I Основы строения и реакционная способность органических соединений
- •1.1 Теория строения органических соединений
- •1.2 Классификация органических соединений
- •1.3 Изомерия органических соединений
- •1.4 Строение атома углерода. Типы гибридизаций
- •1.5 Классификация органических реакций
- •Раздел II Насыщенные, ненасыщенные и ароматические ув
- •2.1 Алканы (предельные ув)
- •2.2 Циклоалканы
- •2.3 Алкены (непредельные ув, олефины)
- •3. Гидрирование алкинов:
- •2.4 Алкины (ненасыщенные ув)
- •2.5 Алкадиены
- •2.6 Арены (ароматические ув)
- •Раздел III Производные ув
- •3.1 Кислородсодержащие производные ув
- •3.1.1 Спирты
- •2) Взаимодействие с аммиаком с образованием аминов (300ºС).
- •3.1.2 Альдегиды (оксосоединения)
- •2. Циклическая полимеризация (тримеризация, тетрамеризация).
- •3.1.3 Карбоновые кислоты
- •2. Взаимодействие с аммиаком с образованием амидов кислот.
- •1. Общие способы получения:
- •3.1.4 Сложные эфиры. Жиры
- •Получение жиров.
- •3.2 Галогенпроизводные ув
- •3.3 Азотсодержащие производные ув
- •3.3.1 Амины. Анилин
- •3.3.2 Аминокислоты
- •Методические указания к выполнению практических занятий Практическое занятие № 1. Теория строения органических соединений а.М. Бутлерова. Классификация органических соединений
- •Методические указания к выполнению лабораторных работ Лабораторная работа № 1. Качественный элементный анализ органических соединений
- •Экспериментальная часть.
- •Экспериментальная часть
- •Экспериментальная часть.
- •Экспериментальная часть.
- •Методические указания для самостоятельной работы студентов Задания в тестовой форме для самоконтроля
- •1 Предельные, непредельные и ароматические ув
- •2 Кислородсодержащие производные ув: спирты, карбонильные соединения, карбоновые кислоты.
- •30. Определите промежуточное вещество х в синтезе ацетона по схеме: пропен → х → ацетон
- •3 Азотсодержащие производные ув: амины, нитросоединения, аминокислоты
- •4 Высокомолекулярные соединения
- •Перечень контрольных вопросов
- •Список рекомендуемой литературы
1.3 Изомерия органических соединений
Все изомеры делят на две большие группы – структурные изомеры и пространственные изомеры. Структурные изомеры отличаются друг от друга порядком соединения атомов. В пространственных изомерах порядок соединения атомов один и тот же, но атомы благодаря электронным или геометрическим особенностям отличаются положением в пространстве относительно других атомов.

Среди структурных изомеров выделяют три группы:
1. Изомеры, принадлежащие одному классу соединений, но отличающиеся строением углеродных скелетов, например:
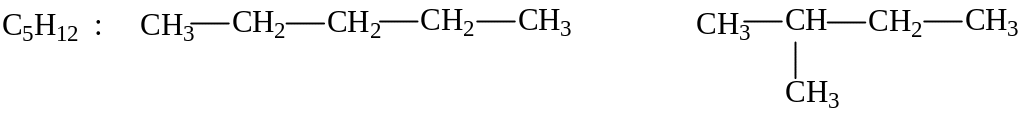
пентан 2-метилбутан
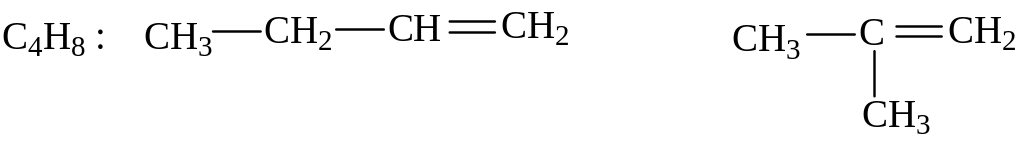
бутен–1 2-метилпропен
Этот вид изомерии характерен для всех классов органических соединений.
2. Изомеры, принадлежащие одному классу соединений, отличающиеся положением функциональной группы:

1-хлорпропан 2-хлорпропан
или кратной связи в молекуле:
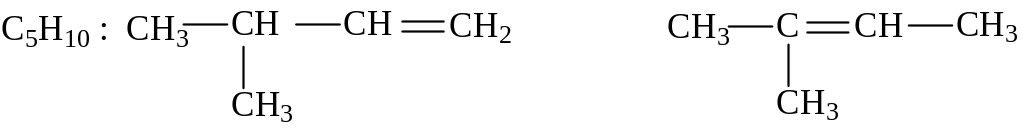
3-метилбутен–1 3-метилбутен–2
Этот вид изомерии характерен для всех классов органических соединений, кроме предельных углеводородов.
3. Изомеры, относящиеся к различным классам органических соединений (межклассовые изомеры), например:
СН3СООН НСООСН3
уксусная кислота метилацетат
Единственный класс органических соединений, представители которого не имеют межклассовых изомеров, это – алканы (предельные алифатические углеводороды).
Пространственные изомеры (стереоизомеры) можно разделить на два класса: цис-транс-изомеры и оптические изомеры.
1. Цис-транс-изомерия характерна для соединений, содержащих двойную связь или цикл. В таких молекулах отсутствует свободное вращение вокруг связи С = С или С – С (в циклах) и заместители у двух соседних атомов углерода могут оказаться по одну сторону (цис-) или по разные стороны (транс-) от плоскости, проходящей через двойную связь:
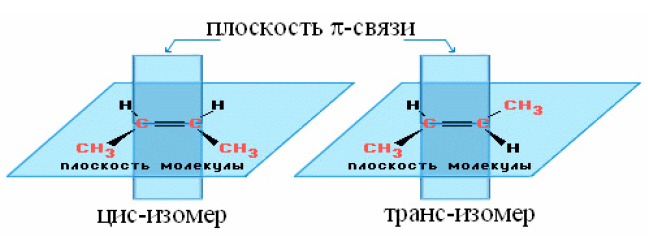
Цис- и транс-изомеры могут заметно отличаться друг от друга по своим физическим и химическим свойствам.
Если хотя бы один из атомов углерода при двойной связи соединен с двумя одинаковыми заместителями, то цис- и транс-изомеры совпадают друг с другом и, следовательно, представляют одно и то же вещество, например:

2. Оптическая изомерия характерна для молекул, которые не совпадают со своим зеркальным отображением. Таким свойством обладают любые молекулы, имеющие хотя бы один асимметрический (хиральный) центр – атом углерода, связанный с четырьмя различными заместителями. Например, оптические изомеры имеет молекула молочной кислоты СН3СН(ОН)СООН, в которой асимметрическим центром является центральный атом углерода:

Оптические изомеры имеют почти одинаковые физические и химические свойства.
1.4 Строение атома углерода. Типы гибридизаций
Электронная структура атома углерода в основном состоянии имеет вид 1s22s22p2. При небольшом возбуждении один из s-электронов переходит на 2р–подуровень, и атом приобретает электронную конфигурацию 1s22s12р3. При образовании связей 2s-орбиталь и от одной до трех 2p-орбиталей перемешиваются, образуя смешанные, или так называемые гибридные орбитали. Это явление называется гибридизацией. Основные типы гибридизации углерода:
1) sр3-Гибридизация (первое валентное состояние) характерна для насыщенных УВ. В этом случае в гибридизации участвуют одна 2s- и три 2p-орбитали, в результате образуются четыре одинаковые sp3-гибридные атомные орбитали (АО). Образовавшиеся гибридные орбитали образуют четыре σ-связи, в пространстве располагаются в форме тетраэдра на расстоянии максимального отталкивания друг от друга – под углом 109,5°.
2) sр2-Гибридизация (второе валентное состояние) характерна для органических соединений, содержащих двойную связь. Гибридизации подвергаются одна 2s- и две 2p-орбитали атома углерода. В результате образуются три sp2-гибридные орбитали, которые расположены под углом 120° друг к другу и направлены к вершинам правильного треугольника, в центре которого находится атом углерода. Три sp2-гибридные орбитали атома углерода образуют три σ-связи при перекрывании с орбиталями атомов других элементов. Единственная негибридная 2p-орбиталь может перекрываться с аналогичными негибридными 2p-орбиталями других атомов углерода с образованием π-связей.
3) sр-Гибридизация (третье валентное состояние) характерна для органических соединений, содержащих тройную связь. В этом случае одна 2s- и одна 2p-орбитали атома углерода в результате перемешивания образуют две одинаковые sp-гибридные орбитали, которые расположены под углом 180° друг к другу. Две sp-гибридные орбитали атома углерода образуют две σ-связи. Две негибридные 2р-орбитали образуют две π-связи.
