
- •Вопросы к коллоквиуму № 1
- •Стандартизация растворов титрантов
- •Основные приемы титрования
- •Расчеты в титриметрическом анализе
- •2.3.1. Химический эквивалент
- •2.3.2. Расчет результата прямого титрования при разных способах выражения концентрации раствора
- •2.3.3. Расчет результата в методах обратного титрования
- •Понятие о кривых титрования
- •2. Кислотно-основное титрование.
- •Рабочие растворы
- •2.7.2. Кривые титрования и выбор индикатора
- •3. Окислительно-восстановительное титрование.
- •Окислительно-восстановительные системы
- •Основные факторы, влияющие на потенциал
- •Константы равновесия окислительно-восстановительных реакций
- •Построение кривой окислительно-восстановительного титрования
- •Влияние условий на ход кривых титрования
- •Определение точки эквивалентности
- •Окислительно-восстановительные индикаторы
- •Перманганатометрия
- •Хроматометрия
- •Иодометрия
- •Вопросы к коллоквиуму № 2
- •1. Комплексонометрическое титрование
- •Понятие о комплексонах
- •Рабочие растворы
- •Индикаторы в комплексонометрии
- •Выполнение комплексонометрических определений
- •Определение жесткости воды
- •Определение кальция и магния в различных растворах и материалах
Стандартизация растворов титрантов
Под стандартизацией раствора титранта понимают установление его точной концентрации с относительной погрешностью, не превышающей±0,1%.
Различают приготовленные и установленные растворы титрантов. Приготовленные растворы точной концентрации получают растворением точной навески тщательно очищенного исходного вещества в определенном объеме воды или другого растворителя. Так готовят, например, титрованный раствор NaCl.
Однако
многие растворы, например титрованный
раствор HCl,
приготовить этим способом нельзя. В
таких случаях готовят раствор титранта,
концентрация которого известна лишь
приблизительно, а затем его стандартизуют,
т.е. устанавливают концентрацию точно.
Эти растворы называют установленными.
Для стандартизации растворов применяют
специальные установочные вещества –
первичные стандарты. Эти вещества должны
иметь состав, точно отвечающий химической
формуле, быть устойчивыми на воздухе и
иметь по возможности большую молярную
массу эквивалента*.
Они должны быть также доступными и легко
очищаться от примесей. Реакция титранта
с раствором установочного вещества
должна отвечать требованиям, которые
предъявляются к титриметрическим
реакциям, т.е. протекать быстро,
количественно и стехиометрически.
Например, растворы NaOH и KOH часто
стандартизуют по гидрофталату калия 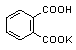 или
дигидрату щавелевой
кислоты H2C2O4×2H2O,
растворы HCl и H2SO4 –
по карбонату
натрия или буре Na2B4O7×10H2O,
растворы перманганата
калия –
по оксалату натрия Na2C2O4 и
т.д.
или
дигидрату щавелевой
кислоты H2C2O4×2H2O,
растворы HCl и H2SO4 –
по карбонату
натрия или буре Na2B4O7×10H2O,
растворы перманганата
калия –
по оксалату натрия Na2C2O4 и
т.д.
Нередко для целей стандартизации используют вторичные стандарты, в качестве которых выступают титрованные растворы веществ, способных взаимодействовать с титрантом.
Как правило, стандартизацию титранта стремятся проводить в тех же условиях, какие будут при выполнении анализа.
Основные приемы титрования
В методах прямого титрования определяемое вещество непосредственно реагирует с титрантом. Для проведения анализа этим методом достаточно одного рабочего раствора.
В методах обратного титрования (или, как их еще называют, методах титрования по остатку) используются два титрованных рабочих раствора: основной и вспомогательный. Широко известно, например, обратное титрование хлорид-иона в кислых растворах. К анализируемому раствору хлорида сначала добавляют заведомый избыток титрованного раствора нитрата серебра (основного рабочего раствора). При этом происходит реакция образования малорастворимого хлорида серебра: Ag+ + Cl- → AgCl. Не вступившее в реакцию избыточное количество AgNO3оттитровывают раствором тиоцианата аммония (вспомогательного рабочего раствора): Ag+ + SCN- → AgSCN. Содержание хлорида можно рассчитать, т.к. известно общее количество вещества (моль), введенное в раствор, и количество вещества AgNO3, не вступившее в реакцию с хлоридом.
Третьим основным видом титриметрических определений является титрование заместителя (титрование по замещению, косвенное титрование). В этом методе к определяемому веществу добавляют специальный реагент, вступающий с ним в реакцию. Один из продуктов взаимодействия затем оттитровывают рабочим раствором. Например, при иодометрическом определении меди к анализируемому раствору добавляют заведомый избытокKI. Происходит реакция
2Cu2+ + 4I- → 2CuI + I2.
Выделившийся иод оттитровывают тиосульфатом натрия.
Известны и более сложные титриметрические методики анализа, являющиеся комбинацией этих трех основных.
