
- •Вопросы к коллоквиуму № 1
- •Стандартизация растворов титрантов
- •Основные приемы титрования
- •Расчеты в титриметрическом анализе
- •2.3.1. Химический эквивалент
- •2.3.2. Расчет результата прямого титрования при разных способах выражения концентрации раствора
- •2.3.3. Расчет результата в методах обратного титрования
- •Понятие о кривых титрования
- •2. Кислотно-основное титрование.
- •Рабочие растворы
- •2.7.2. Кривые титрования и выбор индикатора
- •3. Окислительно-восстановительное титрование.
- •Окислительно-восстановительные системы
- •Основные факторы, влияющие на потенциал
- •Константы равновесия окислительно-восстановительных реакций
- •Построение кривой окислительно-восстановительного титрования
- •Влияние условий на ход кривых титрования
- •Определение точки эквивалентности
- •Окислительно-восстановительные индикаторы
- •Перманганатометрия
- •Хроматометрия
- •Иодометрия
- •Вопросы к коллоквиуму № 2
- •1. Комплексонометрическое титрование
- •Понятие о комплексонах
- •Рабочие растворы
- •Индикаторы в комплексонометрии
- •Выполнение комплексонометрических определений
- •Определение жесткости воды
- •Определение кальция и магния в различных растворах и материалах
2.3.3. Расчет результата в методах обратного титрования
Рассмотрим расчет результата на примере обратного титрования хлорида. В этом случае к анализируемому раствору хлорида добавляется заведомый избыток титрованного раствора AgNO3, и не вступившее в реакцию с хлоридом количество вещества AgNO3 оттитровывается растворомNH4SCN. Если n(AgNO3) – количество вещества AgNO3, добавленное к анализируемому раствору хлорида, n(AgCl) – количество вещества эквивалента AgNO3, израсходованное на реакцию с хлоридом, а n(AgSCN) – на реакцию с тиоцианатом, то, очевидно,
n(AgNO3) = n(AgCl) + n(AgSCN).
Величина n(AgNO3) определяется молярной концентрацией эквивалента основного рабочего раствора AgNO3 и его объемом
![]() .
.
Молярная концентрация эквивалента вспомогательного рабочего раствора NH4SCN и его объем, затраченный на реакцию с избытком AgNO3после осаждения хлорида, точно известны, поэтому
![]() .
.
Количество вещества эквивалента хлорида в растворе находим из уравнения
n(AgCl) = n(AgNO3) – n(AgSCN).
Подставим в эту формулу выражения для количества вещества эквивалента
![]()
Масса хлорида в анализируемом растворе будет равна
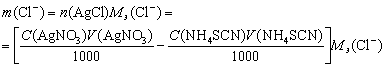
Таким образом, результат обратного титрования всегда рассчитывается по разности между взятым количеством вещества эквивалента основного рабочего вещества и оставшимся после его реакции с определяемым компонентом.
Понятие о кривых титрования
Важной характеристикой титриметрических методов являются кривые титрования. Они показывают графическую зависимость концентрации участника реакции, протекающей при титровании (либо логарифма концентрации или какой-то характеристики раствора) от объема добавленноготитранта (либо от степени оттитрованности). Например, для реакций кислотно-основного взаимодействия такой характеристикой раствора служит его pH.
Различают рассчитанные теоретически и экспериментальные кривые титрования. Теоретический расчет кривых титрования обычно проводится по данным о константе равновесия реакции, протекающей при титровании, и исходным концентрациям реагирующих веществ. Если нормальные концентрации титруемого раствора и титранта одинаковы и для титрования взяли 100,0 мл раствора, то число миллилитров добавленного титранта будет равно степени протекания реакции между титрантом и определяемым веществом (степени оттитрованности). Такие кривые служат главным образом для обоснованного выбора индикатора в данном титровании, который обеспечил бы необходимую точность определения.
Экспериментальные кривые титрования получают, измеряя какое-либо свойство системы в ходе титрования (оптическую плотность,диффузионный ток и т.д.) в зависимости от объема добавленного титранта и строят соответствующий график. Такие кривые служат для определенияточки эквивалентности.
2. Кислотно-основное титрование.
.К методу кислотно-основного титрования (нейтрализации) относят все определения, которые основаны на реакции взаимодействия кислот и оснований с образованием малодиссоциирующих молекул воды:
![]()
или
![]()
В зависимости от титранта различают ацидиметрическое и алкалиметрическое титрование. В методе ацидиметрии в качестве титрантов применяют сильные кислоты. Этим методом определяют сильные и слабые основания, соли слабых кислот и органических соединений, обладающих основными свойствами.
В методе алкалиметрического титрования в качестве титрантов применяют сильные основания. Методом алкалиметрии определяют сильные и слабые кислоты, соли слабых оснований и органических соединений, обладающих кислыми свойствами.
Смеси. Если в образце содержатся два определяемых вещества, взаимодействующие с одним и тем же титрантом, их можно определить в одной операции титрования при условии, что реакция каждого из этих веществ с титрантом имеет достаточно высокую константу равновесия и что эти константы существенно различаются (как правило, не менее чем на два порядка). На рис. 5 приведены кривые титрования для смесей анализируемых веществ с различными pKa. Первым титруется вещество, реакция которого с титрантом имеет большую константу равновесия. Объем от начала титрования до первой конечной точки позволяет определить концентрацию этого анализируемого вещества, а объем между конечными точками титрования - концентрацию второго анализируемого вещества. Если константы равновесия слишком близки, то локализовать первую конечную точку титрования будет сложно или вообще невозможно. В таком случае анализируемые вещества нельзя определить по отдельности, а суммарный объем титранта позволит рассчитать лишь сумму их концентраций.
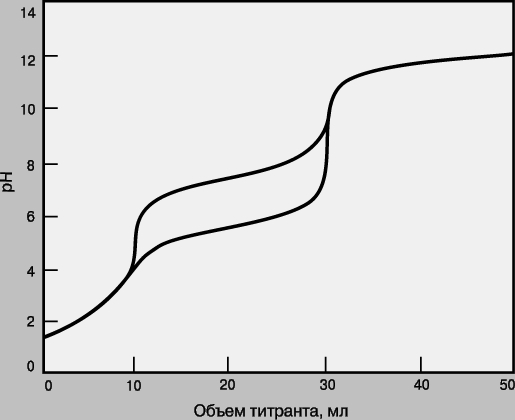 Рис.
5. КРИВЫЕ ТИТРОВАНИЯ для смеси двух
определяемых веществ с pKa = 2 (Kр = 10 12) и
pKa = 6 или 8 (Kр = 10 8 или 10 6).
Рис.
5. КРИВЫЕ ТИТРОВАНИЯ для смеси двух
определяемых веществ с pKa = 2 (Kр = 10 12) и
pKa = 6 или 8 (Kр = 10 8 или 10 6).
В настоящее время все более широкое применение находят физико-химические методы индикации, так как некоторые из них можно полностью автоматизировать. Их можно применять и тогда, когда нет полноты протекания реакции между титрантом и титруемым веществом. В отличие от визуальной индикации физико-химические методы требуют значительных расходов на аппаратуру.
