
- •Титриметрические методы анализа
- •Содержание
- •1. Общая характеристика титриметрических методов анализа
- •1.1. Требования к химическим реакциям титрования
- •1.2. Классификация реакций, применяемых в титриметрии
- •Кислотно-основное титрование (протолитометрия).
- •Окислительно-восстановительное титрование (редоксиметрия).
- •1.3. Стандартные растворы – титранты
- •1.4. Способы выражения концентрации стандартных растворов
- •1.5. Закон эквивалентов
- •1.6. Общие приемы титрования
- •1.7. Кривые титрования
- •2. Кислотно-основное титрование (протолитометрия)
- •2.1. Теории кислотно-основного взаимодействия
- •2.2. Буферные растворы
- •2.3. Кривые титрования сильных протолитов
- •2.3.1. Титрование сильной кислоты раствором сильного основания
- •2.3.2. Титрование сильного основания раствором сильной кислоты
- •2.3.3. Анализ кривых титрования
- •2.4. Кислотно-основные индикаторы
- •2.5. Титрование слабого протолита сильным протолитом
- •2.5.1. Титрование слабой кислоты сильным основанием
- •2.5.2. Титрование слабого основания сильной кислотой
- •2.5.3. Особенности титрования слабых протолитов
- •2.6. Титрование смеси протолитов , полипротонных кислот, поликислотных оснований
- •2.6.1. Титрование смеси двух кислот – сильной и слабой
- •2.6.2. Титрование двух слабых кислот
- •2.6.3. Титрование полипротонных кислот (н3ро4)
- •2.6.4. Титрование поликислотных оснований (Na2co3)
- •2.7. Источники ошибок в титриметрическом анализе
- •3. Комплексиметрические методы анализа (комплексиметрия)
- •3.1. Общая характеристика метода
- •3.2. Комплексонометрия
- •3.2.1. Кривые титрования в комплексонометрии
- •3.2.2. Влияние кислотности раствора
- •3.2.3. Влияние дополнительных лигандов
- •3.2.4. Определение точки эквивалентности в методе комплексонометрии. Металлоиндикаторы
- •3.2.5. Особенности метода комплексонометрии
- •4. Окислительно-восстановительное титрование (редоксиметрия)
- •4.1. Общая характеристика метода
- •4.2. Кривые окислительно-восстановительного титрования
- •4.3. Определение точки эквивалентности в методе редоксиметрии
- •4.4. Факторы, влияющие на величину редоксипотенциала
- •4.4.1. Применимость формулы Нернста
- •4.4.2. Влияние ионной силы раствора на величину редоксипотенциала
- •4.4.3. Влияние рН раствора на величину редоксипотенциала
- •4.4.4. Влияние комплексообразования или образования малорастворимых соединений на величину редоксипотенциала
- •4.5. Особенности редоксиметрии
- •4.5.1. Предварительная подготовка пробы к анализу
- •4.5.2. Константы равновесия окислительно-восстановительных реакций
- •4.5.3. Скорость и механизм окислительно-восстановительных реакций
- •4.5.4. Устойчивость водных растворов окислителей и восстановителей
- •4.5.5. Факторы, влияющие на скорость окислительно-восстановительной реакции
- •4.6. Методы окислительно-восстановительного титрования
- •4.6.1. Перманганатометрия
- •4.6.2. Дихроматометрия
- •4.6.3. Хромометрия
- •4.6.4. Иодометрия
- •4.6.5. Ванадатометрия
- •4.6.6. Цериметрия
- •4.6.7. Броматометрия
- •Литература
2.6.4. Титрование поликислотных оснований (Na2co3)
В растворе поликислотного (многоосновного) основания, так же как и в растворе многоосновной кислоты, диссоциация более слабых электролитов подавлена более сильными электролитами. Поэтому при добавлении сильной кислоты в раствор поликислотного основания (или смеси оснований) оттитровывается прежде всего более сильное основание. Более слабое основание начинает титроваться тогда, когда оставшееся количество сильного основания не хватает для подавления ионизации слабого основания. При этом если последовательные константы ионизации различаются более чем в 104 раз, то на кривых титрования наблюдаются отчетливые скачки титрования.
Соли слабых полипротонных кислот и щелочных металлов являются поликислотными основаниями, например, Na2CO3.
Рассмотрим титрование 0,1 М раствора Na2CO3 раствором 0,1 М HCl.
CO3-2
+ H+
= HCO3 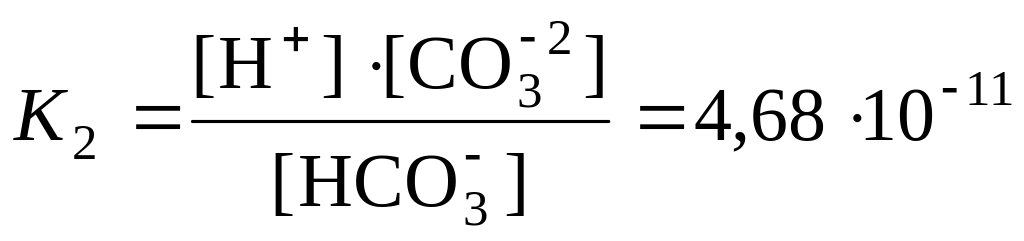 pK2=10,33
pK2=10,33
HCO3
+
H+
= H2CO3 ![]() pK1=6,37
pK1=6,37
Расчет рН исходного 0,1 М раствора Na2CO3. Основность раствора соли определяется процессом гидролиза:
CO3-2 + H2O = HCO3 + OH-,
Запишем два равнозначных выражения константы гидролиза:

и

тогда 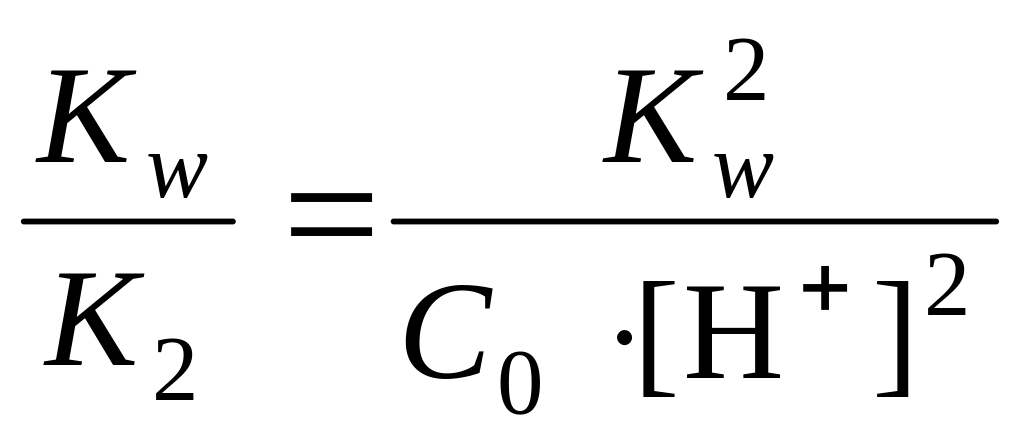
откуда ![]()
![]()
В процессе титрования до первой точки эквивалентности в растворе будет находиться смесь NaHCO3 и Na2CO3 – буферная смесь.
![]()
![]()
При х1 = 50 % значение рН = рK2 = 10,33 – область буферного действия.
В растворе в ТЭ1 находится соль NaHCO3. Гидрокарбонат-ион HCO3 участвует в следующих равновесных процессах:
HCO3 = H+ + CO3-2
HCO3 + H+ = H2CO3
Уравнение материального баланса: [CO32-] = [H+] + [H2CO3]. Концентрации ионов [CO32-] и [H2CO3] можно выразить из констант ионизации угольной кислоты, тогда получим:
![]()
приводим к общему знаменателю K1[H+]:
K1K2[HCO3] = K1[H+]2 + [H+]2[HCO3]
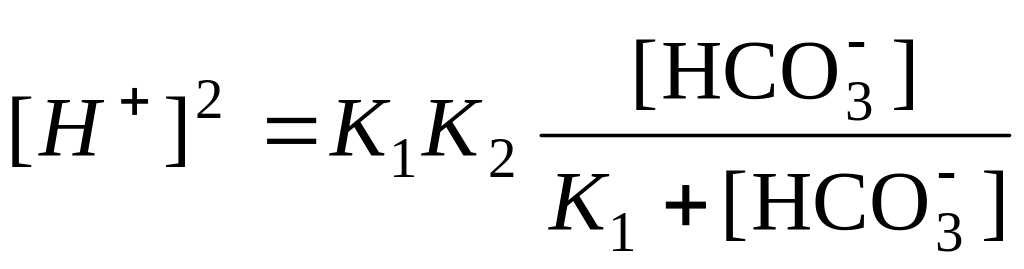
если K1
Сo(NaHCO3),
то ![]()
![]()
При дальнейшем добавлении кислоты до второй точки эквивалентности в растворе смесь NaHCO3 и H2CO3 – буферная смесь:
![]()
При x2 = 50 % величина рН = рK1 = 6,37.
В растворе в ТЭ2 находятся H2CO3 и NaCl. Значение рН раствора определяется ионизацией угольной кислоты в основном по первой ступени, поскольку K1 K2.
![]()
![]()
![]()
После второй точки эквивалентности рН раствора определяется избыточной концентрацией HCl:
pH = -lgCизб.(HCl)
Кривая титрования карбоната натрия раствором соляной кислоты приведена на рис. 2.5.
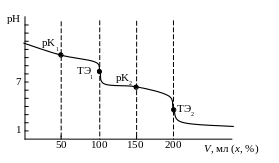
Рис. 2.5. Кривая титрования карбоната натрия Na2CО3 0,1 М раствором соляной кислоты HCl 0,1 М
В первой точке эквивалентности карбонат превращается в гидрокарбонат, рН = 8,35. При использовании индикатора фенолфталеина (рТ = 9) переход окраски из малиновой в бесцветную не очень резкий, точность титрования невысока, поскольку K2 = 4,6810-11 10-8 (очень мала).
Во второй точке эквивалентности гидрокарбонат превращается в угольную кислоту, рН = 3,69. Можно использовать индикатор метилоранж (рТ = 4), желтая окраска переходит в розовую, переход четкий, но происходит медленно. Лучше использовать метиловый красный (рТ = 5,3), титровать до появления красной окраски, затем прокипятить раствор для удаления растворенного CO2 (при этом рН возрастает), охладить и продолжить титрование до резкого перехода окраски индикатора из желтой в красно-розовую.
