
Шпоры по биофизике
.pdf
*1.Особенности физических методов исследования биологических систем.
Исследования биообъектов физическими методами проводится, на двух уровнях:
1.Метод квантовой химии.
2.Моделирование биопроцессов. Смысл исследования – выбрать наиболее
существенные характеристики данной системы. Функционирование биологических систем является следствием взаимодействия отдельных частей, элементов и процессов, происходящих в этой системе. Выяснение принципов регулирования этих систем и возможности воздействия на эти процессы регулирования, являются главными задачами. Метаболические процессы фундаментально определяют многие явления, в том числе и патологические.
Пусть в системе имеется5 составляющих, например концентрации соединений – Ci, i зависит от многих условий и факторов. Мы интересуемся кинетикой процессов:
dC1 = f1 (c1 , c2 ,...cn ) , dt
dC2 = f2 (c1 , c2 ,...cn ) ,(1) dt
dCn = fn (c1 ,c2 ,...cn ) dt
Так как биосистемы все открыты, состояние термодинамического равновесия в принципе невозможно. Стационарные системы: набор параметров либо не меняется, либо меняется незначительно (но состояние неравновесное).
f1(c1,c2…cn)=0 (2) |
M |
Возьмем n мерное пространство в ХОУ системе |
|
координат.
Точка М будет определять состояние системы. Базовое пространство определяется точкой М,х геометрическое место точек при перемещении точки М с изменением параметров – фазовое пространство. Значение с один. во всем рассмотренном пространстве – это точечное состояние (1) .Если (2) не сохраняются, то величины Сi зависят от пространства
координат:
dC1 ( X1Y1 Z1 ) |
= f (C |
( X Y Z |
), C |
2 |
( X |
2 |
Y |
Z |
2 |
),...) |
||
|
||||||||||||
dt |
1 |
1 |
1 |
1 |
|
|
2 |
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
Дифференциальное уравнение биопроцессов – сложны, очень громоздки, поэтому главная задача
– их упростить.
Принцип «узкого места»: если исследуемый процесс представляет из себя многостадийный процесс (почти все биопроцессы), то чрезвычайно важно узнать время течения этих процессов и выделить наиболее медленный процесс (определяющий время течения всего процесса) – это звено носит название «узкого места». Оно может быть не только для времени, это может быть любой параметр.
Динамическое поведение систем может быть расписано математическими моделями только «узкого места» (процесса, являющегося наиболее медленным для данной цепи). Значения С в уравнении (3) дают стационарные состояния системы.
*2.Качественные методы исследования простейших биологических систем. Качественный анализ дифференциальных уравнений.
Для биосистем являются справедливыми уравнения химической кинетики Необходимо учитывать особенности биосистем: В биосистемах одновременно много химических и физических процессов, организованных в пространстве и во времени, т.е. имеется определенное упорядочение, определенная временная последовательность. Каждый элемент системы находится в состоянии непрерывного взаимодействия с остальными элементами данной системы. при химических и других превращениях параметры и характеристики могут меняться. Переменные величины в биосистемах меняются не только во времени, но зависят от пространственных координат. В биосистемах существует специальный механизм саморегулирования, основанный на принципах обратной связи. Биосистемы гетерогенны в пространстве. Условия взаимодействия элементов зависят от точки пространства этой системы, где это взаимодействие. Так как все биосистемы динамические, то и модули тоже должны быть динамическими, которые описываются как совокупность переменных величин и измеряемых параметров, остающихся постоянными на период наблюдения. Динамика системы определяется при количестве веществ N:
dC1 = f1 (c1 , c2 ,...cn ) dt
dCdt2 = f2 (c1 , c2 ,...cn )
dCn = fn (c1 , c2 ,...cn ) dt
Уравнения, описывающие систему, являются сложными, зависят от большого количества величин. Вычислительная техника открывает возможности получения частных решений.С1, С2,…Сn
– зависят от внутренних и внешних воздействий, т.к. биосистема открытая.Термодинамическое равновесие невозможно, но стационарное составляющие характеризуются тем, что многочисленные процессы, идущие в системе взаимоуравновешиваются. Принцип «узкого места» позволяет изучить поведение всей системы с ее множеством процессов (выделяется наиболее медленный процесс, определяющий время этого процесса – если изучаемый параметр – время). Динамическое поведение истолковывается, исходя из изучения «узкого места». Если интересует быстро протекающий процесс, то характеристиками медленного процесса пренебрегают.
Каждое решение дифференциального уравнения заключается в том, чтобы охарактеризовать состояние системы набором значений Сi прямоугольной системы координат в n – мерном пространстве, то получим точку, соответствующую значению Сi. Изменения состояния системы описывается смещением N (n мерное пространство– фазовое, смещение точки М – фазовая траектория). Стационарные состояния будут соответствовать тому состоянию, когда f1(c 1,c2…cn)=0.Система будет устойчивой, если при малом смещении от N по координате со временем, а сама система не изменится от исходного состояния на большую разницу. Рассмотренная система – точная система, где предполагается, что параметр Сi является неизменным в момент t в фазовом пространстве. В реальных биосистемах структурные гетерогенные особенности приводят к тому, что на эти уравнения накладываются дополнительные члены.
*3.Теорема о самом низком собственном значении гамильтониана системы.
Гамильтониан́(функция Гамильтона) — функция, описывающая энергию системы в классической и квантовой механике, а также квантовой теории поля. Для частицы в потенциальном поле сил гамильтониан H – это полная энергия частицы, выраженная через координаты и импульс:
Для поиска уравнений, определяющих спин орбитали или орбитали. пользуются вариационным принципом квантовой механики, который лежит в основе большей части приближенных методов решения уравнения Шрёдингера для многочастичных систем. Вариационный принцип утверждает, что среднее значение гамильтониана
H на произвольно выбранной функции Ψ, называемое функционалом энергии Е, всегда больше или равно наименьшему собственному
значению гамильтониана H , т.е.
E = |
ψ H ψ |
≥ E0 |
|
ψψ |
|||
|
|
||
или |
|
|
|
E = ψ H ψ |
≥ E0 , если , ψ ψ =1 |
||
для любой пробной функции Ψ .
*5.Адиабатическое приближение.
Адиабатическое приближение основано на том, что масса ядер атомов во много раз больше массы электронов, поэтому движение электронов во много раз быстрее, чем у ядер.
Погрешность конечных результатов обусловлена адиабатическим приближением и имеет порядок
me 0.5 , где М суммарная масса ядра. Но
M
существуют процессы , где движение ядер существенно. Адиабатическое приближение дает возможность достаточно резко сократить количество независимых переменных, но это упрощение не является радиальным для такой системы: «ион – молекула – водород». Задачу точного решения можно выполнить для системы +Н2.Разделение движения ядер и электронов дает возможность представить волновую функцию ψ в виде произведений двух волновых функций, одна из которых зависит только от координат ядер. получаем два уравнения Шредингера. Таким образом, мы получили волновую функцию, описывающую только электронное состояние. Полученная полная энергия и называется электронной энергией
*7.Приближение самосогласованного поля.
Мгновенная конфигурация определяется положением всех элементарных частиц. Самосогласование – электрон последовательно улучшает волновую функцию (улучшение последующего значения через предыдущее).
Te −(∑ |
e2 |
+ ∑ |
|
Ze2 |
|
)ψ = Ef ri |
|
r |
ρ |
|
−r |
||||
|
r |
M |
|
||||
|
i |
|
|
|
i |
|
|
расстояние между е, Те оператор кинетич энергии
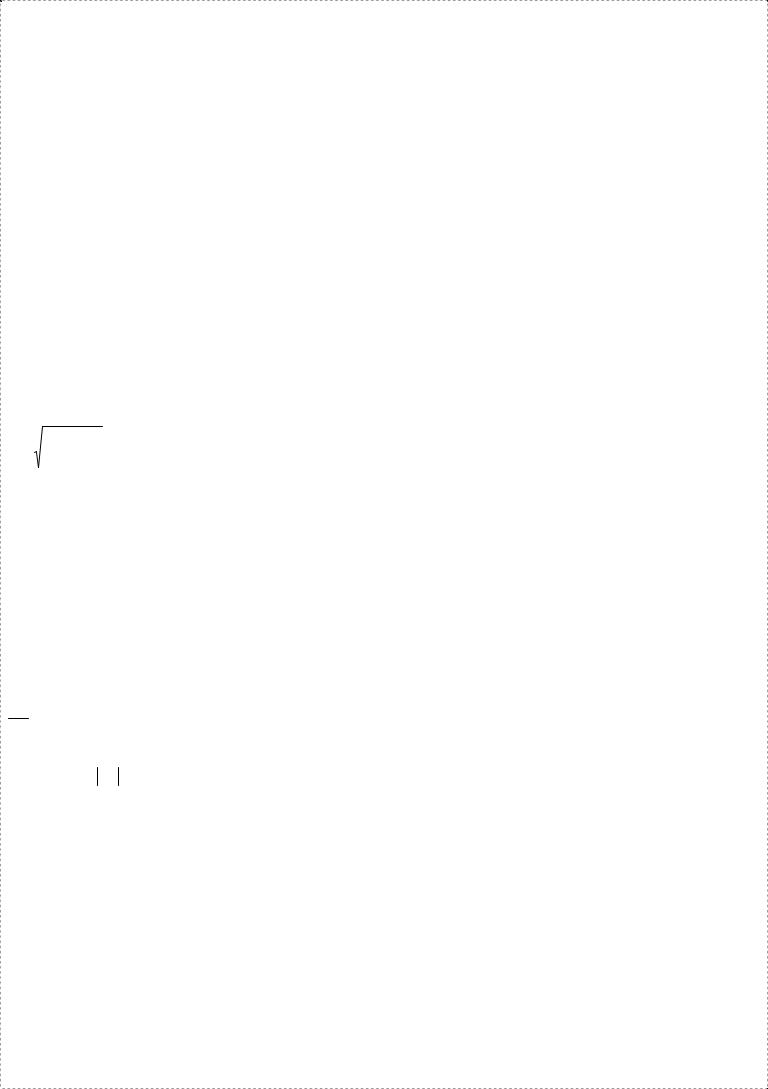
*4.Уравнение Шредингера. Определение электронных характеристик изолированной молекулы.
Шредингера не выводимо не из каких конкретных фактов.
h2 |
∂2ψ ∂2ψ ∂2ψ |
|
|
|||||||
|
|
|
2 + |
|
2 + |
|
2 |
|
+(U − E)ψ = 0 |
Пр |
|
|
|
|
|||||||
|
|
∂x |
∂y |
∂z |
|
|
||||
2m |
|
|
|
|
|
|
||||
остейшей системой, которую можно описать уравнением Шредингера – атом водорода. Для него:
h 2 |
∆ ψ + (U − E )ψ = 0 |
|
2 m |
||
|
Это единственная система, которая удовлетворяет уравнению Шредингера без допущений. Если допустить, что е находится в центрально симметрическом электрополе, то уравнение упрощается при его записи в сферических координатах:
x= r∙sinθ∙cosϕ y= r∙sinθ∙sinϕ z= r∙cosϕ
Решением уравнения является волновая функция, которая в общем случае – комплексная величина. Физический смысл имеет ψ
 2 показывает
2 показывает
вероятность обнаружения данного е в данном объеме dU результат носит статический характер. Понятие «траектория» в квантовой механике теряет физический смысл, т.е. невозможно проследить за движением е , связанного с тем или иным ядром.
ψ = |
Z3 |
e |
− |
Z |
r |
|
πa 3 |
|
a Для водорода Z=1 Z – число |
||||
|
0 |
|
|
|
||
|
|
|
|
|
|
|
зарядов; a0 – радиус Бора; r – расстояние между е и данным ядром. Решение уравнения Шредингера приводит к тому, что значение энергий оказывается дискретным. Реальные системы имеют более двух частиц уравнение усложняется:
h |
2 |
n |
n |
|
|
∆ψ + ∑U (R, r)ψ + ∑∑neψ = Е |
|||
2m |
||||
1 |
|
|||
Уравнение в этом виде не решается, если пренебречь взаимодействием частиц между собой, то уравнение интегрируется, но это пренебрежение приводит к грубым результатам. Взаимодействие еми между собой физически оправдано заменить эффектом экранирования остальными е ми.
Взаимодействие ∑∑Uneψ
разбивается на две части:
h2 ∆ψ +Uψ +U /ψ =ψE ;
2m
U поле ядра Значение волновой функции дает возможность определить вероятность нахождения
системы: P = ∫∫∫ψne 2 dxdydz Этот метод
Хартри Фока реализуется для сложных систем при наличии специальных программ вычисления.
*6.Одноэлектронное приближение.
Одноэлектронное приближение взаимодействие каждогоэлектронасостальными, зависящееот мгновеннойэлектроннойконфигурации, заменяется действиемнекоторогостационарногополя, создаваемогоопределеннымобразомусредненным пространственнымраспределениемэлектронов. В этомприближениимногоэлектроннаяволновая функция представляетсяввидекомбинации одноэлектронныхволновыхфункций, которые записываютсяввидепроизведениямолекулярных орбиталей (одноэлектронныхволновыхфункций, зависящихоткоординаттолькоодногоэлектрона) на
спиновыефункции:ψµ =ψµ (i)σµ (i) Где:ϕµ(i)
молекулярнаяорбиталь µ i ro электрона, σµ(i) спиноваяфункция i ro электрона.
В одноэлектронном приближении многоэлектронная волновая функция представляется в виде комбинации одноэлектронных волновых функций. Для системы из 2N электронов полная 2N электронная волновая функцияимеетвид: гдеР операторперестановок электронов, действиекоторогосводитсяктому, что есличислоперестановоквпоследовательности1, 2,..., N четное, топриписываетсязнак"+", еслинечетное знак" ", затемвсечленыскладываютсяисумма делится на (2N!). Число перестановок 2N.Функция Ф обладает основными свойствами волновой функции: она нормирована, меняет знак перемене местами какой либо пары электронов, удовлетворяетпринципуПаули обращаетсявнуль, есликакие либодвеспин орбиталисовпадают, и соответствуетполномуспинуэлектронов, равномуну лю.
Длянахождениянаилучшейволновойфункциив этомприближениииспользуют вариационный принцип, в соответствии с которым требуют, чтобы полнаяэнергияэлектроновмолекулыбыла минимальна. Производяварьирование и приравнивая к нулю коэффициенты при δΨ1 … δΨ1n, получаем системууравненийХартри Фока. Посколькувэтойсистемеучитываетсявзаимо действиекаждого электронасполем, создаваемым усредненнымпространственнымраспределением остальныхэлектронов, тоодноэлектронные волновыефункции всех электронов взаимосвязаны и согласованы. Поэтому МО, полученныев результатерешениясистемыуравненийХартри Фока, являютсясамосогласованными. Нодлясложных молекулэтусистемууравненийиспользовать довольносложно. Поэтомупредполагается, что любуюМОможнопредставить в виде линейной комбинации (ЛК) атомных орбиталей (АО).
*8.Второй закон термодинамики в открытых системах. Соотношение Ознагера.
Биосистемы – открытые, осуществляют обмен с окружающей средой. Все системы – на 3 типа: 1) Замкнутые 2) Обменивается веществом без обмена энергий 3) Обменивается веществом и энергией. δQ=dU+δA 1 й закон термодинамики для тепловых процессов. dU – изменение внутренней энергии, δA – работа при передаче тепла.
dS≥Q/T – второй закон термодинамики.
Любая система в замкнутом положении стремится занять устойчивое состояние, соответствующее максимальному значению энтропии. Все биологические системы из за обмена с открытой средой не соответствуют 1 и 2 му законам, а если добиться полной замкнутости, то биосистема перестает существовать как таковая. Для биосистемы:
dS=des+dis (соответственно изменение энтропии, вносимое извне и изменение собственно в этой системе)
dS/dt=des/dt+dis/dt
Энтропия может, увеличивается или уменьшается.
Возможны случаи, когда: dS/dt=0, des/dt= dis/dt –
система в стационарном состоянии. Возрастание энтропии собственно биосистемы будет уравниваться переносом des/dt извне.
dS/dt≤0, dis =dS des, δQ=(dU δA)/T, T=const, dis=(dST dU+dA)/T, dis= ∆δ (термодинамическая функция, равная разности энергий в начале и конце какого либо процесса). Вывод: изменение энергии собственно биосистемы определяется возрастанием термодинамического потенциала. Термодинамическое равновесие соблюдается частично и не всегда. О переходе системы в состояние устойчивости можно судить только для простейших систем.
Если система открытая, вблизи точки равновесия в стационарном состоянии скорость прироста энтропии за счет внутренних процессов достигает постоянного минимального прироста энтропии.
Соотношение Ознагера.
Изменение энтропии внутри системы при необратимых процессах определяется изменением термодинамического
потенциала: |
diS |
= |
1 d ' ' c |
изменение |
|||
|
|
|
|
||||
dt |
T dt |
||||||
|
|
|
|||||
термодинамического потенциала определяется разностью химического сродства в начале и конце рассматриваемых биохимических и химических
превращений. |
diS |
= |
1 |
AV = Ix , где |
|
dt |
T |
||||
|
|
|
Движущая сила, V скорость, I поток вещества, х ускор сила процесса. Пусть у нас имеется несколько химических превращений, происходящих в биосистеме, идущих одновременно. Процесс идет вблизи точки равновесия. Х мало => I=>0. В этом случае I=LX. L коэффициент, определяющий способности данного процесса. Для двух процессов:I1=X1L11+X2L12 и I2=X1L21+X2L22. Из теорий химии: L21=L12. Процесс происходит вблизи точки равновесия, поэтому зависимость между движущей силой и потоком имеет линейный характер, выполняется соотношение Ознагера, показывающее, что на интенсивность первого потока оказывает влияние движения второго. Пример: через мембрану проникает а) вещество, растворенное в воде 2)вода I1=(P1 P2)L11+(PОСМ1 РОСМ2)L12 общий поток.

*9.Соотношения Ознагера.
Пусть имеется открытая система, находящаяся вблизи равновесия, т.е. потоки энергии(вещества),обеспечивающие жизнедеятельность этой системы ,близки к 0 это является физической идеализацией. Пусть движущие силы являются X(разность хим. сродства), поток, возникающий под действием движущей силы =Y.При малых значениях Y(~=0),м/о
написать: Y = L * X т.е. в биосистеме Бывает совокупность превращений, хим. реакций. Пусть идут 2 взаимодействующих
процесса: Y1 = L11 * X1 + L12 * X2 ,где L11 линейный коэффициент, связывающий поток с
движущей силой X, L12 * X 2 показывает
воздействие 2 ой движущей силы на величину 1 ой. Из общих соображений очевидно,
что L12 = L21 ,т.е. влияние 1 го потока на 2 ой
равняется влиянию 2 го на 1 ый, это и есть соотношение Ознагера. Значение соотношения Ознагера заключается и в том, что оно позволяет восстановить линейный или нелинейный характер процесса. Закон Ома, гидравлические законы могут быть рассмотрены как соотношение Ознагера и справедливость доказывается экспериментально.
*16.Миграция энергии в биоструктурах.
Конформационные процессы в белковой молекуле невозможно истолковать без транспорта энергии. Построение электронной структуры происходит заметно быстрее, чем последующие, вызванные электронными процессами изменения конформационного состояния. Эта разница изменения скорости процесса, связанная с электронным перестроением и изменением конформации открывает возможность раздельного рассмотрения этих процессов. Экситонный мех м миграции энергии: Если падающая свет волна имеет λ, кот больше а – расст е м/у соседними атомами, то возможно когерентное возбуждение всего кристалла. Если время распр ния эн ии по кристаллу и время рассеивания эн ии в кристалле имеют вид: τд>>τэ, то эн я возб я продвигается по кристаллу. Если в белке имеется мех м утилизации эн ии, то экситонный мех м служит для переноса эн ии вдоль белковой мол лы. Мех м п/п ков: Эл ны из зоны валентности переходят в зону проводимости и становятся носителями эн ии Перенос энергии в биологических системах – важный процесс. Примеры – миграция энергии от светонакапливающих молекул, пигментов к реакционным центрам фотосинтетических мембран. Во всех фотохимических реакциях свободная энергия исходных молекул и свободная энергия конечных продуктов (H2O и CO2) имеют соотношения, что эти реакции невозможны в силу термодинамических причин. Поэтому накопление энергии света (механизм накопления, перенос) явл ся чрезвычайно важным.
*10.Теорема Пригожина.
Рассмотрим открытую систему, в которой одновременно протекают необратимые процессы( вблизи состояния термодинамического равновесия, где справедливы линейные соотношения между значениями скоростей и сродства и соотношения Онзагера). Согласно: β=ТdiS/dt=∑∑Lkj Xj Xk , получим: β=J1X1 +J2X2 >0 феноменологические уравнения будут J1=L11X1+L12X2
J2=L21 X1+L22X2
Пусть в стационарном состоянии J1=0. В случае химической реакции это означает, что в стационарном состоянии изменение концентрации соответствующего промежуточного вещества не происходит во времени dc/dt =0. Для процессов переноса теплоты или диффузии вещества через мембрану равенство J1=0 соответствует постоянной стационарной скорости, при которой количество переносимой через мембрану в единицу времени теплоты или вещества остается постоянным. Значение скорости продуцирования энтропии описывается выражением: ТdiS/dt=β(X1,X2)=L11X12+ L22X22+2L12X2X1.Нас будет интересовать характер зависимости величины β от X1, поскольку, по предположению, именно X1 претерпевает такие изменения, которые в конечном итоге приводят к установлению стационарного состояния J1=0. Возьмем частную производную dβ/d X1 при постоянном X2. Получим dβ/d X1=2(L11X1+L12X2) =2J1.Условия J1=0 и dβ/d X1=0 при X2=const
эквивалентны в области линейной термодинамики. Уравнение dβ/d X1=0 определяет существование экстремума функции β(X1,X2). Так как величина β является существенно положительным квадратичным выражением во всей области изменения независимого переменного X1>=0, то равенство нулю производной dβ/d X1=0 является условием минимума. Аналогичным образом легко получить условия стационарности и для другого потока: J2=0,dβ/d X2=0 при X1=const. Это заключение будет справедливо и в общем случае, если в системе протекает несколько процессов, связанных между собой уравнениями Ознагера. Формулы, их результат, полученный в термодинамике необратимых процессов для открытых систем находящихся вблизи равновесного состояния. При неизменных внешних условиях в частично равновесной открытой системе в стационарном состоянии, близком к термодинамическому равновесию, значение скорости прироста энтропии за счет внутренних необратимых процессов достигает отличного от нуля постоянного минимального положительного значения. Принцип минимума прироста энтропии представляет собой количественный критерий для определения общего направления самопроизвольных изменений в открытой системе. По изменению величины ежесекундного прироста энтропии можно предсказать переход системы в конечное стационарное состояние, если все эти процессы протекают вблизи равновесия. Вблизи равновесия величина β монотонно уменьшается, dβ>0 или dβ/dt<0, постепенно приближаясь к минимальному положительному значению по мере достижения конечного стационарного состояния. Это означает, что dβ/dt<0 является критерием эволюции систем к стационарному состоянию вблизи равновесия. Если система находится в стационарном состоянии, то она не может самопроизвольно выйти из него за счет внутренних необратимых изменений. Если же в результате флуктуаций система незначительно удаляется от стационарного состояния, то в ней должны произойти такие изменения, которые вновь возвратят ее к исходному стационарному состоянию. Это и означает, что данное стационарное состояние является устойчивым, а возвращение в него при незначительных возмущениях проявляют принцип устойчивости равновесных состояний. Очевидно, условие устойчивости стационарного состояния имеет вид: dβ>0. Знак положительного неравенства показывает, что любое отклонение от устойчивого
стационарного состояния вызовет увеличение скорости продуцирования энтропии. Этот вывод справедлив и для открытых систем, где происходят не только химические реакции, но совершаются и другие процессы, характеризующиеся значениями потоков Jk обобщенных сил Хk. Пусть в результате возмущения величина потока Jk изменится на δJk, тогда Jk*=Jk+δJk=Jk+LkkδXk Так как в стационарном состоянии J=0, то, следовательно Jk*= LkkδXkт.е. величина потока Jk*, возникающего в возмущенной системе, пропорциональна значению движущей силы δXk. Так как коэффициент пропорциональности Lkk>0, то β*=Jk*δXk= LkkδXk2>0, где β* скорость приращения энтропии, связанного с процессами, которые возникают в системе в результате возмущения. Неравенство Jk*δXk>0 означает, что величина потока, вызванного возмущением, должна иметь тот же знак , что и величина самого возмущения δXk. Иными словами, возникший в устойчивой возмущенной системе поток будет стремиться уменьшить возмущение δXk и тем самым вернуть систему в первоначальное состояние. Из монотонного характера изменения величины β следует, что вблизи равновесия в системе невозможны периодические автоколебательные процессы. При движении по замкнутым траекториям переменные концентрации в системе, а значит величины J и Х, будут периодически принимать одни и те же 4значения, что несовместимо с однонаправленным монотонным изменением и ее постоянством в стационарной точке.

*11.Статистический характер организации полимеров.
Для раскрытия механизма действия межатомных связей в белках разумно выделить фрагменты, состоящие из большого числа одинаковых звеньев. Для таких исследований применяются статистические модели. Наиболее распространенной моделью является следующая. Молекула ДНК и др биол большие молекулы рассматриваются как некая совокупность жестких стержней, связанных между собой определенными сочленениями. Т.е. так называемый стержень под действием теплового движения сохраняет в неизменном положении атомы относительно друг друга, но положение каждого стержня занимает независимое положение относительно остальных звеньев. Если кол во звеньев достаточно велико, тепловое движение является достаточно интенсивным, то положение сегментов относительно друг друга можно рассматривать независимо. Такой статистич подход дает возможность определить некоторые средние параметры какой то усредненной молекулы: длину, радиус молекулы, распределение молекулы по методу Гаусса и т.д.
Пусть нас интересует длина молекулы. Под тепл движнием белок приобретает какую то структуру. Если расположить начало белковой цепи в начале координат, то полная длина молекулы равна: h=ΣLi (i=1,N), где N полное число этих стержней. Т.к. все направления пространства равновероятны, то в среднем h=0. Но можно указать вероятность места нахождения конца белка, если начало этой молекулы будет располагаться в нач координат. Если система декартова, то вероятность WX
нахождения молекулы в точке X: WX=(3/(2πNL2))½e X²/NL² , где L длина стержня, N число
сегментов. WY=(3/(2πNL2))½e Y²/NL² WZ=(3/(2πNL2))½e Z²/NL²
Если нас интересует вероятность нахождения конца полимерной цепи в области пространства dXdYdZ=dτ, то это она будет равняться
произведению этих вероятностей: Wt=(3/(2πNL2))³/²e t²/NL²
Вероятность нахождения конца цепи в некоторой полости равна произведению W на объем полости: V=4/3π(R3 r3).
Такой подход является справедливым, если N достаточно велико и если полимерная цепь обладает необходимой гибкостью.
*12.Взаимодействия в биологических полимерах.
Существуют различные типы взаимодействий биологических полимерах, от которых в основном зависит вторичная структура макромолекул.
Взаимодействия Ван дер Ваальса
Силы Ван дер Ваальса играют большую роль в образовании конденсированных
жидких и твердых состояний, во взаимодействиях на поверхности раздела фаз.
Ими определяются взаимодействия в газах и возникающие отклонения от законов идеальных газов. В первом приближении эти отклонения подчиняются известному уравнению Ван дер Ваальса для газов
(р + a/v2)(v b)= nRT,
Биологические макромолекулы можно также рассматривать как своего рода конденсированную систему, состояние которой определяется слабыми невалентными взаимодействиями. Именно последние и дают основной вклад в стабилизацию конформационного состояния и его изменение в процессах функционирования. К Ван дер ваальса относят ориентационные, индукционные и дисперсионные взаимодействия.
Водородная связь. Заряд дипольные взаимодействия
Наряду с обычными силами Ван дер Ваальса большую роль в стабилизации биоструктур играют также водородные связи и электростатические взаимодействия между заряженными и полярными группами. В частности, известно, что водородные связи стабилизируют вторичную структуру полипептидных цепей.
Электростатические взаимодействия. Этот вид взаимодействий не только дает вклад в энергию водородных связей, но и играет важную самостоятельную роль в стабилизации биоструктур. Различные атомы в пептидных цепочках сильно различаются по характеру распределения на них зарядов.
Потенциал внутреннего вращения. Как было показано, энергия ближних взаимодействий атомных групп, проявляющаяся при вращении их вокруг единичных связей, определяет общую конформационную энергию полимерной цепи. Природа этих взаимодействий связана в основном с отталкиванием атомов, у которых перекрываются электронные оболочки, вследствие чего появляется тормозящий энергетический потенциал внутреннего вращения, препятствующий вращению атомных групп. В зависимости от расстояния между вращающимися атомными группами при изменении угла поворота вокруг единичной связи значение тормозящего потенциала будет различно и, следовательно, различные поворотные изомеры дают различный вклад в информационную энергию всей молекулы.
Поворотная изомерия. Различающиеся между собой устойчивые конформации, возникающие в результате поворотов вокруг единичных связей, называются поворотными изомерами.
*13.Пространственная организация белков и проблема уникальности структуры белков.
Набор слабых взаимодействий приводит к формированию третичной структуры белка. Третичная структура может иметь строение клубка
– это значит, что получается динамическая система, кот. имеет рыхлую структуру, диаметры и размеры которой непрерывно меняются, причем изменение размеров диаметра может достигать величины диаметра. При некотором уменьшении температуры происходит определенное упорядочение клубка. Появляется достаточно плотная сердцевина клубка. Такое состояние молекулы наз. глобулой. При этом происходят след изменения: резкое возрастание плотности, возникновение некоторого упорядочения. Существует температура, при которой тепловое движение разрушает связи, приводящие к корреляции между отдельными звеньями и группами, глобула разрушается и возникает клубок. Эта температура наз. θ температурой. Переход белков из глобулы в клубок и наоборот является фазовым переходом 2 го рода. Фазовый переход клубок глобула сопровождается изменением теплоемкости.
Cp,
tD денатурация
Энтальпия(полное изменение энергии): H=∫Cp(t)dt, Ср изменение теплоемкости при пост давлении. При повышении температуры происходит разрушение связей дальнего порядка, что приводит к потреблению энергии и повышению теплоемкости данной глобулы.
Проблема уникальности структуры белков сводится к поиску ответов на следующие вопросы:
1)Действительно ли в первичное строение белков заложена программа, по которому сформирована вторичная и третичная структуры? Определяет ли первичная структура биологические функции молекулы?
2)Возможен ли случайный процесс укладки последовательности кислотных остатков в структуре подобной белкам?
3)Как происходила эволюция существующих последовательностей, и по какому принципу они были построены?

*14.Особенности пространственного строения ДНК.
Основная биологическая функция ДНК заключается в хранении, передаче генетической информации. Информация кодируется в виде определенной последовательности нуклеотидов двойной спирали.
Молекула ДНК должна быть достаточно стабильной, чтобы хранить без искажений закодированную информацию; с другой стороны она должна быть способна к определенным изменениям своей структуры, чтобы укладываться в вирусы.
Молекула ДНК представляет собой две спирали, связанных между собой водородными связями. Эти водородные связи определяют механическую жесткость молекулы ДНК. Молекула обладает упругостью изгиба и упругостью вращения, т. е. для поворота молекулы вокруг своей оси требуется затратить определенную энергию.
Вирусы должны укладываться в некоторых объемах, сечения которых намного меньше линейных размеров ДНК, т.е. молекула должна иметь гибкие точки (шарниры) или раскрываться (гибкие участки).
Тепловое движение при физиологических температурах обуславливает поворот некоторых атомов или групп атомов относительно соседей до ±5º. Для перехода из одной конформации в другую достаточно поворота на 2,5º. Из за теплового движения заметно меняются и химические связи (расстояние между атомами). Эти изменения достаточны для перехода из одной конформации в другую. Эксперименты показывают, что под действием теплового движения одна и та же молекула может находиться одновременно в 2 х разных конформациях.
Общая энергия конформационных переходов описывается выражением:
Ek=jk/2Σθi2(i=1,N), где jk коэффициент упругости (жесткости) при попытке согнуть одно звено на единичный угол; θ угол, образующийся между осями соседних оснований, прилегающих друг к другу; N число звеньев в этой спирали.
Под действием теплового движения возможно раскрытие некоторых пар оснований, при этом некоторые участки цепи из спиралеобразной формы переходят в клубкообразное состояние. Одновременно раскрываются активные точки и они становятся доступными для химич реагентов. Вероятность раскрытия пары оснований равна 10 5.
*15.Перенос электронов по белковой цепи. Туннельный эффект.
Транспорт электронов часто происходит при сверхнизких темпе рах, когда движение самих белковых мол л затруднено. Туннельный эфффектт состоит в следующем: согласно ∆x∆p≤h, т.е. если пространственные координаты определены точно, то энергетическое состояние является полностью неопределенным.
1 2 3
Пусть имеется электрон, расположенный в какой то точке, где энергия =E,и имеется точка, в которой энергия больше E на U. Явление, когда электрон, обладающий энергией, меньшей, чем высота потенциального барьера, преодолевает этот барьер, наз. туннельным эффектом. Предположим, что нас интересует одномерная система (движение только вдоль оси X).
Ур е Шредингера для области 1: ( ћ/2m)(d2ψi/dX2)=Eψi;
для 2 состояния: ( ћ/2m)(d2ψj/dX2)=(E U)ψj.
Общее решение этого ур я:
ψ=Ciψi+Cjψj , ψi =ϕI/ϕj; ψj=ϕiϕj/; Решив это уравнение можно найти вероятность нахождения электрона в области 2:
|ψj|2=B2e( 2m(E U)X)/ћ. |ψ j | 2 = B2 e(-2m(E-U)X)/ћ
Вероятность проникновения электрона в обл.2 зависит от: массы, соотношения E и U, величины X.Транспорт электронов в туннельном механизме является характерным для внутримолекулярных процессов. Но существуют цепи, куда входят разные молекулы, по которым происходит транспорт электронов. Такие молекулярные системы образуют комплексы. По пути из начальной точки в конечную электрон может преодолевать несколько потенциальных барьеров. Комплексы, которые формируются из 2 х или нескольких молекул, наз. электронными тропами. Т.к. биол. молекулы являются достаточно сложными системами, то для расчета нужно выбирать оптимальную тропу.
*18.Физические основы ЯМР.
Резонансное поглощение эл х волн, обусл е кван ми перех ми атомн х ядер между энерг ми состояниями с разными состояниями спины ядра. Ядра обладают собств м мех м моментом. Магн й момент: Р=γµ (γ гиромагн е отношение). В зав ти от соотн я элем х частиц: 1) четное число нейтронов и протонов, РΣ=0 2) нечетное пр в и четн нейтр в, РΣ=К*1/2 3) четное пр в и нечетн нейтр в, РΣ=К*1/2 4) нечетное пр в и эл в. Спины отличные от нуля: Н,
С13=1/2, N14=1, N15=1/2.
Энергия взаимод я: Е=γВ0.
∆E=E1 E2=1/2γhВ0 – ( 1/2γhВ0)=γhВ0
Если значение энергии источника внешнего поля: hν=γhВ0, происходит избирательное поглощение эл го поля системой спинов, расположенных в этом поле.
Химический сдвиг изменение частоты резонансного поглощения ядер, расположенных в постоянном внешнем магн м поле под действием химического окружения. Метод ЯМР дает возможность определить электронное строение и геометрию молекул без разрушения вещества.
*19.Техника ЯМР, непрерывный метод. Проблема чувствительности.
Состав спектрографа: 1)постоянный магнит (для подстройки или модуляции поля может наматываться катушка), электромагнит (если диаметр соленоида достаточно большой, то поле – однородное, но надо охлаждать и дорого), сверхпроводящий магнит (на суперсоленоидах, самые высокие напряженности, но некомпактный и низкие Т) 2)Датчик (зонд) – резонатор (кол й контур). Исследуемое вещество вставляется в катушку, а понижение добротности регистр ся разл ми способами. Содержит предусилитель с мин м уровнем шумов 3)Термостат 4)Синхронный детектор 5)Генератор эл магн х колебаний с выс й стабильн ю 6)Усилитель 7)Система стабилизации поля (источник со стабил й или ОС за счет катушки помещенной в зазор) 8)Система регистрации Резонансные линии погл я раз ся по времени и частоте. Для пов я чувств ти, сглаживания шумов использ ся сужение полосы пропускания и накопители.

*17.Механизмы ферментного катализа. Формирование активной конфигурации.
Биосистемы – сложные физ хим системы. Прост я хим реакция: превращение А и В в продукт Р возможно в случае, если энергия А+В достаточна для преод я барьера Е, т.е. энергия А и В должна суммироваться, чтобы А и В сблизились на расстояние хим го взаимод я. Для ускорения реакции необходимо увеличить энергию А и В (подогреть), но т.к. в биосистемах Т const, то применяют понижение барьера с пом ю ферментов. Особенности ферментативного катализа: 1) специфический характер (ускорение опр й реакции) 2) все ускоряемые реакции – с участием мол л белков 3) все реакции идут без катализаторов
Ферменты – белки, обладающие значительными геометрическими размерами. Субстрат часто низкомолек. структуры. Как показал рентгеностуктурный аналлиз, проводимый с белками в кристаллическом состоянии. Эти белки обладают нек. полостью, куда проходит субстрат, вступающий в биохим. превращения. В этой полости кислородные группы создают поле, имеющее напр сть порядка 105. В следствии этого реагенты занимают строго определённое положение6 отн но внутр. поля ферм го белка. Важные факторы:1) внутреннее молекулярное поле белка ориентирует реагенты отн но друг друга и при сближении будут сближаться активные центры; 2)эксперименты показали, что ускорение реакции происходит у той части субстрата, кот. нах ся во внутр.полости белка. Следствие: если при сближении мол лы невступили в хим.акт и разлетелись, если они нах ся в большом пр ве, то вер сть встречи таких мол л мала, но т.к. стенки полости фермента отраж. при столкновении реагенты, тем самым увелич. Вер ть их повторного сближения для хим.взаимодействия. 3)внутреннее поле вызывает перераспределение приводит к тому, что плотность возрастает на разрыхляющих электронных орбиталях, то мы получаем ослабление энергии связи, которая разрывается при сближении реагентов и возникает новая связь: при этом должно соблюдаться E2 > E1. 4) биохим.процессы чаще происходят в водной среде.Переход субстрата из водной среды в полость фермента приводит к изм ю диэлектрической постоянной среды. Попадание в среду с более низкой диэлектрической постоянной увеличивает электростатического вз я.
Механизм действия ферментов скорее предполагаем, чем известен. Ферментативные реакции сложны. Влияние на хим. процесс акт.центров явл ся определяющим. Сущ ют следующие модели: под действием ферментов м/у реагентами возникает некоторый комплекс, вследствии кроторого происходит перераспределение эл.плотности. Нарушенное равновесие плотности эл.зарядов приводит к многочисленным конформационным переходам ядерной системы. Кол во промежуточных этапов опр ся чисто умозрительно. Исследуемые методики квантовой химии позволяют определить ту цепочку конформации превращений, кот. приводят к образованию продукта.
При возбуждении электрона часто энергия эл.возбуждения переносится на колебательные степени. Здесь метод ЯМР, ПМР позволяют опр ть промежуточные этапы электронных конформационных превращений. Наличие туннельного процесса док ло, что обнаружение процессов при низких темп рах, когда движение в этих системах малоинтенсивны. С одной стороны, когда субстрат попадает в белковую среду из водной среды одновременно повышается напр сть эл.поля в среде, создаваемой зарядом.
k1 k2
[S]∙[E] < ==> [E]∙[S] =>[E] =>[P]
k 1
где S – субстрат; E – фермент; P – продукт, с некоторыми кинетическими параметрами. Дифференциальные уравнения, описывающие этот процесс:
dSdt = −k1[ES] + k−1[ES] ;
dEdt = −k1[ES] + k1[ES] − k2 [E];
d[ES] |
= k1[E] − k−1[ES] − k−2 [E]; |
||
|
|
||
dt |
|||
dE |
=k1[ES] + k2 [ES] − k−1[ES]; |
||
dt |
|||
|
|
||
dP |
= k2 [ES]; |
||
dt |
|||
|
|
||
В любой системе [S] >>[E], то есть E/S << 1; Эти уравнения можно складывать, вычитать.
Скорость образования продукта (dP/dt)зависит от [E] и [S]. Т.к. [S]>>[E], то эта зависимость имеет вид
рис.1.
|
|
рис2 |
рис1 |
Описанная модель является предельно упрощённой .В реальных системах необходимо учитывать:
1)наличие ингибиторов, кот. влияют на скорость превращений, наличие др. вещ в, кот. Могут связываться с S и блокировать тем самым образование S E комплекса.
2)сущ ют вещ ва, кот. Ускоряют выход конечного продукта за счёт того, что увеличивается количество точек связываний S E. Увеличение кол ва точек связи объясняется тем, что возникает тройной комплекс S E D. Решая эту систему уравнений можно опр ть время поворота E, т.е. E связывается c S комплексом с образованием продукта и освобождением E. Решая эти ур я, можно опр ть значения k1, k2 …
Действие ферментов. Принято считать, что все биохимические процессы регулируются ферментами, возникает вопрос о кол ве хим. Превращений. У тех биохимических превращений, которые исследованы, сейчас имеется свой фермент, поэтому теория ферментов должна быть способна ответить на вопросы. Св ва ферментов: 1)чрезвычайно высокая избирательность; 2)ферменты способны ускорить реакцию до 105 раз. 3)они ускоряют только те реакции, которые в принципе возможны (т.е. медленно, но идут сами) 4) паразитная молекулярная активность – превращениепри избыточности субстрата. Чтобы фер т действовал необходимо, чтобы 2 реагента были разделены пот.барьером.(рис 2), где E высота пот.барьера, E2>E1.Если это не так, то:
k1 |
k2 |
A+B < = > AB < = > P+E; Если E2>E1, то: A+B < = > X; |
|
k 1 |
k 2 |
2 способа влияния на скорость хим. реакций (увеличение скорости хим. реакций):увеличение энергии реагентов;2) понизить высоту пот. барьера
(E).
Сущ ет теория, подтверждающая, что в б/х реакциях энергия беспорядочного теплового движения превращается в колебательную эн гию нек. связи( противоречие законам т/д: тепло нельзя превратить в упорядочение).
*20.Техника ЯМР, импульсные методы.
Состав спектрографа: 1)постоянный магнит (для подстройки или модуляции поля может наматываться катушка), электромагнит (если диаметр соленоида достаточно большой, то поле – однородное, но надо охлаждать и дорого), сверхпроводящий магнит (на суперсоленоидах, самые высокие напряженности, но некомпактный и низкие Т) 2)Датчик (зонд) – резонатор (кол й контур). Исследуемое вещество вставляется в катушку, а понижение добротности регистр ся разл ми способами. Содержит предусилитель с мин м уровнем шумов 3)Термостат 4)Синхронный детектор 5)Генератор эл магн х колебаний с выс й стабильн ю 6)Усилитель 7)Система стабилизации поля (источник со стабил й или ОС за счет катушки помещенной в зазор) 8)Система регистрации
Резонансные линии погл я раз ся по времени и частоте. Для пов я чувств ти, сглаживания шумов использ ся сужение полосы пропускания и накопитель.
в импульсном варианте возбуждение ядер осуществляют не "постоянной волной", а с помощью короткого импульса продолжительностью τр (обычно несколько микросекунд):
Радиочастотный генератор включают в момент t0 и выключают в момент t1. Продолжительность импульса зависит от ширины спектра. Например, если используется τр = 10^ 5 с, то
частотная полоса будет шириной 10^ 5 Гц. Если среднее значение
V1 (ню1) выбрано правильно, то все частоты в регистрируемом спектре будут находиться в этой полосе:
Полоса находится в пределах от v1 −τ p −1
до v1 +τ p −1 .
Амплитуды частотных компонент импульса уменьшаются с увеличением расстояния от V1. Т.к., однако, желательно, чтобы все ядра облучались одинаково, необходимо использовать "жесткие импульсы", т.е. короткие импульсы большой мощности. Продолжительность импульса выбирают так, чтобы ширина частотной полосы была больше ширины спектра на один два порядка. Мощность несколько Ватт.

*21.ЭПР. Физические основы.
Физика явления: электроны обладают спинами, как и ядра, т.е. обладают магн моментом. При наложении внешнего магн поля происходит снятие
|
вырождения |
|
|
, т.е. |
|
Е1 |
||
электрон |
||
|
||
|
||
|
ориентирует |
|
|
ся вдоль или |
|
|
против поля, |
|
|
||
Е2 |
т.к. спин= |
|
|
1/2 , то 2 |
|
|
состояния: Е1(по полю) и Е2 (против поля) Энергия взаимодействия электронов, расположенных вдоль поля Е1 к Е2 отличается на ∆Е=Е1 Е2. Населенность, т.е. кол во спинов на нижн и верх энергетич уровнях: N1/N2= exp(γβB0/kT), β магн пост Бора.
Если приложить к сис ме эл нов , расположенных во внешн магн поле hν= ∆E= γβB0 и при выполнении равенства, происходит избирательное резонансное поглощение энергии электр внешнего магн поля данной сис мы – явл е ЭПР, наблюдается когда в исследуемых образцах имеются электроны с нескомпенсированным спином. Мол ла обычно форм ся так, что спины скомпенсированы, но всегда есть какие то повреждения, разрывы в хим связях, след но нескомпенсированные спины. Это ограничение обуславливается тем, что ЭПР менее распространен, чем ЯМР. ЭПР применяется: 1) для исследования свободных радикалов с нескомпенсированным спином, 2) наблюдение за динамическими процессами, 3) можно точно определить место локализации спина Недостатки: различие результатов при исследовании естественных фрагментов полимера в отсутствии синтетич добавки синтезир. группы, где эл ны с нескомпенсированным спином и рез тов при исследовании монтажной группы атомов, которые меняют динамич св ва белка. Спектральные линии ЭПР осложняются спин спиновым взаим ем , что приводит к сверхтонкому расщеплению. Природа этого взаим ия обусловлена тем, что ядра с магн моментом создают доп магн поле в точке расположения эл нов. Сверхтонкое расщепление с одной стороны усложняет анализ, но и дает важную доп инф цию об эл строении данной мол лы. Как м д иссед я стр ры белков: динамич стр ры белков опр ют временем релаксации. ЭПР наблюдается, если магн моменты эл нов расположены вдоль или против поля. Для того, чтобы наблюдать эл н должен иметь нескомпенсир магн мом т , кот имеется у своб радикалов или фрагментов мол л . Иск но сажается парамагн. метка( или ист нескомпенс Эл нов) – она обладает стабильным радикалом с дост длинным временем жизни. Перемещая эту метку вдоль мол лы можно опр ть ее динамич св ва. Согласно пр. Паули эл ны в атомах и мол х распол ся так, что их спины и связ е с ними магн е моменты взаимно скомп ны, т.е. такие сист мы – магнитонейтральны (диамагн е). Диамагнитны больш во тканей орг ма, однако сущ т мол лы в состав кот х входят элементы перех го периода (которые имеют электроны с нескомнесированными спинами). Кроме того, реакции всегда сопровождаются разрывом биохимич связей, т.е. на какое то время появл ся молекула с нескомп ми спинами. Существует группа систем свободных радикалов, кот е обладают нескомп м магн м моментом. Физика методов ЭПР подобна ЯМР, когда система мол л или ат в с нескомп ми спинами нах ся во внешн магнитн поле, то магн й момент спина может занимать два положения: вдоль и против поля. Вел на расщ я определяется вел ной магнитного поля и магн го момента эл на.
Е1 Е2=γB0=w, где w колебания резонансной частоты (происходит резонансное поглощение только данной системой веществ). Отличие ЭПР от ЯМР – в значении магн го момента.
*22.Техника ЭПР.
1) В одно из плеч моста помещается исслед й образец (тщательно сбалансир м его и добьемся резонанса) 2) в исслед е вещество помещ ся объемный резонатор. Для наблюдения эффекта Эпр не требуются столь качественные магниты, как при ЯМР. Частота поглощения на ЭПР – СВЧ, волноводная техника. Основные блоки – электромагнит, ячейка поглощения (волноводный мост). Проблема, связанная с кварцевым генератором: приходится умножать частоты много раз.
Устройство ЭПР проще ЯМР. При исследовании различных объектов пользуются ЭПР томографией. С помощью трех катушек создается градиент поля, соответствующего резонансу. Чувствительность выше, чем у ЯМР, поэтому ЭПР томограф используется для анализха очень небольших объемов. . 26Метод динамического моделирования белков Белок находится в состоянии непрерывного
движения. В твердом состоянии колебания тяжелых атомов происходит с частотой ~ 1013 с1. Здесь амплитуда отклонения от состояния равновесия в пределах 0,01 0,1 А. Её можно описать как гармонические колебания. Белок плотнее воды. Движение происходит в потенциальной яме, которая напоминает частокол. Высота барьера разная. Движение групп атомов полимера требует начальной энергии. В это же время ширина ямы не может быть большой, т.к. может произойти разрушение молекулы. Движение групп молекул белков в окружающей среде по конформации носит диффузионный характер и описывается уравнением диффузии.
x 2 = x 2 (1 −exp(−τtc)) временная зависимость
СКО от состояния равновесия, где τс время релаксации, x среднее отклонение.
τс= γ , где m масса частицы, γ коэффициент
mw0
трения в среде, w0 частота колебаний атомов, фрагментов атомов в потенц. яме. γ= 6πχb, χ коэф. вязкости, b усредненная длина фрагмента. Вязкость зависит от температуры, и при повышении её вязкость ум ся. Значит, здесь ум ся и коэф т трения и время релаксации.
F = m d 2 ri , ri – любая пространственная
dt 2
координата любого атома. Fi= dU , U dr
потенциальная функция. Она учитывает взаимодействия атомов. Метод молекулярной механики дает возможность учитывать все взаимодействия и случайные соударения. Подвижность фрагментов белка увеличивается при перемещении от центра глобулы к периферии. Это способствует крупноформатным движениям молекулы белка (эти движения могут достигать 20 А°). Вращение группы нитевидных – до ±20 А° от состояния равновесия. М д молекулярной механики не объясняет изменения электронного строения молекулы
*23.ИК – спектроскопия. Возможность в биосистемах.
Колебательные переходы и соответствующие им колебательные спектры молекул можно получить как при непосредственном поглощении веществом инфракрасного излучения (диапазон волн 2 50 мкм), так и при поглощении видимого и ультрафиолетового излучения. В последних случаях лишь часть поглощенной энергии расходуется на возбуждение молекул, большая часть реэмиттируется веществом. В соответствии с этим колебательная спектроскопия разделяется на инфракрасную (ИК) и спектроскопию комбинационного рассеяния (КР).
Вследствие простоты получения спектров и технического совершенства приборов наибольшее распространение получил метод ИК спектроскопии. Однако часто необходимым оказывается совместное применение обоих методов.
Как и всякое движение на молекулярном уровне, колебания молекул необходимо рассматривать методом квантовой механики. Однако многие частные вопросы, в частности вопрос о частоте колебаний молекулы, можно решить, рассматривая молекулу как механическую систему, например, как системы шаров, символизирующих атомы, и связывающих их пружин, символизирующих связи между атомами. Тогда колебания вдоль линии связи, соединяющей два атома, можно описать законом Гука, который позволяет вычислить частоту колебаний системы:
v = |
1 |
k |
|
2πc |
m |
где ν частота колебаний (более точно волновое число, имеющее размерность см1);
C скорость света;
K силовая постоянная связи; m приведенная масса системы,
вычисляемая через массы атомов по формуле Не всякое колебание молекул, приводит к
появлению полосы поглощения в спектре ИК. Если при этом изменяется распределение электрического заряда и молекула представляет собой колеблющийся диполь, то такое колебание активно в ИК спектре. Интенсивность поглощения в ИК спектре прямо пропорциональна квадрату первой производной дипольного момента ею межъядерному расстоянию. Такие полярные молекулы, как HCl, имеют наиболее интенсивные полосы в ИК спектре. В спектрах КР проявляются те колебания, при которых происходит изменение поляризуемости молекулы. Интенсивность линий КP пропорциональна квадрату производной поляризуемости молекулы по межъядерному расстоянию.
Точная интерпретация спектров сложных молекул требует трудоемкого анализа колебаний и сложных расчетов. Поэтому спектры ИК часто интерпретируются на основе привлечения некоторых эмпирических закономерностей. При такой интерпретации спектров молекул важнейшим понятием оказывается понятие характеристичности колебаний. При сравнении большого числа спектров различны молекул обнаружено, что колебательные полосы определенных групп атомов имеют приблизительно одинаковые частоты и мало зависят от характера окружающих их групп. Такие полосы поглощения называются характеристическими.
В биосистемах используется для определения количества вещества, патологий связанных с его наличием и количеством.

*24.Люминесценция и её применение для изучений динамики белков. Метод меток.
Люминисценция избыток над тепловым излучением тел. Е=СТ4. При возбужд и молекулы существенно изм ся дипольный момент. Если время релаксации мол лы τ, у которой нав ся дипольный момент, меньше времени
релаксации е в, то энергия взаим я уходит в среду за счет релаксации диполя. Можно измерять подв ть белков, скорость конформ х переходов. Особ ть метода высокая чувствит ть, простота техники.
(Предположим, что белки нах ся в водном растворе и имеют меченые атомы. Например, глубоко в структуре глобулярного белка посажен 14С. Их извлекают и оценивают конф е изм я). Повышая Т, можно менять скорость изотопного обмена. Исследуя зависимость длины волны люминесценции от Т и состояния белка, можно получить сведения о конформации.
Недостаток метода – никакой инф и о мол х мех х. Изотопный обмен в зав ти от Т дал возм ть определить, что имеется два типа конф х переходов: 1) сильно зав е от Т (зависит от конф и самих мол л) 2) Слабо зав е (зав т от изм й внутри мол л). При пов и Т резко возр т кол во раскр. точек (лишние степени св ды).
S3
S2
S1
S0
E
X
*25.Техника ИК – спектроскопии.
По общим принципам устройства ИК спектрометров их можно разделить на две основные группы. Первая включает приборы с последовательным сканированием и регистрацией спектра с помощью одноканального приемника, а вторая спектрометры, в которых на приемник попадает излучение всего изучаемого спектрального диапазона, но сигналы преобразуются и расшифровываются так, что можно получить информацию о каждом отдельном участке с регистрацией полного спектра во всем диапазоне. Приборы этих групп могут быть диспергирующие и недиспергирующие. По схеме освещения ИК спектрометры бывают одно и двухлучевые. При однолучевой схеме спектр поглощения исследуемого вещества регистрируется вместе с фоновым поглощением. Чтобы получить спектр (в процентах пропускания), нужно зарегистрировать также кривую интенсивности испускания источника (фоновый спектр). Принимая интенсивность при каждой λ в регистрируемом спектре и спектре испускания соответственно как Iλ и I0λ , находят значение пропускания Тλ= (Iλ / I0λ) • 100 % и строят по точкам спектральную кривую зависимости от λ (или от ν). Обычно используется двухлучевая схема, которая позволяет выравнивать фон, т.е. линию полного пропускания, и компенсировать поглощение атмосферных паров
H2O и СО2.
Диспергирующие приборы первой группы это сканирующие спектрометры. В качестве диспергирующего устройства (т.е. устройства для разложения спектра) используются призмы из монокристаллов KBr, NaCl, LiF (для средней ИК области 400 5000 см 1), CsI (для 400 200 см 1) и
дифракционные решетки. Несмотря на высокое качество этих приборов, они все больше заменяются на Фурье спектрометры, относяшиеся к группе недиспергирующих приборов.
Недиспергирующие приборы. В основу конструкции Фурье спектрометров положено явление интерференции волн электромагнитного излучения. Для изготовления этих приборов используются интерферометры нескольких типов. Однако, наибольшее распространение получил интерферометр Майкельсона (рис.2). Поток инфракрасного излучения от источника преобразуется в параллельный пучок и затем разделяется на два луча приблизительно одинаковой интенсивности с помощью светоделителя. Один луч попадает на подвижное зеркало, другой на неподвижное. Отраженные от зеркал лучи возвращаются тем же оптическим путем на светоделитель. Эти лучи интерферируют благодаря приобретенной разности хода, а, следовательно, и разности фаз. В результате интерференции получается сложная интерференционная картина, которая является наложением интерферограмм, отвечающих определенной разности хода и длине волны излучения. Объединенный световой поток проходит через образец и попадает на приемник излучения. Усиленный сигнал записывается и одновременно поступает на запись в компьютер. Кривые зависимости подаваемого сигнала от разности хода носят название интерферограммы, Фурье преобразование которой дает спектр поглощения образца. Фурье спектрометры имеют ряд существенных преимуществ по сравнению с диспергирующими спектрометрами. Во первых, это выигрыш в энергии, т.к. при сканировании в каждый момент времени на приемник попадает излучение всего исследуемого спектрального диапазона длин волн, а не узкий его участок после монохроматора.
*26.Приближение ЛКАО.
Метод молекулярных орбиталей (МО) наиболее нагляден в его графической модели линейной комбинации атомных орбиталей (ЛКАО). Метод МО ЛКАО основан на следующих правилах.
1.При сближении атомов до расстояний химических связей из атомных орбиталей (АО) образуются молекулярные.
2.Число полученных молекулярных орбиталей равно числу исходных атомных.
3.Перекрываются атомные орбитали, близкие по энергии. В результате перекрывания двух атомных орбиталей образуются две молекулярные. Одна из них имеет меньшую энергию по сравнению
сисходными атомными и называется связывающей, а вторая молекулярная орбиталь обладает большей энергией, чем исходные атомные орбитали, и называется разрыхляющей.
4.При перекрывании атомных орбиталей возможно образование и σ связи (перекрывание по оси химической связи), и π связи (перекрывание по обе стороны от оси химической связи).
5.Молекулярная орбиталь, не участвующая в образовании химической связи, носит название несвязывающей. Ее энергия равна энергии исходной АО.
6.На одной молекулярной орбитали (как, впрочем, и атомной) возможно нахождение не более двух электронов.
7.Электроны занимают молекулярную орбиталь с наименьшей энергией (принцип наименьшей энергии).
8.Заполнение вырожденных (с одинаковой энергией) орбиталей происходит последовательно по одному электрону на каждую из них.

*27.Индуктивно резонансный метод переноса |
*28.Время поперечной релаксации (спин |
*30.Молекулярный параметр порядка в |
||||
энергии. |
спиновый) метод измерения. |
мембранах, Кинки. |
||||
|
|
|
|
|
Много процессов, вызывающих изменение |
Степень нарушения упорядоченности по мере |
|
|
|
|
|
относительных энергий спиновых состояний за счет |
движения вдоль углеводородной цепи |
|
|
|
|
|
обмена энергией в самой системе спинов. |
характеризуется параметром порядка: θ=3/2cosβ |
|
|
|
|
|
Это так называемые процессы спин спинового |
1/2. β определяется следующим образом: строится |
|
|
|
|
|
взаим я, к рые харак ся временем спин спиновой |
перпендикуляр к поверхности мембраны и |
|
|
|
|
|
релаксации Т2. Для парамагнитных частиц Т2 |
проводится плоскость, на кот лежат все три атома |
|
|
|
|
|
практически не зависит от темп ры и соотв ет |
метильной группы, β угол между ними. Если |
|
|
|
|
|
скорости установл я равновесия м/у спинами |
молекула нах ся в состоянии полного |
|
|
|
|
|
электронов при их взаимодействии друг с другом. |
упорядочения, то θ=1. |
|
|
|
|
|
Вклад в общую ширину линии процессов спин |
Параметры порядка характеризуют подвижность |
|
|
|
|
|
спинового взаим я описыв ся величиной порядка 1/ |
липидов и зависимость этой подвижности от |
|
|
|
|
|
Т2. В общем случае ширина линии определяется как |
глубины погружения. Наиболее нажежный метод |
Если уровни энергии у донора и акцептора между |
Г = Н ~ 1/Тэксп ~ 1/(2Т2) + 1/ Т2 |
экспериментального определения параметров |
||||
S0 и S1 равны или близки, происходит |
где Тэксп – определяется в эксперименте. |
порядка – метод ЯМР: сажают химическим путем |
||||
индуктивно резонанс й метод переноса энергии с |
Для свободных радикалов Т1 >> Т2 , |
вместо водорода дейтерий (происходит резкое |
||||
возбужд й молекулы Д к А. Про исходит |
поэтому для них в отсутствие насыщения ширина |
изменение частоты сигнала), а вместо C12 C13 (что |
||||
безизлучательный переход от Д к А. Индуктивно |
линии определяется в основном Т2 ( Н ~ 1/ Т2), к |
приводит к резкому изменению сигнала в |
||||
резонансный метод переноса эн ии явл ся |
рое составляет ~10^ 8 с. Большие величины Т1 |
помеченной точке). |
||||
эффект м на расстоянии порядка нескольких хим |
(секунды, минуты) для органических свободных |
Существуют некоторые темп ры, при кот липиды из |
||||
связей(15 20 или расстоянии 15 50А). Допустим в |
радикалов связаны с тем, что энергия спинов |
жидкокристалического состояния переходят в |
||||
мол ле произошло возб ие Эл на. Пусть имеется |
электронов передаётся колебаниям ядер решетки |
гелеобразное. При этом меняется теплоемкость. |
||||
спектр люминесценции мол лы и ест др мол ла, |
через спин орбитальное взаимодействие, к рое для |
Резкое увеличение теплоемкости объясняет |
||||
располож я на нек м расст и, исключ м взаимное |
легких ядер весьма мало. |
возникновение крутильных колебаний в |
||||
столкновение, она имеет спектр, перекрывающий |
Мерой спин спинового взаимодействия |
углеводородных хвостах и появление так наз |
||||
спектр 1 мол лы. Если мол лы Д и А распол ы на |
служит константа спин спинового взаимодействия |
“петель”–кинки. Особую роль в образовании кинк |
||||
расст и порядка хим связи, т.е. явл ся соседними |
J, которую выражают в единицах частоты и |
играют ненасыщенные связи. При фазовом |
||||
атомами в молекуле, то работает другой |
определяют по расстоянию между расщепленными |
переходе меняется площадь сечения молекулы. |
||||
механизм. |
линиями. В отличие от химического сдвига, |
Одновременно сокращается длина углевод цепи и |
||||
При этом если спектр флюоресценции донора и |
константа J не зависит от величины внешнего |
меняется расстояние между концами хвостов. |
||||
спектр поглощ я акцептора перекр ся, то передача |
магнитного поля. |
Частота возникновения кинк: ν=kT/ћ *e E/kT , Е |
||||
энергии происходит по обменному мех му, т.е. |
Таким образом, каждый сигнал в спектре |
энергия активации кинка. При возникновении |
||||
электрон, принадл й Д, после возбуждения может |
ЯМР характеризуется двумя основными |
кинка меняется сечение мол лы, а также образуется |
||||
обменяться электроном с акцептором, т.к. |
параметрами (величиной химического сдвига и |
соседняя петля. Кинк не остается на месте, а |
||||
электроны явл ся неразличимыми, то такой обмен |
интенсивностью), а также во многих случаях |
перемещается вдоль цепи – диффузия кинка. |
||||
электронами равносилен переносу энергии. |
величиной константы спин спинового |
Влияние кинка на параметр порядка(ПП): 1 |
||||
Перенос эн ии с Д на А тем интенс е, чем больше |
взаимодействия. |
мембрана близка к жидкому кристаллу, с |
||||
перекрывание рез ных линий. При ум ии т ры |
Характерной особенностью многих ЯМР |
погружением вглубь нее ПП уменьшается, |
||||
ширина рез ных линий сужается и передача эн ии |
спектров является спин спиновое расщепление, |
гетерогенная среда переходит в гомогенную; 2 |
||||
ум ся. Здесь должен быть мех м, пониж й частоту |
которое приводит к расщеплению отдельной |
вязкость уменьш ся →более полное заполнение |
||||
излученного кванта. В целом, перенос энергии |
спектральной линии на мультиплет в результате |
всего пространства. |
||||
осущ ся на большие расстояния. Он состоит из |
взаимодействия между магнитным моментом |
|
||||
нескольких элемент х атомов, причем на этой |
данного ядра с соседним спином, также |
|
||||
тропе переноса могут сочетаться кулоновский |
обладающим магнитным моментом. Характерная |
|
||||
механизм переноса (электрон из за осцилляции |
константа спин спиновой связи J характеризует |
|
||||
вызывает колебания другого, проявляется на |
величину указанного расщепления. Спин спиновое |
|
||||
расстоянии 2 3 хим связей, передача эн ии явл ся |
взаимодействие (или J спаривание) не требует |
|
||||
обратимой), мех м обмена электронами. Кроме |
внешнего магнитного поля, поэтому этот эффект не |
|
||||
этого перенос энергии может осущ ся за счет |
зависит от приложенного внешнего поля. |
|
||||
элементарных соударений. В процессе |
Постоянная связи J выражается в герцах (Гц). |
|
||||
соударений, когда происходит обмен колв м |
|
|
||||
движения, процесс переноса имеет несколько |
|
|
||||
другой характер. Процесс переноса энергии |
|
|
||||
всегда сопровождается изменением электр й |
|
|
||||
структуры и это приводит к конформационным |
|
|
||||
изменениям. Выполн е биол х функций белками |
|
|
||||
всегда связано с изм м электр й конформации |
|
|
||||
сост й. Неизвестно, меняются ли функции биолог |
|
|
||||
мол л при изм и конформации. |
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|

*29.Молекулярная организация биомембран, |
погружением вглубь нее ПП уменьшается, |
*32.Диффузия. Виды диффузий в мембранах. |
|
механические свойства мембраны. |
|
гетерогенная среда переходит в гомогенную; 2 |
Уравнение Фика. |
С мембранами связаны все энергет процессы в |
вязкость уменьш ся →более полное заполнение |
Диффузия – это самопроизвольное перемещение |
|
клетке; на М происходит процесс генерации и |
всего пространства. |
вещ ва из мест с большей их конц цией в места с |
|
распределения нервного импульса; они |
|
меньшей конц цией вещ ва вследствие |
|
обеспечивают селективный транспорт в в ; с ними |
|
хаотического теплового движения частиц. |
|
связано упр е б/хим процессами в клетке. Главное |
|
Диффузия вещ ва ч з липидный бислой вызывается |
|
назначение ограничение пространственного |
|
градиентом конц ции в мембране. Плотность |
|
регулирования. Клеточные мембраны состоят из двух |
|
потока вещ ва по з ну Фика: |
|
слоев липидов. Общая толщина клеточной |
|
I= D(dC/dX), где D коэф т диффузии, X координата, |
|
мембраны не превышает 100 А°. Молекулы липидов |
|
C концентрация. Знак “ “ показывает, что движение |
|
ориентированы так: гидрофильная часть липидов |
|
вещ ва рассматриваем в сторону убывания вещ ва. |
|
втягивается в воду, а гидрофобная – выталкивается |
|
Учитывая толщину мембраны порядка 70Å, |
|
из воды. В состав мембран входят белки, липиды, |
|
экспериментальное определение (dC/dX) –сложная |
|
сахара. |
|
|
задача. Уравнение Фика можно записать след |
Липид обладает низкой вязкостью и на поверхности |
|
образом: |
|
липидного слоя свободно плавают молекулы белков. |
|
I= D(C1/ C2/)/h; C1/=γC1; |
|
Мем нах ся под непрерывным мех и Эл |
|
C2/=γC2; C1 ,C2 конц ции вещ ва в клетке и |
|
воздействием. Механические свойства мембран |
|
межклеточном простр ве, γ коэф т распределения |
|
определяются действием |
|
ионов в мембране и примембранном слое: |
|
следующих сил: |
|
|
I= (Dγ(C1 C2))/h; h толщина мембраны. |
Гидрофобное взаимодействие не |
|
I=(RTUγ(C1 C2))/h; или |
|
дает вылететь липидам в |
|
I=P(C1 C2), где P=RTUγ/h –коэф т проницаемости |
|
жидкость, с другой стороны мол |
|
мембраны, D=URT, U подвижность частиц, |
|
лы липидов свободно |
|
R=8.31Дж/(К*моль) универсальная газовая |
|
обмениваются местами с соседней молекулой и |
|
постоянная. |
|
|
L , l =100нм. |
|
Транспорт вещ в ч з мембрану по величине |
перемещаются на расстояние : l = |
|
пропорционален разности конц ций в клетке и |
|
|
Dt |
|
межклеточ среде и коэф ту прониц ти мембраны, |
Трансмембранная диффузия более медленная. |
|
кот зависит от темп ры и подвижности для данного |
|
Обмен половины молеул происходит за 10 20 часов. |
|
вещ ва в этой мембране. Ур е Фика дает |
|
Из за ассиметрии наружного и внутреннего слоя |
|
возможность определять скорость переноса |
|
мем ны. Микровязкость опр ся м дом ЯМР по |
|
биоактивных вещ в из межклеточ среды в клетку. |
|
уширению линий η = kt / (6rD), где D коэф диффузии, |
|
Изменение конц ции: |
|
к пост. Больцмана. Особое значение имеют упругие |
|
dC/dt=( Dγ/h)/d2C/dX2 . Ур е дает возмож ть |
|
св ва мембраны. Упругость М – способность М |
|
получить изменение конц ции в зависимости от |
|
менять коэф т натяжения δ под действием |
|
времени при фиксированном X, или в завис ти от |
|
растягивающих или сжимающих усилий. Под |
|
координаты при фиксированном t. Решение этого |
|
действием мех х напряжений в мембране возможны |
|
ур я: |
|
след перемещения: растяжение или сжатие(т.е. |
|
CX=C0/(2√(X2/4Dt))*e X²/4Dt |
|
изменение общей пов ти мембраны или смещение |
|
Конц ция меняется по экспоненте: X2/(4Dt)=1, |
|
границ м отн но др др без изм я общей площади) |
|
D= X2/(4t) изменение конц ции вещ ва за заданный |
|
Т.о. мех кие св ва мемб ны опр ся: вязкостью |
|
промежуток времени будет уменьшаться обратно |
|
липидов, составом липидов, наличием |
|
пропорц но квадрату расстояния от точки введения |
|
(отсутствием) белков.катализаторов |
|
|
данного вещ ва. Ур е Фика описывает процесс так |
30.Молекулярный параметр порядка в мембранах. |
|
наз простой диффузии, т.е. транспортированное |
|
Кинки. |
|
|
вещ во не вступает в какие либо взаимодействия с |
Степень нарушения упорядоченности по мере |
|
вещ вом, входящим в состав мембраны. |
|
движения вдоль углеводородной цепи |
|
Облегченная диффузия происходит при участии |
|
характеризуется параметром порядка: θ=3/2cosβ |
|
молекул переносчиков (например, антибиотик |
|
1/2. β определяется следующим образом: строится |
|
валиномицин – переносчик ионов калия). |
|
перпендикуляр к поверхности мембраны и |
|
Особенности облегченной диффузии: |
|
проводится плоскость, на кот лежат все три атома |
|
1. Обладает св вом насыщения, т.е. при увеличении |
|
метильной группы, β угол между ними. Если |
|
конц ции с одной стороны мембраны плотность |
|
молекула нах ся в состоянии полного |
|
потока вещ ва возрастает лишь до некоторого |
|
упорядочения, то θ=1. |
|
|
предела, когда все молекулы переносчика уже |
Параметры порядка характеризуют подвижность |
|
заняты. 2.Процесс диффузии может подавляться |
|
липидов и зависимость этой подвижности от |
|
введением молекул ингибиторов. 3. Перенос ионов |
|
глубины погружения. Наиболее нажежный метод |
|
с участием переносчика происходит значительно |
|
экспериментального определения параметров |
|
быстрее по сравнению со свободной диффузией. 4. |
|
порядка – метод ЯМР: сажают химическим путем |
|
При облегченной диффузии наблюдается |
|
вместо водорода дейтерий (происходит резкое |
|
конкуренция переносимых вещ в в тех случаях, |
|
изменение частоты сигнала), а вместо C12 C13 (что |
|
когда одним переносчиком переносятся разные |
|
приводит к резкому изменению сигнала в |
|
вещ ва; при этом одни вещ ва переносятся лучше, |
|
помеченной точке). |
|
|
чем другие, и добавление одних вещ в затрудняет |
Существуют некоторые темп ры, при кот липиды из |
|
транспорт других. |
|
жидкокристалического состояния переходят в |
|
Осмос преимущественное движение молекул воды |
|
гелеобразное. При этом меняется теплоемкость. |
|
ч з полупроницаемые мембраны из мест с |
|
Резкое увеличение теплоемкости объясняет |
|
меньшей конц цией растворенного вещ ва в места |
|
возникновение крутильных колебаний в |
|
с большей конц цией. Осмос, по сути, диф я воды |
|
углеводородных хвостах и появление так наз |
|
из мест с ее большей конц цией в места с меньшей |
|
“петель”–кинки. Особую роль в образовании кинк |
|
конц цией. Явление осмоса обусловливает гемолиз |
|
играют ненасыщенные связи. При фазовом |
|
эритроцитов в гипотонических растворах и тургор в |
|
переходе меняется площадь сечения молекулы. |
|
растрастениях. |
|
Одновременно сокращается длина углевод цепи и |
|
|
|
меняется расстояние между концами хвостов. Частота возникновения кинк: ν=kT/ћ *e E/kT , Е
энергия активации кинка. При возникновении кинка меняется сечение мол лы, а также образуется соседняя петля. Кинк не остается на месте, а перемещается вдоль цепи – диффузия кинка. Влияние кинка на параметр порядка(ПП): 1 мембрана близка к жидкому кристаллу, с
