

Глава 4. Протеины |
171 |
|
|
|
|
Целью РДСПКИ (мужчины, n=24), проведенного J.M. Joy и соавторами (2013), было изучение вли- яния высоких доз изолята рисового белка (RPI, 48 г, прием сразу после тренировки) в сравнении
сэквивалентными изокалорическими и изони- трогенными дозами WPI на гипертрофию скелет- ных мышц, ТМТ, силу и мощность мышц после 8-недельных периодических силовых тренировок (3 раза в неделю) у лиц с наличием достаточного опыта таких нагрузок. До и после тренировочной
сессии регистрировались субъективные показатели восстановления, болезненность мышц и готов- ность к последующим тренировкам. Кроме того,
в ходе исследования периодически оценивался состав тела, мышечный объем, сила мышц верх- них и нижних конечностей. Результаты показали
почти одинаковую эффективность высоких доз двух форм изолята белка в улучшении большин- ства регистрируемых показателей, включая рост ТМТ и снижение жировой массы. Имелась тен- денция к большей эффективности WPI: рост ТМТ: на фоне RPI +2,5 кг, на фоне WPI +3,2 кг; рост силы мышц – на фоне RPI на 11–13% ниже, чем на фоне WPI, но статистически значимых различий не выявлено. Однако содержание лейцина в RPI при одинаковой дозе с WPI было существенно ниже
(3,8 г в 48 г RPI против 5,5 г в 48 г WPI). Учиты-
вая, что постоянный прием пищевых добавок лей- цина сам по себе малоэффективен, авторы делают вывод, что конечный эффект подобных составов зависит от качества и количества других амино- кислот, которые создают условия и потенцируют действие лейцина в отношении силы, мощности
и гипертрофии мышц при постоянных силовых тренировках. Это важный практический вывод, который свидетельствует, что по мере увеличения
дозы применяемых пищевых добавок протеинов значение содержания в них лейцина снижается,
а эффективность рисового белка сравнивается
стаковой у белков молочной сыворотки. В то же
время количество исследований растительных белков (исключая соевый протеин) в условиях
тренировок различной модальности настолько мало, что необходимы дальнейшие работы по под- тверждению или опровержению этих положений.
Протеины амаранта. Амарант, или щирица
(лат. Amarаnthus) – широко распространенный
род преимущественно однолетних травянистых растений; относится к семейству амарантовых. Широко распространен в дикой природе – в насто- ящее время известно 105 видов амаранта, произ-
растающих в субтропическом и тропическом климате Африки, Америки и Азии, четыре вида
встречаются как дикорастущие в средней полосе России. Еще в 30-е годы минувшего века академик Н.И. Вавилов настоятельно рекомендовал внедре- ние амаранта в народное хозяйство России, отме- чая высокую урожайность, засухоустойчивость,
высокую питательную ценность зерна и зеленой массы (Вавилов Н.И., 1959). Но лишь в последние годы амарант активно входит в культуру, в том числе в Российской Федерации (Гульшина В.А. и соавт., 2007) и в Украине (Высочина Г.И., 2013).
По данным USDA Nutrient Database, в 100 г
амаранта содержится: вода – 11,29 г, белки –
13,56 г, жиры – 7,02 г, углеводы – 68,55 г, пище-
вые волокна (клетчатка) – 6,7 г, зола в количестве 2,88 г, а также практически весь спектр витаминов, макро- и микроэлементов; энергетическая ценность амаранта составляет 371 ккал на 100 г. Высокой
нутриционной ценностью обладает зеленая масса и семена (зерно) амаранта (Железнов А.В., 2005).
Еще в 2005 г. с помощью современных мето- дологий было оценено содержание аминокислот, в первую очередь незаменимых, до и после тер- мообработки в зерне (семенах) шести отобран- ных сортов амаранта и четырех видов: A. cruentus, A. hypochondriacus, A. caudatus и A. hybridus,
культивируемых в Чешской Республике. Высокое
содержание незаменимых аминокислот лизина

172 |
СПОРТИВНАЯ НУТРИЦИОЛОГИЯ |
|
|
|
|
и аргинина (Lys и Arg) было обнаружено как в тер- мически обработанных, так и необработанных зернах, удовлетворительное содержание их харак- терно для цистеина (Cys), и более низкие уровни зарегистрированы по отношению к метионину, валину, изолейцину и лейцину (Met, Val, Ile и Leu).
Были также определены химические количества незаменимых аминокислот и индекс незаменимых аминокислот (EAAI), значение которого на уровне 90,4% свидетельствует о высоких пищевых каче- ствах белка амаранта, что почти сопоставимо
сяичным белком. Термическая обработка при температуре от 170°C до 190°C в течение 30 с при- вела к снижению EAAI до 85,4%, из изучаемых незаменимых аминокислот значительно уменьши- лось (Р <0,05) содержание валина и лейцина. Содер- жание лизина в семенах одного из исследован-
ных видов – A. hypochondriacus – составило 5,95 г
на 16 г азота, что существенно выше по сравнению
саналогичными данными в пшеничной муке –
2,90 г на 16 г азота, а в А. caudatus и A. cruentus
этот показатель колеблется от 5,55 г на 16 г белка до 6,44 г на 16 г белка соответственно. Важнейшим
преимуществом зерен амаранта по сравнению
собычными злаками является относительно высо-
кое содержание белков и более сбалансированный состав незаменимых аминокислот. Именно это, по мнению авторов, предопределяет его использо-
вание в качестве нутритивной замены животным белкам (Písaříková B. et al., 2005).
Амарант содержит уникальный по составу белок со сбалансированным аминокислотным составом, включающим большинство незаменимых аминокислот. Более половины всего белка амаранта приходится на альбумины и глобулины. В послед-
ние годы в пионерском исследовании мексиканских ученых (Silva-Sánchez C. et al., 2008), в котором
сообщается о присутствии луназиноподобного пептида и других потенциально биоактивных пептидов в белковых фракциях амаранта, в четы-
рех генотипах зрелых семян этого растения с помо- щью ELISA был обнаружен луназин в количестве 11,1 мкгЭкв.×г –1 общего экстрагированного белка амаранта. Вестерн-блот-анализ показал полосу 18,5 кДа, а анализ MALDI-TOF показал, что этот пептид в более чем 60% соответствует пептидной
последовательности соевого луназина и обладает антиоксидантной и антиканцерогенной активно- стью. Экстракты также обнаруженного в белко- вой фракции семян амаранта пептида глютелина, расщепленные трипсином, показали индукцию апоптоза против клеток HeLa (экспериментальной опухоли легких). Прогноз биологических свойств других биоактивных пептидов в амарантовых гло- булинах и глютилинах касался в основном гипо- тензивных свойств БАВ. В семенах амаранта также был обнаружен специфический белок амарантин, имеющий молекулярную массу 59 кДа.
Было также установлено, что кислота 11S белка
глобулиновой фракции амарантина кодирует одно из наиболее важных белков-хранилищ семян ама- ранта с высоким содержанием незаменимых ами-
нокислот (Osuna-Castro J.A. et al., 2000). Аргентин-
скими учеными в 2009 г. было показано, что белок глобулиновой фракции, называемый 11S, содержит в своем составе пептиды (трипептиды IKP и LEP
итетрапептиды ALEP и VIKP) с антигипертен-
зивным действием (Vecchi B., Añón M.C., 2009),
что экспериментально подтверждено с помощью анализа ингибирования АПФ in vitro, который показал значения IC50 6,32 мМ и 175 мкМ соответ- ственно. Данное исследование было первым, где
представлены экспериментальные доказательства антигипертензивной ценности амаранта. В после-
дующие годы эти исследования были углублены
идополнены (Ramírez-Torres G. et al. 2017), в част-
ности, было показано, что для гидролиза белков
амаранта из амарантовых белков необходимым ферментом является алькалаза. Этот фермент был
использован для дальнейшего высвобождения при

Глава 4. Протеины |
173 |
|
|
|
|
гидролизе белков глобулиновой фракции антиги- пертензивных пептидов, которые затем влияют на активность ангиотензинконвертирующего фер- мента (ACE-I). По мнению Т.Н. Gamel и соавторов,
регуляция артериального давления с помощью гидролизатов белка амаранта может иметь пози-
тивное влияние на предупреждение формирования патологии сердца (Gamel T.H., Linssen J.P., 2006),
втом числе у спортсменов, путем экономизации его работы.
Врезультате частичного белкового гидролиза семян амаранта можно получить ингредиенты, представляющие существенный интерес для раз-
работки ингредиентов специальных продуктов (Tosi Enzo et al., 2014). Амарантовое зерно, которое известно своими питательными свойствами, позво- ляет получить две основные фракции с использова- нием дифференциального расщепления: во-первых,
гиперпротеиновую муку с содержанием примерно 40% белков с полным аминокислотным профилем, включая ЕАА, а во-вторых, высокоэнергетиче- скую манную крупу с содержанием 90% крахмала. Смесь обоих продуктов создает сырье, подходя- щее для разработки специальных продуктов. Про-
цедуру ферментативного пептидного гидролиза проводили с использованием смеси, содержащей
вравных частях амарантовую гиперпротеиновую муку и манную крупу амаранта с использованием коммерческих протеиназ Alcalase™ (алкалаза) и Flavourzyme™. Глубина гидролиза составляла от 30% до 58%. Молекулярные массы получен- ных пептидов и полипептидов колебались от 0,5 до 240 кДа при сохранении полного амнокислот- ного состава исходного сырья.
Впроведенном в 2015 г. группой сотрудников
кафедры нутритивных наук и питания человека Университета штата Иллинойс (США) в исследо-
вании под руководством Montoya-Rodŕıguez Alvaro
были оценены белки амаранта, представленные
вбазе данных UniProt, на предмет потенциаль-
ного биоактивного пептида при использовании базы данных BIOPEP. Показано, что в протеине семян амаранта содержится 15 основных белков, в том числе таких, как глобулин 11S, 7S глобу- лин, α-амилаза ингибитор, ингибитор трипсина, противомикробные белки, неспецифический липид-трансфер-белок-1, цинк-цинк-белковый белок, просистемин, амарантовый альбумин 1,
атакже ряд ферментов, в частности глюкозо-1-фос- фат-аденилтрансфераза, глюкозилтрансфераза, полиамин оксидаза, гранулометрическая крахмаль- ная синтаза 1 и ацетолактат-синтаза. Всем белкам
была присуща высокая частота встречаемости пептидных ингибиторов АПФ (А=0,161–0,362), связанных с регуляцией артериального давления,
атакже ингибитора дипептидилпептидазы IV (А=0,003–0,087). Другие белки показали наличие антиоксидантной (А=0,012–0,063) и стимулирую- щей глюкозу активности (А=0,023–0,042), а также антитромботические (А=0,002–0,031) и противора- ковые свойства (А=0,001–0,042). Результаты этого исследования подтверждают концепцию о том, что зерно амаранта может быть частью «здоровой» диеты и тем самым предотвращать развитие хро- нических заболеваний человека (Montoya-Rodrıgueź
Alvaro et al., 2015).
В связи с увеличением частоты случаев мал- нутриции, затронувшей, например, в Индонезии почти 31% детей дошкольного возраста, представ-
ляется весьма перспективным также использование полноценного белка листьев амаранта (Andini Rita et al., 2013). При анализе 76 различных образцов растительного (листового) сырья дикорастущих
видов амаранта особо перспективними в плане использования для компенсации белково-энер-
гетической недостаточности оказались три вида растения (A. viridis, A. blitum L., A. dubius) из гор-
ных районов страны. Содержание белков в листьях и общее количество аминокислот в большин-
стве дикорастущих видов амаранта составляли

174 |
СПОРТИВНАЯ НУТРИЦИОЛОГИЯ |
|
|
|
|
2–29 г×100 г –1 DM и 84–93 г белка на 100 г DW
соответственно. Было обнаружено, что листья амарантов являются хорошим источником незаме- нимой аминокислоты лизина, содержание которой в гидролизате зеленой массы находились в диа- пазоне от 6 г белка×100 г –1 DW, которые близки по этому показателю качества белка в соответ- ствии со Стандартами FAO/WHO’s (ФАО/ВОЗ).
Даже эти немногочисленные примеры убедительно свидетельствуют о высокой пищевой ценности протеинов зеленой массы амаранта и возможности использования его в качестве источника полноцен- ного белка в питании человека, в том числе и при интенсивных физических нашрузках, где белок –
крайне необходимый элемент восстановительных процессов (Платонов В.Н., 2017).
Что касается пептидов амаранта, то поскольку клейковина пшеницы, ржи, ячменя и других зла-
ков запускают иммуноопосредованную целиакию у генетически восприимчивых людей и поэтому такие лица нуждаются в безглютеновой диете,
то легко усваиваемые альбумины и глобулины компонентов высококалорийных белков семян ама- ранта могут быть, согласно точке зрения авторов систематического обзора (Venskutonis Petras R., Kraujalis Paulius, 2013), признаны важным канди-
датом на такую замену. Также важным нутриентом
будущего цитируемые исследователи признают гидролизаты протеинов, полученные из листьев амаранта.
Сравнительные данные относительно содержа-
ния протеинов в зерне и зеленой массе амаранта по отношению к другим растениям свидетель-
ствуют о высокой питательной ценности в целом и о значительном вкладе белков амаранта с опти- мальным набором аминокислот, в первую очередь незаменимых (Rastogi Anu, Shukla Sudhir, 2013).
В частности, по данным этих авторов, в зернах амаранта, по сравнению с другими злаками, содер- жится 14,5% протеина, 0,85% лизина, в то время как
взернах кукурузы 9% протеина и 0,25% – лизина,
всеменах гречихи эти показатели составляют соответственно 12% и 0,55% на 100 г продукта. Что же касается зеленой массы амаранта, то содер- жание протеина в ней составляет 3,5 г, в листьях шпината – 3,2 г, а в листьях базилика – всего лишь 1,8 г на 100 г продукта.
Эти сведения дают основания говорить о серьез- ных перспективах использования частей расте- ния, особенно листьев, в производстве пищевых продуктов и специальных функциональных про- дуктов питания. Но исследований относительно
эффективности применения протеинов амаранта у спортсменов, в том числе для стимуляции рабо- тоспособности, проведенных с использованием методов и принципов доказательной медицины, пока не найдено. Однако с учетом полноценности белков, полученных из семян, а также зеленой массы, можно думать о перспективности их при-
менения при физических нагрузках для ускорения восстановления.
Влияние протеинов и аминокислот на иммунитет при физических нагрузках
В Международном Консенсусе 2017 г. «Имму-
нопитание и тренировки» (Consensus Statement: Immunonutrition and Exercise) была проанализи-
рована роль аминокислот, основным источником поступления которых являются белки различ-
ного происхождения и непосредственно пищевые добавки, в регуляции иммунитета спортсменов
илиц, активно занимающихся спортом (Bermon S. et al., 2017). В составе дополнительных источников
питания в качестве иммуномодулирующих агентов наиболее часто рассматриваются глутамин, неза- менимые аминокислоты с разветвленной цепью – ВСАА, аланин и аргинин. При этом в схемах пред-
ипосттренировочного питания доминируют ВСАА

Глава 4. Протеины |
175 |
|
|
|
|
иL-глутамин и его дипептиды, а основными источ- никами белка являются whey-протеины.
ВСАА. В процессе длительных истощающих тренировок потребление ВСАА (лейцин, изолей- цин, валин) сопровождается быстрым возрастанием концентраций всех трех аминокислот с после-
дующей утилизацией работающей мышечной тканью. Окисление ВСАА дает энергию, но, что более важно в плане регуляции иммунитета,
метаболизм ВСАА обеспечивает необходимое для синтеза глутамина количество азота. Хорошо
идавно известное в спортивной научно-методиче-
ской литературе падение концентрации глутамина в плазме крови в процессе и после постоянных тренировок (Décombaz J. et al., 1979; Rennie M.J. et al., 1981), как предполагается, может быть связано с возникновением синдрома вторичного спортив-
ного иммунодефицита в результате длительных
иинтенсивных физических нагрузок (Castell L.M. et al., 1996; Rohde T. et al., 1996). Таким образом,
ВСАА отдельно или в составе протеинов (особенно WP) может опосредованно влиять на иммунный ответ организма. Однако, несмотря на повышение
уровней ВСАА в плазме крови и мышцах после перорального приема этих аминокислот, выход глутамина из работающих мышц остается неиз- менным, несмотря на потребление даже большого количества ВСАА (Blomstrand E., Saltin B., 2001; MacLean D.A. et al., 1994, 1996). В противополож-
ность этим данным, хроническое употребление пищевых ВСАА-добавок спортсменами предот-
вращает снижение уровня глутамина в организме
ииммунодепрессию, например, в триатлоне в забеге на 30 км (Bassit R.A. et al., 2000), а также предотвращает (при приеме в течение 10 недель) повышение уровня нейтрофилов у тренирован-
ных велосипедистов (Kephart W.C. et al., 2016),
наблюдаемое в группе без употребления ВСАА. Наряду с непрямым ВСАА могут оказывать и пря-
мое стимулирующее влияние на иммунитет за счет
увеличения синтеза протеинов (главным образом, лейцина), что приводит к увеличению образования цитокинов и антител. Формулировка Консенсуса
в отношении ВСАА выглядит следующим образом
(Bermon S. et al., 2017): «Существуют некоторые данные, что потребление ВСАА может редуци- ровать иммунодепрессию. Однако существующих
данных недостаточно для рекомендаций приема ВСАА именно по данному показанию. Необходимы дальнейшие расширенные контролируемые иссле- дования по оценке эффективности ВСАА и тре- нировок в отношении иммунитета».
Взаимодействие протеинов и аминокислот с микробиомом
кишечника
Как известно (см. подробнее в главе 3), пере-
варивание протеинов не заканчивается в тонком кишечнике, а продолжается в толстом кишечнике. При постоянном потреблении повышенного коли- чества белка (вне зависимости от использования других нутриентов или в связи с ними) происхо- дят изменения состава микробиома (Singh R.K. et al., 2017). Впервые влияние протеинов на МБ было описано еще в 1977 г.: пониженное количе-
ство Bifidobacterium adolescentis и повышенное – Bacteroides и Clostridia у лиц, потребляющих большое количество мяса по сравнению с лицами, находящимися на нестрогой вегетарианской (без мяса) диете (Hentges D.J. et al., 1977). С появ-
лением методики секвенирования генома (ана- лиз белков и нуклеиновых кислот, определение их аминокислотной или нуклеотидной после- довательности), в частности, секвенирования РНК, был выполнен ряд работ по оценке влия- ния протеинов на состав МБ (Meddah A.T. et al., 2001; De Filippo C. et al., 2010; Świątecka D. et al., 2011; Eeckhaut V. et al., 2013; Kim C.H. et al., 2014; Machiels K. et al., 2014), сводные результаты

176 |
СПОРТИВНАЯ НУТРИЦИОЛОГИЯ |
|
|
|
|
Таблица 44. Влияние протеинов на состав МБ человека (цит. по: Singh R.K. et al., 2017)
|
|
|
|
|
|
|
|
|
|
|
|
Вид белка |
МД |
Bifidobacteria |
Lactobacilli |
Bacteroides |
Alistipes |
Bilophila |
Clostridia |
Roseburia |
Eubacterium Rectale |
|
|
|
|
|
|
|
|
|
|
|
|
Животный белок |
↑ |
↑↓ |
|
↑↓ |
↑ |
↑ |
↑ |
|
↑↓ |
|
|
|
|
|
|
|
|
|
|
|
|
WP |
↑ |
↑ |
↑ |
↓ |
|
|
↓ |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Белок гороха |
↑ |
↑ |
↑ |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Примечания: МБ – микробиом кишечника; WP – whey-протеин; МД – уровень диверсификации МБ.
которых представлены в таблице 44, из данных которой видно, что диета, содержащая whey-про- теины и белок гороха, приводит к увеличению содержания симбиотических Bifidobacterium и Lactobacillus, в то время как WP-диета снижает количество патогенных бактерий Bacteroides fragilis и Clostridium perfringens.
Протеин гороха увеличивает количество короткоцепочечных жирных кислот, которые обе- спечивают адекватное функционирование защит- ного кишечного барьера и противовоспалитель- ное действие. Напротив, потребление животных белков увеличивает количество желчетолерант-
ных анаэробов, таких как Bacteroides, Alistipes
и Bilophila. Применение высокобелковой/низкоу- глеводной диеты, хотя и способствует снижению веса, может оказаться не совсем полезной в плане поддержания общего здоровья. Такая диета может снижать количество Roseburia и Eubacterium rectale, что сопровождается уменьшением содер- жания основной КЦЖК – бутирата – в фекалиях
(De Filippo C. et al., 2010; Russell W.R. et al., 2011).
Эта ситуация очень схожа с тем, что наблюдается
в МБ у пациентов с синдромом раздраженного кишечника (IBS) и болезнью раздраженного
кишечника (IBD) – снижение количества бути- рат-продуцирующих микробов по сравнению с МБ здоровых лиц.
Аминокислоты как составляющие протеи-
нов также играют важную роль в поддержании функционального статуса МБ кишечника и пре-
дотвращении возникновения воспалительных процессов в толстом кишечнике, в частности
IBS и IBD (He F. et al., 2018). Аминокислоты,
включая незаменимые аминокислоты (EAA), условно незаменимые аминокислоты (CEAAs) и заменимые аминокислоты (NEAAs), улучшают функции кишечного барьера и функционирова- ние противовоспалительных цитокинов и бел- ков соединительной ткани, а также уменьшают
выраженность окислительного стресса и апоптоза энтероцитов, а также снижают активность про- воспалительных цитокинов и, соответственно, их роль в кишечном воспалении. Функции ами-
нокислот связаны с различными сигнальными путями, включая механистическую мишень рапа- мицина (mTOR), индуцируемую синтазу оксида азота (iNOS), кальцийчувствительный рецеп- тор (CaSR), ядерный фактор-каппа-B (NF-κB), митогенактивированную протеинкиназу (MAPK),

Глава 4. Протеины |
177 |
|
|
|
|
ядерный фактор, связанный с эритроидом 2 (Nrf2), общую контролируемую нередуцируемую киназу 2 (GCN2) и ангиотензинпревращающий фермент 2 (ACE2). Таким образом, аминокис- лоты, попадающие в оргнанизм в составе рациона и пищевых добавок, должны быть представлены различными классами, включая и нечасто упоми- наемые заменимые АК, для поддержания функции
МБ в организме спортсмена и предотвращения заболеваний.
Заключение по эффективности пищевых добавок на основе протеинов при физических нагрузках
В 2017 г. в Британском журнале спортивной
медицины был опубликован систематический обзор, мета-анализ и мета-регрессионный анализ
влияния пищевых добавок протеинов на рост мышечной массы и силы у здоровых взрослых лиц (Morton R.W. et al., 2017). В нем отмечается,
что использование пищевых добавок протеи- нов в процессе силовых тренировок (resistance exercise training – RET) является общепринятой практикой в спорте. Авторы провели поиск иссле-
дований данной тематики в электронных базах данных Medline, Embase, CINAHL и SportDiscus
за период до января 2017 г. Из просмотренных 3056 статей для мета-анализа были отобраны 49 интервенционных РКИ. Данные мета-ана- лиза, регрессионного мета-анализа и анализа
чувствительности позволили сделать ряд важных заключений относительно влияния как самих силовых тренировок, так и пищевых протеиновых добавок, на силу и мышечную массу спортсменов.
Среднее увеличение силы мышц под влиянием силовых тренировок составило 27 кг (27±22 кг),
при этом вклад в увеличение этого показателя за счет пищевых добавок протеинов – 2,49 кг (9%). Это подтверждает точку зрения многих
специалистов, что силовые нагрузки представ-
ляют значительно более мощный анаболический стимул, чем дополнительный прием протеинов. Однако, учитывая высокий уровень конкурен- ции во многих силовых видах спорта (например,
втяжелой атлетике), где разница в результатах измеряется куда меньшими величинами, чем 9%,
такой вклад протеинов может иметь решающее практическое значение.
Вдополнение к увеличению мышечной силы, силовые тренировки способствуют росту мышеч- ной массы за период в среднем 13 недель. При этом вклад пищевых добавок протеинов в увели- чение ТМТ составляет уже 27%, а в увеличение размеров мышечных волокон – 38%. Выявлена
обратная зависимость эффекта пищевых добавок протеинов от уровня тренированности: чем выше уровень тренированности, тем меньше позитив- ный эффект протеинов, что объясняется авторами «эффектом базы» (запас для роста у трениро- ванных лиц меньше, чем у нетренированных). С возрастом также влияние протеинов снижается,
что требует увеличения дозы для достижения такого же результата в плане роста мышечной массы. Средняя доза протеинов для 1863 участни- ков мета-анализа составила 1,4 г×кг –1 в день, что расценено авторами как недостаточное потребле- ние белка, и ими для силовых видов спорта реко- мендована более высокая цифра – 1,6–2,4 г×кг –1
вдень.
Ранее выполненный мета-анализ (Stearns R.L. et al., 2010) показал, что дополнение протеинами изотонических углеводно-электролитных напит-
ков отдаляет время наступления усталости при интенсивных физических нагрузках и ускоряет восстановление после окончания тренировок. Этот принцип лежит в основе концепции «Быстрой метаболической оптимизации» (см. подраздел «Белки гороха»), которая используется в клиниче- ской нутрициологии (Луфт В.М., Дмитриев А.В.,

178 |
СПОРТИВНАЯ НУТРИЦИОЛОГИЯ |
|
|
|
|
2017) и может оказаться эффективной в различ- ных видах спорта. Совместный прием углеводов
и протеинов для восстановления после нагрузки с учетом появившихся в спортивно-методической литературе многочисленных данных стал обще- принятой практикой.
В начале 2018 г. в журнале «Нутриенты» опу- бликован большой обзор канадских исследовате-
лей T. Stokes и соавторов из McMaster University,
посвященный перспективам применения пищевых добавок протеинов в сочетании с силовыми тре- нировками для стимулирования мышечной гипер- трофии в популяции молодых лиц. В результате авторами сформулирован ряд практических реко- мендаций по использованию протеинов в зависи-
мости от планируемого состояния энергетического баланса организма:
А. Лица в состоянии энергетического баланса при физических нагрузках:
1.Дополнительное потребление белка ~0,4 г×кг –1 массы тела максимально стимулирует синтез мышечных протеинов (MPS) в период отдыха или истощающих силовых тренировок.
2.Целесообразно разделение суточной общей дозы белка (суммарно в пище) на порции с интер- валом приема 3–5 часов в течение дня, что мак- симизирует MPS в течение 12-часового периода бодрствования.
3.Практика приема протеинов перед сном (за 1–3 часа) компенсирует снижение MPS, которое происходит во время ночного голодания.
4.Для получения максимального прироста мышечных белков под влиянием силовых трени-
ровок необходимо суммарно потреблять протеины
вдиапазоне доз от 1,6 г×кг –1 в день до 2,2 г×кг –1
вдень. Это можно сделать за три приема пищи, каждый из которых содержит ~0,53 г×кг –1 белка, или за четыре приема пищи – по ~0,4 г×кг –1 белка.
Б. Лица в условиях ограничения поступления энергии при физических нагрузках:
1.Суточная потребность в белке выше для поддержания или увеличения ТМТ, чем у лиц
всостоянии энергетического баланса.
2.Силовые тренировки в период ограничения потребления энергии должны быть построены таким образом, чтобы сохранять по возможности ТМТ и не допустить ее снижения.
3.Для спортсменов, ограничивающих свой вес в течение длительного периода, должен быть выбран протеин из высококачественных источ- ников (например, whey-протеин, казеин или их смесь), оптимизирован контроль аппетита и должна соблюдаться сбалансированная диета.
4.Для стимулирования роста ТМТ в процессе выполнения программ снижения веса целесо-
образно повышенное потребление протеинов на уровне ~2,3–3,1 г×кг –1 в день. Интенсивно тре-
нирующиеся лица с большим процентом жировой массы могут достичь этой цели, используя потреб- ление белка на нижней границе приведенного диа- пазона. В то же время «тощие» люди с опытом силовых тренировок более уязвимы в плане сниже- ния ТМТ из-за ограничения потребления энергии
и поэтому требуют приема белка на уровне верхней границы рекомендуемого диапазона.
Важно помнить, что, несмотря на способность организма переваривать большое количество белка,
дополнительный прием протеинов усиливает синтез и снижает распад белка только до опреде- ленного ограниченного индивидуального коли- чественного предела. В обычных условиях допол- нительный прием протеина ~0,3 г×кг –1 массы тела приводит к «насыщению» MPS, что стимулирует катаболизм и выведение излишних аминокислот.
Силовые тренировки расширяют метаболические «ворота» для синтеза белка, но и в данном случае
имеется индивидуальный предел потребления протеинов, при превышении которого, несмотря на отчетливое повышение концентрации амино- кислот в крови, MPS будет снижаться.

Глава 4. Протеины |
179 |
|
|
|
|
«Потребление протеинов» vs «усвоение протеинов»:
что важнее для повышения эффективности тренировочного процесса?
В обзорной аналитической работе B.J. Schoenfeld и A.A. Aragon (2018) справедливо подни-
мается вопрос усвоения ПД протеинов как в диа- пазоне рекомендованных суточных значений, так и при превышении последних при интен- сивных пролонгированных нагрузках. В ряде
клинических спортивных ситуаций потребляемое суточное количество белка, исчисляемое в г×кг –1 массы тела и правильно распределенное по вре- мени в течение суток, не усваивается полностью по ряду причин: выбранный протеин в опре- деленной форме (изолят, концентрат, гидроли- зат и др.) или смесь протеинов перевариваются
иабсорбируются в кишечнике в меньшей сте- пени по сравнению с расчетными величинами; транспортные системы крови и клеточные мем- бранные системы переноса аминокислот рабо- тают менее активно; поступление в организм макронутриентов – источников энергии (жиры
иуглеводы) не соответствует потребленному количеству белка; уровни физической нагрузки не требуют большого количества белка. Таким образом, главными клиническими критериями
оценки усвоения белка с позиций доказательной медицины является выраженность эргогенных эффектов при однократном и курсовом назна-
чении и изменение внутримышечного синтеза белка (MPS) по данным биопсии.
Как показали исследования J.L. Areta и соав- торов (2013), существует универсальная зави-
симость между интенсивностью синтеза белка (MPS) в мышечных клетках и дробностью приема суточной дозы белка в условиях силовых трени- ровок. Прием 80 г протеина в день в трех вариан-
тах (8 порций по 10 г каждые 1,5 часа; 4 порции по 20 г каждые 3 часа; 2 порции по 40 г каждые 6 часов) показал максимальное значение MPS при приеме 20 г белка каждые 4 часа. В то же время данная закономерность верна для относи- тельно малых суточных доз белка (менее 1 г×кг –1
всутки). Для whey-протеинов с высокой биоло-
гической доступностью и быстрым всасыванием максимальная скорость абсорбции при хорошо функционирующем ЖКТ составляет 10 г в час, для протеинов сваренного яйца – 3 г в час, для омлета с 20 г белка – 7 часов. Совместное потреб- ление «быстрых» белков с углеводами ускоряет метаболический эффект протеинов, в то время как действие казеина меняется мало. В составе пищи (суммарное количество белка, включая пищевые добавки) максимальный уровень MPS в условиях
силовых тренировок наблюдается в диапазоне доз от 0,25 г×кг –1 приема пищи (у молодых спортс- менов) до 0,6 г×кг –1 приема пищи (у лиц старшего возраста) при трехкратном приеме пищи в день.
После абсорбции в кишечнике и попадания
вклетки скелетных мышц аминокислоты вклю- чаются во внутриклеточные процессы обмена.
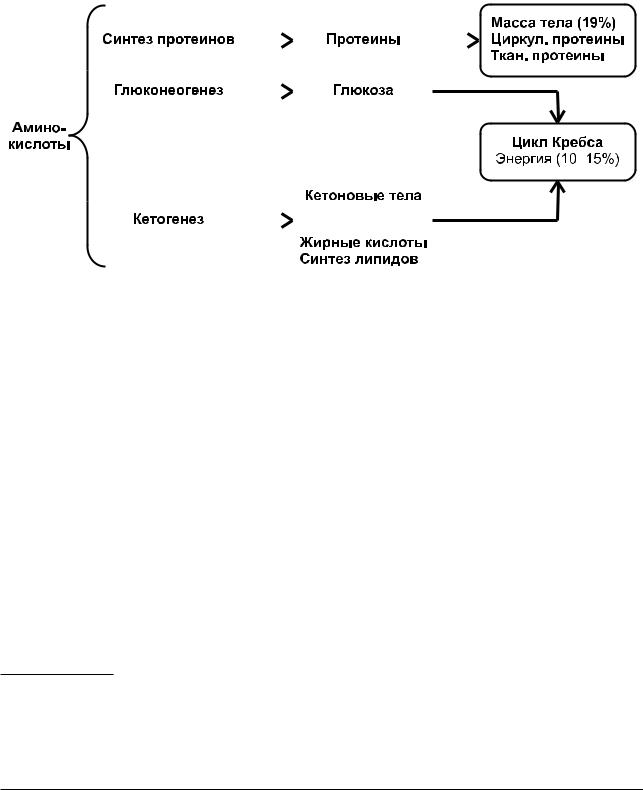
Конечный результат очень важен для проявлений эргогенных эффектов белков, поскольку аминокис- лоты могут использоваться в разных метаболиче- ских путях (рис. 18). Аминокислоты – биохими- ческие тотипотентные молекулы, т. е. молекулы,
обладающие полимодальным метаболическим действием. Они способны:
1)быть источником энергии, углеводов и жиров;
2)исходным пластическим материалом для строительства клеток;
3)в зависимости от потребностей организма может преобладать п. 1 или п. 2.
В условиях критических состояний, травм, болезней увеличивается энергетическая направлен- ность белкового обмена (растут затраты энергии
180 |
|
|
|
СПОРТИВНАЯ НУТРИЦИОЛОГИЯ |
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Рисунок 18. Метаболизм экзогенных и эндогенных аминокислот в клетках скелетных мышц после абсорбции в кишечнике в норме, при физических нагрузках и патологических состояниях (цит. по: Pasini E. et al., 2018)
впокое). АК метаболизируются в цикле Кребса, конкурируя с углеводами и жирами через β-окис- ление; расход белка растет.
Преобладание того или иного направления
вметаболизме аминокислот зависит от состоя- ния организма спортсмена (активная нагрузка, восстановление и др.), поступления других макро- нутриентов и пр.
Энергетическое обеспечение усвоения про-
теинов. Метаболизм белков – энергозатрат- ный процесс. Суточный обмен белков требует 18 kJ (4,3 ккал) на кг массы тела или 20% BMR* (Waterlow J.C., Millward D.J., 1989), исходя из затрат
на расщепление и синтез белков и регуляторные процессы. Он не включает расход энергии на вну- триклеточные регуляторные реакции, которые
*BMR (от англ. Basal Metabolic Rate) – минималь-
ное количество энергии, расходуемое человече-
ским организмом для поддержания собственной жизни в покое. Эта энергия тратится на дыхание, кровообращение, переваривание пищи, поддер- жание температуры тела и др.
ранее считались незначительными, но в настоящее время оценены как существенные (Nesheim R.O. et al., 1999). Синтез протеинов – наиболее затрат- ный внутриклеточный процесс, на который расхо- дуется около 50% общей клеточной энергии в зави-
симости от стадии развития организма и условий его функционирования. Недостаточное обеспе-
чение организма энергетическими субстратами ведет к замедлению синтеза протеинов (в частно- сти мышечных белков). Дието-контролируемые РДСПКИ показали, что относительная энергети- ческая недостаточность в течение 10 дней и более
нарушает усвоение белков у мужчин и женщин
(Pasiakos S.M. et al., 2010).
Таким образом, диета и пищевые добавки с про-
теинами должны быть сбалансированы по жирам и углеводам. В качестве примера: рекомендуемые величины энергообеспечения и потребления про- теинов для взрослых здоровых лиц согласно Кон- сенсусу-2019 клиник Великобритании составляют 100–145 kJ×кг –1 массы тела, или 25–35 ккал×кг –1,
