
3 курс / Фармакология / Диссертация_Гильдеева_Г_Н_Формирование_междисциплинарного_подхода
.pdf201
|
|
|
Давление – 57кПа |
|
|
|
|
Температура интерфейса - 3000С |
|
|
|
|
Газ носитель – Гелий марки «А» |
|
|
|
|
|
|
|
|
|
Начальная температура колонки - 800С в течении 1 |
|
Температурная |
минуты |
|||
Нагрев – со скоростью 200С/минуту до 2800С |
||||
программа: |
|
|||
|
Предочистка - 2800С в течении 14 минут |
|||
|
|
|
||
|
|
|
Общее время анализа 24 минуты |
|
|
|
|
||
Объем |
вводимой |
2,5 мкл |
||
пробы: |
|
|
||
|
|
|
||
|
|
|
||
Раствор |
для |
Гексан 100% |
||
промывки иглы: |
||||
|
||||
|
|
|
|
|
|
|
|
Митотан: |
|
Параметры |
масс- |
Позитивная ионизация (Ei+), m/z 235 |
||
детектора: |
|
4-4-ДДТ |
||
|
|
|
Позитивная ионизация (Ei+), m/z 235 |
|
|
|
|
||
Время |
регистрации |
1.5 минуты |
||
хроматограммы: |
||||
|
||||
|
|
|
|
|
Количественное определение концентрации определяемого вещества
Использовалось автоматическое интегрирование хроматограмм с помощью программного обеспечения Shimadzu GCSolutions 4.30. Для количественного определения использовался метод градуировочного графика. В качестве параметра бралось соотношение площадей пика аналита и внутреннего стандарта.
5.2.Результаты исследований
5.2.1.Препараты дезогестрела
Результаты валидации аналитической методики
Валидация методики количественного определения этоногестрела в плазме крови человека методом высокоэффективной жидкостной хроматографии с масс-
спектрометрическим детектированием была проведена в соответствии с нормами
GCP/CLP, руководством FDA для предприятий «Bioanalytical Method Validation»
202
(Май 2001 г.), руководством EMEA: Guideline on bioanalytical method validation, (Июль 2011 г.). Валидация методики включала следующие параметры:
чувствительность, селективность, линейность, правильность, прецизионность,
кросс-перенос, матричный эффект и стабильность.
Тест «Пригодность хроматографической системы»
Тестирование пригодности хроматографической системы включало оценку следующих параметров:
- число теоретических тарелок;
- фактор удерживания;
- коэффициент асимметрии пика;
Полученные значения вышеперечисленных параметров представлены в
таблице ниже:
Параметр |
Значение |
|
|
Число теоретических тарелок (N): |
6057 |
|
|
Фактор удерживания (коэффициент емкости) (k’) |
4,95 |
|
|
Коэффициент асимметрии пика (Аs) |
1,63 |
Время удерживания этоногестрела |
2,80+0,05 минут |
|
|
Селективность
Для определения селективности были протестированы 6 образцов биологической матрицы, обработанной без стандарта этоногестрела, на возможность создания помех потенциально мешающими веществами (эндогенные компоненты матрицы, метаболиты, продукты разложения).
Для демонстрации отсутствия влияния потенциально мешающих веществ на рис. 5.1 приведена хроматограмма проанализированных образцов биологической матрицы, не содержащих этоногестрела.
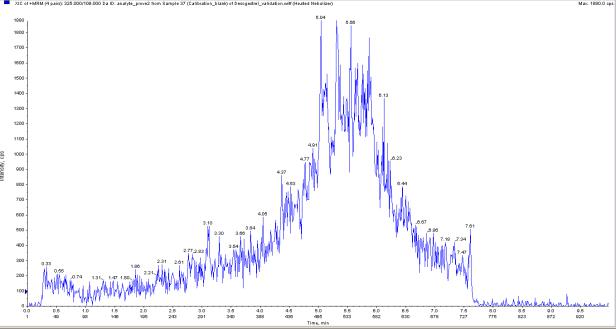
203
Рис. 5.1 - Хроматограмма плазмы крови без добавления этоногестрела
Линейность и чувствительность Определение предела обнаружения этоногестрела.
Предел обнаружения этоногестрела был определен как сигнал,
соответствующий утроенной величине уровня шума, наблюдаемого в хроматографической системе. При анализе шести образцов «холостой пробы» -
бланковой плазмы - был установлен уровень сигнала в диапазоне 75-125
условных единиц, уровень шума равный 24±3 условных единицы, а при анализе трех образцов с концентрацией 20 пг/мл уровень сигнала был в диапазоне 200-250
условных единиц, соотношение сигнал/шум 2,2-4,4. По полученным данным можно сделать вывод, что пределом обнаружения этоногестрела является концентрация 20 пг/мл. Хроматограмма одного из образцов плазмы с концентрацией этоногестрела 20пг/мл приведена на рис. 5.2.
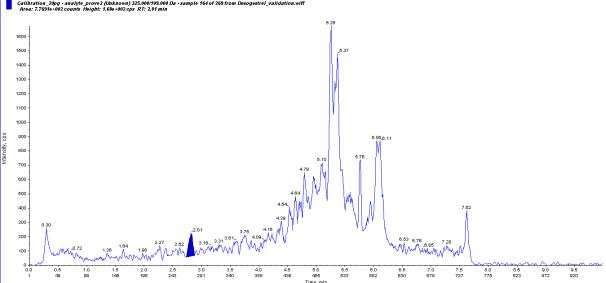
204
Рис. 5.2 - Хроматограмма плазмы крови с концентрацией этоногестрела 20
пг/мл
Линейность
Калибровочная кривая состояла из 8 ненулевых калибровочных стандартов,
охватывающих диапазон концентраций 40-4000 пг/мл для этоногестрела.
Концентрация определяемого вещества 40 пг/мл была принята в качестве нижнего предела количественного определения, поскольку были выполнены следующие условия:
1. Показания стандарта на нижнем пределе количественного определения (НПКО) были как минимум в 5 раз больше соотношения сигнал/шум
“холостой” пробы.
2. Показания стандарта на нижнем пределе количественного определения (НПКО) поддавались определению и были воспроизводимы с точностью 8,8%, не превышающей 20%, и достоверностью 99,80%, входящей в диапазон 80-120%.
Зависимость отношения величин площадей пиков аналита и внутреннего стандарта от концентраций калибровочных стандартов была линейной с весовым коэффициентом 1/х и описывалась уравнением типа Y=4,37·10-6X + 8,78·10-5 c
коэффициентом корреляции R2 не менее 0,99. Образец калибровочной кривой представлен на рисунке 5.3.

205
Рис. 5.3 - Калибровочная кривая этоногестрела в плазме крови в диапазоне
концентраций 40-4000 пг/мл
Для оценки воспроизводимости результатов были получены 5
калибровочных кривых и проведен обратный расчет концентраций используемых стандартов по всем кривым и определены статистические данные.
Воспроизводимость результатов с учетом критерия приемлемости достигается во всем интервале концентраций.
Прецизионность и правильность внутри одной аналитической серии
Прецизионность и правильность метода внутри одной серии оценивались по результатам параллельных анализов образцов контроля качества QCA; QCB;
QCC; QCD и QCE в составе одной аналитической серии. Каждый образец определялся в 6 повторах. Расчет концентраций образцов контроля качества проводился по калибровочной кривой, полученной в составе той же аналитической серии. Данные по прецизионности и правильности определения этоногестрела в плазме крови человека внутри одной серии удовлетворяют критериям приемлемости.
Прецизионность и правильность между аналитическими сериями
Прецизионность и правильность метода между аналитическими сериями оценивались по результатам параллельных анализов образцов контроля качества
206
QCA; QCB; QCC; QCD и QCE, выполненных в трех аналитических сериях.
Каждый образец определялся в 6 повторах. Расчет концентраций образцов контроля качества проводился по калибровочной кривой, полученной в составе той же аналитической серии. Данные по прецизионности и правильности определения этоногестрела в плазме крови человека между аналитическими сериями удовлетворяют критериям приемлемости.
Степень извлечения
Степень извлечения этоногестрела из плазмы крови человека определяли путем сравнения площадей пиков образцов, экстрагированных из образцов контроля качества QCA (40 пг/мл), QCB (100 пг/мл), QCC (1000 пг/мл), QCD
(2000 пг/мл) и QCE (4000 пг/мл) с площадями пиков растворов матрицы для определения матричного эффекта, представляющих 100% извлечение. Растворы для определения матричного эффекта готовили следующим образом: брали по 500
мкл «холостой» плазмы, такой же, что и для приготовления QCA-QCE,
экстрагировали и растворяли в 240 мкл разбавителя и центрифугировали без добавления этоногестрела и внутреннего стандарта. Затем отбирали по 200 мкл надосадочной жидкости и добавляли по 42 мкл соответствующего сток-раствора стандарта (400 пг/мл для QCA, 1,00 нг/мл для QCB, 10,0 нг/мл для QCC, 20,0
нг/мл для QCD и 40,0 нг/мл для QCЕ) и по 8,3 мкл раствора внутреннего стандарта. Получали по 250 мкл растворов для определения матричного эффекта,
которые затем количественно переносили в виалы для автосемплера и анализировали вместе со свежеприготовленными образцами QCA-QCE.
Измерение для каждой концентрации стандартов проводилось в шести повторах.
Полученные значения удовлетворяют критериям приемлемости.
Стабильность
Для оценки стабильности этоногестрела в плазме крови человека использовали образцы контроля качества QCA (40 пг/мл), QCB (100 пг/мл), QCC
(1000 пг/мл), QCD (2000 пг/мл) и QCE (4000 пг/мл), которые хранили в автосэмплере при +4°С в течение 24 часов, в течение 36 часов при комнатной

207
температуре, а также образцы контроля качества после трёх циклов заморозки и последующей разморозки. Далее проводился анализ образцов вместе со свежеприготовленными образцами в составе одной аналитической серии.
Рассчитанные концентрации образцов после хранения сравнивались со средними значениями концентраций свежеприготовленных образцов контроля качества. На их основе рассчитывался модуль разницы по формуле:
Ср.концентрация образца при хранении – Ср.концентрация
свежепригот. Образца
100
Ср. концентрация свежепригот образца
Разница по полученным результатам не превышает 15%.
Кросс-перенос
Для оценки кросс-переноса были сделаны следующие инжекции в хроматографическую систему: пустая инжекция растворителя, затем 6 инжекций образца контроля качества QCE, затем снова пустая инжекция растворителя.
Перенос пробы во второй инжекции растворителя не должен превышать 20%
НПКО аналита и 5% внутреннего стандарта. Полученные результаты удовлетворяют критериям приемлемости.
Матричный эффект
Для оценки матричного эффекта получали хроматограммы образцов для определения матричного эффекта этоногестрела, соответствующей QCB (низкая концентрация не более троекратного НПКО), QCD (средняя концентрация) и QCE
(верхний предел количественного обнаружения) в 6 повторах. Матричный фактор аналита рассчитывали как отношение площади пика этоногестрела в образце с матрицей (плазмой крови здоровых добровольцев) к площади пика этоногестрела в чистом растворе вещества соответствующей концентрации. Аналогичную процедуру проводили для определения матричного фактора внутреннего стандарта. Далее для каждого образца получали соотношение матричного фактора этоногестрела к матричному фактору внутреннего стандарта. Коэффициент
208
вариации данного соотношения не должен превышать 15%. Полученные значения удовлетворяют критериям приемлемости.
Идентификация пика на хроматограмме
Идентификация пика этоногестрела происходила по его характеристичным ионам, родительскому и дочернему, (режим MRM).
Заключение по результатам валидации методики
Проведена валидация аналитической методики количественного определения этоногестрела в плазме крови человека методом высокоэффективной хроматографии с масс-спектрометрическим детектированием. Чувствительность метода составила 40 пг/мл. Воспроизводимость, прецизионность и правильность достигается во всем интервале концентраций. Степень извлечения из плазмы крови человека составила 76,7%, анализируемое вещество стабильно при хранении в автосэмплере при температуре +4°С в течение 24 часов после пробоподготовки, в течение 36 часов при комнатной температуре, а также после трех циклов заморозки и последующей разморозки.
Результаты исследования биоэквивалентности
Разработанная аналитическая методика применялась в рамках исследования биоэквивалентности препаратов дезогестрела. Дизайн исследования -
одноцентровое, открытое, рандомизированное, по перекрестной схеме,
включающее два периода с однократным приемом натощак двух препаратов дезогестрела (Диамилла и Чарозетта®). Исследование состояло из скрининга, 2
периодов исследования и периода «отмывки». Длительность скрининга – до 14
дней. Длительность каждого периода – до 96 ч. после приема препарата, период
«отмывки» - 28 дней. В процессе исследования было скринировано 40
добровольцев. Всего в результате скрининга было рандомизировано 36
добровольцев женского пола. Препараты Диамилла и Чарозетта® назначались согласно предварительно сгенерированной (до начала исследования)
рандомизационной схеме, все включенные в исследование добровольцы получали исследуемый препарат Диамилла в дозе 75 мкг (1 таблетка, покрытая пленочной
209
оболочкой) и препарат сравнения Чарозетта® в дозе 75 мкг (1 таблетка, покрытая пленочной оболочкой).
В течение каждого периода у добровольцев было отобрано по 16 образцов крови: до приема препарата и через 0.25, 0.5, 1.0, 1.5, 2.0, 2.5, 3.0, 4.0, 6.0, 8.0, 12.0, 24.0, 48.0, 72.0 и 96.0 часов после приема исследуемого лекарственного препарата или лекарственного препарата сравнения.
Вывод о биоэквивалентности сравниваемых препаратов был сделан с использованием подхода, основанного на оценке 90%-ных доверительных интервалов для отношений средних значений логарифмически преобразованных фармакокинетических параметров AUC0-t, AUC0-∞, Cmax и Cmax/AUC0-t
этоногестрела. Препараты считались биоэквивалентными, если границы оцененного 90% доверительного интервала для AUC0-t и AUC0-∞ находились в пределах 80.00-125.00%. Для показателей Cmax и Cmax/AUC0-t, характеризующихся большей вариабельностью, эти пределы составляли 75.00-133.00 %.
Этоногестрел быстро абсорбировался в кровь со средним значением Tmax = 1.5 ± 0.5 часа для препарата Диамилла и Tmax = 1.4 ± 0.4 часа для препарата Чарозетта® и элиминировался из крови со средним значением T1/2 = 27.5 ± 14.6
часа и 30.2 ± 13.0 часа для тестового и референтного препаратов соответственно.
Максимальная концентрация этоногестрела после приема препарата Диамилла составила Cmax = 1776.6 ± 867.0 пг/мл и Cmax = 1679.3 ± 635.3 пг/мл после приема препарата Чарозетта®. Значения AUC0-∞ и AUC0-t этоногестрела после приема препарата Диамилла составили 15278.8 ± 6250.7 пг*ч/мл и 12677.4 ± 6058.4
пг*ч/мл соответственно. Значения AUC0-∞ и AUC0-t этоногестрела после приема препарата Чарозетта® составили 15491.7 ± 6065.4 пг*ч/мл и 12796.3 ± 5869.8
пг*ч/мл соответственно. По указанным параметрам наблюдалась значительная межсубъектная вариабельность, характеризуемая соответствующим коэффициентом (CV).
Доверительный интервал для отношения логарифмически преобразованных значений AUC0-t этоногестрела составил 88.96-107.90% (среднее значение
210
98.02%). Для логарифмически преобразованных значений Сmax и Сmax/AUC0-t
этоногестрела доверительные интервалы отношений составили 93.15-111.07%
(среднее значение 101.71%) и 91.58-117.59% (среднее значение 103.77%)
соответственно. Полученные доверительные интервалы лежат в пределах,
установленных «Оценкой биоэквивалентности лекарственных средств
(Методические рекомендации, 2008)», что говорит о биоэквивалентности исследуемых препаратов.
5.2.2. Препараты, содержащие фиксированную комбинацию дезогестрел+этинилэстрадиол
Результаты валидации аналитической методики
При разработке условий масс-спектрометрического детектирования раствор каждого тестируемого соединения (этинилэстрадиол был подвегрнут дериватизации дансилхлоридом, анализировали дансил-этинилэстрадиол) в
мобильной фазе (3) с концентрацией 50 нг/мл анализировали путем прямого ввода в масс-спектрометр при помощи программы автоматической оптимизации в режиме регистрации положительных ионов.
При сканировании в режиме (Q1) определяли молекулярный ион исследуемого соединения, основные ионы-продукты фиксировали в режиме
Product Ion. Для количественного анализа была проведена оптимизация МС/МС метода в режиме MRM для достижения максимальной чувствительности. При анализе регистрировали по 2-3 MRM-перехода для каждого аналита, при количественной обработке хроматограмм использовали один из них, (наиболее интенсивный или наиболее селективный при введении вещества в матрице).
Масс-спектры 3-кетодезогестрела и этинилэстрадиола, ВС показаны на рисунках 5.4-5.5.
