
- •Обработка результатов измерений
- •1. Химическая термодинамика
- •Лабораторная работа № 1.1
- •Калориметрия
- •Краткое теоретическое введение
- •Определение действительного изменения температуры в калориметрических опытах
- •Обработка полученных данных
- •Выполнение работы
- •Определение тепловой постоянной калориметра
- •Определение содержания кристаллизационной воды в CuSo4xH2o
- •Теплоты растворения 1 г соли в 50 мл воды CuSo4 xH2o и ZnSo4 xH2o
- •Пример расчёта
- •Вопросы для самопроверки
- •Лабораторная работа № 1.2 криометрия Теоретические основы метода
- •Используемое оборудование
- •Выполнение работы
- •Вопросы для самопроверки
- •Лабораторная работа № 1.3 определение термодинамических параметров реакций методом эдс Теоретические основы метода
- •Используемое оборудование
- •Выполнение работы
- •Вопросы для самопроверки
- •2. Химическая кинетика формальная кинетика Краткое теоретическое введение
- •2A продукты,
- •Экспериментальные методы определения скорости и порядка реакции
- •Лабораторная работа № 2.1 определение константы скорости инверсии сахарозы Теоретические основы работы
- •Используемое оборудование
- •Выполнение работы
- •Вопросы для самопроверки
- •Лабораторная работа № 2.2 изучение кинетики окисления тиомочевины гексацианоферратом (III) в щелочном растворе Теоретические основы работы
- •Используемое оборудование
- •2. Технические данные
- •3. Узел светофильтров
- •1. Общие указания по эксплуатации
- •Измерение коэффициента пропускания или оптической плотности раствора
- •5. Выбор светофильтра
- •6. Выбор кюветы
- •7. Определение концентрации вещества в растворе
- •Последовательность выполнения работы
- •Вопросы для самопроверки
- •Лабораторная работа № 2.3 определение константы скорости иодирования ацетона Краткое теоретическое введение
- •Выполнение работы
- •Вопросы для самопроверки
- •Лабораторная работа № 2.4 определение константы скорости реакции омыления сложного эфира Теоретические основы работы
- •Выполнение работы
- •Задания
- •Вопросы для самопроверки
- •3.Электрохимия
- •Лабораторная работа № 3.1
- •Измерение электропроводности растворов электролитов
- •Теоретические основы метода
- •Используемое оборудование
- •Выполнение работы
- •3.1.1. Определение константы ячейки
- •3.1.2. Определение предельной электропроводности сильных электролитов
- •3.1.3. Определение предельной электропроводности слабых электролитов
- •3.1.4. Измерение константы диссоциации слабого электролита
- •Вопросы для самопроверки
- •Лабораторная работа № 3.2 числа переноса ионов. Кулонометрия Теоретические основы метода
- •Используемое оборудование
- •Выполнение работы
- •Вопросы для самопроверки
- •Лабораторная работа № 3.3 измерение электродвижущих сил и электродных потенциалов Теоретические основы метода
- •Используемое оборудование
- •Выполнение работы
- •3.3.1. Приготовление медного и цинкового электродов и определение их электродных потенциалов
- •3.3.2. Определение стандартного окислительно-восстановительного потенциала
- •3.3.3. Определение стандартных окислительно-восстановительных потенциалов методом потенциометрического титрования
- •Вопросы для самопроверки
- •Лабораторная работа № 3.4 водородный показатель. Буферные растворы Теоретические основы метода
- •Используемое оборудование
- •Выполнение работы
- •3.5.1. Калибровка стеклянного электрода и измерение рН раствора
- •3.5.2. Построение буферной диаграммы и определение буферной ёмкости
- •3.5.3. Потенциометрическое титрование слабого электролита
- •Вопросы для самопроверки
- •Лабораторная работа № 3.6 определение рН гидратообразования Теоретические основы метода
- •Используемое оборудование
- •Выполнение работы
- •Вопросы для самопроверки
- •Литература
Теплоты растворения 1 г соли в 50 мл воды CuSo4 xH2o и ZnSo4 xH2o
Кристаллогидрат |
Теплота растворения, Дж/г |
Кристаллогидрат |
Теплота растворения, Дж/г |
CuSO4 |
417 |
ZnSO4 |
478.7 |
CuSO4·H2O |
219 |
ZnSO4·H2O |
234.8 |
CuSO4·3H2O |
70,9 |
ZnSO4·6H2O |
–16.0 |
CuSO4·5H2O |
–46,9 |
CuSO4·7H2O |
–65.6 |
Пример расчёта
Теплота растворения 3,6 г смеси гидратов CuSO4 равна 306 Дж. Вычислить процентное содержание воды в образце.
Решение.
1.
Теплота растворения одного грамма смеси
![]()
По данным о теплотах растворения различных форм гидратов (см. выше) можно предположить, что здесь имеется смесь х г CuSO4·3H2O и (3,6 – х) г CuSO4·H2O.
2. Определить количество той и другой формы гидратов, содержащихся в 3,6 г смеси, решая уравнение
![]()
где Qx и Qy – удельные теплоты растворения CuSO4·3H2O и CuSO4·H2O соответственно, Дж/г, после подстановки значений которых в последнее уравнение оно имеет вид
![]()
Решение уравнения приводит к значениям: x = 3,26 г CuSO4·3H2O, y = 0,34 г CuSO4·H2O
3.
Определить число молей воды
![]() в навеске; её массу и процентное содержание
в навеске; её массу и процентное содержание
![]() ,
,
где Мх и Му – молярные массы CuSO4·3H2O и CuSO4·H2O, соответственно; множители у частных равны числу молекул воды в кристаллогидрате.
Содержание
воды
![]()
Вопросы для самопроверки
1. Первый закон термодинамики, его формулировка, аналитическое выражение.
2. Дайте определения теплоты, работы, внутренней энергии, энтальпии, теплового эффекта реакции.
3. Сформулируйте закон Гесса и его следствия. Что называется стандартными теплотами образования и сгорания?
4. Виды калориметров.
5. Методы нахождения постоянной калориметрической установки.
6. Методы измерения температуры.
7. Устройство термометра Бекмана.
8. Дифференциальная и интегральная теплота растворения, теплота нейтрализации и теплота гидратообразования.
9. Объясните зависимость температуры от времени в ходе калориметрического измерения в случае экзотермического процесса в калориметре.
Задачи
1. При сгорании нафталина в калориметрической бомбе при 298 К с образованием воды и углекислого газа U= –5157,72106 Дж/кмоль. Вычислить тепловой эффект сгорания нафталина при постоянном давлении, если водяной пар, образующийся при сгорании нафталина:
а) конденсируется, б) не конденсируется.
2. Вычислите интегральную теплоту растворения при 298 К одного моля хлорида калия в воде с образованием насыщенного раствора, если теплота разбавления 10 мл насыщенного раствора в 100 мл воды –87,86 Дж. Теплоту растворения для полученного раствора взять из справочника.
3. При нейтрализации 14,88 г 16,7 %-ной соляной кислоты избытком щёлочи температура калориметра повысилась на 1,86 С. Суммарная теплоёмкость калориметрической системы 2218 Дж/К. Теплота разведения кислоты Hразв = –314 Дж. Определить теплоту нейтрализации 1 г и 1 моля кислоты.
Лабораторная работа № 1.2 криометрия Теоретические основы метода
Зависимость
химического потенциала от температуры
описывается уравнением
![]() .
Мольная энтропия Sm
– величина положительная, поэтому с
ростом температуры химический потенциал
всегда уменьшается, причём наиболее
сильно для газовой фазы. для твёрдой
фазы темпы падения наименьшие. Для
жидкости это изменение промежуточное
(рис.1.2).
.
Мольная энтропия Sm
– величина положительная, поэтому с
ростом температуры химический потенциал
всегда уменьшается, причём наиболее
сильно для газовой фазы. для твёрдой
фазы темпы падения наименьшие. Для
жидкости это изменение промежуточное
(рис.1.2).
П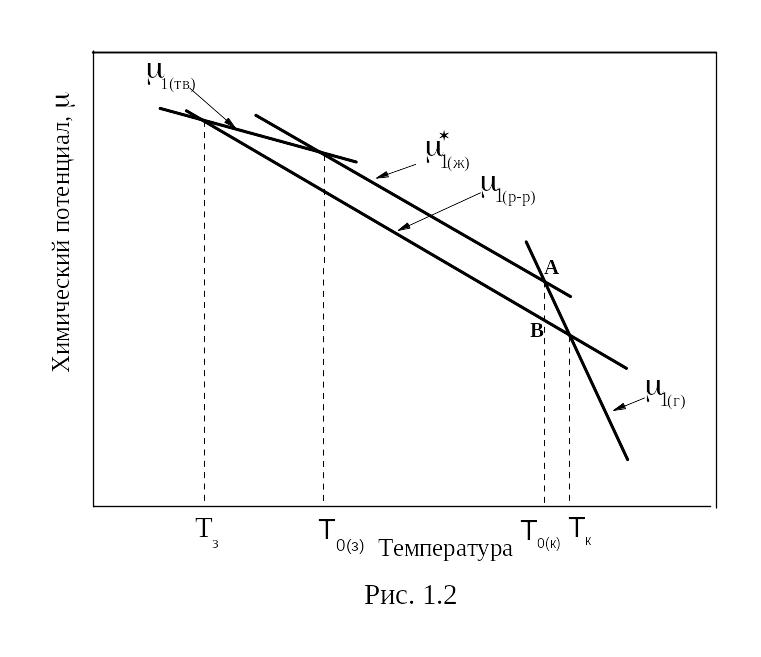 ри
равновесии между фазами
и
химические потенциалы i
любого компонента в каждой фазе
должны быть одинаковыми. Условие
ри
равновесии между фазами
и
химические потенциалы i
любого компонента в каждой фазе
должны быть одинаковыми. Условие
![]() выполняется при температуре фазового
перехода. В случае однокомпонентной
системы это будут температура
затвердевания1
(или плавления) Т0(з)
и температура кипения Т0(к)
чистого вещества.
выполняется при температуре фазового
перехода. В случае однокомпонентной
системы это будут температура
затвердевания1
(или плавления) Т0(з)
и температура кипения Т0(к)
чистого вещества.
Если в жидкости (первый компонент) растворить второй компонент (мольная доля N2) , то химический потенциал растворителя уменьшится и при мольной доле последнего N1 станет равным
![]() ,
,
т.е.
прямая для химического потенциала
сместится на рисунке вниз на величину
![]() ,
если раствор разбавленный. Если
растворённое вещество нелетучее и при
охлаждении раствора оно не кристаллизуется,
а начинают образовываться лишь кристаллы
растворителя, то положение графических
зависимостей
,
если раствор разбавленный. Если
растворённое вещество нелетучее и при
охлаждении раствора оно не кристаллизуется,
а начинают образовываться лишь кристаллы
растворителя, то положение графических
зависимостей
![]() для пара и твёрдой фазы не изменится.
Прямая для химического потенциала
растворителя в жидкой фазе пересечёт
прямые для твёрдой и газовой фаз при
других значениях температур. Раствор
начнёт кипеть при более высокой
температуре Т(к),
а замерзать при более низкой Т(з).
для пара и твёрдой фазы не изменится.
Прямая для химического потенциала
растворителя в жидкой фазе пересечёт
прямые для твёрдой и газовой фаз при
других значениях температур. Раствор
начнёт кипеть при более высокой
температуре Т(к),
а замерзать при более низкой Т(з).
Из геометрических соотношений следует, что для раствора повышение температуры кипения Тк = Тк – Т0(к) и понижение температуры замерзания Тз = Тз –Т0(з) пропорциональны мольной доле растворённого вещества. Поскольку в разбавленных растворах мольная доля последнего пропорциональна моляльной концентрации, то выполняются соотношения
![]() ,
(1.4)
,
(1.4)
![]() ,
(1.5)
,
(1.5)
в которых коэффициенты Е и К соответственно эбуллиоскопическая и криоскопическая константы растворителя, зависящие только от его природы. Эти уравнения можно получить также, исходя из закона Рауля для давления р1 пара растворителя над жидким раствором
![]() ,
,
где
![]() –
давление пара чистого растворителя при
данной температуре.
–
давление пара чистого растворителя при
данной температуре.
Применяя уравнение Клаузиуса–Клапейрона к межфазным равновесиям, можно показать, что эбуллиоскопическая и криоскопическая константы равны соответственно
![]() ,
(1.6)
,
(1.6)
![]() ,
(1.7)
,
(1.7)
где lисп и lпл – удельные теплоты испарения и плавления растворителя, соответственно. Криоскопические константы и температуры плавления некоторых растворителей приведены в таблице.
-
Растворитель
Тпл, К
К
Вода
273,2
1,86
Бензол
278,7
5,07
Нитробензол
278,9
6,9
Фенол
313,2
7,27
Камфара
451,2
40,0
Рассмотренные явления можно использовать в лабораторной практике для определения молярной массы М2 растворённого вещества‑неэлектролита в растворителях с известными величинами Е и К. Наиболее просто применять криоскопический метод, измеряя понижение температуры начала замерзания раствора, содержащего массу растворителя g1 и растворённого вещества g2. Легко получить уравнение
![]() .
(1.8)
.
(1.8)
Сначала с помощью термометра Бекмана определяется температура замерзания растворителя Т0(з) в процессе его охлаждения (она остаётся постоянной, пока не закристаллизуется весь растворитель). Затем определяется температура начала замерзания раствора Т(з), когда начинается кристаллизация растворителя. При кристаллизации растворителя выделяется тепло, поэтому скорость падения температуры замедляется, т.е. на кривой охлаждения появляется излом, соответствующий температуре начала кристаллизации. В процессе кристаллизации растворителя концентрация раствора возрастает и понижается температура замерзания.
