
- •Билет 1 Взаимодействие тел. Первый закон Ньютона. Инерциальные системы отсчета.
- •Билет 2 Сила. Масса. Второй закон Ньютона. Взаимодействие тел. Сила. Второй закон Ньютона. Принцип относительности в механике.
- •Билет 3 Закон всемирного тяготения. Сила тяжести. Вес тела. Невесомость.
- •Билет 4 Третий закон Ньютона. Принцип относительности Галилея. (Третий закон Ньютона. Значение законов Ньютона.)
- •Билет 5 Импульс. Закон сохранения импульса.
- •Билет 6 Упругие деформации. Закон Гука. (Сила упругости. Закон Гука.)
- •Билет 7 Взаимодействие точечных зарядов. Закон Кулона.
- •Билет 8 Кинетическая энергия. Потенциальная энергия. Закон сохранения механической энергии. Потенциальная и кинетическая энергия. Закон сохранения энергии в механике.
- •Билет 9 Действие магнитного поля на проводник с током. Закон Ампера.
- •Билет10
- •Билет 11 Колебательный контур. Свободные электромагнитные колебания а контуре. Формула Томпсона.
- •Билет 12 Опыт резерфорда. Ядерная модель атома.
- •Билет 13 Магнитный поток. Явление электромагнитной индукции.
- •Билет 14 Квантовые постулаты Бора. Излучение и поглощение света атомами.
- •II постулат Бора (правило частот):
- •Ill постулат Бора (правило квантования орбит): стационарные (разрешенные) электронные орбиты в атоме находятся из условия
- •Билет 15
- •Билет 16
- •Билет 16 Идеальный газ. Изотермический, изобарный и изохорный процессы в идеальном газе. Идеальный газ. Газовые законы. Закон Авогадро. Закон Дальтона.
- •Билет 18
- •Билет 19
- •Билет 20
- •Билет 21
- •Билет 22 Радиоактивность. Закон радиоактивного распада.
- •Билет 23
- •Билет 24
- •Билет 25
- •Билет 26 Электромагнитные волны. Свойства электромагнитных волн. Скорость распространения электромагнитной волны.
- •Билет 27
Билет 16
Идеальный газ. Изотермический, изобарный, изохорный процессы в идеальном газе.
Используя зависимость давления от концентрации и температуры, можно найти связь между макроскопическими параметрами газа – объемом, давлением и температурой.
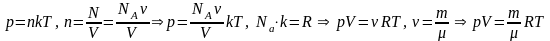 .
.
Это уравнение называют уравнением состояния идеального газа (уравнение Менделеева-Клапейрона).
Изотермическим процессом
называется процесс, протекающий при
постоянной температуре. Из уравнения
состояния идеального газа следует, что
при постоянной температуре, массе и
составе газа произведение давления на
объем должно оставаться постоянным.
Графиком изотермы (кривой изотермического
процесса) является гипербола. Уравнение
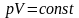 называют законом Бойля-Мариотта.
называют законом Бойля-Мариотта.
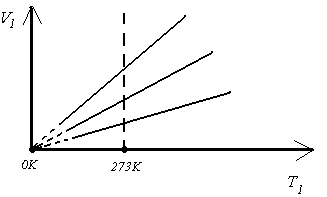
Изохорным процессом называется
процесс, протекающий при неизменном
объеме, массе и составе газа. При этих
условиях
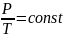 (или
(или
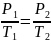 ).
Это уравнение называется законом Шарля.
График уравнения изохорного процесса
называется изохорой, и представляет из
себя прямую, проходящую через начало
координат.
).
Это уравнение называется законом Шарля.
График уравнения изохорного процесса
называется изохорой, и представляет из
себя прямую, проходящую через начало
координат.
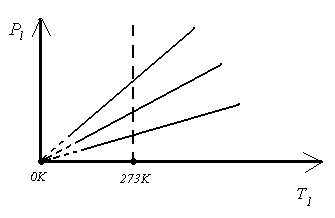
Изобарным процессом называется
процесс, протекающий при неизменном
давлении, массе и составе газа. Аналогичным
образом как и для изохорного процесса
можно получить уравнение для изобарного
процесса
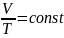 (или
(или
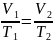 ).
Уравнение, описывающее этот процесс,
называется законом Гей-Люссака. График
уравнения изобарного процесса называется
изобарой, и представляет из себя прямую,
проходящую через начало координат.
).
Уравнение, описывающее этот процесс,
называется законом Гей-Люссака. График
уравнения изобарного процесса называется
изобарой, и представляет из себя прямую,
проходящую через начало координат.
Билет 16 Идеальный газ. Изотермический, изобарный и изохорный процессы в идеальном газе. Идеальный газ. Газовые законы. Закон Авогадро. Закон Дальтона.
При использовании температурной шкалы Кельвина Графики законов Шарля и Гей-Люссака принимают вид пропорциональности, математическое выражение законов тоже изменяется.
Закон Гей-Люссака:
если объем V данного количества вещества газа ν не меняется, то отношение его давления р к температуре Т постоянно:
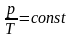 .
.
Закон Шарля:
если давление р данного количества газа ν не меняется, то отношение его объема V к температуре Т постоянно:
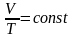 .
.
Экспериментальные газовые законы дают возможность получить уравнение состояния газа, то есть функциональную зависимость между параметрами (р, V, Т), характеризующими состояние системы:
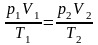 .
.
Это уравнение состояния для фиксированного количества газа или уравнение Клапейрона. Подчеркнем, что оно описывает только равновесные состояния газа.
Таким образом, при любом изменении состояния данного количества газа произведение давления на объем, деленное на абсолютную температуру, остается постоянным.
Газ может находиться в разных состояниях, однако в физике четко фиксированы так называемые нормальные условия: р0=1,00 атм=1,01*105 Па=760 мм рт.ст. и Т0=273 К (t=00С).
Рассмотрим
один моль газа при нормальных условиях.
В соответствии с законом Авогадро один
моль любого газа занимает при нормальных
условиях один и тот же объем V0=22,4
л. Следовательно, одного моля любого
газа соотношение
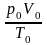 имеет одно и то же значение, обозначаемое
R
и называемое универсальной
газовой постоянной:
имеет одно и то же значение, обозначаемое
R
и называемое универсальной
газовой постоянной:
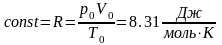 .
.
С помощью универсальной газовой постоянной уравнение Клапейрона для одного моля любого газа можно записать в виде рV=RT.
Д. И. Менделеев обобщил это уравнение на произвольное количество газа, так как при одних и тех же значениях температуры и давления ν молей газа занимают в ν раз больший объем, то один моль:
рV= ν RT.
Полученное равенство называется уравнением Клапейрона-Менделеева. Оно представляет собой уравнение состояния для произвольного количества газа.
Уравнение состояния полученное на основе экспериментально установленных газовых законов. Условия применимости его для различных газов различны. Физическая модель газа, для которой уравнение состояния выполняется точно, называется идеальным газом. Вследствие этого уравнение состояния Клапейрона-Менделеева правильно называть уравнением состояния идеального газа.
Из формулы рV= ν RT следует, что если различные газы содержат одно и то же число молей и имеют одинаковые давления и температуру, то они будут занимать один и тот же объем (закон Авогадро):
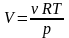 .
.
Отсюда следует, что равные объемы газа при одинаковых давлении и температуре содержат равное число молекул. Таким образом, закон Авогадро эквивалентен выражению о том, что R постоянна для всех газов.
В случае, когда два или более газов занимают один и тот же объем (т. е. в сосуде находится смесь газов), справедлив закон Дальтона: давление смеси химически не взаимодействующих газов равно сумме парциальных давлений отдельных газов. Парциальное давление газа определяется как давление этого газа. если бы он один занимал весь объем. Если в рассматриваемом объеме содержится n газов, то
р=р1+р2+…+рn.
Чтобы упростить изучение свойств газов, реальные газы заменяют их упрощенной моделью, которую в молекулярно-кинетической теории (МКТ) называют идеальным газом. Считают, что в идеальном газе:
а) отсутствуют силы межмолекулярного взаимодействия, это значит, что молекулы не притягиваются и не отталкиваются одна от другой;
б) взаимодействие молекул осуществляется только при их соударении и является упругим;
в) молекулы газа не имеют объема и, значит, являются материальными точками. Ближе всего эта модель газа соответствует свойствам разреженных одноатомных газов.
Экспериментальное задание: «Проверка условия равновесия неподвижного блока».
Оборудование: блок, штатив с лапкой и муфтой, груз на нити (m> 102 г), динамометр.
Порядок выполнения задания.
Определить динамометром вес Р груза на нити.
Закрепить блок в лапке штатива с лапкой и муфтой, груз на нити (m>102 г.), динамометр.
Перебросить через блок нить, один конец которой связан с грузом, а другой — с динамометром.
Удерживая динамометром систему в равновесии, определить силу упругости
Fупр пружины динамометра и показать, что Р = Fупр .
