
- •Лекция 1
- •1.2. Признаки живой материи
- •1.3. Состав живых организмов
- •1.4. Молекулярные аспекты организации живой материи
- •1.4.1. Малые органические молекулы (мономеры)
- •1.4.2. Макромолекулы или биополимеры
- •1.5. Α-Аминокислоты
- •1.5.1. Изомерия аминокислот
- •1.5.1.1. Изомерия положения аминогруппы
- •1.5.1.2. Оптическая изомерия аминокислот
- •L-аминокислота d-аминокислота
- •1.5.1.3. Классификация α-аминокислот
- •1.5.2. Физико-химические свойства аминокислот
- •1.5.2.1. Кислотно-основное равновесие в растворе α-аминокислот
- •1.5.3. Химические свойства аминокислот
- •1.5.4. Пептидная связь. Структура пептидной связи
- •Рис 1.10. Пептидная связь
- •1.5. Пептиды
- •1.5.1. Конформация полипептидной цепи
- •1.5.2. Номенклатура пептидов
- •1.5.3. Пептиды небелковой природы и их биологическая роль
1.5. Α-Аминокислоты
Аминокислоты представляют собой основные «строительные» единицы всех белков.
Большинство аминокислот, участвующих в биохимических превращениях, являются карбоновыми кислотами, содержащими карбоксильную и аминную группы, которые находятся у одного и того же углеродного атома. В организме человека найдено 70 аминокислот. Двадцать из них входят в состав белков. Это так называемые протеиногенные аминокислоты.
Общая формула α-аминокислот представлена на Рис. 1.2:
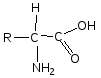
Рис. 1.2. Общая формула аминокислот
Аминокислоты отличаются друг от друга структурой боковых групп, которые в приведенной выше формуле, обозначены через R. Эти группы имеют различную химическую структуру.
1.5.1. Изомерия аминокислот
1.5.1.1. Изомерия положения аминогруппы
Для аминокислот, прежде всего, характерна изомерия положения аминогруппы.
В биологии и химии до сих пор широко распространены названия аминокислот, в которых взаимное расположение аминогруппы по отношению к карбоксильной группе обозначается греческими буквами.
Так, если аминогруппа и карбоксил находятся у одного и того же атома углерода, то такая аминокислота называется α-аминокислотой.
В β-аминокислотах функциональные группа разделены двумя атомами углерода, в γ- - тремя и т.д.
Белки образованы только из α-аминокислот, но в организме встречаются и другие аминокислоты. Например γ-аминомасляная кислота (ГАМК):
CH2(NH2)-CH2-CH2-COOH
Рис. 1.3. γ-аминомасляная кислота
ГАМК играет важную роль в механизме передачи нервного импульса.
1.5.1.2. Оптическая изомерия аминокислот
α-Аминокислоты характеризуются наличием оптической активности, т. е. они могут вращать плоскость поляризованного света вправо или влево. Это свойство природных аминокислот обусловлено наличием ассиметрического атома углерода или иначе: хирального центра (хиральность от греч. Cheir – рука), т. е. атома углерода с четырьмя различными заместителями.
Все α-аминокислоты, имеющие ассиметричесийй атом углерода, образуют оптические (зеркальные, т. е. которые нельзя совместить) изомеры.
Оптические изомеры принято обозначать латинскими буквами. L- (от лат. Louvus – левый) и D- (от лат dexter – правый).
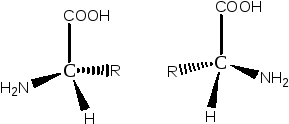
L-аминокислота d-аминокислота
Рис. 1.4. L и D оптические изомеры α-аминокислот
Считают, что кислота относится к L-ряду, если в написании фишеровской проекции аминогруппа расположена слева (рис. 1.4).
Все природные аминокислоты, входящие в состав белков, относятся именно к L-ряду.
Вся белковая жизнь на земле – «левая». Есть и «исключения», но они только подтверждают правило. Оказывается, D-аминокислоты крайне редко, но все же встречаются в природе.
Например, они присутствуют в оболочке бактерии, которая является возбудителем сибирской язвы. Именно поэтому оболочка бактерии не разрушается ферментами, разрывающими белковые цепи L-аминокислот.
Из 20 α-аминокислот, входящих в состав белков:
1) 17 обладают одним ассиметричным атомом углерода;
2) одна не содержит ассиметричного атома углерода: глицин;
3) две имеют два ассиметричных атома углерода: изолейцин и треонин.
