
- •Лекция 1
- •1.2. Признаки живой материи
- •1.3. Состав живых организмов
- •1.4. Молекулярные аспекты организации живой материи
- •1.4.1. Малые органические молекулы (мономеры)
- •1.4.2. Макромолекулы или биополимеры
- •1.5. Α-Аминокислоты
- •1.5.1. Изомерия аминокислот
- •1.5.1.1. Изомерия положения аминогруппы
- •1.5.1.2. Оптическая изомерия аминокислот
- •L-аминокислота d-аминокислота
- •1.5.1.3. Классификация α-аминокислот
- •1.5.2. Физико-химические свойства аминокислот
- •1.5.2.1. Кислотно-основное равновесие в растворе α-аминокислот
- •1.5.3. Химические свойства аминокислот
- •1.5.4. Пептидная связь. Структура пептидной связи
- •Рис 1.10. Пептидная связь
- •1.5. Пептиды
- •1.5.1. Конформация полипептидной цепи
- •1.5.2. Номенклатура пептидов
- •1.5.3. Пептиды небелковой природы и их биологическая роль
1.5. Пептиды
Поскольку дипептид также содержит свободную карбоксильную и аминогруппы, то к нему с помощью новых пептидных связей могут присоединяться новые аминокислотные мономеры; в результате образуется олиго- или полипептид (Рис. 1.15).
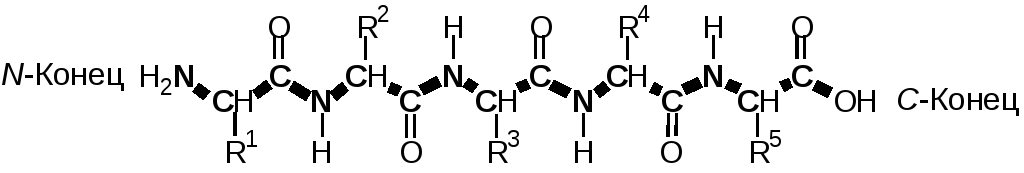
Рис. 1.15 Пентапептид (пептид из пяти аминокислотных остатков). R1, R2 и т.д. — боковые радикалы аминокислот. Пептидный остов молекулы выделен утолщенными линиями.
Пептидная цепь имеет одно направление и два разных конца — N-конец, несущий свободную аминогруппу первой аминокислоты, и С-конец, несущий свободную карбоксильную группу последней аминокислоты. В пептидах аминокислотные остатки связаны в цепочку последовательно. Цепочку амидных групп и α-углеродных атомов называют пептидным остовом молекулы (выделен на Рис. 1.15).
1.5.1. Конформация полипептидной цепи
Таким образом, полипептидная цепь составлена из ряда жёстких плоскостей, чередующихся с группировками CHR (Рис. 1.16):
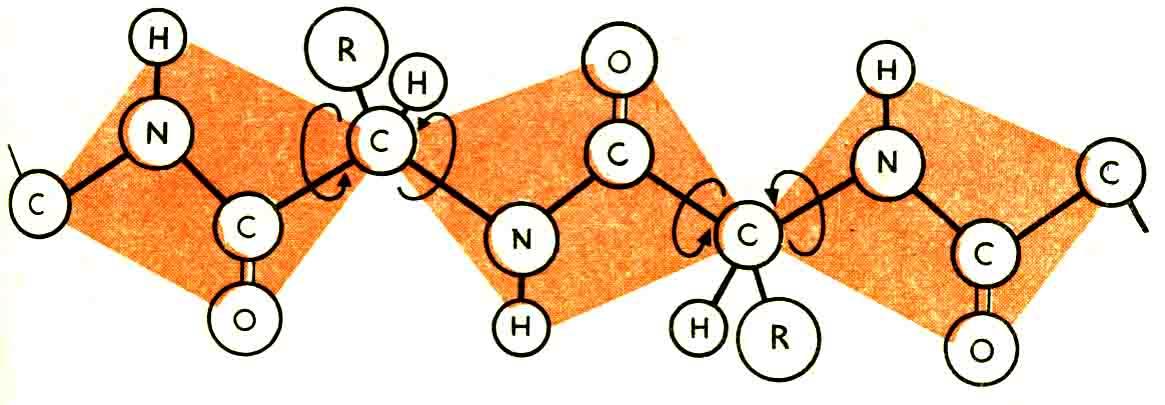
Рис 1.16 Полипетидная цепь состоит из ряда жёстких плоскостей, чередующихся с группировками CHR
Атомы углерода и азота в цепи располагаются приблизительно в одной плоскости, в то время как атомы водорода и радикалы группировок CHR направлены к этой плоскости под углом 109º28´.
Пептидный остов молекулы полипептида окружен разнообразными по химической природе боковыми радикалами. Характер радикалов оказывает большое влияние на пространственную конфигурацию полипептидной цепи, определяет круг химических реакций, свойственных боковым цепям.
Каждый аминокислотный остаток, за исключением концевых, принимает участие в образовании двух пептидных связей (с предыдущим и последующим фрагментами). Поскольку вращение вокруг связи C—N затруднено, повороты возможны только вокруг связей N--Cα и Cα--C ). Такие повороты измеряются двугранными углами φ и ψ. Угол φ характеризует поворот вокруг связи N---Cα, а следовательно, положение предшествующей пептидной связи; угол ψ характеризует поворот вокруг связи Сα—С, т. е. положение последующей связи.
Форма пептидной молекулы определяется (белковой) этими углами между плоскостями, в которой лежат атомы пептидной связи, разделёнными друг от друга –CH-R-группами, что ведёт к возникновению определённых вторичных структур.
1.5.2. Номенклатура пептидов
Поскольку аминокислоты в составе пептидов находятся в форме ацилов (кислотных остатков), то в названии пептидов им придают характерное для ацилов окончание «ил». Название концевой аминокислоты со свободной карбоксильной группой оставляют без изменений (Рис. 1.17).
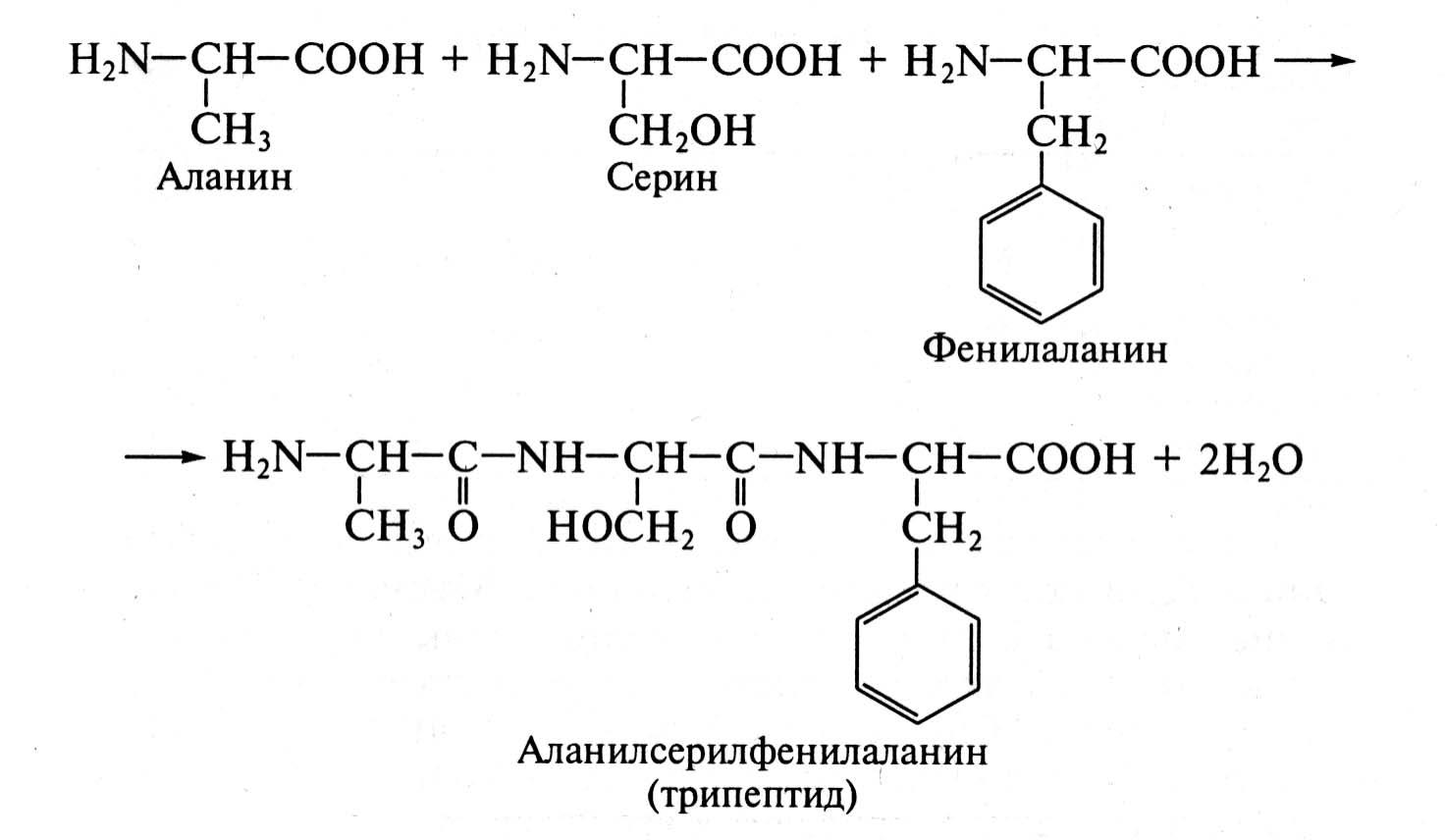
Рис. 1.17 Трипептид аланилсерилфенилаланин
Название пептида начинают с аминокислоты, сохранившей свободную α-аминогруппу. Для того чтобы назвать конкретный пептид, достаточно перечислить (начиная с N-конца) последовательность входящих в его состав аминокислотных остатков.
1.5.3. Пептиды небелковой природы и их биологическая роль
Почти все клетки содержат свободные пептиды. В настоящее время из природных источников выделено более сотни индивидуальных пептидов, детально изучено их строение, свойства и биологическая активность.
В качестве примера приведём строении глутатиона – одного из наиболее широко распространённых внутриклеточных пептидов так называемого полимодального действия, принимающего участие в переносе аминокислот через мембрану, в окислительно-восстановительных и других процессах в клетке (Рис. 1.18).

Рис. 1.18 Пептид небелковой природы глутатион или γ-глутамилцистеинилглицин
Некоторые природные пептиды-антибиотики (синтезируются микроорганизмам) имеют циклическое строение: грамицидин S, бацитрицин A, циклоспорин А (Рис. 1.19). В их состав могут входить непротоиногенные аминокислоты и D-изомеры.

Рис. 1.19. Циклоспорин А – пептид-антибитик, имеющий циклическое строение
Циклоспорин A (cyclosporin A) - лекарственное вещество, подавляющее функции иммунной системы; назначается для предотвращения и лечения отторжения пересаженных органов или костного мозга.
Роль пептидов в процессе жизнедеятельности организмов многообразна. Многие из них служат гормонами (инсулин, глюкагон, гормон роста и др.). Некоторые являются сильнейшими ядами (яды змей, пауков, насекомых, высших грибов) антибиотиками, регуляторами психической деятельности.
Значительное число природных пептидов удалось синтезировать. Искусственным путём получены сотни аналогов природных пептидов, ряд которых обладает более сильным биологическим действием.
