
- •11) Изопроцессы, адиобатический
- •12) Круговой процесс (цикл). Обратимые и необратимые процессы
- •13) Энтропия, ее статистическое толкование и связь с термодинамической вероятностью
- •14) Второе начало термодинамики
- •15). Силы и потенциальная энергия межмолекулярного взаимодействия
- •16). Уравнение Ван-дер-Ваальса
- •17). Изотермы Ван-дер-Ваальса и их анализ
- •18). Внутренняя энергия реального газа
- •19). Сжижение газов
- •20) Свойства жидкостей. Поверхностное натяжение
- •21) Давление под искривленной поверхностью жидкости
- •22). Твердые тела. Моно- и поликристаллы
- •23). Типы кристаллических твердых тел
- •2. Физический признак кристаллов.
- •24. Теплоемкость твердых тел
- •25). Испарение, сублимация, плавление и кристаллизация. Аморфные тела
- •27). Диаграмма состояния. Тройная точка
- •10) Теплоемкость
- •9). Первое начало термодинамики
- •8). Число степеней свободы молекулы. Закон равномерного распределения энергии по степеням свободы молекул
- •5) Среднее число столкновений и средняя длина свободного пробега молекул
- •Опытное обоснование молекулярно-кинетической теории
10) Теплоемкость
Удельная теплоемкость вещества величина, равная количеству теплоты, необходимому для нагревания 1 кг вещества на 1 К:
![]()
(Дж/(кг•К)).Молярная теплоемкость— величина, равная количеству теплоты, необходимому для нагревания 1 моля вещества на 1 К:
![]()
где v = m/M — количество вещества, выражающее число молей.Различают теплоемкости при постоянном объеме и постоянном давлении, если в процессе нагревания вещества его объем или давление поддерживается постоянным.
Если газ нагревается при постоянном объеме,:
![]()
т. е. молярная теплоемкость газа при постоянном объеме
![]() Если
газ нагревается при постоянном давлении,
то выражение (53.3) можно записать в
виде уравнением
Майера
Если
газ нагревается при постоянном давлении,
то выражение (53.3) можно записать в
виде уравнением
Майера
![]()
Молекула двухатомного газа обладает тремя поступательными, двумя вращательными и одной колебательной степенями свободы.
9). Первое начало термодинамики
Q=U+A. (51.1)
Уравнение (51.1) выражает первое начало термодинамики: теплота, сообщаемая системе, расходуется на изменение ее внутренней энергии и на совершение ею работы против внешних сил.
Выражение (51.1) в дифференциальной форме будет иметь вид
dQ=dU+dA, или в более корректной форме
Q=dU+A, (51.2)
т. е. вечный двигатель первого рода —
периодически действующий двигатель, который совершал бы большую работу, чем сообщенная ему извне энергия,— невозможен (одна из формулировок первого начала термодинамики).
Работа газа при изменении его объема
Если газ, расширяясь, передвигает поршень на бесконечно малое расстояние dl, то производит над ним работу
A=Fdl=pSdl=pdV,
где S — площадь поршня, Sdl=dV— изменение объема системы. Таким образом,
A=pdV. (52.1)
Полную работу A, совершаемую газом при изменении его объема от V1 до V2, найдем интегрированием формулы (52.1):
![]()
8). Число степеней свободы молекулы. Закон равномерного распределения энергии по степеням свободы молекул
Важной характеристикой термодинамической системы является ее внутренняя энергия U — энергия хаотического (теплового) движения микрочастиц системы (молекул, атомов, электронов, ядер и т. д.) и энергия взаимодействия этих частиц. Из этого определения следует, что к внутренней энергии не относятся кинетическая энергия движения системы как целого и потенциальная энергия системы во внешних полях.
при переходе системы из одного состояния в другое изменение внутренней энергии определяется только разностью значений внутренней энергии этих состояний и не зависит от пути перехода. В ряде задач молекулу одноатомного газа (рис. 77, а) рассматривают как материальную точку, которой приписывают три
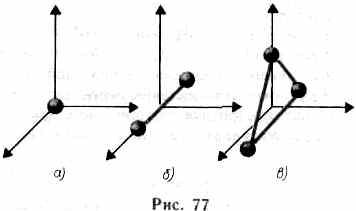
степени свободы поступательного движения. При этом энергию вращательного движения можно не учитывать (r—>0, J= mr20, Tвр =J2/20).
В классической механике молекула двухатомного газа в первом приближении рассматривается как совокупность двух материальных точек, жестко связанных недеформируемой связью (рис. 77,б). Эта система кроме трех степеней свободы поступательного движения имеет еще две степени свободы вращательного движения. Вращение вокруг третьей оси (оси, проходящей через оба атома) лишено смысла. Таким образом, двухатомный газ обладает пятью степенями свободы (i=5). Трехатомная (рис. 77,0) Независимо от общего числа степеней свободы молекул три степени свободы всегда поступательные.:
![]()
закон Больцмана о равномерном распределении энергии по степеням свободы молекул: для статистической системы, находящейся в состоянии термодинамического равновесия, на каждую поступательную и вращательную степени свободы приходится в среднем кинетическая энергия, равная kT/2, а на каждую колебательную степень свободы — в среднем энергия, равная kT. Таким образом, средняя энергия молекулы
![]()
В классической теории рассматривают молекулы с жесткой связью между атомами; для них i совпадает с числом степеней свободы молекулы.
Так как в идеальном газе взаимная потенциальная энергия молекул равна нулю (молекулы между собой не взаимодействуют), то внутренняя энергия, отнесенная к одному молю газа,:
![]()
Внутренняя энергия для произвольной массы т газа
![]()
где М — молярная масса, v — количество вещества.
7) Термодинамика - наука о закономерностях превращения энергии.
В термодинамике широко используется понятие термодинамической системы.
термодинамической системой называется совокупность материальных тел, взаимодействующих, как между собой, так и с окружающей средой. Все тела находящиеся за пределами границ рассматриваемой системы называются окружающей средой.Первый закон термодинамики является обобщением закона сохранения и превращения энергии для термодинамической системы. Изменение ΔU внутренней энергии неизолированной термодинамической системы равно разности между количеством теплоты Q, переданной системе, и работой A, совершенной системой над внешними телами.
ΔU = Q – A.
Q = ΔU + A.
Количество теплоты, полученное системой, идет на изменение ее внутренней энергии и совершение работы над внешними телами.
Применим первый закон термодинамики к изопроцессам в газах.
В изохорном процессе (V = const) газ работы не совершает, A = 0. Следовательно, Q = ΔU = U (T2) – U (T1).
В изобарном процессе (p = const) работа, совершаемая газом, выражается соотношением A = p (V2 – V1) = p ΔV.
Первый закон термодинамики для изобарного процесса дает: Q = U (T2) – U (T1) + p (V2 – V1) = ΔU + p ΔV.
|
Первый закон термодинамики для изотермического процесса выражается соотношением Q = A.
|
Количество теплоты Q, полученной газом в процессе изотермического расширения, превращается в работу над внешними телами. При изотермическом сжатии работа внешних сил, произведенная над газом, превращается в тепло, которое передается окружающим телам.
Наряду с изохорным, изобарным и изотермическим процессами в термодинамике часто рассматриваются процессы, протекающие в отсутствие теплообмена с окружающими телами. Сосуды с теплонепроницаемыми стенками называются адиабатическими оболочками, а процессы расширения или сжатия газа в таких сосудах называютсяадиабатическими.
В адиабатическом процессе Q = 0; поэтому первый закон термодинамики принимает вид A = –ΔU,
|
6) Явление переноса. Получение вакуума. в термодинамических неравновесных системах возникают особые необратимые процессы, называемые явлениями переноса, в результате которых происходит пространственный перенос энергии, массы, импульса.
1)Теплопроводность.
Если в одной области газа средняя кинетическая энергия молекул больше, чем в другой, то с течением времени вследствие постоянных столкновений молекул друг с другом происходит процесс выравниваний средних кинетических энергий молекул, т.е., иными словами, выравнивание температур.
Перенос энергии в форме теплоты подчиняется закону Фурье:
![]()
Коэффициент теплопроводности:
![]()
2)Диффузия.
Явление диффузии заключается в том, что происходит самопроизвольное проникновение и перемешивание частиц двух соприкасающихся газов, жидкостей и даже твердых тел. Диффузия сводится к обмену масс частиц у этих тел, возникает и продолжается пока существует градиент плотности. Явление диффузии для химически однородного газа подчиняется закону Фика:
![]()
. Коэффициент диффузии
![]()
3)Внутреннее трение (вязкость).
Механизм возникновения внутреннего трения между параллельными слоями газа или жидкости, движущимися с различными скоростями, заключается в том, что из-за хаотического теплового движения происходит обмен молекулами между слоями, в результате чего, импульс слоя, движущегося быстрее, уменьшается, а движущегося медленнее, увеличивается, что приводит к торможению слоя, движущегося быстрее, и к ускорению слоя, движущегося медленнее. Сила внутреннего трения между двумя слоями газа или жидкости подчиняется закону Ньютона
![]()
Вакуум и его методы получения. Если из сосуда откачивать газ, то по мере понижения давления число столкновений молекул друг с другом уменьшается, что приводит к увеличению их длины свободного пробега. При достаточно большом разрежении столкновения между молекулами относительно редки, поэтому основную роль играют столкновения молекул со стенками сосуда. Вакуумом называется состояние газа, при котором средняя длина свободного пробега <l> сравнима или больше характерного линейного размера d сосуда, в котором газ находится. В зависимости от соотношения <l> и d различают низкий (<l> << d), средний (<l> £ d), высокий (<l> > d) и сверхвысокий (<l> >> d) вакуум. Газ в состоянии высокого вакуума называется ультраразреженным.
Для получения высокого вакуума применяются диффузионные насосы (рабочее вещество — ртуть или масло), которые не способны откачивать газ из сосудов начиная с атмосферного давления, но способны создавать добавочную разность давлений, поэтому их употребляют вместе с форвакуумными насосами.
