
- •II. Реакции окисления
- •III. Термические превращения алканов
- •53. Алкены. Изомерия и номенклатура. Электронное строение. Р-ции в боковой цепи. Использование в лабораторной практике и промышленности.
- •Галогенирование Механизм электрофильного присоединения.
- •Гидрогалогенирование
- •Присоединение протонных кислот и воды
- •Реакция полимеризации
- •7. Реакции замещения (реакции радикального замещения аллильного атома водорода). Реакция алкенов в боковой цепи.
- •54. Алкены. Р-ции присоединения по двойной связи (гидрогенирование, галогенирование, гидрогалогенирование, гидратация, полимеризация, окисление) мех-мы и основные закономерности.
- •55. Алкины. Изомерия и номенклатура. Применение алкинов. Образование ацетиленид-анионов и их использование в орг синтезе.
- •56. Реакции присоединения по кратной связи алкинов (гидрогенирования, галогенирования, гидрогалогенирования, гидратации, полимеризации, окисления): механизмы и основные закономерности.
- •57. Алкадиены. Классификация, номенклатура, изомерия, электронное строение. Химические свойства, понятие о термодинамическом и кинетическом контроле реакций присоединения к сопряженным диенам.
- •II. Пространственная
- •58. Арены. Номенклатура, изомерия. Ароматичность, правило Хюккеля. Полициклические ароматические системы.
- •58А. Реакции боковой цепи аренов, представление о механизме, закономерности галогенирования и окисления.
- •60. Реакции бензола и его конденсированных аналогов с нарушением ароматичности (гидрогенирование, окисление, галогенирование).
- •61. Примеры синтетич. Использования р-ций аренов(нитрования, галогенирования, сульфирования, ацилирования, алькилирования по Фриделю Крафтцу). Синтез жирноароматических альдегидов и кетонов
- •62. Представление о реакциях нуклеофильного замещения и элиминирования как конкурентных процессах в ряду монофункционально замещенных углеводородов (галогеналканы, спирты, амины).
- •63. Представление о механизмах мономолекулярного и бимолекулярного нуклеофильного замещения. Факторах, влияющих на направление процесса.
- •65. Взаимодействие галогеналканов с металлами. Представление о строении и использовании в синтезе металлорганических соединений.
- •66. Номенклатура, строение, применение галогеналканов, хим. Св-ва. Р-ции нуклеофильного замещения (с о-, Hal-, n-, с- нуклеофилами). Элиминирование.
- •67. Одноатомные и многоатомные спирты. Номенклатура, изомерия. Физические и медико-биологические свойства. Химические св-ва: реакции нуклеофильного замещения, элиминирования и ацилирования.
- •69. Фенолы. Номенклатура, строение, изомерия. Химические свойства: кислотность (влияние заместителей), р-ции по он-группе (в сравнении с алканами) и ароматическому кольцу (в сравнении с аренами).
- •71. Особенность поведения ароматических аминов. Основность и нуклеофильность аминов. Использование аминов в органическом синтезе.
- •72. 73. Альдегиды и кетоны. Изомерия и номенклатура. Физические и медико-биологические свойства. Взаимодействие альдегидов и кетонов с водородом и нуклеофильными реагентами.
58А. Реакции боковой цепи аренов, представление о механизме, закономерности галогенирования и окисления.
Вступают в реакции свободнорадикального замещения. Направление реакции можно контролировать.
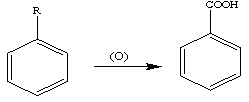
Реакция окисления: при окислении гомологов бензола обычными окислителями (перманганат калия, бихромат калия, разб. азотная кислота) боковая цепь легко подвергается окислению с образованием ароматических кислот. Независимо от длины боковая цепь образует карбоксильную группу, связанную с бензольным кольцом, т.е. окисление происходит по Сα-атому боковой цепи:
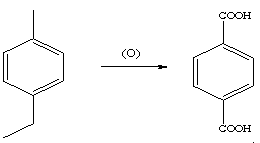 терефталевая
к-та
терефталевая
к-та
Эта реакция используется для синтеза ароматических кислот.
2. Галогенирование: на свету! По боковой цепи.
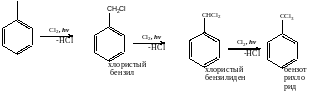
При гидролизе возможно образование 1. Бензилового спирта, 2. Бензойного альдегида, 3. Бензойной кислоты.
В алкилбензолах с более длинной боковой цепью, реакция радикального хлорирования идет в основном в α-положение боковой цепи:
 β-хлор-
α-фенил-этан (9%)
β-хлор-
α-фенил-этан (9%)
α-хлор-α-фенил-этан (91%)
При бромировании этиленбензола вследствие меньшей реакционной способности атома брома замещение водорода боковой цепи происходит исключительно в α-положение (бензильное положение). Бензольное кольцо резко повышает реакционную способность бензильного положения боковой цепи гомологов бензола в Sr реакциях по сравнению с алканами. По стабильности бензильный радикал близок к алкильному.
59. Р-ции электрофильного замещения в ароматическом кольце SeAr, общие закономерности и мех-змы.Правило ориентации.
Реакции электрофильного замещения в ароматическом кольце SEAr
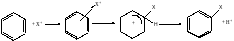
π-комплекс σ-комплекс
На 1й стадии электрофильная частица X притягивается к π-электронному облаку и обр-т с ним π-комплекс. Затем 2 из 6 π-электронов кольца обр-т σ-связь между X+ и одним из атомов С. При этом ароматичность системы нарушается, т.к. в кольце остается только 4 π-электрона, распред-ные между 5 атомами С (σ-комплекс). Для восстановления ароматичности σ-комплекс выбрасывает протон, а 2 электрона связи С-Н переходят в π-электронную систему. По механизму электрофильного замещения протекают следующие реакции ароматических углеводородов: галогенирование, нитрование, сульфирование, алкилирование по Фриделю-Крафтсу, алкилирование алкенами. Электрофильное замещение в ряду монозамещенных бензолов. Электроно-доноры: алканы, галагены, -ОR, -NR2, -SR. Электроно-акцепторы: -CF3, -C=N, -C-X, -NO2, -SO3H. Заместители влияют на скорость и направление процесса. Электродонорные заместители (кроме галог.) ускоряют, а электроакцепторные – замедляют процесс электрофильного замещения.
Правило ориентации. Заместители оказывают различное влияние на энергию активации трех возможных переходных состояний. Дезактивирующие заместители дестабилизируют σ-комплекс и увеличивают энергию активации стадии, приводящей к его образованию. Группы, активирующие бензольное кольцо, стабилизируют σ-комплекс, снижают его энергию и энергию активации образования σ-комплекса.
Г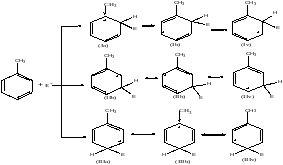 раничные
(предельные) структуры σ-комплекса,
вносящие вклад в его стабилизацию на
примере толуола. При взаимодействии
толуола с электрофилом Е+
атака в орто- и пара-положения
приводит к большей стабилизации
интермедиата. В структурах (1а) и (3б)
положительный заряд в заметной степени
компенсируется вследствие смещения
электронной плотности от донорной
метильной гр. При атаке в мета-положение
такой компенсации не происходит.1-ая
стадия явл-ся скорость определяющей.
Скорость образования определяется
энергией активации. 2-ая стадия очень
быстрая и необратимая, поэтому более
стабильный комплекс обр-ся быстрее.
Стабильность σ-комплекса опр-ся 2
факторами: электроным (при орто- и
пара-замещении донорный заместитель
участвует в делокализации, а при мето-
не участвует) и стерическим (при наличии
полярных заместителей дестабилизируют
орто-σ-комплекс). Более стабильному
комплексу соот-ет меньшая Е активации.
Донорные заместители ускоряют процесс,
а акцепторные – ослабляют.
раничные
(предельные) структуры σ-комплекса,
вносящие вклад в его стабилизацию на
примере толуола. При взаимодействии
толуола с электрофилом Е+
атака в орто- и пара-положения
приводит к большей стабилизации
интермедиата. В структурах (1а) и (3б)
положительный заряд в заметной степени
компенсируется вследствие смещения
электронной плотности от донорной
метильной гр. При атаке в мета-положение
такой компенсации не происходит.1-ая
стадия явл-ся скорость определяющей.
Скорость образования определяется
энергией активации. 2-ая стадия очень
быстрая и необратимая, поэтому более
стабильный комплекс обр-ся быстрее.
Стабильность σ-комплекса опр-ся 2
факторами: электроным (при орто- и
пара-замещении донорный заместитель
участвует в делокализации, а при мето-
не участвует) и стерическим (при наличии
полярных заместителей дестабилизируют
орто-σ-комплекс). Более стабильному
комплексу соот-ет меньшая Е активации.
Донорные заместители ускоряют процесс,
а акцепторные – ослабляют.
«Орто»-отака
«Мета»-отака
«Пара»-отака
