
- •Тема 1. Образование белков: общие представления о фолдинге
- •1.1. Строение белков
- •Вариантами вторичной структуры
- •1.2. Модели сворачивания белков.
- •Факторы фолдинга
- •Ферменты фолдинга
- •Шапероны
- •1.3.3. Прионы как антишапероны
- •Тема 2. Сортировка и модификация белков
- •2.1. Процессы в гранулярной эпс
- •2.2. Процессы в комплексе Гольджи
- •2.3. Сортировка и транспорт белков митохондрий
- •2.4. Образование коротких пептидов
- •2.5. Распад белков
Тема 1. Образование белков: общие представления о фолдинге
Процесс образования белков состоит из трех стадий:
трансляция
фолдинг
модификация
и завершается доставкой белка к месту его будущего функционирования. Для этого существуют специальные механизмы, и решение проблемы начинается еще с трансляции.
Трансляция – последовательное включение аминокислот в строящиеся пептидные цепи в соответствии с последовательность кодонов мРНК
В процессе трансляции участвуют 4 вида рРНК, которые в ядрышке объединяются с рибосомальными белками, формируя субъединицы рибосом. Эти субъединицы через ядерные поры перемещаются в цитоплазму. Туда же перемещаются и многие мРНК в комплексе со специальными белками и несколько десятков видов тРНК. С другой стороны в цитоплазме присутствуют 20 видов аминокислот, синтезированных в самой клетке или поступивших из крови. Также здесь находится 20 видов ферментов - аминоацил-тРНК –синтетаза и дополнительные белковые факторы. Все эти вещества участвуют в :
фолдинге – сворачивание пептидной цепи в пространственную структуру
модификации – присоединение углеводных компонентов, окисление определенных аминокислотных остатков и т.д.
По месту окончательной локализации в клетке белки подразделяют на: экспортные, мембранные, лизосомальные и внутренние.
Экспортные – т.е. предназначенные к выделению из клетки, мембранные и лизосомальные белки образуются мембраносвязанными рибосомами. Т.е. рибосомами, прикрепленными к поверхности мембран эндоплазматической сети (ЭПС). Благодаря этому конец синтезируемого пептида проникает во внутреннее пространство ЭПС где потом оказывается и весь белок. В этом же пространстве происходит фолдинг и модификация белка. Далее в транспорте и модификации принимают участие другие мембранные структуры, прежде всего аппарат Гольджи и, в конечном счете, белок
- либо выделяется в ходе экзоцитоза из клетки,
- либо включается в состав той или иной мембраны,
- либо остается внутри сформировавшейся лизосомы.
В отличие от этого внутренние белки (белки гиалоплазмы, митохондрий, ядра и т.д.) синтезируются на свободных, т.е. мембранонесвязанных рибосомах.
1.1. Строение белков
Различают несколько уровней структуры белков: первичную, вторичную, третичную, а для олигомерных белков – и четвертичную структуры.
Первичная структура – это последовательность аминокислотных остатков, связанных друг с другом пептидными связями. Именно данная структура непосредственно кодируется последовательностью кодонов в мРНК и воспроизводится при трансляции.
Принципиально важно, что практически все 20 аминокислотных остатков, встречающихся в природных белках, имеют сходный план строения. Они содержат трехчленный остов, со средним (-углеродным) атомом которого связан тот или иной радикал (R). Соединяясь друг с другом пептидными связями, они формируют непрерывный остов пептидной цепи, где чередуются три типа связи (рис.1.1).
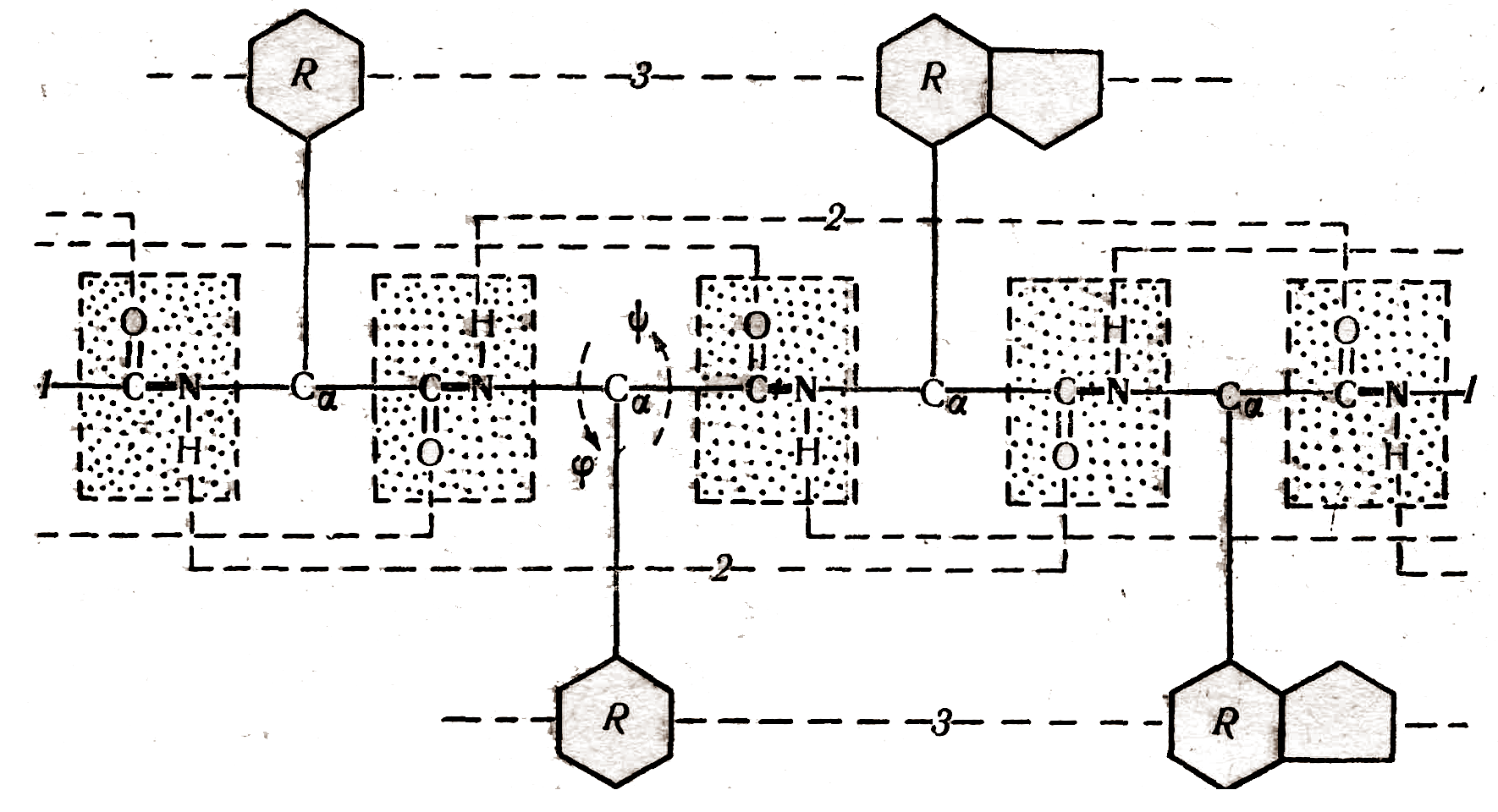
Рис. 1.1 Первичная структура белков
Вокруг одной из них – пептидной связи –СО-NH- вращения невозможны. Вокруг двух остальных –NH-CН- и –CН-СО- – возможно вращение. Это позволяет пептидной цепи изгибаться, образовывая вторичную и третичную структуры.
Вторичная структура. Вначале многие фрагменты пептидной цепи приобретают периодическую укладку того или иного типа: -спираль или -структура. Такой тип укладки называется вторичной структурой. В одной и той же молекуле глобулярного белка могут встречаться разные виды вторичной структуры и также бесструктурные участки. Соотношение между ними различно (табл.1.1).
В фибриллярных белках вторичная структура как правило однообразна. Альфа спиралью представлены белки – миозин, тропомиозин, альфа-кератин. В этих белках несколько цепей с альфа-спиралью закручены в суперспираль. Белки только с бета-структурой– фибрин шелка и бета-кератин (образуется из -кератина при обработке горячим паром).
Таблица 1.1. Распределение аминокислотных остатков между тремя
