
- •М.А. Булатов комплексная переработка многокомпонентных жидких систем
- •3.3. Совершенствование аппаратурно-технологического оформления процесса нейтрализации сточных вод
- •Физико-химические особенности процесса
- •1) Внешняя диффузия.
- •2) Поверхностная реакция.
- •Математическое описание процесса кристаллизации в реакторе-смесителе
- •Данные опытов по нейтрализации фторсодержащих сточных вод суспензией мела [16]
Министерство общего и профессионального образования Российской Федерации
МОСКОВСКАЯ ГОСУДАРСТВЕННАЯ АКАДЕМИЯ ХИМИЧЕСКОГО МАШИНОСТРОЕНИЯ
М.А. Булатов комплексная переработка многокомпонентных жидких систем
Ресурсосберегающие и малоотходные технологии, экологически чистая продукция
Москва - 1997
3.3. Совершенствование аппаратурно-технологического оформления процесса нейтрализации сточных вод
Процессы нейтрализации с использованием химических реагентов обладают в кинетическом отношении целым рядом особенностей, которые необходимо учитывать при очистке сточных вод. Эффективность процесса зависит при прочих равных условиях от интенсивности турбулентности в ядре потока, с увеличением которой возрастает вероятность дробления образующихся агрегатов. Существующие методы смешения не учитывают этих особеностей, что приводит к потере устойчивости образующихся коллоидных структур, разрушению их каркаса и, как следствие, к малоэффективному их осаждению в отстойниках.
В МГАХМе разработана новая конструкция реактора-смесителя, отличающаяся тем, что перемешивание реагентов проводится во встречных закрученных потоках, что обеспечивает необходимую степень перемешивания к снижение энергетических и материальных затрат (рис. 3.1). Преимуществом разработанного оборудования по сравнению с существующим является отсутствие движущихся перемешивающих устройств. Специальная конструкция статического рассекателя позволяет обеспечить гидродинамический режим в аппарате, благоприятствующий процессу флокулообразования.
Физико-химические особенности процесса
Как следует ив табл. 3.1 реагентный метод позволяет проводить очистку сточных вод от растворимых примесей.
Фторсодержащие сточные воды нейтрализуют обычно суспензией мела. При этом возможно протекание следующих реакций:
Na2SiF6 + СаСО3 = CaSiF6 + Na2CO3 ( 3.1 )
CaSiF6 + 2СаСО3 = 3CaF2 + SiO2 + 2CO2 ( 3.2 )
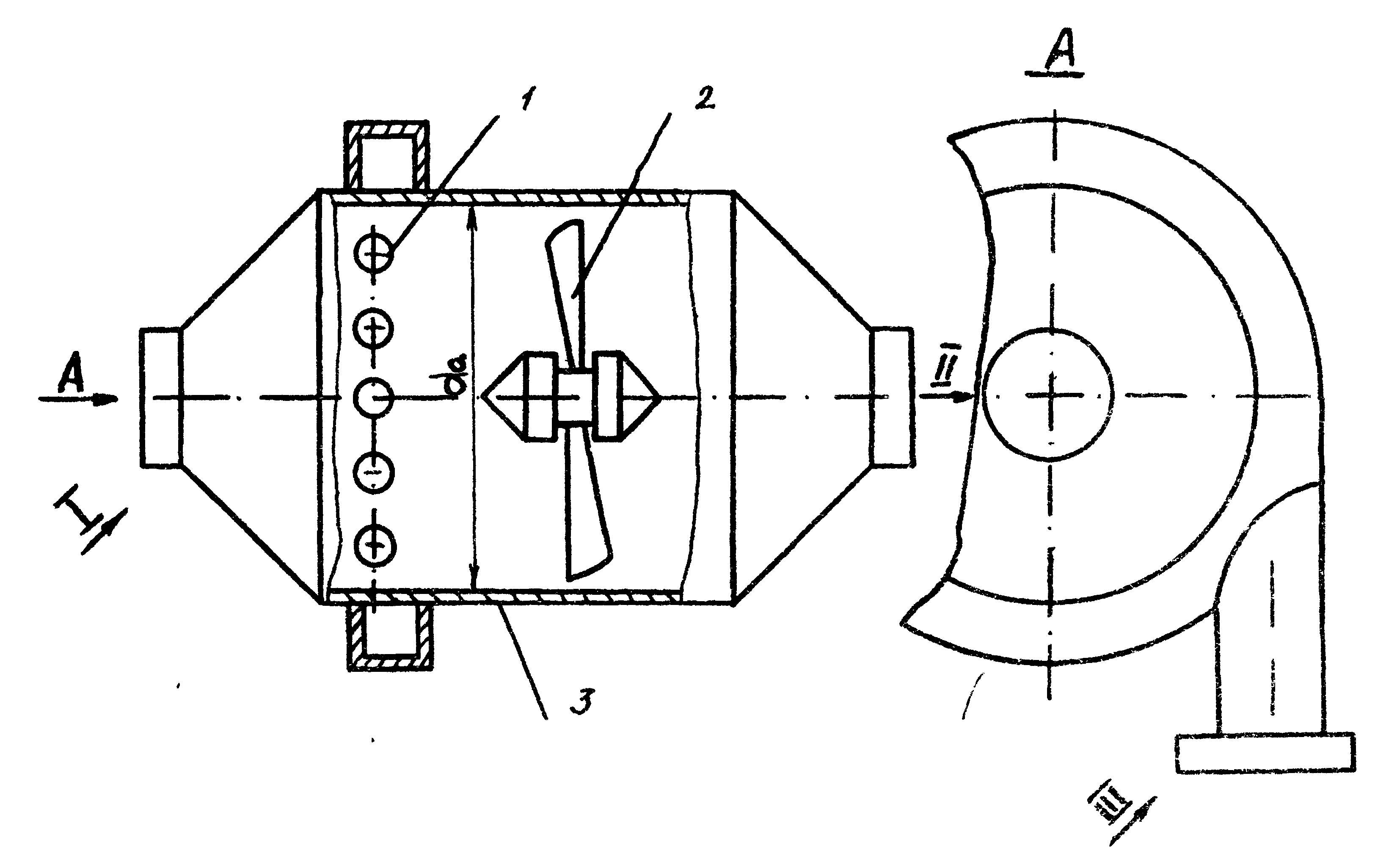
Рис. 3.1. Схема статического реактора-смесителя
1 - распределительное устройство для ввода реагентов;
2 - перераспределитель потока; 3 - корпус.
Линии: I - ввода раствора; II - вывода раствора;
III - ввода осадительного реагента
Таблица 3.1
Методы очистки сточных вод
|
Физико-химические свойства загряэняющего вещества
|
Размер частиц загрязняющего вещества, м |
||||||||||||||||
|
Твердые нерастворимые примеси
|
Коллоидные частицы
|
Вирусы
|
Ионы, молекулы
|
||||||||||||||
|
10-3 |
10-4 |
10-5 |
10- 6 |
10-7 |
10-8 |
10-9 |
10-10 |
||||||||||
|
Размер частиц
|
тканевый фильтр, решетки-сита
|
Микрофильтр
|
|
|
|
|
|||||||||||
|
|
|
ультрафильтрация
|
обратный осмос |
||||||||||||||
|
|
|
|
|
|
|
||||||||||||
|
|
коагуляция флокуляция |
|
|
|
|||||||||||||
|
|
|
|
|||||||||||||||
|
седиментация |
|
|
|||||||||||||||
|
Плотность
|
центрифугирование
|
|
|
|
|
||||||||||||
|
|
|
|
ультрацентрифугирование |
|
|||||||||||||
|
|
|
||||||||||||||||
|
Диффузия
Ионный заряд |
|
|
|
|
диализ |
|
|||||||||||
|
|
электродиализ |
|
|||||||||||||||
|
|
ионообмен |
||||||||||||||||
|
Растворимост |
|
|
|
экстракция |
|||||||||||||
|
|
|
реагентная очистка |
|||||||||||||||
|
Поверхностные свойства |
|
флотация
|
сорбция |
||||||||||||||
|
Температура кипения |
|
|
|
дистилляция, концентрирование |
|||||||||||||
2HF + СаСО3 = CaF2 + CO2 + Н2О (3.3 )
Для увеличения эффективности очистки целесообразно вводить в сточную воду более растворимые соединения кальция, например гидроксид кальция Процесс нейтрализации будет протекать по реакции
H2SiF6 + ЗСа(ОН)2 = 3СF2 + SiO2 + 4Н2О (3.4)
При этом возможно протекание и других реакций.
Na2SiF6+ Ca(OH)2 = CaSiF6 + 2NaOH ( 3.5 )
NaSiF6 + 3Са(ОН)2 = 3СaF2 + SiO2 + 2H2O + 2NaOH ( 3.6 )
CaSiF6 + 2Ca(OH)2 = 3CaF2 + SiO2 + 2H2O ( 3.7 )
2HF + Ca(OH)2 = CaF2 + 2H2O ( 3.8 )
Приведенные обменные реакции протекают практически мгновенно. При этом образуются растворы электролитов, пересыщенные по соединениям кальция. В пересыщенных растворах начинается процесс кристаллизации - образование и рост кристаллов солей кальция (например, CaF2). По мере увеличения размера кристаллического продукта происходит его осаждение. Экспериментально показано, что определяющим процессом в присутствии затравочных кристаллов является их рост. Рост кристаллов - типичный гетерогенный процесс в системе жидкость - твердое.
Рассмотрим единичную шарообразную частицу твердой примеси, находящуюся в потоке реакционной смеси (рис. 3.2а).
Основные стадии процесса роста кристаллов:
