
- •Глава 1. Элементы кинематики.
- •§1.1 Механическое движение. Системы отсчёта. Физические модели.
- •§1.2 Уравнение движения.
- •§1.3 Кинематические характеристики вращательного движения.
- •Глава 2. Динамика частиц
- •§2.1 Динамика частиц. 1-й закон Ньютона.
- •§2.2 Силы. 2-й закон Ньютона.
- •§2.3 Импульсная форма 2-го закона Ньютона.
- •Глава 3. Законы сохранения
- •§3.1 Закон сохранения импульса.
- •§3.2 Механическая работа и мощность.
- •§3.3 Теорема о кинетической энергии.
- •§3.4 Потенциальная энергия.
- •§3.5 Закон сохранения механической энергии.
- •§3.6 Закон сохранения полной энергии.
- •§3.7 Упругий и неупругий удар тел.
- •Глава 4. Закон всемирного тяготения
- •§4.1 Закон всемирного тяготения.
- •Глава 5. Динамика вращательного движения
- •§5.5 Закон сохранения момента импульса.
- •§5.6 Вычисление момента инерции.
- •§5.7 Работа и кинетическая энергия при вращательном движении.
- •Глава 6. Основы специальной теории относительности
- •§6.1 Классический принцип относительности. Преобразования Галилея.
- •§6.2 Преобразования Лоренца. Постулаты сто.
- •§6.3 Сокращение длинны.
- •§6.4 Удлинение промежутков времени.
- •Значит наблюдатель в системе s` сначала увидит молнию передней части вагона и потом задней.
- •§8.2 Графический способ представления колебаний.
- •§9.2 Дифференциальное уравнение гармонических колебаний. Гармонический осциллятор.
- •§9.3 Кинетическая энергия гармонических колебаний.
- •§9.4 Затухающие колебания.
- •§9.5 Вынужденные колебания.
- •Гл. 10 Упругие волны
- •§10.1 Продольные и поперечные волны.
- •§10.2 Уравнение бегущей волны.
- •§10.3 Фазовая скорость. Энергия упругих волн.
- •§10.4 Сложение волн.
- •Молекулярная физика и термодинамика.
- •Глава 11. Кинетическая теория газов
- •§11.1 Основное уравнение кинетической теории газов.
- •§11.2 Кинетическая интерпретация абсолютной температуры.
- •§11.3 Закон равномерного распределения энергии по степеням свободы.
- •§11.4 Внутренняя энергия идеального газа.
- •Глава 12. Статистические распределения
- •§12.1 Распределения Максвелла молекул по скоростям.
- •§12.3 Барометрическая формула.
- •§12.4 Распределение Больцмана.
- •Глава 13. Физическая кинетика
- •13.1 Длина свободного пробега.
- •§13.2 Явление переноса в газах.
- •Диффузия
- •Теплопроводность
- •Глава 14. Физические основы термодинамики
- •§14.2 Зависимость работы от характера термодинамического процесса.
- •§14.3 Теплоемкость газов.
- •§14.4 Круговые процессы. Принцип работы тепловых машин.
- •§14.5 Идеальная тепловая машина Карно.
- •§14.6 Обратимые и необратимые процессы.
- •§14.7 Второй закон термодинамики.
- •§14.8 Энтропия.
- •§14.9 Статистическая природа энтропии.
- •Глава 15. Реальные газы
- •§15.1 Межмолекулярные силы.
- •§15.2 Уравнение Ван-дер-Ваальса.
§10.4 Сложение волн.
Сложение волн подчиняется принципу суперпозиции: волны распространяются в среде, не зависимо друг от друга, при этом результирующее значение равно векторной сумме смещений каждой волны в отдельности.
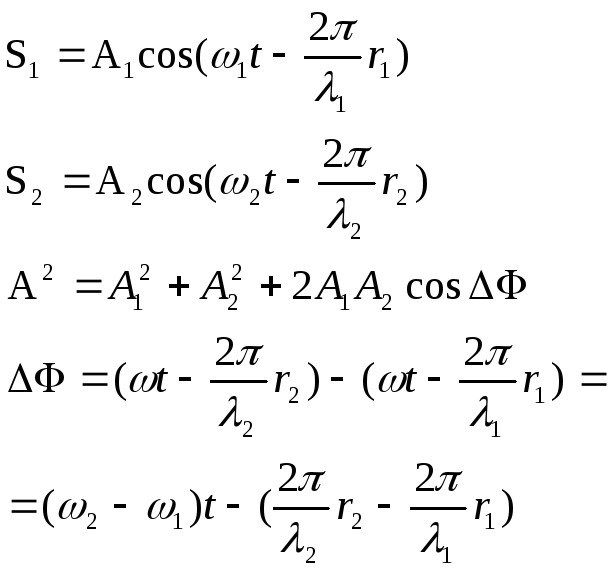

12, ΔФ=f(t)
![]()
A2=A12+A22
W~A2
W=W1+W2
ω1=ω2, λ1=λ2
![]()
a) cosΔФ=1, ΔФ=2πn,
Δr=2πλ/2
A=Amax A1=A2=A0
W=4W0
б) cosΔФ=-1, ΔФ=π(2n+1)
r=(2n+1)λ/2
Amin2=(A1-A2)2 A1=A2=A0
A=0 W=0
Таким образом в пространстве возникают участки в которых энергия в 4 раза больше чем энергия источника и существуют участки где энергия равна. Такая картина распределения интенсивности колебаний называется интерференцией.
Молекулярная физика и термодинамика.
Молекулярная физика – это раздел, в котором изучаются физические свойства тел на основе из внутреннего строения. Современная наука стоит на основе принципов атомизма. Все вещества состоят из атомов и молекул, которые находится в непрерывном тепловом хаотическом движении. Характер этого движения зависит от агрегатного состояния вещества в твердых телах - это колебания ионов в узлах кристаллической решетки относительно положения равновесия. В газах – это ломаная линия. В жидкостях тепловое движение носит промежуточный характер, который сводится к тому, что молекулы находятся в определенном равновесном положении, перескакивают время от времени из одного положения в другое. Исторически имеются 2 подхода в молекулярной физике. Один называется статистическим, а второй – термодинамический. В 1-м случае рассматривается движение огромного числа частиц, во втором рассматривается макроскопические характеристики (давление, объем, температура, плотность). В основе 2-го подхода лежит эмпирические законы, которые называют началами термодинамики. Закон Авогадро: в одном моле вещества находится NA= 6.02 * 1023частиц.
Глава 11. Кинетическая теория газов
§11.1 Основное уравнение кинетической теории газов.
Идеальным газом называют газ, в котором отсутствуют взаимодействие между молекулами и размеры атомов пренебрежимо малы (материальные точки), атомы или молекулы совершают упругие соударения со стенками сосуда. При этих условиях молекулы идеального газа оказывают силовое воздействие на стенки сосуда, которое характеризуется физической величиной называемой давлением. P=F/S, Па. Давление – сила, действующая на единицу поверхности.
Основное уравнение МКТ.


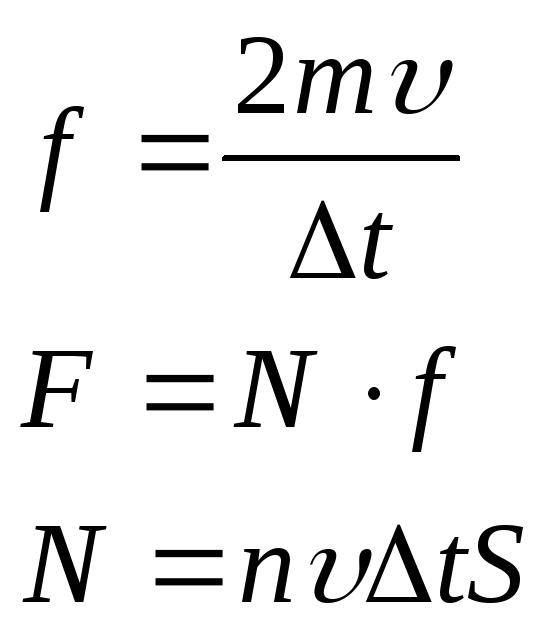

Поскольку молекулы движутся хаотически, то на каждую стенку давление будет оказываться в 6 раз меньше.

§11.2 Кинетическая интерпретация абсолютной температуры.
Давление, объём и температура связаны эмпирическим уравнением Менделева-Клапейрона:
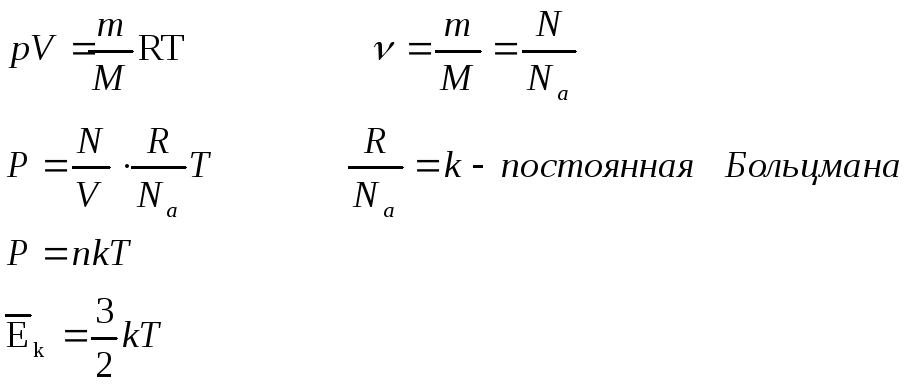
Сравнивая последнее уравнение с основным
уравнением МКТ
![]() ,
то
,
то![]()
Абсолютная температура по шкале Кельвина характеризует интенсивность теплового движения. Отсюда ясен физический смысл абсолютного нуля. Нулю по шкале Кельвина соответствует полное отсутствие движения молекул.
§11.3 Закон равномерного распределения энергии по степеням свободы.
Числом степеней свободы называют
количество независимых координат,
которые определяют положение тела в
пространстве. Точка в пространстве
имеет 3 координаты и имеет 3 степени
свободы. Твердое тело имеет 3 степени
свободы, центра инерции и 3 вращательных
степени свободы. Молекулы идеального
газа имеют среднюю кинетическую энергию
![]() .
Таким образом, на одну степень свободы
приходитсяkT/2. Этот закон
очевиден для идеального газа и справедлив
для любого случая и гласит, что на одну
степень свободы в среднем приходится
одинаковое количество энергии равное
kT/2.
.
Таким образом, на одну степень свободы
приходитсяkT/2. Этот закон
очевиден для идеального газа и справедлив
для любого случая и гласит, что на одну
степень свободы в среднем приходится
одинаковое количество энергии равное
kT/2.
i=3 – одноатомный
i=3+2=5 – 2-х атомный
i=3+3=6 – 3-х атомный и более
Для многоатомного газа:

