
5. Основные свойства микобактерий туберкулеза.

Ученые не прекращают интенсивный поиск эффективных и нетрудоемких методов диагностики туберкулеза: испытывают туберкулезные антигены для серологических исследований и более современные методы — иммуноферментный анализ (ИФА), полимеразно-цепную реакцию (ПЦР), метод дактилоскопии и др.
Согласно методическим указаниям диагноз на туберкулез считают установленным, если выделена культура возбудителя из патматериала или получены положительные результаты биопробы. У крупного рогатого скота, буйволов и верблюдов диагноз также считают установленным при обнаружении в органах и тканях изменений, типичных для туберкулеза. В пунктах, неблагополучных по туберкулезу, всех животных, положительно реагирующих на туберкулин, считают больными туберкулезом.
ЗАДАНИЕ ДЛЯ САМОСТОЯТЕЛЬНОЙ РАБОТЫ
В период производственной практики освоить методы туберкулинизации животных разных видов и составление отчетной документации.
Занятие 24. Профилактика и ликвидация туберкулеза
Цель занятия: изучить систему профилактических и оздоровительных мероприятий при туберкулезе.
Материалы и оборудование: действующие Правила по профилактике и ликвидации туберкулеза, биопрепараты, дезсредства.
Место проведения занятия: аудитория кафедры эпизоотологии.
МЕТОДИЧЕСКИЕ УКАЗАНИЯ
Профилактические и оздоровительные мероприятия при туберкулезе животных регламентированы Правилами, утвержденными Департаментом ветеринарии МСХ РФ (далее приведены основные положения).
Профилактические мероприятия. В группу этих мероприятий входят ежегодный клинический осмотр животных и плановые профилактические туберкулинизации:
коров и быков-производителей исследуют 2 раза в год: весной, перед выгоном на пастбище, и осенью, перед переводом на зимнее содержание;
молодняк крупного рогатого скота (начиная, с 2-месячного возраста) и поголовье откормочных групп — 1 раз в год;
лошадей, мулов, ослов, овец и коз — в зависимости от эпизоотической обстановки;
взрослых свиноматок и молодняк после отъема в племенных, хозяйствах — 1 раз в год, остальное поголовье свиноферм — в зависимости от эпизоотической обстановки;
взрослых птиц (старше 2 лет) исходных линий и прародительских стад на племенных заводах и селекционно-племенных птицеводческих станциях — 1 раз в год.
Животных, принадлежащих гражданам, исследуют на туберкулез одновременно с поголовьем хозяйств.
При выявлении в благополучном хозяйстве животных, реагирующих на туберкулез, их дополнительно исследуют глазным и внутривенным способами. Реагирующих на офтальмо- или внутривенную пробу убивают с диагностической целью. При обнаружении хотя бы у одного из животных изменений, типичных для туберкулеза, диагноз считают установленным.
( При отсутствии животных с положительной офтальмо- или внутривенной пробой все поголовье (в том числе животных, ранее реагировавших на внутрикожную туберкулинизацию) через 30...45 I дней проверяют симультанной аллергической пробой с применением ППД для млекопитающих, КАМ или ППД для птиц. Если в данном стаде (на ферме) не выявлено животных, реагирующих на туберкулин для млекопитающих, или у реагирующих на этот препарат утолщение кожной складки во всех случаях выражено в большей степени на КАМ или туберкулин для птиц, стадо считают благополучным по туберкулезу.
При выявлении в благополучном хозяйстве свиней или овец (коз), реагирующих на туберкулин, 3...5 животных с наиболее выраженными реакциями убивают с диагностической целью. Независимо от наличия или отсутствия патологоанатомических изменений отбирают материал для бактериологического исследования. Диагноз на туберкулез считают установленным, если из биоматериала выделена культура возбудителя туберкулеза птичьего или человеческого вида или получен положительный результат биопробы. У животных других видов диагноз на туберкулез устанавливают на основании результатов патологоанатомических и бактериологических исследований.
Оздоровительные мероприятия. Хозяйство (ферму, отделение, птичник, населенный пункт и т. д.), в котором установлен туберкулез, решением местной администрации объявляют неблагополучным и вводят комплекс ограничений, предупреждающих распространение болезни. Одновременно утверждают комплексный план оздоровления неблагополучного хозяйства (фермы, стада и т.д.).
Животных, реагирующих на туберкулин, немедленно изолируют и в течение 15 дней сдают на убой независимо от племенной и производственной ценности.
Животных, больных туберкулезом, и полученный от них приплод запрещается использовать для воспроизводства стада.
Сырое молоко, полученное от коров неблагополучного по туберкулезу стада (фермы), запрещается продавать на рынках, поставлять в столовые, лечебно-профилактические, детские и школьные учреждения.
Молоко от коров, реагирующих на туберкулин, обеззараживают кипячением или перерабатывают на топленое масло-сырец. Молоко от коров с отрицательной туберкулиновой пробой непосредственно в хозяйстве пастеризуют при температуре 90 "С в течение 5 мин или при 85 °С в течение 30 мин, а при отсутствии пастеризаторов кипятят, после чего вывозят на молокозавод или используют внутри хозяйства.
Убой больных туберкулезом животных на месте (в хозяйстве) разрешается только на оборудованной площадке (пункте) под контролем ветеринарного врача с соблюдением мер личной профилактики и правил, исключающих разнос возбудителя инфекции.
Пастбищные участки, на которых выпасали неблагополучные по туберкулезу стада, разрешается использовать для здоровых животных через 2 мес в южных районах страны и через 4 мес — в остальных районах.
Непроточные водоемы разрешается использовать для водопоя здорового скота через 4 мес после того, как их прекратили использовать для водопоя больных туберкулезом животных.
В оздоровительные мероприятия обязательно входят текущая дезинфекция (помещений, загонов, выгульных площадок, оборудования, инвентаря и других объектов), дезинсекция и дератизация. Навоз обеззараживают одним из способов.
Для оздоровления стад крупного рогатого скота используют следующие методы:
единовременную полную замену поголовья неблагополучного стада (фермы) здоровыми животными;
систематические диагностические исследования с выделением больных животных или целых неблагополучных групп и последующим их убоем.
В обоих случаях обязателен комплекс организационных, хозяйственных и ветеринарно-санитарных мероприятий.
Метод единовременной полной замены поголовья применяют тогда, когда туберкулез впервые установлен в районе, области, республике и при заболевании более 15 % поголовья. В этом случае поступают следующим образом:
прекращают аллергические исследования скота на туберкулез;
не осеменяют коров и телок;
все молоко пастеризуют при 85 °С в течение 30 мин или при 90 °С в течение 5 мин, после чего дают откормочным телятам или отправляют на молокоперерабатывающее предприятие;
в течение 6 мес все поголовье неблагополучного стада вместе с молодняком сдают на убой. В первую очередь отправляют на мясокомбинат откормочное поголовье, непродуктивных коров, волов и молодняк;
помещения, освободившиеся от скота, дезинфицируют 3%-ми растворами формальдегида и каустической соды.
После выполнения ветеринарно-санитарных мероприятий, заключительной дезинфекции всех помещений и лабораторной проверки ее качества с фермы снимают ограничения.
При заболевании туберкулезом менее 15 % поголовья для оздоровления применяют метод систематических исследований с убоем больных животных:
все поголовье начиная с 2-месячного возраста каждые 45...60 дней исследуют двойной внутрикожной туберкулиновой пробой. Одновременно исследуют на туберкулез животных других видов, находящихся в хозяйстве (в том числе собак и кошек): реагирующих на туберкулин признают больными, изолируют и в течение 15 дней сдают на убой (собак и кошек подвергают эутаназии).
Если по всему стаду получены подряд два отрицательных результата аллергической пробы, животных ставят на 6-месячное контрольное наблюдение, в период которого дважды исследуют туберкулиновой пробой с интервалом 3 мес. При отрицательных результатах контрольного исследования и выполнении комплекса ветеринарно-санитарных мероприятий ферму (стадо) объявляют благополучной по туберкулезу.
При установлении туберкулеза среди крупного рогатого скота частного сектора все поголовье исследуют внутрикожной аллергической пробой каждые 45...60 дней до получения двукратных (подряд) отрицательных результатов по всему стаду. Реагирующих животных сдают на убой. При отсутствии новых случаев заболевания все поголовье частного сектора считают благополучным по туберкулезу. Ветеринарно-санитарные мероприятия в населенных пунктах проводят в соответствии с Правилами по профилактике и ликвидации туберкулеза животных.
При установлении туберкулеза в свиноводческих хозяйствах всех реагирующих на туберкулин животных, в том числе и супоросных свиноматок, хряков, откормочное поголовье, сдают на убой. По завершении опоросов и откорма молодняка сдают на убой все поголовье фермы — не позднее 6 мес с момента установления диагноза на туберкулез. После выполнения комплекса ветеринарно-санитарных мероприятий с фермы снимают ограничения.
При установлении туберкулеза у лошадей, овец и коз всех реагирующих на туберкулин животных убивают. Оставшееся поголовье исследуют: лошадей—глазной пробой, овец и коз — внутри-кожной каждые 45...60 дней до получения однократного отрицательного результата, после чего животных соответствующей группы признают здоровыми.
При установлении туберкулеза у пушных зверей их осматривают клиническим методом, больных самок вместе с приплодом изолируют. В период созревания шкурок зверям ежедневно скармливают тубазид в лечебной дозе. После убоя шкурки используют без ограничений. Остальным животным неблагополучной группы добавляют в корм тубазид в профилактической дозе. Для иммунизации норок используют вакцину БЦЖ.
Звероводческое хозяйство считают благополучным по туберкулезу, если в течение сезона от родов до убоя у павших и убитых с диагностической целью зверей не находят типичных для туберкулеза изменений органов и тканей. Ограничения с хозяйств снимают после выполнения ветеринарно-санитарных мероприятий.
В птицеводческих хозяйствах при установлении туберкулеза все поголовье неблагополучного птичника (цеха) сдают на убой, после соответствующих ветеринарно-санитарных мероприятий снимают ограничения и формируют новое стадо из здоровых молодок. Яйца от птиц неблагополучного птичника (цеха) не используют для инкубации, а сдают на хлебопекарные и кондитерские предприятия.
ЗАДАНИЯ ДЛЯ САМОСТОЯТЕЛЬНОЙ РАБОТЫ
1. Изучить Правила по профилактике и ликвидации туберкулеза животных.
2. Составить план оздоровления мелочно-товарной фермы.
Занятие 25. Диагностика бруцеллеза
Цель занятия: изучить методы диагностики бруцеллеза.
Материалы и оборудование: безыгольный инъектор или набор для аллергических исследований, набор для постановки РБП, иглы для взятия крови, набор диагностикумов, позитивных сывороток, антигенов, противобруцеллезные вакцины; бруцеллин ВИЭВ, дезсредства.
Место проведения занятия: лаборатория кафедры эпизоотологии.
МЕТОДИЧЕСКИЕ УКАЗАНИЯ
Бруцеллез — хронически протекающая инфекционная болезнь животных, вызываемая бактериями рода Brucella, в который входят 6 самостоятельных видов: В. melitensis — возбудитель бруцеллеза у коз и овец, В. abortus — у крупного рогатого скота, В. suis — у свиней, северных оленей, зайцев, В. ovis—у овец, В. canis—y собак, В. neotomae — у древесных крыс. В. melitensis и В. abortus могут мигрировать на животных других видов. От больных животных могут заразиться люди, для которых наиболее опасен возбудитель бруцеллеза овец и коз.
Диагноз на бруцеллез основан на результатах бактериологических, серологических, аллергических исследований и клинико-эпизоотических данных.
Клинические признаки болезни у животных нехарактерны — аборты, артриты, бурситы, эндометриты, вагиниты, орхиты, эпидидимиты могут встречаться при многих других заболеваниях.
Патологоанатомические изменения при бруцеллезе также малохарактерны. Самый надежный и точный диагноз—лабораторный, т. е. выделение и дифференциация возбудителя.
При лабораторных исследованиях возбудителя обнаруживают тремя методами: бактериоскопией мазков, выделением чистой культуры из исходного материала и, при необходимости, методом биопробы на морских свинках.
Мазки окрашивают по Граму, Козловскому, Шуляку—Шину, Стампу. Бруцеллы — мелкие грамотрицательные коккобактерии, располагаются попарно или кучно. При окраске по Козловскому, Шуляку—Шину, Стампу клетки бруцелл красного цвета.
Для культивирования бактерий используют мясопептонный печеночный бульон (МППБ), печеночно-глюкозо-глицериновый бульон (ПГГБ), картофельный агар и др. Посевы помещают в термостат при 37...38 °С и просматривают каждые 3...4 дня до 30 дней. В бульоне бруцеллы образуют равномерное помутнение и пристеночное кольцо, в дальнейшем — небольшой осадок на дне пробирки. На агаре растут в виде мелких блестящих выпуклых просвечивающихся колоний сероватого оттенка. Выделенные культуры идентифицируют в реакции агглютинации (РА) на стекле с позитивной бруцеллезной сывороткой.
Для биопроб используют двух морских свинок массой 350...400 г, предварительно проверенных на бруцеллез серологическим методом (отрицательный результат РА в разведении 1 : 5).
Суспензию исходного материала на стерильном физиологическом растворе (соотношение 1:10) вводят подкожно с внутренней стороны бедра морским свинкам в дозе 1 мл. На 15, 25, 40-й день сыворотки крови свинок исследуют в пробирочной РА в разведении от 1 : 10 до 1 : 80. При положительной РА (в разведении 1 : 10 и выше) морских свинок убивают, материал от них исследуют бактериологическим методом. При отрицательной РА биопробу считают отрицательной.
При массовых исследованиях большое значение имеют серологические и аллергические методы диагностики бруцеллеза:
у крупного рогатого скота, яков, зебу, буйволов — серологический: РА в пробирках, реакция связывания комплемента (РСК) или реакция длительного связывания комплемента (РДСК), пластинчатая реакция агглютинации с Роз-Бенгал антигеном — Роз-Бенгал проба (РБП), кольцевая реакция с молоком (КР), реакция иммунодиффузии с О-ПС-антигеном (РИД);
у овец, коз, оленей, маралов, лошадей, верблюдов—серологический: РА, РСК/РДСК, РБП; аллергический;
у свиней — серологический: РСК/РДСК, РБП; аллергический;
у собак и животных других видов — серологический: РА, РСК.
Повторно животных исследуют на бруцеллез серологическим методом через 15...30 дней, аллергическим — через 25...30 дней.
Коров (нетелей), буйволиц, верблюдиц исследуют независимо от периода беременности, овцематок (козематок) и свиноматок— через 1...2 мес после родов, молодняк животных всех видов — начиная с 4-месячного возраста.
Крупный и мелкий рогатый скот, иммунизированный против бруцеллеза, исследуют в порядке и в сроки, предусмотренные наставлением по применению вакцины, и оценивают их состояние
по бруцеллезу.
Заболевание бруцеллезом считают установленным при выделении культуры бруцелл из биоматериала, положительной биопробе или при положительных результатах следующих серологических исследований невакцинированных животных: крупного рогатого скота (буйволов, яков, зебу), верблюдов и лошадей — одновременно в РИД и РА с титром антител 200 МЕ/мл и выше; овец и коз — в РА с титром антител 100 МЕ/мл и выше; оленей (маралов) и собак—в РА с титром антител 50 МЕ/мл и выше; животных всех видов — в РСК в разведении сыворотки 1 : 5 и выше.
При положительных результатах серологических исследований невакцинированных животных: крупного рогатого скота (буйволов, яков, зебу), верблюдов, лошадей — только в РА с титром антител 50...100 МЕ/мл; овец, коз, оленей (маралов) в РА с титром антител 25...50 МЕ/мл — обследуют повторно через 15...30 дней. При повышении титров заболевание считают установленным;
если титры остались прежними, прибегают к дополнительным исследованиям (согласно утвержденным Правилам).
Заболевание считают установленным, если в неблагополучных по бруцеллезу стадах крупного рогатого скота выявлены ранее не вакцинированные животные, положительно реагирующие в РА с титром антител 100 МЕ/мл и выше или (и) в РСК (РДСК) в разведении 1 : 5 и выше.
Иммунизированные отары овец и коз признают неблагополучными по бруцеллезу при положительном результате бактериологического исследования абортированных плодов или положительной биопробе, а также при выявлении среди баранов-производителей, пробников и ярок животных, положительно, реагирующих в РА с титром антител 100 МЕ/мл и выше, РСК в разведении сыворотки 1 : 5 и выше.
Свиней признают больными бруцеллезом, если аллергическая проба подтверждается положительной РСК.
Бруцеллин вводят свиньям с наружной стороны ушной раковины в дозе 0,2 мл. Реакцию учитывают через 24 и 48 ч пальпацией места инъекции. У больных животных на месте введения аллергена отмечают воспалительную реакцию в виде припухлости плотной или тестоватой консистенции. У здоровых местная реакция отсутствует.
Результаты обследования крупного рогатого скота в РИД и КР оценивают в соответствии с наставлениями по постановке и учету этих реакций.
ЗАДАНИЯ ДЛЯ САМОСТОЯТЕЛЬНОЙ РАБОТЫ
1. Исследовать под микроскопом готовые препараты.
2. Описать рост культуры бруцелл на питательных средах.
3. Оценить результаты заранее поставленных РА в пробирке и КР с молоком.
4. Поставить и учесть РБП на бруцеллез (рис. 8).

Занятие 26. Профилактика и ликвидация бруцеллеза
Цель занятия: изучить систему профилактических и оздоровительных мероприятий при бруцеллезе.
Материалы и оборудование: действующие Правила по профилактике и ликвидации бруцеллеза, дезсредства.
Место проведения занятия: аудитория кафедры эпизоотологии.
МЕТОДИЧЕСКИЕ УКАЗАНИЯ
Мероприятия в благополучных хозяйствах и населенных пунктах.
В плановом порядке обязательно исследуют на бруцеллез быков-производителей, коров, буйволов, зебу, яков, верблюдов, оленей (маралов) и телок в возрасте старше 1 года, баранов-производителей, овцематок (козематок), оставшихся без ягнят (козлят), хряков и свиноматок.
Лошадей и других животных исследуют в хозяйстве, неблагополучном по бруцеллезу, при выявлении признаков, дающих основание подозревать у них данное заболевание (бурситы и др.), а также перед снятием ограничений с фермы, признанной благополучной по бруцеллезу. Положительно реагирующих на бруцеллез лошадей направляют на убой.
В звероводческих хозяйствах ветеринарный контроль заключается в бактериологических исследованиях абортированных плодов.
В благополучных зонах, где не применяют противобруцеллезные вакцины или с момента окончания иммунизации взрослого поголовья крупного рогатого скота прошло более 4 лет, животных на бруцеллез исследуют в РА 1 раз в год перед переводом на стойловое содержание.
В хозяйствах, поставляющих молоко в детские и медицинские лечебные учреждения, санатории, дома отдыха и торговую сеть по прямым связям, крупный рогатый скот исследуют на бруцеллез 2 раза в год в РА и РСК или в РА и РИД (весной и перед переводом на стойловое содержание).
В племенных хозяйствах быков исследуют на бруцеллез 2 раза в год в РА и РСК или РА и РИД.
Всех животных, поступивших из других областей, исследуют в период карантина в РА и РСК. или РА и РИД (свиней в РСК/ РДСК и аллергическим методом).
Откормочное поголовье крупного и мелкого рогатого скота обследуют на бруцеллез перед сдачей на убой, но не ранее чем за 30 дней до отправки на мясокомбинат.
Мероприятия в неблагополучных пунктах. При установлении диагноза на бруцеллез местной администрации представляют проект решения о наложении ограничений и план оздоровления хозяйств от бруцеллеза.
Необеззараженное молоко, полученное от коров неблагополучного хозяйства, запрещается сдавать на молокоперерабатывающие предприятия, продавать на рынках, использовать в сети общественного питания и т. д. до полной ликвидации болезни и снятия ограничений. Такое молоко подлежит первичной обработке непосредственно в хозяйстве.
Молоко от коров с положительным результатом серологических исследований на бруцеллез обеззараживают кипячением или перерабатывают на топленое масло-сырец с соблюдением санитарных требований к производству пищевых продуктов.
Аналогично поступают с молоком, полученным в благополучных хозяйствах (населенных пунктах) от коров с положительным результатом исследований на бруцеллез до тех пор, пока не будет установлен (исключен) диагноз на эту болезнь.
Кипяченое молоко разрешается использовать в пищу, но запрещается поставлять в лечебно-профилактические, детские и школьные учреждения.
Молоко от коров с отрицательным результатом исследований
бруцеллез обеззараживают при температуре 70 "С в течение О мин, при температуре 85...90 "С в течение 20 с или кипячением.
Необеззараженное молоко (кроме молозива) и обезжиренное молоко запрещается использовать для кормления молодняка животных.
Молоко- и маслозаводы отпускают хозяйствам обезжиренное молоко пастеризованное или термически обработанное. Пахту и обезжиренное молоко, полученные при изготовлении топленого масла, используют в корм только животным данной фермы, запрещается давать их животным благополучных ферм и вывозить в другие хозяйства.
Молоко овец и коз с ферм, неблагополучных по бруцеллезу, запрещается использовать в пищу и для переработки.
Для оздоровления хозяйств применяют следующие схемы:
полностью ликвидируют поголовье неблагополучного хозяйства и санируют помещения, территорию ферм, пастбищ, водоемов и т. д.;
иммунизируют скот согласно утвержденным наставлениям по применению вакцин с последующим систематическим исследованием.
Метод полной замены неблагополучного поголовья применяют в следующих случаях:
при установлении бруцеллеза в благополучных областях, республиках;
при установлении бруцеллеза в благополучных районах неблагополучных областей, краев, республик, если в районах скот не иммунизирован против бруцеллеза;
при остром течении болезни, сопровождающемся массовыми абортами, а также если не удалось полностью ликвидировать болезнь в течение 2...5 календарных лет с помощью вакцинации.
Метод оздоровления неблагополучных хозяйств с использованием противобруцеллезных вакцин применяют по согласованию с Департаментом ветеринарии МСХ РФ в районах, областях, краях и республиках, где широко распространено заболевание.
Хозяйство, занимающееся разведением крупного рогатого скота, признают благополучным по бруцеллезу в следующих случаях:
при полной ликвидации неблагополучного поголовья, после санации животноводческих помещений и если дважды с интервалом 30 дней были получены отрицательные результаты серологических исследований на бруцеллез, включая собак, контактировавших с поголовьем неблагополучной фермы, и скот, принадлежащий жителям данного населенного пункта;
при использовании в системе оздоровления противобруцеллезных вакцин и получении двукратных (с интервалом 30 дней) отрицательных результатов серологических исследований всего поголовья крупного рогатого скота данного хозяйства, животных всех других видов, контактировавших с неблагополучным поголовьем включая скот, принадлежащий жителям данного населенного пункта, а также после санации помещений, территорий ферм, пастбищ и водопоя.
При установлении заболевания овец (коз) бруцеллезом в стационарно благополучных районах, областях, краях, республиках неблагополучное поголовье независимо от форм собственности вместе с приплодом немедленно направляют на убой. Остальное поголовье овец (коз), контактировавшее с неблагополучной отарой, исследуют серологическим методом двукратно с интервалом 30 дней.
Ограничения снимают при отрицательном результате исследований, а также после убоя неблагополучной отары, санации территории ферм и животноводческих помещений.
Неблагополучные по бруцеллезу буйволоводческие, яководческие, зебуводческие и верблюдоводческие фермы (стада) оздоравливают в таком же порядке, как и стада крупного рогатого скота.
На фермах и комплексах, где установлено заболевание свиней бруцеллезом, все поголовье, в том числе и молодняк, сдают на убой (супоросных свиноматок—после окончания опороса и отъема поросят). Очаг бруцеллеза ликвидируют в течение не более 6 мес. На неблагополучной ферме запрещено осеменять свиноматок.
Чтобы выявить очаги бруцеллеза среди северных оленей, прибегают к клиническому осмотру поголовья. Животных с признаками заболевания (аборты, орхиты, эпидидимиты, бурситы и др.) выделяют из стада, исследуют на бруцеллез серологическим методом (РБП или РА и РСК, РДСК), в случае положительной реакции — направляют на убой. Кроме того, у взрослых оленей, поступивших на убой на мясо, также берут кровь для серологического исследования на бруцеллез. Оленей в неблагополучных по бруцеллезу стадах исследуют серологическим методом и 1 раз в квартал клиническим методом.
Хозяйство (стадо оленей) признают благополучным по бруцеллезу, если в течение последних 2 лет в нем не было выявлено животных с клиническими признаками заболевания, при серологическом исследовании получены отрицательные результаты и в хозяйстве выполнены ветеринарно-санитарные мероприятия.
В звероводческих хозяйствах, где установлен бруцеллез, животных исследуют 1 раз в месяц серологическим методом. Положительно реагирующих зверей (самок вместе с пометом) содержат в изоляторе до убоя на мех. Ограничения снимают после убоя положительно реагирующих животных, получения отрицательных результатов серологических исследований оставшихся зверей и санации помещений фермы.
Если бруцеллез установлен среди крупного рогатого скота частных ферм, все поголовье исследуют серологическим методом (РА рсК или РА и РИД) до получения двукратных отрицательных на неблагополучных фермах обязательны дезинфекция, дезинсекция, дератизация, санитарный ремонт животноводческих помещений и другие ветеринарно-санитарные мероприятия в соответствии с действующими Правилами.
Для дезинфекции применяют 20%-ю взвесь свежегашеной извести, взвесь или осветленный раствор хлорной извести, содержащий 2 % активного хлора, препарат ДП-2, 2%-й горячий раствор гидроксида натрия, 3%-й горячий раствор каустифицированной содопоташной смеси, 2%-й раствор формальдегида, 5%-й горячий раствор кальцинированной соды, 0,5%-й раствор глутарового альдегида, 5%-й раствор технического фенолята натрия, растворы нейтрального гипохлорита кальция, тексанита, содержащие 3 % активного хлора.
Очищенные и герметически закрытые помещения дезинфицируют в отсутствие животных аэрозольным методом с помощью 40%-го водного раствора формальдегида.
Навоз обеззараживают одним из способов в порядке, предусмотренном Рекомендациями по обеззараживанию навоза в хозяйствах, неблагополучных по туберкулезу и бруцеллезу.
ЗАДАНИЕ ДЛЯ САМОСТОЯТЕЛЬНОЙ РАБОТЫ
Составить план оздоровительных мероприятий в хозяйстве, неблагополучном по бруцеллезу крупного рогатого скота.
Занятие 27. Диагностика, профилактика и ликвидация ящура
Цель занятия: изучить методы диагностики ящура и систему профилактических и оздоровительных мероприятий.
Материалы и оборудование: действующие Правила по профилактике и ликвидации ящура, вакцины против ящура, плакаты, слайды, кинофильм «Ящур сельскохозяйственных животных».
Место проведения занятия: аудитория кафедры эпизоотологии.
МЕТОДИЧЕСКИЕ УКАЗАНИЯ
Ящур — высококонтагиозная, остропротекающая болезнь домашних и диких парнокопытных животных, вызываемая афтовирусом из семейства Picornaviridae.
Методы диагностики. Диагноз устанавливают на основании эпизоотологческих данных, клинических признаков, патологоанатомических изменений и результатов лабораторных исследований.
При анализе эпизоотологических данных учитывают все связи хозяйства далеко за пределами республики, а также возможность передачи вируса перелетными птицами, транспортом, даже не связанным с животными.
По клиническим признакам во многих случаях удается установить точный диагноз. Первый симптом заболевания — повышение температуры тела до 41 °С. У больных отмечают учащение пульса покраснение слизистой оболочки ротовой полости, конъюнктивит ты, отечность венчика копыт. При появлении в ротовой полости афт у животных обильно выделяется слюна, отмечают своеобразное причмокивание. При поражении конечностей животное часто переступает.
Наряду с доброкачественным наблюдают и злокачественное течение болезни, особенно у телят, которое характеризуется сильной депрессией и слабостью, иногда гастроэнтеритом, тахикардией и параличом сердца.
У овец ящур протекает легче, чем у крупного рогатого скота, почти всегда с высокой температурой (40...41,5 °С), через 3 дня в ротовой полости появляются везикулы и затем афты. Слюнотечения не бывает. Поражаются дистальные отделы конечностей, в результате возникает хромота.
Ящур у свиней проявляется образованием афт на пятачке, вымени и на венчике копытец. Животные много лежат, передвигаются ползком, опираясь на запястные суставы; иногда спадает роговой башмак.
Для лабораторных исследований отправляют (с нарочным) афтозный материал — не менее 5 г. У крупного рогатого скота берут стенки созревших непрорвавшихся афт с языка, у свиней — с пятачка или вымени, у овец и коз — с беззубого края верхней челюсти. Материал помещают во флакон с консервирующей жидкостью, состоящей из смеси равных частей химически чистого глицерина и фосфатно-буферного раствора (рН 7,4...7,6).
Вирус ящура идентифицируют с помощью серологических реакций: РСК, РДСК, РУСК (реакция ускоренного связывания комплемента), РДП, РПГА (реакция пассивной гемагглютинации).
При определении типов и вариантов используют также биологические методы исследований — проверяют перекрестный иммунитет переболевших и вакцинированных животных, ставят реакцию серозащиты на мышатах-сосунах, РН-вируса в культуре клеток.
В трудных случаях патологический материал разрешается исследовать методом биопробы на морских свинках или восприимчивых сельскохозяйственных животных
1. Схема противоэпизоотических мероприятий при ящуре

Профилактические и оздоровительные мероприятия. Все мероприятия организуют строго по инструкции «О мероприятиях по предупреждению и ликвидации заболевания животных ящуром», 1985 г. (схема 1). Их успех во многом зависит от правильности определения границ эпизоотического очага, неблагополучного пункта и угрожаемой зоны. Строгих критериев для определения границ эпизоотического очага нет, в каждом конкретном случае необходим тщательный эпизоотологический анализ.
ЗАДАНИЕ ДЛЯ САМОСТОЯТЕЛЬНОЙ РАБОТЫ
Решить эпизоотологическую задачу.
На мелочно-товарных фермах шести хозяйств одновременно заболели телята. При эпизоотологическом обследовании установлено, что все хозяйства находятся в зоне обслуживания одного молокозавода. Молоко из хозяйств поступало на молокозавод, откуда хозяйства получали обезжиренное молоко, которое использовали в корм телятам без пастеризации.
При клиническом исследовании коров в хозяйствах—поставщиках молока в одном из них выделено несколько животных, у которых на слизистой верхней губы и языке обнаружены афты и заживающие эрозии.
1. Установить предварительный диагноз.
2. Назначить дополнительные исследования для уточнения диагноза.
3. Определить границы эпизоотического очага, неблагополучного пункта и угрожаемой зоны.
4. Составить проект решения о наложении карантина.
5. Разработать план противоэпизоотических мероприятий.
Занятие 28. Диагностика, профилактика и ликвидация бешенства
Цель занятия: изучить методы диагностики бешенства, систему профилактических и оздоровительных мероприятий.
Материалы и оборудование: мазки из ткани мозга с тельцами Бабеша—Негри, положительные реакции преципитации в агаровом геле, диапозитивы, кинофильмы, плакаты, образцы вакцин, ветеринарное законодательство.
Место проведения занятия: аудитория кафедры эпизоотологии.
МЕТОДИЧЕСКИЕ УКАЗАНИЯ
Бешенство — острая болезнь, вызываемая вирусом из семейства Rabdoviridae, опасная для всех теплокровных животных и человека.
Методы диагностики. Диагноз устанавливают на основании
эпизоотологических данных, клинических наблюдений, патолого-анатомического и лабораторного исследований.
При эпизоотологическом исследовании принимают во внимание характер эпизоотической ситуации в данной местности и соседних районах, учитывают сезонность болезни и данные анамнеза, свидетельствующие о нападении или появлении подозрительных по заболеванию диких хищников или собак.
Из клинических признаков наиболее важны непровоцируемая агрессивность, парезы и параличи, развивающиеся в определенной последовательности. При изучении клинической картины необходимо иметь в виду атипичную форму болезни, или так называемое <лисье бешенство», которое у крупного рогатого скота протекает Кратковременно и проявляется клинически в основном тимпаний а также парезами и параличами.
Лабораторные методы диагностики бешенства имеют исключительно важное значение. В лабораторию с нарочным направляют трупы целиком или головы мелких животных, а от крупных— головы. Трупы, головы пересылают в двойных полиэтиленовых мешках, в металлических контейнерах или в другой влагонепроницаемой таре. При взятии и упаковке материала обязательно соблюдают меры предосторожности: работают в перчатках, защитных очках, тщательно моют руки с мылом.
Комплексный лабораторный анализ включает в себя гистологическое исследование с целью обнаружения телец-включений Бабеша—Негри, серологическое — РП в агаровом геле, метод флюоресцирующих антител и биопробу на белых мышах-сосунах или кроликах. Обнаруженный вирус идентифицируют в РН на мышах.
Разработаны новые методы диагностики бешенства — радиоиммунный анализ (РИА), экспресс-диагностика методом иммуноферментного анализа (ИФА). Перспективна идентификация вируса с помощью наборов моноклональных антител.
При дифференциальной диагностике необходимо исключить болезнь Ауески, у собак—нервную форму чумы и у лошадей— инфекционный энцефаломиелит.
Профилактические и оздоровительные мероприятия. Все мероприятия регламентированы действующими Правилами и в основном сводятся к следующему.
Контролируют и регулируют численность диких хищных животных, отлавливают бродячих собак и кошек. По рекомендации МЭБ (1976 г.) в неблагополучной по бешенству местности количество лис не должно превышать 1 ...2 особи на 10 км2.
Ведут строгий учет домашних кошек и собак, регламентируют условия их содержания.
Во всех населенных пунктах РФ всех собак независимо от их принадлежности, а в некоторых случаях и кошек обязательно вакцинируют против бешенства. В нашей стране применяют следующие вакцины: сухую инактивированную этанол-вакцину (ВГНКИ); сухую культуральную инактивированную вакцину из штамма «Щелково-51»; культуральную лиофилизированную и культуральную сорбированную вакцину из штамма ТС-80 (ВНИ-ИВВиМ); вирусвакцину для оральной иммунизации плотоядных животных против бешенства (синраб) (ВНИИЗЖ).
В зонах стационарного неблагополучия по бешенству диких хищников необходима плановая профилактическая вакцинация крупного рогатого скота. При наличии хозяйственных возможности 2 раза в год (февраль-апрель и октябрь—декабрь) иммунизируют диких хищников оральным методом.
При установлении бешенства на населенный пункт накладывают карантин и приступают к оздоровительным мероприятиям согласно действующим Правилам.
Карантин снимают решением органов местной администрации через 2 мес со дня последнего случая заболевания при условии выполнения запланированных противоэпизоотических и профилактических мероприятий.
ЗАДАНИЕ ДЛЯ САМОСТОЯТЕЛЬНОЙ РАБОТЫ
Решить эпизоотологическую задачу.
Район благополучен по бешенству. В стадо коров во время пастьбы забежал волк и покусал нескольких животных. Волка не поймали. Особенно большие (10 х 15 см) и глубокие раны были на голове, шее, подгрудке у одной коровы. Ввиду сильного кровотечения из ран корова прирезана пастухом.
1. Перечислить животных — носителей вируса бешенства в природе.
2. Решить, как поступить с мясом от вынужденно убитой коровы.
3. Разработать план мероприятий по профилактике бешенства и ликвидации эпизоотического очага.
Занятие 29. Диагностика, профилактика и ликвидация болезни Ауески в свиноводческих и звероводческих хозяйствах
Цель занятия: изучить методы диагностики болезни Ауески, систему профилактических и оздоровительных мероприятий.
Материалы и оборудование: зараженные кролики; диапозитивы, диафильмы, плакаты, таблицы, схемы по системе мероприятий.
Место проведения занятия: аудитория кафедры эпизоотологии.
МЕТОДИЧЕСКИЕ УКАЗАНИЯ
Болезнь Ауески — заболевание животных всех видов. Возбудитель — вирус из семейства Herpesviridae.
Методы диагностики. Диагноз устанавливают на основании комплекса данных — эпизоотологических, клинических, патологоанатомических и лабораторных.
Эпизоотологическое обследование начинают с выявления источника возбудителя инфекции. При обследовании хозяйства необходимо учитывать случаи заболевания и падежа собак и кошек, массовую гибель грызунов.
Важнейшим из клинических признаков болезни служит зуд, сопровождающийся расчесами кожи. У свиней зуда не бывает. У поросят наблюдают симптомы энцефаломиелита, а у взрослых свиней — гриппоподобное переболевание с признаками пневмонии.
Патологоанатомические изменения при болезни Ауески нехарактерны.
Диагноз подтверждают с помощью лабораторных методов— биопробы на кроликах или молодых кошках и вирусологического исследования.
В лабораторию направляют труп целиком или его части (голову или головной мозг, кусочки паренхиматозных органов, от свиней — обязательно легкие) и лимфоузлы. Используют методы вирусологической и серологической диагностики: РН на кроликах;
выделение вируса и серологическую идентификацию в культуре клеток. РСК, РДП, РНГА, РИФ применяют для ретроспективной диагностики болезни.
Профилактические и оздоровительные мероприятия. Свиноводческое хозяйство, в котором установлена болезнь Ауески, объявляют неблагополучным и накладывают карантин. Больных и подозрительных по заболеванию животных изолируют и лечат глобулином. Животных всех возрастных групп кормят только в станках. Кормушки после каждого кормления дезинфицируют. Новорожденным поросятам до дачи молозива, поросятам-сосунам, подозреваемым в заражении, свиноматкам за 2 недопороса вводят с профилактической целью специфический глобулин и через 3 нед вакцинируют. Все остальное клинически здоровое поголовье вакцинируют сразу.
Свиноматок, хряков, переболевших болезнью Ауески, а также молодняк, как переболевший, так и неболевший, из неблагополучных свинарников откармливают и сдают на убой.
Карантин снимают через 1 мес со дня последнего случая заболевания и сдачи на убой переболевшего поголовья. Свиноводческие хозяйства считают благополучными по болезни Ауески, если в течение 6 мес со дня последней вакцинации получен здоровый приплод.
В звероводческих хозяйствах мясные корма, в которых подозревают наличие вируса болезни Ауески, заменяют другими. Больным и подозреваемым в заболевании животным вводят специфический глобулин и назначают симптоматическое лечение. Животных, подозреваемых в заражении, вакцинируют.
Карантин снимают через 15 дней со дня последнего случая заболевания, сдачи на убой переболевших животных и после заключительных ветеринарно-санитарных мероприятий.
Для профилактики болезни Ауески применяют сухую культуральную вирусвакцину ВГНКИ против болезни Ауески свиней, крупного рогатого скота и овец; сухую культуральную вирусвакцину из штамма БУК-628 против болезни Ауески свиней; инактивированную культуральную концентрированную вакцину УНИЭВ лротив болезни Ауески пушных зверей, овец и свиней; концентрированную эмульгированную вакцину БАК против болезни Ауески; вирусвакцину Суибивак ассоциированную сухую культуральную против болезни Ауески и чумы свиней.
ЗАДАНИЕ ДЛЯ САМОСТОЯТЕЛЬНОЙ РАБОТЫ
Решить эпизоотологическую задачу.
На свиноферме среди поросят-сосунов появилось массовое заболевание. Поросята не могут двигаться, сосать, у них наблюдают спазм глотки, слюнотечение. Некоторые внешне здоровые животные внезапно падают в приступе клонических судорог, при этом отмечают скрежет зубами, слюнотечение, параличи и смерть, у других появляются судороги шейных и жевательных мышц, повышается кожная чувствительность, возникают конъюнктивиты. Животные падают и, лежа на боку с запрокинутой головой, судорожно двигают конечностями или принимают позу сидячей собаки, совершая головой круговые движения.
1. Установить диагноз.
2. Составить план оздоровительных мероприятий.
Занятие 30. Диагностика, лечение, профилактика и ликвидация лептоспироза
Цель занятия: изучить методы диагностики лептоспироза, систему профилактических и диагностических мероприятий.
Материалы и оборудование: плакаты, диафильмы, вакцины, диагностикумы. Место проведения занятия: аудитория кафедры эпизоотологии.
МЕТОДИЧЕСКИЕ УКАЗАНИЯ
Лептоспироз — инфекционная природно-очаговая болезнь диких, домашних животных и человека, широко распространенная в различных ландшафтно-географических зонах мира. Возбудитель — патогенные спирохеты рода Leptospira.
Методы диагностики. Диагноз на лептоспироз устанавливают на основании комплекса данных — эпизоотологических, клинических, патологоанатомических и лабораторных.
Согласно эпчзоопгологчческим данным болеют домашние животные всех видов (чаще свиньи и крупный рогатый скот), любого возраста, но молодняк более восприимчив, и болезнь у него протекает тяжелее, чем у взрослых. Источники возбудителя лептоспирозной инфекции подразделяют на 2 группы. К первой относят грызунов и насекомоядных, которые служат основными хозяевами (резервуаром) возбудителя в природе; ко второй—домашних животных (свиней, мелкий и крупный рогатый скот, лошадей, собак), а также пушных зверей клеточного содержания, формирующих антропургические (сельскохозяйственные) очаги.
Основные клинические признаки болезни: повышение температуры тела, резкое угнетение, слабость, желтушность слизистых Волочек, некроз кожи, нарушения сердечно-сосудистой системы, желудочно-кишечного тракта, у беременных животных —аборт. Пептоспироз у животных протекает молниеносно, остро, подостро, хронически.
При патологоансипомическом исследовании обнаруживают желтуху или анемию, геморрагический диатез, некроз кожи и слизистых оболочек, дистрофические и воспалительные изменения в паренхиматозных органах. Печень увеличена, от глинисто-красного до охряно-желтого цвета, упругой, дряблой или ломкой консистенции. Желчный пузырь растянут и переполнен густой желчью темно- или буро-зеленого цвета. Почки также увеличены, дряблые. Границы коркового и мозгового слоев сглажены.
Лабораторные методы диагностики включают в себя серологические, бактериологические и гистологические исследования. В лабораторию отправляют кровь, мочу, органы и ткани, а также трупы мелких животных.
Серологический метод основан на обнаружении специфических антител в крови животных реакцией микроагглютинации (РМА) и реакцией иммуноадсорбции (РИА). По результатам серологических исследований диагноз на лептоспироз считают установленным, если специфические антитела обнаружены в сыворотке крови при однократном исследовании в РМА в титре 1 : 100 у вакцинированных и в титре 1 : 50 и выше у более чем 25 % невакцинированных животных. Лептоспироз считают причиной абортов при обнаружении антител в сыворотке крови абортированного плода. Предполагают заболевание при высоком титре антител (1 :2500 и более) в группе абортировавших животных и низком титре (1 : 500) или отрицательной реакции в группе клинически здоровых животных.
Гистологический метод основан на обнаружении лептоспир в гистосрезах, импрегнированных серебром. При микроскопии лептоспиры чаще обнаруживают на поверхности эпителия и в просвете мочевых канальцев почек, несколько реже — в цитоплазме эпителия, преимущественно группами. Лептоспиры окрашиваются в черный цвет, а окружающая ткань — в буровато-желтый.
Бактериологический метод заключается в обнаружении лептоспир в исследуемом материале путем темнопольной микроскопии (рис. 9) и иммунофлюоресцентным методом, выделении чистой культуры на специальных средах, ее идентификациии и дифференциации, биопробе на лабораторных животных.
Посевы культивируют при 20...28 °С в течение 3 мес. Иногда лептоспиры обнаруживают в средах на З...5-е сутки или через 1...2 мес и очень редко — через 2...3 мес культивирования.
Серовариантную принадлежность изолятов лептоспир изучают в РИА: сначала устанавливают се-рогрупповую принадлежность, а затем с помощью перекрестной РМА определяют степень антигенного родства каждого исследуемого штамма со всеми штаммами-эталонами, входящими в состав данной серогруппы. Серогруппо-вую или серовариантную принадлежность культур лептоспир можно установить с помощью моноклональных антител.

Рис.9.
Культура лептоспир
при микроскопии в темном поле
Вирулентность выделенной культуры изучают на золотистых хомячках или крольчатах, которых заражают внутрибрюшинно 5...7-дневной культурой, содержащей 70...100 лептоспир в поле зрения микроскопа. Высоковирулентные культуры вызывают гибель животных в дозе менее 0,1 мл, средней вирулентности — 0,2... 0,4мл и слабовирулентные — 0,5...1,0 мл.
По результатам бактериологических исследований диагноз на лептоспироз считают установленным, а хозяйство — неблагополучным по лептоспирозу в любом из следующих случаев:
при обнаружении методом микроскопии лептоспир в крови или суспензии из органов животных, абортированном плоде, моче или органах зараженных лабораторных животных;
обнаружении методом флюоресцирующих антител в исследуемом материале бактерий с морфологией, типичной для лептоспир, при интенсивности свечения не менее чем в два креста;
выделении культуры лептоспир из исходного материала или органов лабораторного животного, зараженного исходным материалом.
Лептоспироз считают причиной:
гибели животных—при наличии клинических признаков и патологических изменений, характерных для лептоспироза, специфичность которых подтверждена обнаружением лептоспир в крови паренхиматозных органах;
абортов—при обнаружении лептоспир в органах (тканях) Сортированного (мертворожденного) плода.
Профилактические и оздоровительные мероприятия. Чтобы своевременно выявить лептоспироз, исследуют сыворотку крови животных: в племенных хозяйствах — всех производителей 2 раза в год' свиней, крупный и мелкий рогатый скот, лошадей — поголовно перед ввозом (вывозом) для племенных и пользовательных целей (за исключением откормочной группы); во всех случаях при подозрении на лептоспироз.
Чтобы не допустить заноса заболевания в хозяйство, необходимо:
контролировать клиническое состояние животных, число абортов и при подозрении на лептоспироз отправлять материал для лабораторного анализа;
исследовать всех поступающих в хозяйство животных в период 30-дневного карантина на лептоспироз в РМА в разведении сыворотки 1 : 25 (свиней, ввозимых в хозяйство для племенных целей, — путем микроскопии мочи независимо от результатов серологических исследований); не выпасать невакцинированных животных на территории природных очагов лептоспироза;
систематически уничтожать грызунов в животноводческих помещениях, на территории ферм и в местах хранения кормов.
Разрешается комплектовать откормочное хозяйство клинически здоровыми животными без обследования на лептоспироз, но с обязательной вакцинацией их против лептоспироза в период карантина.
При установлении диагноза на лептоспироз в хозяйстве вводят ограничения и в плане оздоровительных мероприятий предусматривают необходимые диагностические исследования животных, ветеринарно-санитарные и организационно-хозяйственные мероприятия.
После клинического осмотра больных и подозрительных по заболеванию животных изолируют, лечат гипериммунной сывороткой и антибиотиками, указанными в наставлениях по их применению.
Убой таких животных разрешен на санитарной бойне. Помещение и оборудование после убоя дезинфицируют. Если установлен лептоспироз и обнаружены дегенеративные изменения мышц или их желтушное окрашивание, не исчезающее в течение 2 сут, тушу и внутренние органы направляют на утилизацию. При отсутствии дегенеративных изменений в мышцах, но при наличии желтушного окрашивания, исчезнувшего в течение 2 сут, тушу, а также внутренние органы без патологоанатомических изменений выпускают после проварки. Кишечник и патологически измененные органы направляют на утилизацию.
Туши и другие продукты, полученные от убоя животных с положительным результатом серологического исследования на лептоспироз, но без клинических признаков или патологоанатомических изменений в мышечной ткани и органах, выпускают без ограничений.
Клинически здоровых животных всех видов и возрастных групп, восприимчивых к лептоспирозу, вакцинируют. Животных, которых лечили, вакцинируют через 5...7 дней после выздоровления.
Всех животных откормочных хозяйств откармливают и сдают на убой. Маточное поголовье, производителей и ремонтный молодняк, который необходимо сохранить для воспроизводства, после вакцинации обрабатывают лептоспироцидными препаратами и переводят в продезинфицированные помещения.
Сперму производителей, инфицированных лептоспирами (положительная РМА, лептоспиры в моче), не используют и исходя из хозяйственной целесообразности направляют таких животных на убой или обрабатывают стрептомицином, дезинфицируют помещения. Все поголовье вакцинируют против лептоспироза. Через 10...15 дней эффективность лечения контролируют путем микроскопии мочи. При обнаружении лептоспир в моче повторяют курс лечения и вновь проверяют его эффективность. От быков, признанных здоровыми, продолжают использовать сперму.
Сыворотку крови повторно исследуют в РМА и микроскопируют мочу всех производителей на ранее неблагополучном по лептоспирозу предприятии (станции) через 3 мес и при получении отрицательных результатов —далее каждые 6 мес.
В питомниках служебного собаководства изолируют клинически больных и подозрительных по заболеванию собак, лечат их гипериммунной сывороткой и стрептомицином. Всех остальных собак вакцинируют.
Ограничения в неблагополучных по лептоспирозу хозяйствах снимают в следующем порядке:
в откормочных хозяйствах — после сдачи поголовья на убой и заключительных ветеринарно-санитарных мероприятий;
в племенных и пользовательных хозяйствах — после установления их благополучия по лептоспирозу с помощью лабораторных методов;
животных повторно исследуют на лептоспироз в ранее неблагополучных хозяйствах через 6 мес после снятия ограничений;
хозяйство считают благополучным по лептоспирозу при получении отрицательных результатов исследований всех животных.
Разрешается вывозить животных для племенных и пользовательных целей только из хозяйств, благополучных по лептоспирозу.
Животных, предназначенных для продажи, содержат в карантине и исследуют сыворотку крови в РМА, у свиней, кроме того, — мочу на наличие лептоспир. При выявлении у отдельных животных антител в крови или лептоспир в моче всю группу оставляют в хозяйстве и применяют дополнительные методы диагностики, чтобы решить вопрос о благополучии хозяйства по лептоспирозу.
Для специфической профилактики используют: поливалентную вакцину ВГНКИ и концентрированную вакцину против лептоспироза животных; ассоциированную вакцину против лептоспироза и парвовирусной инфекции свиней; ассоциированную вакцину против лептоспироза и эмфизематозного карбункула крупного рогатого скота; ассоциированную вакцину против лептоспироза и кампилобактериоза крупного рогатого скота; вакцину против лептоспироза собак; инактивированную жидкую вакцину против лептоспироза; вакцину против чумы плотоядных, инфекционного гепатита, аденовироза, парвовирусного энтерита и лептоспироза собак («Гексаканивак»).
Во всех случаях выбор вакцины зависит от эпизоотической обстановки хозяйства. Вакцинируют всех восприимчивых животных в неблагополучных по лептоспирозу хозяйствах; в откормочных хозяйствах, где поголовье комплектуют без обследования на лептоспироз; при выпасе животных в зоне природного очага лептоспироза; при выявлении в хозяйстве животных, сыворотка крови которых реагирует в РМА; в районах с отгонным животноводством.
ЗАДАНИЕ ДЛЯ САМОСТОЯТЕЛЬНОЙ РАБОТЫ
Разработать схему дифференциальной диагностики болезней, сопровождающихся абортами (бруцеллез, лептоспироз, хламиди-оз, листериоз, кампилобактериоз, инфекционный ринотрахеит).
Занятие 31. Диагностика, профилактика и ликвидация листериоза
Цель занятия; изучить методы диагностики листериоза, систему профилактических и оздоровительных мероприятий.
Материалы и оборудование: таблицы, диапозитивы, биопрепараты (диагности-кумы, вакцины).
Место проведения занятия: аудитория кафедры эпизоотологии.
МЕТОДИЧЕСКИЕ УКАЗАНИЯ
Листериоз — инфекционная болезнь животных и человека, возбудитель которой Listeria monocytogenes—подвижная полиморфная грамположительная мелкая палочка. Листерии широко распространены во внешней среде, сравнительно высокоустойчивы:
при низких температурах (4...6°С) длительное время (до нескольких лет) сохраняются в почве, воде, соломе, зерне. Размножаются в почве, воде, молоке, мясе, силосе, а также в трупах.
Методы диагностики. Диагноз на листериоз устанавливают на основании эпизоотологических данных, клинических признаков, патологоанатомических изменений, а также результатов лабораторных исследований.
Согласно эпизоотологическим данным листериоз поражает домашних и сельскохозяйственных животных—свиней, мелкий и крупный рогатый скот, лошадей, кроликов, реже — кошек и собак, а также домашнюю и декоративную птицу — гусей, кур, уток, индюшек, голубей, попугаев и канареек. Более восприимчив молодняк и беременные животные. Источник возбудителя инфекции—больные, листерионосители (5...90 %); основной резервуар —дикие и синантропные грызуны. Возбудитель передается фекально-оральным, контактным, аэрогенным, трансплацентарным путем и через поврежденную кожу; выделяется из организма с истечениями из носа, половых органов, с абортированными плодами, молоком, калом и мочой.
Клинические признаки зависят от формы и течения болезни. Наиболее характерные симптомы: угнетение, снижение аппетита, нарушение координации движений, судороги, парез нижней челюсти, конъюнктивит, потеря зрения (кератит), расстройство желудочно-кишечного тракта, повышение температуры тела, аборты, задержание последа, маститы.
Патологоанатомические изменения также зависят от формы и течения болезни. При нервной форме отмечают отек мозга, кровоизлияния в мозговой ткани и отдельных внутренних органах. При септической форме находят изменения, свойственные септическому процессу, — кровоизлияния в паренхиматозных органах, увеличение селезенки и дегенеративные изменения во всех органах, а также отек или гиперемию легких; при генитальной — поражения матки (десквамация эпителия, эрозии, кровоизлияния).
Лабораторная диагностика состоит из бактериологического, серологического и гистологического исследований. Для посмертной диагностики в ветеринарную лабораторию направляют трупы мелких животных или голову (головной мозг), паренхиматозные органы (часть печени, селезенку, почку, пораженные участки легких), абортированный плод и его оболочку. Материал посылают свежим или консервируют 30%-м водным раствором глицерина. Для гистологического исследования используют кусочки головного (все отделы) и спинного мозга, а также паренхиматозных органов, зафиксированные в 10%-м растворе нейтрального формалина.
Для прижизненной диагностики на бактериологическое исследование отправляют истечения из половых органов самок, у которых отмечены аборты; при маститах — молоко из пораженных долей вымени; на серологическое—кровь или сыворотку крови от больных или подозрительных по заболеванию животных (желательно парные сыворотки, взятые с интервалом 7...14 дней).
Бактериологический метод диагностики при листериозе — решающий. Мазки из исходного материала окрашивают по Граму, а также методами флюоресцирующих антител (прямой и непрямой). Для выделения чистой культуры используют обычный или печеночный агар и бульон с добавлением 1 % глюкозы и 2...3 % глицерина, а также кровяной агар и элективные среды (с теллуритом калия, с теллуритом калия и флоримицином или полимиксином). Черный цвет колоний обусловлен восстановлением теллурита калия до металлического теллура. Характерные признаки возбудителя листериоза — помутнение бульона и появление мелких росинчатых колоний на агаре, формирование зоны р-гемолиза на кровяном агаре. Колонии листерий в проходящем свете — голубого цвета с зеленоватым оттенком и мелкозернистые по структуре. Идентификация состоит из нескольких направлений. Определяют подвижность, исследуя 6...12-часовую культуру, ферментативные свойства (пестрый ряд). Листерий идентифицируют серологически — в РА на стекле с поливалентной листериозной агглютинирующей сывороткой, а также конъюнктивальной пробой на морских свинках или внутрикожной пробой на морских свинках или кроликах. На конъюнктиву морской свинке наносят 2 капли исследуемой бульонной культуры и легко массируют веки ватным тампоном. При положительном результате на 2...4-й день развивается гнойный конъюнктивит. При внутрикожной (дермонекротической) пробе в тщательно выстриженный участок на боку морской свинке или кролику вводят 0,3...0,5 мл бульонной культуры. Через 24...48 ч возникает воспаление с последующим некрозом и образованием струпа.
Для биопробы используют 2...3 белых мышей. Суспензию головного мозга, внутренних органов или чистой культуры вводят животным подкожно или внутрибрюшинно в дозе 0,3...0,5 мл. Чтобы повысить эффективность биопробы, мышам за З...4ч до заражения инъецируют внутримышечно кортизон в дозе 5 мг. При положительной биопробе животные погибают через 2...6сут. На вскрытии отмечают множественные некротические очажки в печени, селезенке, почках (иногда они отсутствуют). Срок наблюдения за животными 14 сут.
С помощью гистологического исследования тканей головного и спинного мозга при поражении бактериальными формами листерий обнаруживают хорошо выраженные пролиферативные изменения, отек, дегенерацию нейронов, нейронофагию, а при поражении Z.-формами — энцефалопатию, сопровождающуюся дистрофическими изменениями без пролиферации клеток.
Для серологической диагностики применяют PA, PCK, РНГА и РИФ, с помощью которых устанавливают диагноз, выявляют листерионосительство и хронически больных животных. Кроме того, при исследовании парных сывороток (ретроспективная диагностика) нарастание титра антител в 2...4 раза подтверждает диагноз на листериоз.
Используют также прямой (ПМФА) и непрямой (НМФА) методы флюоресцирующих антител, с помощью которых можно идентифицировать возбудителя в культурах, обнаружить листерии в органах и тканях, а также определить их серогрупповую принадлежность. При люминесцентной микроскопии для листерии характерно ярко выраженное золотисто-зеленоватое свечение, четко заметны морфологические особенности бактерий и темная центральная зона клетки.
Профилактические и оздоровительные мероприятия. В целях профилактики комплектуют фермы животными только из благополучных по листериозу хозяйств. Строго учитывают все случаи абортов, мертворождения и падежа и направляют патологический материал для лабораторного анализа. При маститах исследуют молоко бактериологическим методом.
При выявлении больных листериозом животных в хозяйстве проводят тщательное эпизоотологическое обследование.
При установлении диагноза на листериоз хозяйство объявляют неблагополучным и вводят ограничения.
Осматривают все поголовье и выбраковывают клинически больных животных. Чтобы выявить животных листерионосителей и бессимптомно больных, исследуют сыворотки крови. Положительно реагирующих изолируют, лечат антибиотиками и затем направляют на убой. Остальных вакцинируют сухой живой вакциной из штамма АУФ согласно наставлению по ее применению.
Туши и продукты убоя больных и подозрительных по заболеванию животных запрещается выпускать в сыром виде. Если обнаружены дегенеративные и другие патологические изменения в мышцах (абсцессы и т.д.),тушу и внутренние органы направляют на утилизацию; при отсутствии патологических изменений — исследуют на сальмонеллез бактериологическим методом. В случае обнаружения сальмонелл внутренние органы направляют на утилизацию или уничтожают, а туши проваривают и используют для изготовления консервов. При отсутствии сальмонелл туши, шпик и внутренние органы перерабатывают на вареные, варено-копченые колбасы и консервы или проваривают. При листериозе мясо, кроме того, разрешается использовать на изготовление вареных колбас, варено-копченых грудинок и кореек.
Патологически измененные органы, кишки и кровь, а также головы от животных, больных листериозом, во всех случаях направляют на утилизацию с обработкой при температуре не менее 100 "С или проваривают при той же температуре в течение 1ч.
Молоко, полученное от животных, давших положительный результат в серологической реакции, кипятят в течение 15 мин или перерабатывают на топленое масло.
Для искусственного осеменения используют сперму здоровых производителей.
Непременное условие эффективности оздоровительных мероприятий — регулярная дезинфекция, дезинсекция и дератизация. Навоз обеззараживают биометрическим способом. Для дезинфекции используют осветленный раствор хлорной извести с содержанием 2 % активного хлора, 3%-й горячий раствор гидроксида натрия, 5%-й раствор хлорида йода или ксилонафт.
Пробы силоса, хранящегося в траншеях или буртах, направляют на бактериологическое исследование. В случаях контаминации силосной массы листериями весь силос обеззараживают биотермическим способом.
Хозяйство (ферму, отделение, двор) объявляют благополучным по листериозу через 2 мес со дня последнего случая выявления клинически больных животных и после заключительной дезинфекции помещений и территории фермы.
Допускается вывозить овец для племенных и пользовательных целей в течение 2 лет после оздоровления хозяйств только при условии отрицательного результата серологического исследования. Вывоз животных других видов разрешается при тех же условиях в течение 1 года. Кроме того, разрешается без ограничений сдавать животных на мясокомбинат.
В хозяйствах, ранее неблагополучных по листериозу, животных исследуют серологическим методом 1 раз в год перед постановкой на стойловое содержание до тех пор, пока не будут получены отрицательные результаты у 100 % поголовья. Положительно реагирующих животных изолируют, лечат и направляют на убой. При вывозе животных в ветеринарном свидетельстве указывают результат их исследования на листериоз.
ЗАДАНИЕ ДЛЯ САМОСТОЯТЕЛЬНОЙ РАБОТЫ
Решить эпизоотологическую задачу.
На мелочно-товарной ферме начали использовать в корм силос, после чего среди коров и телят возникло заболевание со следующими клиническими признаками: повышение температуры тела до 40,5 °С (у некоторых животных — в пределах нормы), угнетение, отказ от корма, потеря зрения (кератит), конъюнктивит, стоматит, приступы буйства, кроме того, у телят — понос. У одной стельной коровы отмечен аборт.
Установить диагноз и разработать схему дифференциальной диагностики листериоза.
Занятие 32. Диагностика, лечение, профилактика и ликвидация пастереллеза
Цель занятия: изучить методы диагностики и лечения пастереллеза, систему профилактических и оздоровительных мероприятий.
Материалы и оборудование: таблицы, диапозитивы, рисунки, микроскопы, готовые мазки, окрашенные по Романовскому—Гимзе, и биопрепараты, применяемые при пастереллезе животных и птиц.
Место проведения занятия: аудитория кафедры эпизоотологии.
МЕТОДИЧЕСКИЕ УКАЗАНИЯ
Пастереллез — инфекционная болезнь млекопитающих многих видов и птиц. Возбудитель — бактерия рода Pasteurella.
Методы диагностики. Диагноз на пастереллез устанавливают на основании эпизоотологических данных, клинических признаков, патологоанатомических изменений и результатов лабораторных исследований.
Согласно эпизоотологическим данным болеют домашние и дикие животные всех видов (более восприимчив молодняк) и человек. Болезнь проявляется среди кроликов в виде эпизоотии, у животных других видов — в виде энзоотических вспышек. Для пастереллеза характерно формирование стационарных эпизоотических очагов. Болезнь часто регистрируют осенью и весной. Источник возбудителя инфекции — больные и переболевшие животные — пастереллоносители. У больных животных возбудитель выделяется с истечениями из носа, выдыхаемым воздухом, слюной, фекалиями, молоком.
Клинические признаки болезни зависят от ее течения — сверхострого, острого, подострого и хронического. У больных животных резко повышается температура тела, нарушаются функции дыхательной системы и желудочно-кишечного тракта.
При сверхостром течении клиническая картина не успевает развиться, животное погибает внезапно с признаками нервных и сердечно-сосудистых расстройств. При более затяжном течении наблюдают конъюнктивиты, колиты, поносы, мышечную дрожь. Отмечают серозные, серозно-катаральные риниты, иногда истечения из носовых отверстий с примесью крови, сухой болезненный кашель.
В зависимости от развития патологического процесса различают отечную, грудную, кишечную формы, а в последнее время и менингеальную.
Патологоанатомические изменения зависят от продолжительности и формы болезни. У павших животных обнаруживают геморрагический диатез в большинстве органов. Печень и почки перерождены, с очагами некроза, селезенка слегка опухшая, лимфоузлы увеличены, темно-красного цвета. Легкие отечные, иногда отмечают серозно-фибринозный плеврит. В желудочно-кишечном тракте фибринозно-геморрагическое воспаление.
Лабораторная диагностика включает в себя микроскопию мазков-отпечатков, выделение культур пастерелл и их идентификацию, биопробу.
Для исследования в лабораторию направляют 2...3 трупа мелких животных, от крупных — сердце с перевязанными сосудами, части селезенки, печени, почек, экссудат из грудной полости и трубчатую кость; при поражении легких — кусочки (5х5 см) на границе нормального и измененного участков, миндалины, бронхиальные, средостенные и заглоточные лимфатические узлы. Материал берут от павших (не позднее 3...5 ч после гибели) или убитых с диагностической целью животных, не подвергавшихся лечению антибактериальными препаратами.
Для диагностики пастереллеза у птиц в лабораторию направляют кроме свежих трупов 5...6 живых птиц с явными признаками болезни. Больных птиц убивают в лаборатории и делают высевы из костного мозга, сердца, печени и селезенки.
Мазки-отпечатки из каждого органа фиксируют, окрашивают по Леффлеру или Романовскому—Гимзе и микроскопируют. В мазках из патматериала пастереллы выглядят как овоиды или короткие палочки с закругленными концами и заметной биполярностью, вокруг которых может быть видна прозрачная капсула. В мазках из культур при окраске по Граму бактерии обнаруживают в виде грамотрицательных овоидов или коккобактерий, расположенных одиночно или попарно.
При выделении культур посевы из исходного материала делают в МПБ и на МПА или в бульон и на агар Хоттингера. Выделенные культуры идентифицируют по ферментативным свойствам и подвижности. Основные дифференцирующие признаки видов рода Pasteurella приведены в таблице 6.

Примечание. «+» — результат положительный, «—» — результат отрицательный.
Методом биопробы определяют патогенность выделенной культуры и обнаруживают возбудитель в исходном материале.
Двум белым мышам массой 16...18 г вводят подкожно по 0,2 мл 18...24-часовой бульонной культуры. Вирулентные штаммы Р. multocida, относящиеся в основном к сероварианту В и являющиеся возбудителями геморрагической септицемии, вызывают гибель зараженных белых мышей в течение 24...72 ч; слабовирулентные штаммы серовариантов А и D, участвующие в развитии пневмоний, — через более продолжительный срок (до 7 сут). Р. haemolytica может вызвать гибель белых мышей только при внутрибрюшинном заражении.
Патогенность культур, выделенных от птиц, проверяют на белых мышах или цыплятах. Срок наблюдения за зараженными животными 7 сут.
Диагноз считают установленным в случае:
выделения из исходного материала культуры со свойствами характерными для возбудителя пастереллеза, и установления ее патогенности на лабораторных животных;
гибели хотя бы одного лабораторного животного из двух зараженных исходным материалом и выделения из его органов культуры со свойствами, характерными для возбудителя пастереллеза если даже в посевах из исходного материала культуры возбудителя не выделено. Срок исследования до 10 сут.
Профилактические и оздоровительные мероприятия. Чтобы предупредить заболевание животных пастереллезом, поступают следующим образом:
всех ввозимых в хозяйство животных выдерживают в профилактическом карантине в течение 30 дней;
комплектуют стадо только животными из хозяйств, благополучных по инфекционным болезням;
не допускают контакта животных общественного и частного секторов;
на фермах оборудуют санпропускники и обеспечивают обслуживающий персонал сменной одеждой и обувью;
на территориях пастбищ организуют мелиоративные работы, так как возбудитель пастереллеза в заболоченных мелких водоемах может сохраняться до 6 мес;
систематически проводят дератизацию на территории ферм;
в административных районах, где на фермах или среди отдельных групп животных были зарегистрированы случаи заболевания пастереллезом, всех животных вакцинируют против пастереллеза в течение одного года, руководствуясь наставлением по применению соответствующей вакцины;
хозяйства, в которых был зарегистрирован пастереллез, в течение одного года комплектуют поголовьем, вакцинированным против пастереллеза в хозяйстве-поставщике либо в период профилактического карантина;
не разрешают ввозить невакцинированных животных в ранее неблагополучное стадо в течение одного года после его оздоровления.
При установлении диагноза на пастереллез хозяйство объявляют неблагополучным по данной болезни и вводят ограничения.
Чтобы купировать эпизоотический очаг и ликвидировать заболевание: осматривают с термометрией всех животных неблагополучной группы. Больных и подозрительных по заболеванию изолируют и закрепляют за ними обслуживающий персонал, который обеспечивают спецодеждой, обувью, дезсредствами, аптечкой, рукомойником, мылом, полотенцем;
всем больным и контактировавшим с ними животным вводят поотивопастереллезную сыворотку (в зависимости от вида животного и эпизоотической ситуации используют следующие сыворотки' против пастереллеза крупного рогатого скота, буйволов, овец свиней; против пастереллеза свиней, кроликов, пушных зверей;
против пастереллеза, сальмонеллеза, парагриппа-3 и инфекционного ринотрахеита крупного рогатого скота) и один из следующих антибиотиков: террамицин, окситетрациклин, биомицин (хлор-тетрациклин), тетрациклин, стрептомицин, левомицетин, пролонгированные антибиотики (дибиомицин, дитетрациклин, дистрептомидазол, бициллин-3). Антибиотики назначают в дозах, указанных в наставлениях по их применению: их вводят 3 раза в день в течение 3...5 сут, пролонгированные антибиотики — однократно. Назначают также сульфаниламидные препараты, глюкозу и другие симптоматические средства; хорошие результаты дает применение пастереллезного фага или полифага;
поросятам и ягнятам, находящимся под больными пастереллезом матками, вводят гипериммунную противопастереллезную сыворотку в лечебной дозе и назначают курс антибиотиков тетрациклинового ряда. Телятам до 3-месячного возраста, находящимся на территории неблагополучной фермы, вводят сыворотку и дают молоко только от здоровых коров. Через 14 дней после введения сыворотки всех животных, достигших прививочного возраста, вакцинируют против пастереллеза.
Для иммунизации используют одну из далее указанных вакцин в соответствии с наставлением по их применению:
крупный рогатый скот и буйволов вакцинируют эмульгированной вакциной против пастереллеза крупного рогатого скота, буйволов и овец;
мелкий рогатый скот — преципитированной формол-вакциной против пастереллеза овец и свиней или эмульгированной вакциной против пастереллеза крупного рогатого скота, буйволов и овец;
кроликов — формол-вакциной против пастереллеза кроликов;
нутрий — сапонинформол-вакциной против пастереллеза нутрий;
свиней — преципитированной формол-вакциной против пастереллеза овец и свиней или эмульгированной вакциной против пастереллеза свиней. Для вакцинации супоросных свиноматок и поросят в возрасте менее 2 мес используют концентрированную поливалентную формол-квасцовую вакцину против паратифа, пастереллеза и диплококковой септицемии поросят (ППД) или поливалентную инактивированную вакцину против сальмонеллеза ц пастереллеза свиней. В хозяйствах угрожаемой зоны применяют эмульгированную вакцину против пастереллеза свиней.
В хозяйствах, неблагополучных по пастереллезу, обязательны систематические дезинфекция, дератизация, дезинвазия, дезинсекция. Текущая дезинфекция должна быть ежедневной: после утренней уборки помещения, где содержатся больные и подозрительные по заболеванию животные, и все, с чем они соприкасаются, дезинфицируют одним из следующих средств: 10...20%-йвзвесыосве-жегашеной извести или раствором хлорной извести, содержащим 2 % активного хлора, 2%-м раствором гидроксида натрия, 3%-м раствором креолина, 0,5%-м раствором формальдегида.
Трупы животных, павших от пастереллеза, сжигают или перерабатывают на утильзаводах либо обеззараживают в биотермических ямах, шкуры от павших или убитых животных дезинфицируют 1%-м раствором соляной кислоты, разведенной 20%-м раствором поваренной соли.
Спецодежду дезинфицируют текучим паром при экспозиции 1,5ч в паровых камерах, кипячением в 2%-м растворе кальцинированной соды в течение 1 ч или погружением на 2 ч в 1%-й раствор хлорамина при расходовании 5 л раствора на 1 кг вещей. Резиновую и кожаную обувь погружают на 2 ч в 5%-й раствор хлорамина или в 4%-й раствор формальдегида.
Ограничения с хозяйства снимают через 14 дней со дня последнего случая заболевания пастереллезом и после поголовной вакцинации, а также выполнения организационно-хозяйственных и ветеринарно-санитарных мероприятий и заключительной дезинфекции.
После снятия ограничений животных вакцинируют против пастереллеза в течение одного года. Вновь поступившее поголовье иммунизируют в хозяйствах-поставщиках или в период профилактического карантина.
ЗАДАНИЯ ДЛЯ САМОСТОЯТЕЛЬНОЙ РАБОТЫ
1. Исследовать под микроскопом готовые мазки из чистой культуры.
2. Разработать схему дифференциальной диагностики пастереллеза.
Занятие 33. Диагностика, лечение, профилактика и ликвидация дерматомикозов
Цель занятия: изучить методы диагностики дерматомикозов, систему профилактических и оздоровительных мероприятий.
Материалы и оборудование: пробы для исследования, взятые от животных, больных трихофитией, препаровальные иглы, пинцеты анатомические, чашки Петри, 10...20%-е растворы гидроксида натрия или калия, 50%-й раствор глицерина, предметные и покровные стекла, спиртовки, питательные среды, микроскопы, лампа ПРК-4, вакцины.
Место проведения занятия: аудитория кафедры эпизоотологии.
МЕТОДИЧЕСКИЕ УКАЗАНИЯ
Дерматомикозы (трихофития, микроспория, фавус) — инфекционные болезни кожи животных и человека, вызываемые грибами-дерматофитами родов Trichophyton, Microsporum,
Achorion.
Методы диагностики. Диагноз на дерматомикозы устанавливают на основании эпизоотологических и клинических данных, а также результатов лабораторных исследований.
Согласно эпизоотологическим данным дерматомикозами болеют сельскохозяйственные и дикие животные всех видов, а также человек. Восприимчивы все возрастные группы, но наиболее — молодняк. Источником возбудителя инфекции служат больные и переболевшие животные. Дерматомикозы встречаются в любое время года, но чаще в осенне-зимний период. При эпизоотологическом обследовании хозяйства особое внимание обращают на условия содержания и кормления животных, степень распространения болезни, характер эпизоотического процесса, возраст и вид пораженных животных. Необходимо отметить, что перемещение и перегруппировки, скученное содержание, плохое кормление нередко приводят к перезаражению животных и массовому распространению дерматомикозов.
Клиническая картина дерматомикозов настолько характерна, что в большинстве случаев можно поставить окончательный диагноз без дополнительных исследований.
При лабораторных исследованиях материалом служат соскобы кожи, волосы, чешуйки, корочки с пораженных или периферических участков кожи, не подвергавшейся лечению.
Для микроскопического исследования патологический материал помещают на часовое стекло или в чашку Петри и заливают 10%-м раствором гидроксида натрия, затем ставят на .15...20 мин в термостат или слегка подогревают, после чего расщепляют препаровальными иглами. Необходимое количество материала переносят на предметное стекло в каплю 50%-го раствора глицерина, накрывают покровным стеклом и исследуют под микроскопом.
Грибы рода Trichophyton при микроскопическом исследовании обнаруживают в виде прямых гифов мицелия с перегородками, лежащими параллельными рядами по длине волоса. Споры одноклеточные, круглые, овальные, расположены муфтами или цепочками у основания волоса.
Грибы рода Microsporum под микроскопом представляют собой круглые одноклеточные, резко преломляющие свет споры, расположенные, как правило, беспорядочно внутри волоса и на его
поверхности.
Грибы рода Achorion обнаруживают в препарате в виде тонкого мицелия, иногда септированного и широкого, состоящего из прямоугольных клеток с двухконтурной оболочкой. Споры округлые или многогранные, располагаются цепочками или группами. Кроме спор в волосе можно увидеть пузырьки воздуха в виде черных длинных тяжей, а также капельки жира.
Для дифференциальной диагностики дерматомикозов широко применяют люминесцентный метод. Он основан на свойстве грибов рода Microsporiim флюоресцировать. При ультрафиолетовом облучении пораженные волосы дают ярко-зеленое свечение. Техника исследования следующая: животное ставят в темное помещение на расстоянии 20 см от лампы ПРК-4 или другого источника со светофильтрами, пропускающими ультрафиолетовое излучение. Исследуют только животных (материал), которых не обрабатывали медикаментами. Пораженные микроспориями волосы дают хорошо видимое свечение, а при поражении трихофитонами свечения не бывает.
При необходимости делают посевы из исходного материала на агар Сабуро, МПА, в сахарный МПБ с антибиотиками и используют биопробу на кроликах, морских свинках или белых мышах.
В дальнейшем изучают морфологию и культуральные свойства выделенных культур. Сроки исследований: микроскопического — 1 день, микологического — 10...20 дней.
Профилактические и оздоровительные мероприятия. Общая профилактика дерматомикозов складывается из следующих мер: соблюдают ветеринарно-санитарные правила на фермах, не допускают контакты животных общественного стада и частных ферм, создают нормальные условия содержания поголовья, обеспечивают его полноценными кормами, проводят регулярную дезинфекцию и дератизацию. Всех животных, восприимчивых к дерматомикозам, тщательно осматривают, вновь поступивших выдерживают 30 дней в карантине. При этом обязательно обрабатывают их кожные покровы 1...2%-ми растворами гидроксида натрия, сульфата меди или другими средствами.
С профилактической целью в ранее неблагополучных по трихофитии хозяйствах в корм добавляют гризеофульвин, серу с метионином.
Для специфической профилактики и лечения дерматомикозов животных различных видов в нашей стране разработан ряд средств:
против трихофитии крупного рогатого скота применяют ТФ-130, ЛТФ-130, ТФ-130К; лошадей —СП-1; кроликов и пушных зверей — «Ментавак»; овец — «Трих-овис»; верблюдов — «Камель-вак»; северных оленей — ОЛТВ; против микроспории и трихофитии кошек, собак—сухую вакцину «Гримивак»; пушных зверей и кроликов — жидкую вакцину
Миковак».
Инактивированную вакцину «Поливак-ТМ» против дерматомикозов (включает в себя 8 видов грибов рода Trichophyton и Microsporiim) применяют для представителей семейства собачьих, кошачьих и других домашних и сельскохозяйственных животных. Все препараты используют согласно наставлению по их применению.
Кроме того, животных, больных дерматомикозом, лечат с по-
мошью 5...10%-й салициловой мази, 10%-го салицилового спирта, 10%-го спиртового раствора йода, сульфона, серного ангидрида, 5...10%-х растворов карболовой и бензойной кислот, йодоформа, хлорида йода, 10%-х растворов сульфата меди и аммиака, мази «Ям», нитрофунгина, микосептина, салифунгина и др. Все перечисленные препараты используют согласно наставлению по их рименению. В хозяйства, неблагополучные по дерматомикозам, запрещают ввозить здоровых животных из благополучных ферм, перегруппировывать и вывозить животных в другие хозяйства. Больных животных изолируют и лечат одним из вышеуказанных препаратов. Поголовье неблагополучной фермы осматривают не реже 1 раза в 10 дней. Для дезинфекции используют щелочной раствор формалина, содержащий 1 % щелочи и 2 % формальдегида; 10%-й раствор серно-карболовой смеси; формалино-керосиновую эмульсию (10 частей формалина, 10—керосина, 5 — креолина, 75 частей воды). Одновременно обрабатывают предметы ухода за животными и спецодежду. Навоз обеззараживают биотермическим способом.
Ветеринарно-санитарные мероприятия выполняют с соблюдением мер личной профилактики, учитывая опасность заражения.
Хозяйство считают благополучным через 2 мес со дня последнего случая выделения животных, клинически больных трихофитией, а при поражении фавусом—через 21 день с момента выздоровления (убоя) больных животных, в том числе птиц, и после заключительной дезинфекции.
ЗАДАНИЯ ДЛЯ САМОСТОЯТЕЛЬНОЙ РАБОТЫ
1. Исследовать под микроскопом приготовленные мазки.
2. Освоить технику исследования животных с помощью лампы
ПРК-4.
3. Рассказать, как диагностируют дерматомикозы.
4. Разработать схему дифференциальной диагностики трихофитии и микроспории.
5. Перечислить меры личной профилактики при работе с заразным материалом.
Замятие 34. Диагностика, профилактика и ликвидация оспы
Цель занятия: изучить методы диагностики оспы, систему профилактических и оздоровительных мероприятий.
Материалы и оборудование: плакаты, схемы, вакцины. Место проведения занятия: аудитория кафедры эпизоотологии.
МЕТОДИЧЕСКИЕ УКАЗАНИЯ
Оспа — контагиозная вирусная болезнь млекопитающих и птиц многих видов, вызываемая представителями семейства Poxviridae.
Методы диагностики. При типичном течении оспы для постановки диагноза вполне достаточно анализа эпизоотологических данных и клинической картины болезни. В сомнительных случаях исследуют под микроскопом мазки из свежих папул, окрашенные по методу Морозова. При световой микроскопии на желтом фоне препарата видны темно-коричневые элементарные тельца размером 2...20 • 10~3 мм.
При атипичном течении болезни для идентификации возбудителя прибегают к биопробе. Материалом от коров заражают кроликов, от свиней — поросят, от овец и коз — ягнят и козлят. Суспензию (1 : 10) вируссодержащего материала вводят подопытному животному в дозе 0,2...0,5 мл.
Дополнительными методами диагностики служат РИФ и РИД. Вирус выделяют, заражая культуру клеток и куриные эмбрионы.
Профилактические и оздоровительные мероприятия. Чтобы предупредить возникновение болезни, необходим ряд ветеринарно-санитарных мер: карантин вновь поступающих животных, исключение контакта животных разных хозяйств, ветеринарный контроль за поступлением кормов.
При возникновении оспы среди овец, коз, верблюдов и птиц на хозяйство накладывают карантин, при оспе коров, лошадей, свиней и других млекопитающих животных вводят ограничения. Больных и подозрительных по заболеванию животных изолируют и лечат. Клинически здоровых овец и коз переводят в другое помещение или на другой участок пастбища и вакцинируют. Для активной иммунизации овец против оспы применяют сухую культуральную вирусвакцину из штамма НИСХИ, живую сухую вакцину из штамма ВНИИЗЖ и сухую культуральную вакцину из штамма ВНИИВВиМ. Помещения дезинфицируют 3%-м раствором каустической соды, 2%-м раствором формальдегида.
Карантин с хозяйства снимают через 20 дней после полного выздоровления, падежа или убоя больных оспой овец и коз, заключительной дезинфекции и обработки кожного покрова всех животных. Ограничения при оспе коров и свиней снимают через 21 день. В птицеводческих хозяйствах больное поголовье убивают, мясо используют после проварки, условно благополучное — прививают против оспы сухой эмбрионвирусвакциной из штамма 27-AlU. Карантин с хозяйства снимают через 2 мес после ликвидации болезни и заключительной дезинфекции.
ЗАДАНИЕ ДЛЯ САМОСТОЯТЕЛЬНОЙ РАБОТЫ
Решить эпизоотологические задачи.
Задача 1. В овцеводческом хозяйстве в одной отаре в осеннюю дождливую погоду среди овец всех возрастов возникло массовое заболевание, которое наиболее тяжело проявилось у молодняка. Болезнь начиналась угнетением, анорексией и лихорадкой. Одновременно отекали веки, появлялись серозно-слизистые и серрозно-гнойные выделения из глаз и носа. Через 2...3 дня с начала болезни обнаруживали сыпь на коже головы, губах и крыльях носа, вокруг глаз, на внутренних поверхностях передних и задних
конечностей.
1. Установить диагноз, организовать лечение больных овец.
2. Разработать мероприятия по охране других отар от заноса
этой болезни.
3. Составить план мероприятий по ликвидации данной инфекции в хозяйстве.
Задача 2. На птицеферме в одной секции возникло массовое
заболевание птиц со следующими клиническими признаками: катаральное воспаление слизистых оболочек верхних дыхательных путей и ротовой полости. Через 2...3 дня появились беловатые возвышающиеся наложения округлой формы и желто-белой окраски, которые, сливаясь друг с другом, образовывали наложения, напоминающие сыр и глубоко проникающие в слизистые оболочки.
1. Установить диагноз.
2. Разработать план мероприятий по профилактике болезни в остальных птичниках и ликвидации эпизоотического очага.
Занятие 35. Диагностика, лечение, профилактика и ликвидация столбняка
Цель занятия: изучить методы диагностики столбняка, систему профилактических и оздоровительных мероприятий.
Материалы и оборудование: диапозитивы, рисунки, противостолбнячные вакцины и сыворотки, две-три белые мыши или две морские свинки, зараженные возбудителем столбняка за 3...4 дня до занятия.
Место проведения занятия: аудитория кафедры эпизоотологии.
МЕТОДИЧЕСКИЕ УКАЗАНИЯ
Столбняк — острая инфекционная болезнь животных, вызываемая токсином бактерии С. tetani.
Методы диагностики. Диагноз на столбняк устанавливают на основании клинических признаков, а также лабораторных исследований.
Клинические признаки столбняка характерны: судорожные сокращения мышц (рис. 10). Течение болезни острое.
Лабораторные исследования ведут в двух направлениях—обнаружение токсина и выделение культуры возбудителя с последующей проверкой ее токсичности.
В лабораторию направляют раневой секрет, пробы ткани, которые берут из глубоких слоев мест поражения: подозрительные места освобождают от грязи, обрабатывают спиртом, затем стерильными инструментами делают глубокий разрез и извлекают кусочки пораженной ткани. От павших животных кроме материала из мест поражения на исследование отправляют кровь (5...10 мл), кусочки печени, селезенки.
Диагноз считают установленным: при обнаружении столбнячного токсина в исходном материале (без выделения культуры);
при выделении из исходного материала культуры со свойствами, характерными для возбудителя столбняка, продуцирующего токсин.
При дифференциальной диагностике необходимо исключить бешенство, при котором тоже бывает повышенная возбудимость животного, но отсутствует тризм, а кроме того, обнаруживают паралич нижней челюсти и агрессивность к животным и человеку.

Рис. 10. Клиническое проявление столбняка (клонические судороги) у животных разных видов:
А — лошади; Б — собаки; В— овцы
Профилактические и оздоровительные мероприятия. В качестве специфического лечебного препарата используют антитоксическую противостолбнячную сыворотку. Для ослабления судорожных сокращений мышц животным вводят успокаивающие и наркотические средства: хлоралгидрат, сульфат магния, алкоголь, аминазин, а также сердечные средства. Полезны новокаиновые блокады.
Больное животное содержат в затемненном помещении с обильной подстилкой, устраняют внешние раздражители, назначают диетическое кормление (болтушки из отрубей, протертые корнеплоды). При необходимости применяют питательные клизмы с глюкозой (400 г на 1 л воды), вводят сердечные средства с гексаметилентетрамином (50 мл 20%-го раствора). Прямую кишку освобождают от кала, массируют мочевой пузырь.
При профилактике следует предупреждать травматизм животных. Необходимо соблюдать правила асептики и антисептики при хирургических вмешательствах, включая полную первичную обработку ран с удалением размозженных тканей и инородных тел. При обширных ранениях, особенно в области конечностей, а также при тяжелых родах с целью профилактики животным вводят антитоксическую противостолбнячную сыворотку от 3 до Ютыс.ЕД (желательно не позднее 12ч после ранения). В хозяйствах, где в течение короткого времени зарегистрировано несколько случаев заболевания столбняком, животных иммунизируют анатоксином, чтобы создать активный иммунитет. Жеребцов желательно вакцинировать за 1 мес до кастрации.
При установлении диагноза на столбняк всю тушу с внутренними органами направляют на техническую утилизацию.
ЗАДАНИЯ ДЛЯ САМОСТОЯТЕЛЬНОЙ РАБОТЫ
1. Приготовить мазки из патматериала, полученного при вскрытии морских свинок, окрасить, изучить под микроскопом.
2. Разработать схему дифференциальной диагностики столбняка от бешенства, пастбищной тетании, менингита.
3. Перечислить препараты, которые применяют для лечения животных, больных столбняком, указать дозы и способы введения.
Занятие 36. Диагностика, профилактика и ликвидация микотоксикозов
Цель занятия: изучить наиболее широко распространенные микотоксикозы, методы их диагностики, дифференциальной диагностики, профилактических и оздоровительных мероприятий.
Материалы и оборудование: пробы различных грубых кормов, пораженных грибами, плакаты, демонстрирующие строение конидий различных грибов, микроскопы, конидии грибов на сусловом агаре.
Место проведения занятия: аудитория кафедры эпизоотологии.
МЕТОДИЧЕСКИЕ УКАЗАНИЯ
Микотоксикозы — болезни, возникающие после поедания животными кормов, пораженных токсическими грибами, и проявляющиеся острыми и хроническими токсикозами. Известно около 240 видов токсических грибов и более 100 микотоксинов (основные — афлатоксины, стахиботриотоксины, дендродохины, фузариотоксины, эрготоксины и др.). Указанные грибы размножаются не в организме животных, а в растительных продуктах (кормах). Наибольшую опасность представляют корма, загрязненные микотоксинами, относящимися к двум группам.
Первая группа (роды Aspergillus и Penicillium) —так называемые складские грибы. Это в основном плесени хранения, грибы, неспособные поражать растения в период вегетации, попадающие в зерновые и грубые корма главным образом во время уборки, но интенсивно развивающиеся в массе корма, особенно при нарушении режима его хранения.
Во вторую группу отнесены полевые грибы рода Fusarium. Поражают растения в период их вегетации, являются факультативными паразитами, способными во время хранения кормов при благоприятных условиях продолжать развитие.
Микотоксины опасны с двух точек зрения. В больших дозах они вызывают ярко выраженные признаки отравления. Болезнь часто заканчивается гибелью животных. Поступление какого-либо микотоксина (или одновременно нескольких) в малых дозах в организм животного хотя и не вызывает заметных отклонений от нормы и даже не диагностируется, но способствует снижению продуктивности, прироста массы тела, ослаблению резистентности организма. При этом создаются условия для возникновения многих инфекционных болезней.
Методы диагностики. Диагноз устанавливают на основании эпизоотологических данных, клинических признаков и результатов лабораторных исследований кормов.
Согласно эпизоотологическим данным микотоксикозы регистрируют в течение всего года: одни проявляются в стойловый период, другие — в пастбищный. В основном все сельскохозяйственные, мелкие домашние и лабораторные животные, а также рыбы восприимчивы к токсичным продуктам жизнедеятельности грибов. Для микотоксикозов характерна массовость поражения.
После приема токсичного корма первые клинические признаки болезни проявляются через несколько часов, а иногда через 2...3 сут и более. Температура тела остается нормальной или слегка понижена.
При диагностике необходимо учитывать следующие характерные особенности микотоксикозов:
болезнь не передается контактным или воздушно-капельным путем;
химиотерапия лекарственными препаратами или антибиотиками обычно малоэффективна;
болезнь характеризуется сезонностью и зависит от климатических условий.
Однако при нарушении правил хранения зерна и технологии изготовления кормов сезонные особенности микотоксикозов часто не проявляются. Тщательные исследования могут указать на связь заболевания с каким-либо видом корма.
Лабораторные исследования заключаются в микологическом (микроскопия, органолептическая оценка) и токсикологическом исследованиях корма. Токсичность определяют с помощью биопробы (на простейших, растениях, лабораторных животных, куриных эмбрионах), а также специальным окрашиванием, люминесцентным и хроматографическим анализом.
Основным показателем для дифференциальной диагностики микотоксикозов служит обнаружение в кормах токсинов определенных видов методом тонкослойной хроматографии.
Профилактические и оздоровительные мероприятия. Профилактика микотоксикозов заключается в использовании качественных кормов, исследовании их на микотоксины во время заготовки и в процессе хранения, а также в соблюдении техники приготовления и хранения грубых кормов.
Многие из микотоксинов термоустойчивы, не разрушаются при гранулировании, консервировании и других операциях, применяемых в кормопроизводстве. Установлена возможность разрушения микотоксинов с помощью озона, аммиака, пероксида водорода, гипохлорита кальция. Основные требования, предъявляемые кдетоксикации:
должна быть экономически выгодной;
разрушать или инактивировать микотоксины;
не образовывать и не оставлять токсических или канцерогенных веществ в конечном продукте;
разрушать споры грибов и мицелий, которые могли бы при благоприятных условиях размножаться и образовывать новые токсины;
сохранять питательную ценность корма и существенно не менять его важные технологические свойства.
ЗАДАНИЯ ДЛЯ САМОСТОЯТЕЛЬНОЙ РАБОТЫ
1. Разработать схему дифференциальной диагностики:
афлатоксикоза свиней от отравления зоокумарином, охраток-сикоза, рубратоксикоза, болезни Ауески, Тешена;
эрготизма овец (отравления спорыньей) от абортов другой этиологии (бруцеллезные, сальмонеллезные, хламидиозные);
стахиботриотоксикоза лошадей от сапа.
2. Разработать основные принципы мероприятий по профилактике и ликвидации микотоксикозов у крупного рогатого скота, лошадей, свиней и овец.
Гл а в а 2 БОЛЕЗНИ ЖВАЧНЫХ
Занятие 37. Диагностика, профилактика и ликвидация эмфизематозного карбункула (эмкара)
Цель занятия: изучить методы диагностики эмфизематозного карбункула, систему профилактических и оздоровительных мероприятии.
Материалы и оборудование: окрашенные по Граму мазки с возбудителем эмкара, микроскопы, диапозитивы, вакцина против эмкара, две морские свинки, зараженные возбудителем эмкара за 3...4 дня до занятия.
Место проведения занятия: аудитория кафедры эпизоотологии.
МЕТОДИЧЕСКИЕ УКАЗАНИЯ
Эмфизематозный карбункул, или эмкар, — острая инфекционная болезнь, преимущественно крупного рогатого скота, а иногда и овец. Возбудитель — Clostridium chauvoei.
Методы диагностики. Диагноз на эмфизематозный карбункул устанавливают на основании клинических, патологоанатомичес-ких, эпизоотологических данных и результатов лабораторных исследований.
В лабораторию направляют кусочки пораженных мышц, экссудат из крепитирующего отека. Исследование включает в себя микроскопию мазков из исходного материала, окрашенных по Граму, посевы на питательные среды и заражение лабораторных животных.
Очень важно собрать данные об эпизоотическом состоянии каждого пункта, неблагополучного по эмкару. В числе этих данных следует указать количество случаев заболевания эмкаром в каждом пункте, наличие отдельных участков пастбищ (выгонов, дворов, водоемов), неблагополучных по данной инфекции, топографические, почвенные и другие условия обследуемых пунктов, практику водопоя скота в пастбищный период.
Профилактические и оздоровительные мероприятия. В пунктах, неблагополучных по эмфизематозному карбункулу, осушают заболоченные пастбища, благоустраивают места водопоя, а также вакцинируют животных: крупный рогатый скот в возрасте от 3 мес до 4 лет, при возникновении болезни прививают весь скот.
В хозяйствах, где зарегистрирован эмкар овец, прививают все поголовье начиная с 6 мес и старше. Вакцину вводят внутримышечно однократно в дозе 2 мл независимо от возраста и упитанности животных.
При установлении диагноза на эмкар на хозяйство накладывают карантин и в дальнейшем следуют положениям инструкции о мероприятиях против эмфизематозного карбункула.
Карантин с неблагополучного пункта снимают через 14 дней со дня последнего случая заболевания или падежа животных и заключительной дезинфекции.
ЗАДАНИЯ ДЛЯ САМОСТОЯТЕЛЬНОЙ РАБОТЫ
1. Установить особенности патологоанатомических изменений в органах морских свинок при эмкаре. Приготовить мазки из органов, изучить их под микроскопом.
2. Разработать схему дифференциальной диагностики эмфизематозного карбункула, сибирской язвы и злокачественного отека.
3. Решить эпизоотологическую задачу.
В конце мая, вскоре после перевода животных на летнелагерное содержание, были кастрированы бычки текущего года рождения. Бычков-кастратов содержали в отдельном загоне под навесом в течение 4 дней, затем начали выпасать с животными откормочной группы. На следующий день у одного животного отмечена хромота опирающегося типа на правую заднюю конечность. Со слов пастухов известно, что во время выгона животных на пастбище больных не было. До приезда ветеринарного врача животное пало. При осмотре трупа установлено, что труп слегка вздут, область кастрационной раны без признаков посткастрационных осложнений. Область крупа с правой стороны отечная. Труп перевезли на территорию скотомогильника. При разрезе кожи и подлежащих тканей области крупа с правой стороны стекала красноватая жидкость с пузырьками газа. Мышцы темно-красного цвета. Вскрытие трупа прекращено.
Выбрать материал для лабораторного анализа и указать методы его исследования.
Составить план противоэпизоотических мероприятий.
Занятие 38. Диагностика, профилактика и ликвидация паратуберкулеза
Цель занятия: изучить методы диагностики паратуберкулеза, систему оздоровительных и профилактических мероприятий. - Материалы и оборудование: действующая инструкция по профилактике и ликвидации паратуберкулеза крупного рогатого скота, биопрепараты, слайды, схемы.
Место проведения занятия: аудитория кафедры эпизоотологии.
МЕТОДИЧЕСКИЕ УКАЗАНИЯ
Паратуберкулез, или паратуберкулезный энтерит, — хроническая болезнь в основном крупного рогатого скота, которую вызывает Mycobacterium paratuberculosis.
Методы диагностики. Первичный диагноз устанавливают на основании характерных клинических признаков болезни с обязательным подтверждением диагноза лабораторными методами.
Клиническая картина при паратуберкулезе непостоянна и часто имеет много общего с проявлением других болезней. Типичные "ризнаки паратуберкулеза: истощение, понос, вначале перемежающийся, затем постоянный. Снижается удой, появляются отеки в
области подгрудка и подчелюстного пространства, глаза западают кожа становится менее эластичной. Фекалии жидкие, со слизью с пузырьками газа, иногда с кровью и резким зловонным запахом. Однако у животного сохраняется аппетит и температура остается нормальной. По мере развития болезни нарастают общее угнетение животного, вялость. Резко выражена шилозадость. Слизистые оболочки бледные, к концу болезни аппетит обычно отсутствует усиливается жажда.
Для уточнения диагноза прибегают к патологоанатомическому методу исследования (рис. 11).
Лабораторные методы включают в себя бактериологическое и гистологическое исследования.
Мазки (не менее 10) из соскобов со слизистой оболочки прямой кишки и из каловых масс окрашивают по Цилю—Нильсену. При этой окраске темно-красные микобактерии паратуберкулеза располагаются на синем фоне кучками по 2...3 и больше.
Чистую культуру получают, высевая патологический материал на модифицированную казеиновую среду Дюбо—Смита с добавлением фактора роста (экстракт микобактерии тимофеевой травы) и для контроля — на среду Петраньяни. Посевы выдерживают при температуре 38 "С в течение 2...4мес. Культура вырастает в виде плоских колоний с ядром в центре, которые в дальнейшем приобретают бугристость. Сроки роста от 18 дней до 3 мес.
Возбудитель паратуберкулеза непатогенен для лабораторных животных.
При отрицательных результатах бактериологического исследования прибегают к диагностическому убою. На вскрытии характерную картину для паратуберкулезного энтерита всегда обнаруживают в тонком отделе кишечника. Подтверждают диагноз микроскопией мазков со слизистой оболочки пораженных кишок и гистологическим исследованием материала.

Для массовой диагностики паратуберкулеза в неблагополучных хозяйствах используют аллергические и серологические методы.
Аллергическую диагностическую пробу ставят с птичьим туберкулином. Аллерген вводят внутрикожно в дозах (мл): телятам до Змее—0,1; от 6 до 12 мес—0,15; от 1 года до 2 лет—0,2; до 3 лет—0,3; старше 3 лет — 0,4...0,5 . Реакцию учитывают через 48 ч. При образовании разлитого отека на месте введения препарата и утолщения кожной складки на 7 мм и более результат считают положительным, при менее выраженной реакции и утолщении кожи от 5 до 7 мм — сомнительным. Всем животным с отрицательной и сомнительной реакцией аллерген вводят повторно через 48 ч, реакцию учитывают через 24ч. Овцам птичий туберкулин вводят на внутренней поверхности бедра в дозе 0,3 мл однократно, реакцию учитывают через 48 ч. За положительный результат принимают выраженный воспалительный отек на месте введения туберкулина.
Серологическими методами исследуют животных старше 18 мес в соответствии с временным наставлением по постановке РСК для диагностики паратуберкулеза крупного рогатого скота и овец (с антигеном Сибирского научно-исследовательского ветеринарного института).
Профилактические и оздоровительные мероприятия. В зоне, неблагополучной по паратуберкулезу, в системе профилактических мероприятий предусмотрена регулярная диспансеризация с целью контроля за общей резистентностью организма животных, состоянием их минерального и витаминного обмена.
При появлении в хозяйстве болезни все поголовье исследуют клиническим, серологическим и аллергическим методами. Больных животных, подозрительных по заболеванию, а также с положительным результатом аллергического или серологического исследования направляют на убой. При оздоровлении хозяйства руководствуются положениями инструкции «О мероприятиях по профилактике и ликвидации паратуберкулезного энтерита крупного рогатого скота».
ЗАДАНИЯ ДЛЯ САМОСТОЯТЕЛЬНОЙ РАБОТЫ
1. Изучить инструкцию «О мероприятиях по профилактике и ликвидации паратуберкулезного энтерита крупного рогатого скота».
2. Составить план оздоровления мелочно-товарной фермы от паратуберкулезного энтерита крупного рогатого скота.
Занятие 39. Диагностика, профилактика и ликвидация лейкоза крупного рогатого скота
Цель занятия: изучить методы диагностики лейкоза крупного рогатого скота, систему профилактических и оздоровительных мероприятий.
Материалы и оборудование: микроскопы, мазки крови, содержащие незрелые
клетки крови, диапозитивы, таблицы: гематологический ключ, схемы классификации лейкоза,
Место проведения занятия: аудитория кафедры эпизоотологии.
МЕТОДИЧЕСКИЕ УКАЗАНИЯ
Лейкоз крупного рогатого скота — хроническая инфекционная болезнь опухолевой природы. Возбудитель классифицирован как вирус лейкоза крупного рогатого скота (ВЛКРС), семейство Retrovindae. В естественных условиях ВЛКРС поражает чаще крупный рогатый скот. Вирус лимфоцитотропен, факторами передачи служат кровь, секреты, экскреты и другие биологические жидкости, контаминированные кровью.
Методы диагностики. Диагноз устанавливают на основании серологических исследований (РИД), данных клинического, гематологического и гистологического исследований.
Эпизоотологический метод диагностики используют в качестве ориентировочного, с его помощью исключают наличие других инфекционных болезней.
Клинический метод малонадежен, однако необходим при первичной диагностике. Осматривают доступные для исследования наружные и внутренние лимфатические узлы. Обращают внимание на упитанность животного, затрудненность дыхания, акт глотания наличие опухолей, пучеглазия и т.д. При поражении жизненно важных органов можно наблюдать самую разнообразную патологию — истощение, расстройство функции сердечно-сосудистой системы, отеки и т.д. Выраженные клинические признаки проявляются у животных лишь в терминальной стадии заболевания.
Специфические признаки при лейкозах: лимфатические узлы (подчелюстные, предлопаточные, надвыменные, глубокие паховые) симметрично или асимметрично увеличены, подвижны, плотной консистенции. Иногда отмечают одно- или двусторонний экзофтальм (пучеглазие).
При ретикулезах соматические лимфоузлы увеличены, поверхностные — малоподвижны, зачастую спаяны с окружающими тканями и кожей.
В терминальной стадии заболевание сопровождается развитием неспецифических признаков: гипотонией или атонией преджелудков, бесплодием, параличами и т.д.
Лейкоз следует дифференцировать от туберкулеза, бруцеллеза, паратуберкулеза, актиномикоза.
Гематологическая диагностика основана на тестировании количественных и качественных изменений форменных элементов крови (табл. 7). Показателями служат общее количество лейкоцитов в 1 • Ю-3 мл крови, относительное (%) и абсолютное количество лимфоцитов и других групп лейкоцитов, а также наличие недифференцированных и патологических форм клеток.

Результаты гематологических исследований оценивают с учетом возраста животных в соответствии с диагностическим «лейкозным ключом», применяемым в РФ согласно действующей инструкции по борьбе с лейкозом.
Стойкий или прогрессирующий лейкоцитоз (рис. 12) и лимфоцитоз, отмеченные при трехкратном исследовании (с интервалом 2...3 мес), — достоверный показатель лейкоза. Необходимо учитывать, что гематологическим методом не всегда удается диагностировать болезнь. Нередки случаи алейкемического течения заболевания, когда картина крови остается в пределах нормы, характеризуется несколько пониженным общим количеством форменных элементов. Именно в этих случаях особенно велико значение всего комплекса диагностических методов.
При массовых гематологических исследованиях крупного рогатого скота на лейкоз следует учитывать возможность у животных лейкемоидных реакций, обусловленных развитием таких патологических процессов, как туберкулез, бруцеллез, маститы, эндометриты, токсикозы и др. При данных заболеваниях в отличие от лейкоза изменения в показателях крови обычно носят временный характер.
Рис.-12. Увеличение содержания лейкоцитов в крови животного при лейкозе:
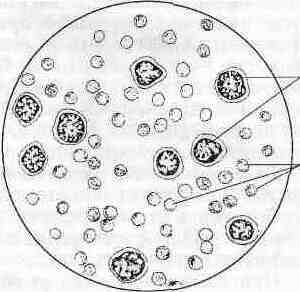
 1
—лейкоциты; 2—
эритроциты
1
—лейкоциты; 2—
эритроциты
Рис. 13. Результат исследования сывороток крови в РДП на лейкоз (схема):
АГ—антиген; СПС — контрольные специфические сыворотки; 1...4— исследуемые сыворотки.
В качестве антигенов используют: гликопротеидный антиген (ГП), входящий в состав оболочек ВЛКРС; полипептидный антиген (р24) — внутренний белок ВЛКРС;
двойной антиген (ГП + р24).
Обнаружение в РДП сывороточных преципитируюших антител к антигенам ВЛКРС отражает развитие у животного лейкоза.
Сравнительные данные, полученные в результате диагностики лейкоза с помощью гематологического и серологического тестов, свидетельствуют о преимуществах последнего.
Патологоанатомические изменения при разных формах лейкоза различаются.
При собственно лейкозах (гемабластозах) селезенка увеличена (при всех формах), размер зависит от стадии заболевания (до 1 м в длину). Отмечают гиперплазию фолликулов. Возможен разрыв капсулы с последующим кровоизлиянием в брюшную полость.
Лимфоузлы увеличены в начале заболевания незначительно, в терминальной стадии—до 20х10 см (надвымянные). Капсула гладкая, легко снимающаяся. На разрезе ткань лимфоузлов саловидная, рисунок ее сглажен.
В других органах патологические изменения устанавливают в поздние сроки развития заболевания. В печени, сердце, почках могут быть диффузные или очаговые разрастания серо-белого или серо-розового цвета.
При ретикулезах обнаруживают следующие изменения. Селезенка при лимфо- и ретикулосаркоме без изменений, при системном ретикулезе и лимфогранулематозе всегда увеличена. Лимфоузлы увеличены неравномерно в различных областях тела. Капсула шероховатая, часто сросшаяся с соседними тканями и органами. Характерны опухолевидные разрастания различных размеров—от горошины до больших конгломератов (25...30 кг). Опухоли плотные, серо-белого цвета, с очагами некроза и кровоизлияний (мраморный вид). В паренхиматозных органах отмечают дистрофические изменения. В сердце, сычуге, матке, почках возможны разрастания опухолевой ткани.
Гистологическое исследование обязательно для подтверждения диагноза на лейкоз. С помощью данного метода определяют форму болезни в зависимости от характера клеток пролиферата, степени их дифференцировки, а также устанавливают стадию патологического процесса.
При собственно лейкозах гистологическим методом обнаруживают следующие изменения: при лимфолейкозе — избыточное образование в ткани селезенки и лимфоузлов клеток лимфоидного ряда с последующей метаплазией костного мозга и появлением в ряде случаев инфильтративных разрастаний в органах, не связанных с кроветворением у взрослых животных; при миелолейкозе — поражение в первую очередь костного мозга и селезенки: нарушенную клеточную структуру этих органов, пролиферацию малодифференцированных полиморфноядерных клеточных форм и присутствие миелоидных элементов. При гемобластозе развитие кроветворных органов прекращается на стадии малодифференцированных родоначальных клеток преимущественно в костном мозге и селезенке с последующим распространением процесса на лимфатические узлы и вовлечением ретикулоэндотелиальной системы всего организма.
Для ретикулезов также характерны различные изменения. При системном ретикулезе поражаются костный мозг, селезенка, лимфоузлы. В них наблюдают диффузную пролиферацию малодифференцированных полиморфноядерных ретикулярных клеток. В патологический процесс вовлекаются также сердце, сычуг, кишечник, почки, матка, легкие и другие органы с развитием в них опухолевых разрастаний недифференцированных ретикулярных элементов. При лимфо- и ретикулосаркоме поражения селезенки и костного мозга отсутствуют. Пролиферация лимфоидных элементов клеток (при лимфосаркоме) или ретикулярных (при ретикулосаркоме) возникает в лимфоузлах, сычуге, сердце, кишечнике, матке. При лимфогранулематозе поражаются лимфоузлы с вовлечением в ряде случаев селезенки и других органов. Клеточный состав пораженных органов полиморфен. Для этой формы ретикулезов характерно появление гигантских клеток Березовского— Штернберга.
Диагноз на лейкоз считают установленным, а хозяйство неблагополучным по этой болезни, если серологическим методом выявлены антитела к вирусу лейкоза крупного рогатого скота; а также если клинические, гематологические и Патологоанатомические изменения, характерные для лейкоза, подтверждены гистологическими исследованиями, а при жизни у этих животных установлены специфические антитела к ВЛКРС.
Животных, у которых в крови обнаружены специфические антитела к ВЛКРС, но отсутствуют гематологические изменения и клинические признаки, оценивают как инфицированных вирусом лейкоза.
Животных, у которых установлены в крови антитела к ВЛКРС, а также гематологические изменения или клинические признаки, характерные для лейкоза, оценивают как больных лейкозом.
Профилактические и оздоровительные мероприятия. Система мероприятий по профилактике и ликвидации лейкоза крупного рогатого скота определена инструкцией.
ЗАДАНИЯ. ДЛЯ САМОСТОЯТЕЛЬНОЙ РАБОТЫ
1. Изучить инструкцию о мероприятиях по борьбе с лейкозом крупного рогатого скота.
2. Составить комплексный план оздоровления хозяйства от лейкоза крупного рогатого скота.
Задание 40. Диагностика, профилактика и ликвидация клостридиозов овец
Цель занятия: изучить методы диагностики клостридиозов овец, систему профилактических и оздоровительных мероприятий.
Материалы и оборудование: окрашенные по Граму мазки с возбудителями брадзота и инфекционной энтеротоксемии овец, диапозитивы, вакцины против клостридиозов овец.
Место проведения занятия: аудитория кафедры эпизоотологии.
МЕТОДИЧЕСКИЕ УКАЗАНИЯ
Б р ад з от—быстро протекающая инфекционная болезнь овец, вызываемая анаэробной бактерией Clostridium septicum.
Инфекционная энтеротоксемия— остро протекающая болезнь животных различных видов (овец, телят, поросят, пушных зверей, птиц).
Анаэробная дизентерия ягнят—аналогичная болезнь новорожденных ягнят.
Возбудитель энтеротоксемии овец—спорообразующийанаэ-роб С. perfringens типов С и D, анаэробной дизентерии ягнят— типа В.
Методы диагностики. Диагноз на клостридиозы овец устанавливают на основании эпизоотологических, клинических, патологоанатомических данных и результатов лабораторных исследований.
Исследование на брадзот включает в себя микроскопию мазков из патологического материала, посевы на питательные среды и заражение лабораторных животных.
В лабораторию направляют паренхиматозные органы, измененные участки стенки сычуга, отечную ткань, трубчатую кость, часть двенадцатиперстной кишки, перевязанную с двух сторон, экссудат грудной и брюшной полости, инфильтрат подкожной клетчатки.
Диагноз на брадзот считают установленным в случае:
выделения из исходного материала культуры со свойствами, характерными для возбудителя данного заболевания, и гибели хотя бы одной морской свинки из двух, зараженных исходным материалом, и выделения из ее органов культуры возбудителя;
гибели хотя бы одной морской свинки из двух, зараженных исходным материалом, при наличии у нее типичной для данного возбудителя патологоанатомической картины и выделении из органов культуры возбудителя, если даже в посевах из исходного материала культура возбудителя не выделена.
Лабораторные исследования на инфекционную энтеротоксемию и анаэробную дизентерию ягнят включают в себя: обнаружение токсина в содержимом тонкого отдела кишечника; выделение культуры возбудителя из исходного материала с последующей проверкой ее токсичности.
В лабораторию направляют труп животного целиком или наиболее пораженные отрезки тонкого отдела кишечника с содержимым, а также часть печени, селезенку и почку. Патологический материал следует брать в течение З...4ч после смерти животного.
Диагноз на инфекционную энтеротоксемию животных и анаэробную дизентерию ягнят считают установленным в случае:
обнаружения токсина в фильтрате содержимого тонкого отдела кишечника методом биопробы и определения его типа в РН с типоспецифическими сыворотками;
выделения из содержимого тонкого отдела кишечника культуры с характерными для данного возбудителя свойствами, продуцирующей токсин, тип которого установлен в РН с типоспецифическими сыворотками.
Профилактические и оздоровительные мероприятия. Профилактика заболевания овец и коз клостридиозами предусматривает полноценное кормление животных без резких изменений рациона, а также соблюдение санитарных и зоогигиенических норм содержания поголовья.
В пунктах, ранее неблагополучных по этим болезням, всех овец не позднее чем за 20...30 дней до сезона появления заболевания или выгона животных на пастбище иммунизируют соответствующими вакцинами.
В хозяйстве, неблагополучном по брадзоту овец или инфекционной энтеротоксемии, вводят ограничения. Всех больных и подозрительных по заболеванию животных изолируют и назначают им бивалентную гипериммунную сыворотку в лечебных дозах, здоровых переводят на стойловое содержание и вакцинируют.
Трупы утилизируют вместе со шкурами (шерсть не снимают). Помещения дезинфицируют 3%-м раствором хлорной извести, 5%-м раствором гидроксида натрия, 10%-м раствором формальдегида.
Ограничения с хозяйства снимают через 20 дней со дня последнего случая падежа животных от указанных инфекций и заключительной дезинфекции.
ЗАДАНИЯ ДЛЯ САМОСТОЯТЕЛЬНОЙ РАБОТЫ
1. Изучить под микроскопом окрашенные мазки.
2. Разработать схему дифференциальной диагностики брадзота, инфекционной энтеротоксемии, сибирской язвы, эмфизематозного карбункула, пастереллеза, пироплазмоза.
3. Решить эпизоотологическую задачу.
Овцеводческое хозяйство было благополучно по инфекционным болезням. В последние дни отмечено заболевание ягнят первых двух дней жизни, реже — в возрасте 2...3 нед. Клинические признаки: температура тела 41 "С; пульс 120 уд/мин; дыхание 50 дв/мин. Общее состояние угнетенное, аппетит отсутствует. Диарея, фекалии жидкие, вначале желтоватого цвета, затем более темные, с примесью крови. Болезнь длится от 2 до 8 дней. Летальность 20...50 %.
Установить первоначальный диагноз.
Указать, какие необходимы исследования для уточнения диагноза.
Составить план противоэпизоотических мероприятий.
Занятие 41. Диагностика парагриппа-3, инфекционного ринотрахеита, вирусной диареи и аденовирусной инфекции крупного рогатого скота
Цель занятия: изучить методы диагностики парагриппа-3, инфекционного ринотрахеита, вирусной диареи и аденовирусной инфекции крупного рогатого скота.
Материалы и оборудование: диапозитивы, таблицы, рисунки. Место проведения занятия: аудитория кафедры эпизоотологии.
МЕТОДИЧЕСКИЕ УКАЗАНИЯ
Диагноз при этих болезнях может быть установлен только с использованием всего комплекса исследований.
Парагрип п-3 — остропротекающая контагиозная болезнь. Возбудитель — вирус семейства Paramyxoviridae.
При установлении диагноза нужно учитывать эпизоотологические данные, симптомокомплекс и патологоанатомические изменения и в первую очередь результаты вирусологических и серологических исследований.
Согласно эпизоотологчческим данным болеют главным образом телята до 6-месячного возраста.
Основной клинический признак болезни — поражение органов дыхания.
Лабораторная диагностика основана на выделении возбудителя из носовых истечений больных животных и идентификации его с помощью реакции гемадсорбции и ее торможения в культуре клеток, реакции торможения гемагглютинации и выявления прироста специфических антител в парных сыворотках.
Инфекционный ринотрахеит — остропротекающая контагиозная болезнь, вызываемая вирусом семейства Herpesviridae.
У крупного рогатого скота известно пять форм клинического проявления инфекционного ринотрахеита: респираторная, глазная, менингоэнцефалитная, или нервная, генитальная и суставная. При попадании вируса в половые органы животного развивается пустулезный вульвовагинит, характерны аборты. У телят часто регистрируют пневмонию. Гибель плода в утробе матери и аборты отмечают через 3 нед после заражения.
Лабораторный диагноз основан на выделении и идентификации вируса в тканевой культуре почек, легких, тестикул бычков. Присутствие вируса инфекционного ринотрахеита в зараженных культурах клеток выявляют по цитопатическому действию (ЦПД) и идентифицируют с помощью РН.
Вирусная диарея (ВД)— острая контагиозная болезнь, вызываемая пестивирусом семейства Flaviviridae.
Согласно эпизоотологическим данным болеет крупный рогатый скот обычно в возрасте от 2 мес до 2 лет.
Клинические признаки болезни зависят от ее течения (острое, подострое, хроническое и латентное). При остром течении у животных резко повышается температура тела (40,5...42,4 °С), развивается угнетение. Одновременно отмечают гиперемию слизистых оболочек носовой полости, а затем слизистые истечения из носовых отверстий.
Для лабораторного исследования направляют кусочки слизистой оболочки носа, кишечника, внутренних органов и лимфатические узлы в термосе со льдом. Вирус выделяют на первичных культурах клеток тестикул быка, почки эмбриона коровы и титруют в РН на культуре клеток, в РИД, РСК, РИФ, РИА.
Аденовирусные инфекции—остропротекающие болезни животных многих видов (чаще болеет КРС). Поражается в основном молодняк, у взрослых животных болезнь протекает латентно. Возбудитель принадлежит к семейству Adenoviridae.
Клинические признаки у телят: лихорадка, снижение аппетита, слезотечение, слизисто-гнойное истечение из носа. Затем отмечают затрудненное дыхание, кашель, диарею с примесью крови. Летальность до 60 %. При переболевании телята долго отстают в развитии.
Диагноз устанавливают на основании лабораторных исследований — выделения вируса в культурах тканей и идентификации его в РСК, РИФ, РДП, РН, РНГА и результатов исследования парных сывороток в РНГА.
Учитывая возможность смешанной инфекции, параллельно исследуют материал бактериологическим методом. Дифференциальная диагностика вирусных респираторных болезней крупного рогатого скота приведена в таблице 8.

ЗАДАНИЯ ДЛЯ САМОСТОЯТЕЛЬНОЙ РАБОТЫ
1. Разработать схему дифференциальной диагностики инфекционного ринотрахеита и хламидиоза.
2. Решить эпизоотологическую задачу.
Комплекс по откорму молодняка крупного рогатого скота. Заболевание телят возникло через 1 сут после их перевозки в холодную дождливую погоду в открытых автомашинах. Болезнь характеризовалась быстрым распространением. В течение 10 дней заболело 80 % телят. При типичном течении болезни животные через 1...2 нед выздоравливали. У отдельных телят (10 %) болезнь приняла затяжное течение и тяжелую форму, при этом нередко оканчивалась смертью, особенно при поражении легких.
Клинические признаки болезни: температура тела 41... 42 "С;
пульс 110...120 уд/мин; дыхание 60...84 дв/мин. Общее состояние угнетенное. Животные плохо поедают корм. Серозно-катаральный конъюнктивит, ринит. Серозное истечение из носовой полости. Сильный сухой кашель. У одних животных наблюдают слюнотечение, на слизистой оболочке ротовой полости эрозии, усиленную перистальтику, жидкие фекалии. У других—вначале серозный конъюнктивит и ринит, а затем слизисто-гнойное истечение из носовой полости, усиливающийся кашель, признаки бронхопневмонии.
Установить первоначальный диагноз.
Выбрать дополнительные методы диагностики, разработать схему дифференциального диагноза.
Занятие 42. Лечение, профилактика и ликвидация парагриппа-3, инфекционного ринотрахеита, вирусной диареи и аденовирусной инфекции крупного рогатого скота
Цель занятия: изучить способы лечения вирусных респираторных заболеваний крупного рогатого скота, систему профилактических и оздоровительных мероприятий.
Материалы и оборудование: аппаратура для получения аэрозолей лекарственных средств (САГ, ДАГ), специфические сыворотки, водорастворимые антибиотики (пенициллин, стрептомицин и др.), сульфаниламидные препараты (норсульфазол натрия, сульфацил натрия), бронхолитики (эфедрин, эуфиллин).
Место проведения занятия: аудитория кафедры эпизоотологии или хозяйство, неблагополучное по респираторным болезням.
МЕТОДИЧЕСКИЕ УКАЗАНИЯ
Способы лечения. Для лечения респираторных болезней крупного рогатого скота применяют сыворотку крови выздоровевших животных, которую вводят парентерально или аэрозольным способом. Если есть возможность, из сыворотки готовят иммунные глобулины, которые назначают с лечебной целью в виде аэрозолей или парентерально. Лучший эффект всегда получают от аэрозольного применения.
Из лекарственных препаратов используют антибиотики, сульфаниламидные средства, аэрозоли лимонной и молочной кислот, лактат этакридина и другие препараты.
Животных обрабатывают в течение 40...60 мин непосредственно в помещениях, где создают герметичность.
Целесообразно использовать антибиотики пролонгированного действия (бициллин, дибиомицин, дитетрациклин, экмоновоцил-лин и др.). Дибиомицин и дитетрациклин вводят внутримышечно по 4000...5000 ЕД на 1 кг массы животного трехкратно каждые 5...7 дней. Эффективность препаратов повышается при назначении их в комплексе с витаминами А, В^, С и гормональными препаратами. Последние способствуют восстановлению функции дыхательных путей и положительно влияют на резорбцию антибиотиков. Применяют гидрокортизон (25 мг ДВ) подкожно по 1 мл или преднизолон внутрь по 20 мл в течение 5...6 дней. При развивающихся патологических процессах в легких рекомендуют ферментотерапию: смесь трипсина с дезоксирибонуклеазой. По 10 мг каждого фермента растворяют в 10 мл физиологического раствора и вводят внутримышечно больному теленку 1 раз в сутки до клинического выздоровления. При бронхопневмонии телят эффективна новокаиновая терапия. На ранней стадии болезни одно- и двукратная блокада грудных нервов и симпатических стволов вполне достаточна, чтобы купировать воспалительный процесс.
При респираторных болезнях антибактериальные и антивирусные препараты лучше использовать в форме аэрозолей, так как при этом способе введения удается достичь терапевтических концентраций в местах первичной локализации возбудителя. Ингалируемые лекарственные вещества начинают проявлять свое действие в 20 раз быстрее, чем те же средства, введенные парентерально. При этом дозы ингалируемых веществ в 4 раза меньше. Кроме того, из легких препараты попадают в большой круг кровообращения через малый, минуя печень, и активность их не уменьшается.
Оздоровительные и профилактические мероприятия. Мероприятия против респираторных болезней в основном базируются на выполнении общих ветеринарно-санитарных мер и сводятся к охране хозяйств от заноса возбудителя, улучшению условий содержания (комплектование равновозрастных групп), кормления и повышению общей ветеринарно-санитарной культуры на фермах. Больных животных необходимо строго изолировать.
На крупных фермах (комплексах) рекомендуют использовать средства, которые характеризуются не только лечебными, но и дезинфицирующими свойствами: могут санировать воздух и помещения, кожный покров животных. К таким веществам относят: йодсодержащие препараты (йодтриэтиленгликоль, мастистерил, хлорид йода, йодид алюминия); хлорсодержащие (гипохлорит кальция или натрия, хлорамин); кислоты (надуксусная, молочная, уксусная) и ряд других средств.
Для специфической профилактики в производственных условиях применяют моно- и ассоциированные культуральные вакцины.
Многие исследователи и практики отдают предпочтение применению сывороток крови реконвалесцентов или приготовленных из них иммунных глобулинов. Последние содержат антитела ко всем антигенам, которые имеются в данном хозяйстве. Введенные аэрозольным методом иммуноглобулины оказываются прекрасным профилактическим лечебным средством.
ЗАДАНИЯ ДЛЯ САМОСТОЯТЕЛЬНОЙ РАБОТЫ
1. Изучить схемы и методику аэрозольной обработки телят различными препаратами.
2. Разработать схему мероприятий по профилактике и ликвидации респираторных болезней в хозяйстве по откорму бычков.
