
304- Органическая химия_Черных В.П. и др_Х., 2007 -776с
.pdf
аЛкены |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
161 |
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CH |
3 |
|
|
δ– |
H+ CH |
3 C+—CH3 |
|
|
|
||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
C—CH2 |
|
|
|
|
|
|
|
(зарождение цепи) |
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||
|
|
|
|
|
|
|
CH3 |
|
|
|
|
|
|
|
CH3 |
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
изобутилен |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
CH3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
δ– |
|
|
|
|
|
СH3 |
|
|
|
|
|
|
СH3 |
|
СH3 |
|
|
||||||||||
CH |
|
|
|
|
|
nH2C=С—CH3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||
3 C+—CH |
|
|
CH |
—С—— |
CH |
—С—— |
CH —С+ |
(рост цепи) |
||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||
CH3 |
3 |
|
|
|
|
|
|
|
|
3 |
|
|
|
|
|
|
2 |
|
|
|
|
|
|
|
2 |
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
СH3 |
|
|
|
|
|
|
СH3 |
n |
СH3 |
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
СH3 |
|
|
|
|
|
|
|
|
|
|
СH3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
СH3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
CH |
—С—— |
CH —С—— |
CH —С+ |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||
|
3 |
|
|
|
2 |
|
|
|
|
|
|
|
2 |
|
|
|
|
–H+ |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
СH3 |
|
|
|
СH3 |
|
n |
|
СH3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
СH3 |
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
СH3 |
СH3 |
|
|
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
CH3—С—— |
CH2—С—— |
CH—С |
СH3 |
(обрыв цепи) |
|||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
СH |
|
|
СH |
3 |
n |
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
3 |
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
полиизобутилен
координационная полимеризация. Координационная полимеризация алкенов представляет собой довольно сложный процесс, протекающий в присутствии комплексных металлорганических катализаторов. Эти катализаторы открыты немецким химиком Карлом Циглером и модифицированы итальянским химиком Джулио Наттой (катализаторы Циглера—Натты). Наиболее распространенным из них является комплекс триэтилалюминия с титана хлоридом Аl(С2Н5)3 · ТiСl4.
Механизм координационной полимеризации пока точно не известен, однако установлено, что образование полимера происходит путем внедрения молекул алкена по связи металл-углерод растущей полимерной цепи.
Полимеризация алкенов в присутствии катализаторов Циглера—Натты позволяет получать высокомолекулярные полимеры при относительно низких давлении и температуре. Этот метод широко используют в промышленности для производства полиэтилена и полипропилена низкого давления.
Важной особенностью координационной полимеризации является ее стереохимическая направленность. При свободнорадикальной и катионной полимеризации образуется полимер нерегулярного строения, то есть с произвольной стереохимической конфигурацией. Такой полимер называют атактическим. Полимеризация алкенов с использованием катализатора Циглера—Натты приводит к образованию стереорегулярного полимера, получившего название «изотактический».
Пространственное строение атактического и изотактического полипропиленов:
H СH3 СH3 H СH3 H H СH3 |
СH3 H СH3 H СH3 H СH3 H |
||||||
C |
C |
C |
C |
C |
C |
C |
C |
СH2 |
СH2 |
СH2 СH2 |
СH2 |
СH2 |
СH2 СH2 |
СH2 |
СH2 |
|
атактический полипропилен |
|
|
изотактический полипропилен |
|
||

Глава 10
162
Изотактическим полимерам по сравнению с атактическими свойственны большая прочность и более высокие температуры плавления.
10.5.4. аЛЛиЛьное гаЛогенироВание аЛкеноВ
При действии на алкены галогенирующих реагентов (Cl2, N-бромсукцинимид и др.) в присутствии инициаторов процесса образования свободных радикалов (пероксиды, температура, УФ-свет) происходит не присоединение галогена по месту разрыва двойной связи, а свободнорадикальное замещение на галоген атома водорода, находящегося при атоме углерода в α-положении к двойной связи (аллильное положение). Так, при температуре 500—600 °С пропен реагирует с хлором, образуя аллилхлорид:
H2C—CH—CH3 + Cl2 |
500—600 °C |
H2C—CH—CH2—Cl + HCl |
пропен |
|
аллилхлорид |
Реакция используется в промышленном синтезе глицерина.
Бромирование алкенов по аллильному положению чаще всего осуществляется действием N-бромсукцинимида в присутствии пероксидов:
|
|
О |
|
|
|
О |
|||||
H C—CH—CH |
—R + |
|
пероксиды |
H |
C—CH—CH—R + |
|
|
||||
N—Br |
N—H |
||||||||||
|
|
||||||||||
2 |
2 |
|
|
|
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
О |
|
Br |
О |
||||||
|
|
|
|
|
|||||||
|
|
N-бромсукцинимид |
|
|
|
сукцинимид |
|||||
Аллильное галогенирование протекает по свободнорадикальному механизму (см. с. 139) и включает стадию образования аллильного радикала. В результате сопряжения неспаренного электрона с π-электронами двойной связи аллильные радикалы являются более устойчивыми, чем обычные алкильные радикалы:
H2C—CH—CH2 
 H2C—CH—CH2
H2C—CH—CH2
Поэтому замещение атома водорода на атом галогена в аллильном положении алкенов происходит легче, чем в алканах.
10.6. ИДЕНТИФИКАЦИЯ АЛКЕНОВ
В отличие от алканов, алкены идентифицируют с использованием инструментальных и химических методов. Химические методы основаны на наличии в структуре алкенов реакционноспособной двойной связи. Обычно для доказательства наличия двойной связи используют реакцию взаимодействия алкенов с раствором брома в хлороформе или четыреххлористом углероде (наблюдается обесцвечивание растворов брома) и реакцию окисления разбавленным раствором калия перманганата в нейтральной или щелочной среде, так называемая проба Байера (наблюдается исчезновение розово-фиолетового окрашивания раствора калия перманганата). Однако эти реакции не являются строго специфическими на двойную связь, поэтому для идентификации алкенов используют комплекс данных, полученных с помощью химических и физических методов исследования.

аЛкены
163
Из физических методов широко применяют ИК-, ПМР-спектроскопию и масс-спектрометрию. В ИК-спектрах алкенов имеется полоса поглощения в области 1670—1640 см–1, обусловленная валентными колебаниями связи С—С,
и полоса в области 3090—3010 см–1, отвечающая валентным колебаниям связи Сsр2—H. Кроме того, в спектре присутствуют полосы деформационных колебаний связей Сsр2—Н, которые для цис-изомера проявляются в области 720—650 см–1,
транс-изомера — 980—960 см–1.
ПМР-спектры алкенов характеризуются наличием сигналов алкеновых протонов при δ 4,5–6,0 млн–1.
Распад алкенов при измерении масс-спектров — достаточно сложный процесс. Вместе с тем легче всего происходит аллильное расщепление молекулярного иона вследствие образования стабилизированного за счет полярного резонанса аллил-катиона:
|
+ |
|
[R—CH2—CH—CH2]+ |
|
R + CH2—CH—CH2 |
|
||
|
|
аллил-катион |
10.7. ОТДЕЛЬНЫЕ ПРЕДСТАВИТЕЛИ. ПРИМЕНЕНИЕ
Этилен н2с—сн2. Бесцветный газ с очень слабым запахом, мало растворим в воде, горит ярким коптящим пламенем, с воздухом образует взрывчатые смеси. Служит сырьем в промышленности для получения этанола, этиленгликоля, уксусного альдегида, полиэтилена и др. Используется в качестве вещества, способствующего созреванию овощей и фруктов.
Пропилен н2с—сн—сн3. Бесцветный газ со слабым запахом. Широко используется в промышленном органическом синтезе для получения изопропилового спирта, глицерина, ацетона, полипропилена и других ценных органических соединений.
Глава 11
АЛКАДИЕНЫ
Алкадиенами называют алифатические углеводороды, содержащие две двойные углеродуглеродные связи.
Общая формула алкадиенов СnН2n–2.
В зависимости от расположения двойных связей в молекуле различают три основных типа алкадиенов:
Алкадиены с кумулированными двойными связями (двойные связи расположены у одного атома углерода)  С—С—С
С—С—С . Такие соединения называют алленами (по тривиальному названию простейшего представителя этого ряда — аллена
. Такие соединения называют алленами (по тривиальному названию простейшего представителя этого ряда — аллена
Н2С—С—СН2).
Алкадиены с сопряженными двойными связями (двойные связи разделены одной простой C—C-связью)  С—С—С—С
С—С—С—С .
.
Алкадиены с изолированными двойными связями (двойные связи разделены одним и более sp3-гибридизованными атомами углерода)  С—С—( С—)n С—С
С—С—( С—)n С—С .
.
11.1. НОМЕНКЛАТУРА
Названия алкадиенов по номенклатуре IUPAC образуют аналогично алкенам. Наличие двух двойных связей обозначают суффиксом -диен с указанием положения каждой из них в главной углеродной цепи:
5 |
4 |
3 |
2 |
1 |
4 |
3 |
2 |
1 |
1 |
2 |
3 |
4 |
СH3—CH—СH—CH—СH2 |
СH3—CH—С—СH2 |
H2С—С—CH—СH2 |
||||||||||
|
|
|
|
|
|
|
|
|
|
СH3 |
|
|
|
|
1,3-пентаäèåí |
|
|
1,2-бутадèåí |
|
2-метил-1,3-áóòàäèåí |
|||||
Для некоторых алкадиенов используют тривиальные и рациональные названия:
H2С—С—CH—СH2 |
H2С—СH—CH—СH2 |
H2С—СH—CH2—CH—СH2 |
СH3 |
|
|
изопрен |
дивинил |
дивинилметан |

аЛкадиены
165
11.2. СТРОЕНИЕ АЛКАДИЕНОВ
В молекуле алкадиенов с кумулированной системой двойных связей атом углерода, образующий две двойные связи, находится в состоянии sp-гибридизации, а соседние с ним атомы углерода — в sp2-гибридизации (рис. 11.1, а). Эти три атома углерода расположены в пространстве линейно, а π-связи находятся в двух взаимно перпендикулярных плоскостях. Четыре заместителя при углеродных атомах в sp2-гибридизации тоже расположены в двух взаимно перпендикулярных плоскостях (рис. 11.1, б).
H |
sð2 |
sð |
sð2 H |
H |
C |
C |
H |
H |
C |
C |
C |
H |
C |
||
|
|
H |
|
|
H |
Рис. 11.1. Схема пространственного строения алленов
Вследствие такого пространственного строения молекулы алленов, у которых при каждом из атомов углерода в sp2-гибридизации имеются разные заместители, являются хиральными, а следовательно, для них возможна оптическая изомерия:
H3C |
— |
— |
H |
H |
— — |
СH3 |
C |
C |
|
|
|||
C |
|
|
C C C |
|
||
H |
|
|
СH3 |
H3C |
|
H |
энантиомеры 1,3-диметилаллена
Если двойные связи в молекуле разделены одной углерод-углеродной σ-связью (алкадиены с сопряженными связями), происходит дополнительное перекрывание р-электронных облаков соседних π-связей (π,π-сопряжение) и образуется единая π-электронная система, в которой π-электроны уже не принадлежат отдельным связям, а делокализованы по всей системе (см. рис. 11.2).
H 0,134 íì |
H |
|
|
|
|
|
1 |
2 |
|
|
H |
C C |
|
C |
C 0,148 íì |
|
||||
H |
|
3 |
4 |
|
C C |
|
|
C |
C |
|
C C |
||
|
H |
0,134 íì |
H |
|
|
|
|
|
a |
|
|
á |
â |
Рис. 11.2. Схематическое изображение сопряженной системы 1,3-бутадиена:
а — геометрия молекулы; б — перекрывание p-АО; в — делокализованная π-МО
Перераспределение электронной плотности в молекуле приводит к укорочению σ-связи, расположенной между этиленовыми группами, и сопровождается выделением энергии, что способствует повышению стабильности системы. Эту энергию называют энергией сопряжения. Так, в молекуле 1,3-бутадиена длина

Глава 11
166
связи С-2—С-3 составляет 0,148 нм, тогда как длина связи С—С в этане равна 0,154 нм. Энергия сопряжения 1,3-бутадиена составляет примерно 15 кДж/моль.
С помощью метода электронографии установлено, что алкадиены с сопряженными связями имеют преимущественно трансоидную конформацию ( транс- расположение двойных связей по отношению к одинарной):
HH
1 |
|
|
|
3 |
|
|
0,134 мм |
|
С |
|
|
H |
|||||
|
2 |
С |
||||||
H |
4 |
|||||||
|
|
С |
С |
|
||||
122°
HH
Алкадиены с изолированными двойными связями построены аналогично алкенам.
Особенности строения алкадиенов различных типов сказываются на их реакционной способности. В частности, алкадиены с кумулированными и изолированными связями по химическим свойствам во многом напоминают алкены. Они легко вступают в многочисленные реакции присоединения, только в них принимает участие не одна, а две двойные связи. Алкадиены с сопряженными двойными связями проявляют своеобразные химические свойства.
11.3. АЛКАДИЕНЫ С СОПРЯЖЕННЫМИ СВЯЗЯМИ
11.3.1. сПосоБы ПоЛучениЯ
Для получения алкадиенов с сопряженными связями чаще всего применяют дегидрирование алканов и алкенов, дегидратацию диолов и непредельных спиртов.
каталитическое дегидрирование алканов и алкенов. Метод широко используют в промышленности для получения 1,3-бутадиена (дивинила) и 2-метил-1,3-бута- диена (изопрена). Реакция протекает в присутствии смешанного алюмохромового катализатора Сr2O3/Аl2O3. Для получения 1,3-бутадиена дегидрированию подвергают бутан-бутеновую фракцию нефти:
CH3—CH2—CH2—CH3 |
|
650 °С, |
кат. |
H2C—CH—CH—CH2 |
|
||||
H2C—CH—CH2—CH3 |
|
–H |
2 |
|
|
1,3-бутадиен |
Для получения изопрена проводят дегидрирование изопентан-изопентеновой фракции нефти:
CH3— |
CH—CH2—CH3 |
|
550 °С, кат. |
H2C—C—CH—CH2 |
|
||||
CH3 |
|
|||
|
–H2 |
|||
CH3— |
CH—CH—CH2 |
|
|
CH3 |
|
|
|||
CH3 |
|
|
2-метил-1,3-бутадиен |
|
|
|
|
||
дегидратация диолов (гликолей). В присутствии минеральных кислот или алюминия оксида 1,3- и 1,4-диолы отщепляют воду с образованием сопряженных алкадиенов:

аЛкадиены |
|
|
167 |
|
|
|
|
|
|
CH2—CH2—CH—CH3 |
Al2O3; 280 °С |
|
||
|
|
|||
–2HO |
2 |
|
|
|
|
|
|
|
|
OH OH
1,3-áóòàнäèол
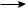 H2C—CH—CH—CH2
H2C—CH—CH—CH2
1,3-бутадиен
дегидратация непредельных спиртов. Спо-
соб имеет важное промышленное значение для получения 1,3-бутадиена и изопрена. 1,3-Бутадиен получают дегидратацией кротилового спирта:
CH |
—CH—CH—CH |
—OH |
|
кат. |
|
|
|
сергей Васильевич ЛеБедеВ |
||||||||
–H2O |
|
|
|
(1874—1934) |
||||||||||||
3 |
кротиловый спирт |
2 |
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
Советский химик. Окончил Петер- |
|||||
|
|
|
|
|
|
|
|
H2C—CH—CH—CH2 |
||||||||
|
|
|
|
|
|
|
|
бургский университет (1900). |
||||||||
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Основные научные исследования |
|
|
В 1928 году советский химик Сергей Ва- |
посвящены полимеризации, изомери- |
||||||||||||||
сильевич Лебедев разработал одностадийный |
зации и гидрогенизации непредельных |
|||||||||||||||
способ получения 1,3-бутадиена из этилово- |
соединений. Впервые (1910) получил |
|||||||||||||||
го спирта путем каталитического дегидриро- |
образец синтетического бутадиеново- |
|||||||||||||||
го каучука. Разработал (1926—1928) |
||||||||||||||||
вания и дегидратации на смешанном цинк- |
одностадийный промышленный спо- |
|||||||||||||||
алюминиевом катализаторе: |
|
|
|
|
|
|
соб получения бутадиена из этилового |
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
ZnO/Al2O3 |
|
|
|
|
|
|
спирта. Получил (1928) синтетический |
|||
2CH3—CH2—OH |
|
|
|
|
|
|
|
каучук полимеризацией бутадиена под |
||||||||
|
|
|
|
|
|
|
|
|
|
действием металлического натрия. |
||||||
|
|
|
H2C—CH—CH—CH2 + 2H2O + H2 |
Разработал (1930) методы получения |
||||||||||||
|
|
|
резины и резино-технических изде- |
|||||||||||||
|
|
|
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
лий. С 1932 года по способу Лебедева |
|
|
Реакция протекает через стадию образо- |
в СССР начала создаваться впервые |
||||||||||||||
вания кротилового спирта. |
|
|
|
|
|
|
в мире промышленность синтетиче- |
|||||||||
|
Изопрен получают дегидратацией непре- |
ского каучука. |
||||||||||||||
|
|
|
||||||||||||||
дельного спирта 2-метил-3-бутен-2-ола: |
|
|
|
|
||||||||||||
|
|
|
|
|
|
OH |
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
кат. |
|
|
|
|
|
|
|
CH3—C—CH—CH2 |
H2C—C—CH—CH2 |
||||||||||||
|
|
|
–H |
O |
||||||||||||
|
|
|
|
|
|
|
|
|
2 |
|
|
|
|
|||
|
|
|
|
|
|
CH3 |
|
|
|
|
|
|
CH3 |
|||
11.3.2. химические сВоЙсТВа
Для алкадиенов с сопряженными связями характерны реакции присоединения и полимеризации, свойственные алкенам. Однако в химическом поведении 1,3-ал-
кадиенов имеются и некоторые особенности. Во-первых, по сравнению с алкенами сопряженные диены проявляют более высокую реакционную способность. Во-вторых, в реакциях электрофильного присоединения чаще всего образуется два продукта,

Глава 11
168
из которых один является результатом присоединения по месту двойной связи (1,2-присоединение), а второй — по концам сопряженной системы (1,4-присоеди- нение). Соотношение этих продуктов зависит от условий проведения реакции (температуры, растворителя), а также природы электрофильного реагента.
гидрирование. Водород в момент выделения образует с 1,3-алкадиенами обычно продукты 1,4-присоединения:
H2C—CH—CH—CH2 |
2CH3OH + 2Na |
CH3—CH—CH—CH3 |
|
||
|
|
2-бутен |
Вприсутствии катализаторов (Ni, Рt) 1,3-алкадиены присоединяют водород
в1,2- и 1,4-положения с образованием соответствующих алкенов, которые подвергаются дальнейшему гидрированию до алканов:
2H2C—CH—CH—CH2 |
H2; êàò. |
|
CH3—CH2—CH—CH2 |
|
H2; êàò. |
|
|
||||
1-бутен |
|
||||
|
|
CH3—CH—CH—CH3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2-бутен |
|
|
|
 CH3—CH2—CH2—CH3
CH3—CH2—CH2—CH3
áóòаí
Присоединение галогенов. Присоединение галогенов к сопряженным диенам приводит к образованию смеси продуктов 1,2- и 1,4-присоединения, состав которой зависит от природы галогена, структуры диенового углеводорода и условий проведения реакции. Как правило, при повышении температуры и переходе от хлора к йоду возрастает выход продукта 1,4-присоединения. В процессе бромирования 1,3-бутадиена при температуре –80 °С образуется преимущественно продукт 1,2-присоединения, а при 40 °С — продукт 1,4-присоединения:
|
|
1,2-присоединение |
|
CH2— |
CH—CH—CH2 |
||
|
|
|
|
||||
H2C—CH—CH—CH2 + Br2 |
|
|
Br |
Br |
|||
|
|
|
|
3,4-дибром-1-бутен |
|
||
|
|
1,4-присоединение |
|
CH2—CH—CH— |
CH2 |
||
|
|
|
|
||||
|
|
|
|||||
|
|
|
Br |
|
Br |
||
|
|
|
|
|
1,4-дибром-2-бутен |
|
|
Аналогично алкенам присоединение галогенов к сопряженным алкадиенам происходит по ионному электрофильному механизму. Особенность механизма состоит в том, что электрофильная частица всегда атакует концевой атом углерода сопряженной системы, поскольку при этом образуется мезомерно стабилизированный карбокатион аллильного типа, строение которого можно представить граничными структурами I и II. Последующая атака карбокатиона бромид-ионом приводит к образованию продуктов 1,2- (III) и 1,4-присоединения (IV).


170 |
|
|
|
|
|
|
|
|
|
|
|
|
Глава 11 |
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Эта реакция относится к реакциям [4+2]-цик- |
|||||||||||
|
|
|
|
|
|||||||||||
|
|
|
|
|
лоприсоединения, поскольку в ней принима- |
||||||||||
|
|
|
|
|
ет участие 4π-электронная система |
диена |
|||||||||
|
|
|
|
|
и 2π-электронная система диенофила. Реак- |
||||||||||
|
|
|
|
|
ция впервые была открыта в 1928 году не- |
||||||||||
|
|
|
|
|
мецкими химиками Отто Дильсом и Куртом |
||||||||||
|
|
|
|
|
Альдером. Диеновый синтез широко исполь- |
||||||||||
|
|
|
|
|
зуется для синтеза полициклических соеди- |
||||||||||
|
|
|
|
|
нений, в том числе при синтезе биологически |
||||||||||
|
|
|
|
|
активных соединений сложного строения. |
||||||||||
|
|
|
|
|
Полимеризация. Важным свойством алка- |
||||||||||
|
|
|
|
|
диенов с сопряженными связями является |
||||||||||
отто Пауль герман диЛьс |
|
их склонность к полимеризации. В качестве |
|||||||||||||
|
инициаторов чаще применяют органические |
||||||||||||||
|
(1876—1954) |
|
|||||||||||||
Немецкий химик-органик. Окон- |
и неорганические пероксиды, металлоргани- |
||||||||||||||
ческие соединения, щелочные металлы. Об- |
|||||||||||||||
чил Берлинский университет (1899). |
разование полимера происходит преимуще- |
||||||||||||||
Основное научное направление — |
|||||||||||||||
структурная органическая химия. Со- |
ственно по типу 1,4-присоединения: |
|
|
||||||||||||
вместно с К. Альдером изучал (1911) |
nH2C—CH—CH—CH2 |
|
|
|
|
|
|
||||||||
азодикарбоновый эфир, а затем от- |
|
|
|
|
|
|
|||||||||
крыли (1928) диеновый синтез. Про- |
1,3-бутадиен |
|
—CH |
|
CH—CH |
—— |
|||||||||
водил работы по установлению строе- |
|
|
—CH |
|
|||||||||||
ния холестерина и холевой кислоты. |
|
|
[ |
2 |
|
|
|
— |
|
2 |
]n |
||||
Лауреат Нобелевской премии (1950, |
|
|
|
|
1,4-полибутадиен |
|
|
||||||||
совместно с Альдером). |
|
При полимеризации замещенных диенов |
|||||||||||||
|
|
|
|
|
|||||||||||
1,4-присоединение осуществляется по принципу «голова к хвосту»: |
|
|
|
||||||||||||
nH2C—C—CH—CH2 |
|
|
···—CH2—C—CH—CH2—CH2—C—CH—CH2—··· |
||||||||||||
|
|
||||||||||||||
|
CH3 |
|
CH3 |
|
|
CH3 |
|
|
|
||||||
|
изопрен |
|
|
|
|
|
|
|
|
|
|
|
|
||
Реакции полимеризации сопряженных диенов широко используют в производстве синтетического каучука.
11.3.3. наТураЛьныЙ и синТеТическиЙ каучук
натуральный (природный) каучук. Получают из латекса (млечный сок) тропического растения гевеи, произрастающей главным образом в Бразилии. Выделяющийся при подсочке деревьев млечный сок содержит 20—60 % каучука, который осаждают добавлением муравьиной или уксусной кислоты.
По химическому строению натуральный каучук представляет собой линейный стереорегулярный полимер изопрена (полиизопрен), имеющий цис-конфигурацию изопреновых звеньев:
H3C |
— |
H |
H3C |
— |
H |
С |
C |
С |
C |
||
···—CH2 |
|
CH2—CH2 |
CH2—CH2 |
|
CH2—··· |
|
|
H3C |
С—C |
|
|
|
|
H |
|
|
|
|
|
натуральный каучук; |
|
|
|
|
|
цис-полиизопрен |
|
|
|

 CH
CH