
304- Органическая химия_Черных В.П. и др_Х., 2007 -776с
.pdf
аромаТические угЛеВодороды. одноЯдерные арены |
211 |
|||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
+ C2H5—Cl |
|
AlCl3 |
|
C2H5 |
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
+ HCl |
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
хлорэтан |
|
|
|
|
|
этилбензол |
|
|
|
|
|||||||
Для алкилирования аренов, помимо га- |
|
|
|
|
||||||||||||||||
логеналканов, могут быть использованы |
|
|
|
|
||||||||||||||||
спирты и алкены. Реакции с участием спир- |
|
|
|
|
||||||||||||||||
тов протекают в присутствии кислот Льюиса |
|
|
|
|
||||||||||||||||
или минеральных кислот (H3PO4, H2SO4): |
|
|
|
|
||||||||||||||||
|
|
|
+ C2H5—OH |
|
AlCl3 |
|
C2H5 |
джеймс мейсон краФТс |
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
+ H2O |
|
|||||||||
|
|
|
|
|
|
|
|
|
|
(1839—1917) |
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
Алкилирование аренов алкенами требует |
Американский химик, член На- |
|||||||||||||||||||
циональной |
академии наук |
США |
||||||||||||||||||
присутствия в качестве катализатора кисло- |
с 1872 года. Основные научные иссле- |
|||||||||||||||||||
ты Льюиса и минеральной кислоты как ис- |
дования посвящены органической хи- |
|||||||||||||||||||
мии. Совместно с Фриделем исследовал |
||||||||||||||||||||
точника протонов. |
|
|
|
|
|
|
|
|
|
|
|
|
|
(с 1863) кремнийорганические соеди- |
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
+ H2C—CH—CH3 |
|
H+; AlCl |
3 |
|
|
|
|
нения, установил четырехвалентность |
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
титана и кремния, а также разработал |
||||||||
пропен |
|
|
|
|
|
H3C—CH—CH3 |
(1877) метод |
алкилирования и |
аци- |
|||||||||||
|
|
|
|
|
лирования ароматических соединений |
|||||||||||||||
|
|
|
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
соответствующими алкил- и ацилга- |
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
логенидами в присутствии алюминия |
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
хлорида (реакция Фриделя—Крафтса). |
|||
|
|
|
|
|
|
|
|
|
|
|
|
кумол |
Занимался также исследованиями |
|||||||
Атакующей электрофильной |
|
|
|
частицей |
газовых термометров и внес огром- |
|||||||||||||||
|
|
|
ный вклад в термометрию. |
|
||||||||||||||||
в реакции алкилирования |
|
по |
|
Фриделю— |
|
|
|
|
||||||||||||
Крафтсу является карбокатион, который образуется в каждом конкретном случае при взаимодействии алкилирующего агента и катализатора.
Образование электрофила из галогеналканов:
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
+ |
|
|
|
|
|
|
|
|
|
|
|
CH —CH |
2 |
|
|
Cl + AlCl |
3 |
|
|
|
|
|
|
CH |
—CH |
2 |
+ AlCl– |
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||
|
|
3 |
|
|
|
|
|
|
|
|
|
|
|
|
3 |
|
|
|
4 |
|
|
|
||||||||
|
|
хлорэтан |
|
|
|
|
|
|
|
|
|
ион карбония; |
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
этил-катион |
|
|
|
|
|
|
|
|||
Образование электрофила из спиртов: |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
+ |
|
– |
|
CH3—CH2—OH + AlCl3 |
|
|
|
|
|
CH3—CH2—OAlCl2 |
|
|
|
|
CH3—CH2 |
+ OAlCl2 |
||||||||||||||||||
|
|
|
|
|
|
|
||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|||||||||||||||||||||||
|
этанол |
|
|
|
–HCl |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
+ |
|
|
|
|
|
|
+ |
|
|
|
|||
CH |
—CH |
—OH + H+ |
|
|
|
|
|
|
CH |
—CH |
—O—H |
|
|
|
CH |
—CH |
|
+ H |
O |
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||
3 |
2 |
|
|
|
|
3 |
|
2 |
|
|
|
|
|
|
|
|
3 |
|
2 |
2 |
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
H |
|
|
|
|
|
|
|
|
|
|
|
Образование электрофила из алкенов: |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||
|
|
|
|
δ+ |
|
|
|
δ– |
|
|
|
|
|
|
|
|
|
|
+ |
|
|
|
|
|
|
|
|
|||
|
|
CH3 |
|
CH—CH2 + H+ |
|
|
|
|
|
CH3—CH—CH3 |
|
|
|
|
||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||
|
|
|
|
|
пропен |
|
|
|
|
|
|
изопропил-катион |
|
|
|
|
||||||||||||||

Глава 14
212
По своему механизму реакция алкилирования аналогична рассмотренным выше реакциям нитрования, сульфирования и галогенирования.
+ |
|
|
|
|
+ |
|
|
|
|
H |
||
|
|
|
|
|
CH2—CH3 –H+ |
|||||||
+ CH2—CH3 |
|
|
|
|
|
CH2—CH3 |
|
|
|
+ |
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
π-комплекс |
|
|
|
σ-комплекс |
||||
 CH2—CH3
CH2—CH3
этилбензол
Введенная в бензольное ядро алкильная группа, являясь электронодонором, повышает реакционную способность ароматического кольца по отношению к электрофильным реагентам. Поэтому образовавшийся в процессе алкилирования продукт более склонен к взаимодействию с электрофилом, чем исходный арен. В результате алкилирование часто не завершается на стадии образования монозамещенного продукта, а приводит к ди- и полиалкиларенам.
ацилирование по Фриделю—крафтсу. Ацилированием называют процесс введе-
ния в молекулу органического соединения ацильной группы R—C O.
O.
Ацилирование бензола и его гомологов по Фриделю—Крафтсу обычно осуществляют галогенангидридами или ангидридами карбоновых кислот в присутствии кислот Льюиса. Данная реакция служит общим методом получения ароматических кетонов.
|
|
|
O |
|
|
|
O |
|
C |
|
|
+ CH —C |
AlCl3 |
CH3 |
+ HCl |
||
|
|||||
|
|
|
|
||
3 |
Cl |
|
|
|
|
|
|
|
|
||
ацетилхлорид |
|
ацетофенон |
|
||
Электрофилом, атакующим бензольное кольцо, в реакции ацилирования яв-
ляется либо ацилиевый ион R—C O, либо комплекс ацилгалогенида с катали-
+
+ —
затором (RCOAlCl4–):
|
|
|
|
|
|
|
|
|
|
|
|
+ |
|
|
|
|
|
|
|
+ |
|
|
|
|||
RCOCl + AlCl3 |
|
|
|
|
|
|
RCOAlCl4– |
|
|
|
R—C—O + AlCl4— |
|
||||||||||||||
|
|
|
|
|
|
|
|
|
||||||||||||||||||
|
|
|
|
|
|
|
|
|
||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
+ |
|
|
|
|
|
|
|
|||
|
(RCO)2O + AlCl3 |
|
|
|
|
|
R—C—O + RCOOAlCl3– |
O |
||||||||||||||||||
|
|
|
|
|
|
|||||||||||||||||||||
|
|
|
|
|
|
|||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
O |
|
|
|
|
|
|
|
O |
|
|
|
|
|
|
|
H O |
|
|
C |
||||||
+ |
|
|
|
|
|
|
|
|
+ |
|
|
|
|
|
|
|
|
|
|
|
C |
|
|
R |
||
+ C |
|
|
|
|
|
|
|
|
|
|
C |
|
|
|
|
|
|
+ |
|
–H+ |
|
|||||
|
R |
|
|
|
|
|
|
|
R |
|
|
|
|
|
|
|
R |
|
||||||||
|
|
|
|
|
|
π-комплекс |
|
|
|
σ-комплекс |
|
|
|
|||||||||||||
Ацилирование ароматического ядра, в отличие от алкилирования, протекает преимущественно с образованием монозамещенных продуктов. Ацильная группа, являясь электроноакцепторным заместителем, снижает реакционную способность бензольного кольца по отношению к электрофильным реагентам. Поэтому диацилпроизводные аренов образуются только в жестких условиях.
аромаТические угЛеВодороды. одноЯдерные арены
213
14.5.2. реакЦии ПрисоединениЯ
Как отмечалось ранее, реакции присоединения для ароматических углеводородов не являются характерными. Однако в жестких условиях они возможны.
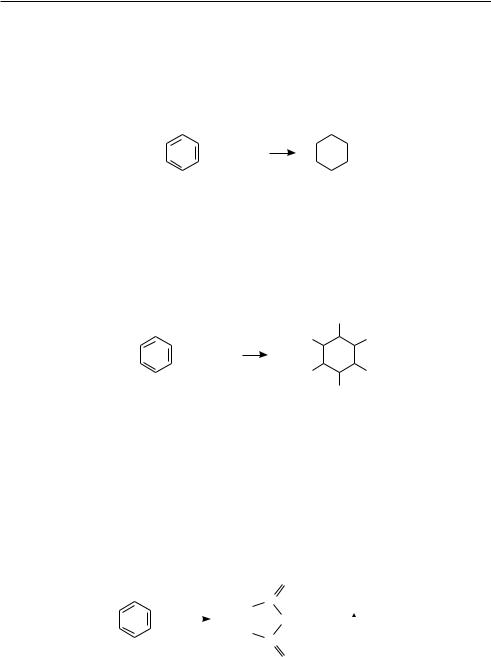
гидрирование. Бензол и его гомологи при повышенных температуре и давлении в присутствии катализаторов (чаще применяют никель Ренея) присоединяют три молекулы водорода, образуя циклогексан и его производные:
Ni
+ 3H2
циклогексан
Остановить реакцию на стадии образования продуктов частичного гидрирования (циклогексадиена, циклогексена) не представляется возможным, поскольку последние гидрируются значительно легче, чем сам бензол.
хлорирование. При интенсивном солнечном освещении или под действием ультрафиолетового облучения бензол присоединяет хлор. Реакция протекает по радикальному механизму с образованием смеси стереоизомеров гексахлорцикло-
гексана (гексахлорана):
|
Cl |
Cl |
Cl |
hν |
|
+ 3Cl2 |
|
Cl |
Cl |
|
Cl |
гексахлорциклогексан |
|
14.5.3. реакЦии окисЛениЯ
окисление бензольного цикла. Бензольное кольцо очень устойчиво к действию окислителей. В обычных условиях такие сильные окислители, как калия перманганат, азотная кислота, хрома (VI) оксид, водорода пероксид и другие, не окисляют бензол. Но в жестких условиях, например при действии кислорода воздуха в присутствии ванадия (V) оксида в качестве катализатора, при температуре 400—500 °С бензольное ядро окисляется, образуя малеиновый ангидрид:
|
|
|
O |
||
O; V2O5 |
HС |
С |
|||
|
|
|
O + 2CO2 |
|
+ 2H2O |
|
|
|
|||
|
HС |
|
|||
|
С |
||||
O
малеиновый ангидрид
окисление гомологов бензола. Алкилбензолы, в отличие от незамещенного бензола, окисляются значительно легче. При действии сильных окислителей (KMnO4, K2Cr2O7 и др.) окислению подвергаются боковые углеродные цепи. Продуктами окисления являются ароматические карбоновые кислоты. Причем каждый алкильный радикал в бензольном кольце, независимо от длины углеродной цепи, окисляется в карбоксильную группу.

Глава 14
214
|
СH3 |
[O] |
|
СOOH |
|
|
|
СH2СH3 |
|
+ CO2 |
|
+ H2O |
|
|
|
|
|
|||
|
|
|
|
|||
|
|
|
СOOH |
|
|
|
о-этилтолуол |
|
фталевая кислота |
|
|
||
Если в бензольном кольце имеется несколько заместителей, то путем подбора оптимальных условий можно провести их последовательное окисление. Алкильные группы по реакционной способности к действию окислителей располагаются в следующей последовательности:
—CHR2 > —CH2R > —CH3
Третичные алкильные группы у бензольного ядра до карбоксильной группы не окисляются.
Окисление алкилбензолов является важным способом получения ароматических карбоновых кислот.
озонирование. Подобно алкенам, бензол и его гомологи реагируют с озоном, образуя взрывоопасные продукты присоединения — триозониды. Под действием воды триозониды разлагаются с образованием дикарбонильных соединений и продуктов их дальнейшего окисления — дикарбоновых кислот:
О
ОCH
|
HC |
|
О |
CH |
О |
|
O |
O 3HO—OH |
O |
O |
||
3O3 |
|
|
|
3HOH |
||||||||
|
|
|
|
|||||||||
|
|
|
О |
|
|
|
|
3 С—С |
|
|
|
С—С |
|
|
|
|
|
|
3HO—OH |
H –3HOH |
|
||||
|
HC |
|
О |
CH |
О |
H |
HO |
OH |
||||
|
|
|
|
|
глиоксаль |
|
|
щавелевая кислота |
||||
|
|
|
CH |
|
|
|
|
|
|
|||
|
О |
|
|
|
|
|
|
|
|
|
||
|
|
|
О |
|
|
|
|
|
|
|
|
|
бензола триозонид |
|
|
|
|
|
|
|
|
||||
14.5.4.гаЛогенироВание гомоЛогоВ БензоЛа
сучасТием БокоВоЙ ЦеПи
Взаимодействие гомологов бензола с галогенами (хлором или бромом) в условиях свободнорадикального замещения (см. с. 139) осуществляется с участием боковой цепи. При этом на атом галогена замещается, как правило, атом водорода при атоме углерода, непосредственно связанном с бензольным кольцом (α-положение):
α |
hn |
|
|
|
|
|
|
|
|
|
|
||
—CH2—CH3 + Cl2 |
|
|
|
— |
CH—CH3 |
+ HCl |
|
|
|
||||
|
|
|
|
Cl |
|
|
этилбензол |
|
|
1-фенил-1-хлорэтан |
|
||
Такое направление замещения обусловлено образованием в качестве промежуточной активной частицы свободного радикала бензильного типа, в котором электронная плотность значительно делокализована за счет сопряжения с бензольным кольцом (см. с. 123):
|
|
|
|
|
· |
|
|
|
|
|
|
|
|||
—CH |
—CH |
+ Cl· |
|
|
|
—CH—CH |
+ HCl |
|
|||||||
2 |
3 |
|
3 |
|
|||
свободный радикал бензильного типа
аромаТические угЛеВодороды. одноЯдерные арены
215
14.6. ВЛИЯНИЕ ЗАМЕСТИТЕЛЕЙ В БЕНЗОЛЬНОМ КОЛЬЦЕ НА НАПРАВЛЕНИЕ И СКОРОСТЬ РЕАКЦИЙ ЭЛЕКТРОФИЛЬНОГО ЗАМЕЩЕНИЯ
В молекуле незамещенного бензола электронная плотность распределена равномерно, поэтому электрофильный реагент может атаковать в равной степени любой из шести атомов углерода.
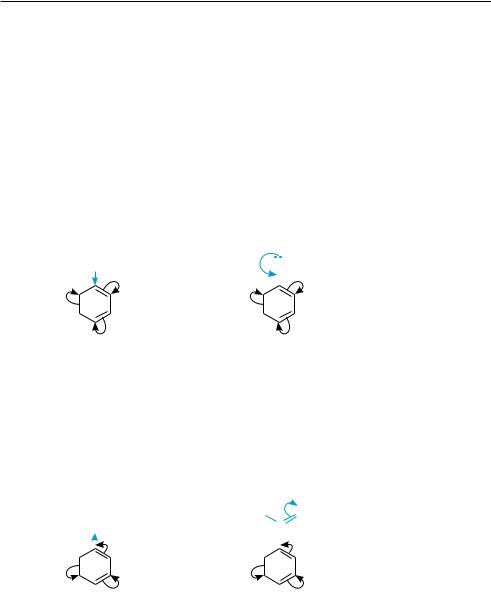
Если в бензольном кольце содержится какой-либо заместитель, то под его влиянием происходит перераспределение π-электронной плотности цикла и новая группа вступает уже в определенные положения по отношению к имеющемуся заместителю. В реакциях электрофильного замещения монозамещенных бензола, в зависимости от электронной природы заместителя, вступающая группа может занимать преимущественно орто-, мета- или пара-положения, а реакция соответственно протекать быстрее или медленнее, чем с незамещенным бензолом.
По влиянию на направление реакций электрофильного замещения и реакционную способность бензольного кольца заместители можно разделить на две группы — заместители I рода (орто-, пара-ориентанты) и заместители II рода (мета-ориентанты).
К заместителям I рода относятся атомы и атомные группы, проявляющие поло- |
|||||||||||
|
|
|
|
|
|
|
|
|
|
.. |
, |
жительный индуктивный или положительный мезомерный эффекты: —O–, —NR |
|||||||||||
.. |
.. |
, |
.. |
.. |
.. |
.. |
.. |
.. |
.. |
..2 |
|
—NHR, |
—NH |
—OH, |
—OR, |
—NHCOR, |
—OCOR, —SR, |
—F, |
—Cl, |
—Br, |
|||
.. |
2 |
|
|
|
|
|
|
|
|
|
|
—I, —Alk и др. |
|
|
|
|
|
|
|
|
|
|
|
Заместители I |
рода (за исключением галогенов) |
увеличивают электронную |
|||||||||
плотность в бензольном кольце и тем самым активируют его в реакциях электрофильного замещения.
Заместители I рода направляют замещение преимущественно в орто- и пара-
положения: |
|
|
|
|
|
|
|
|
|
|
|||
OH |
|
|
OH |
OH |
|||||||||
|
|
|
|
|
|
|
|
|
NO2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2 |
|
|
|
+ 2HNO3 (разб.) |
|
|
|
|
+ |
|
|
|
+ 2H2O |
|
|
|
|
||||||||||
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
NO2 |
|||
фенол |
|
|
о-нитрофенол |
п-нитрофенол |
|||||||||
К заместителям II рода относятся группы, проявляющие отрицательный индук-
—+ —+ — —
тивный или отрицательный мезомерный эффекты: NR3, NH3, NO2, SO3H,
—CN, —CHO, —COR, —COOH, —COOR, —CONH2, —CCl3 и др.
Заместители II рода уменьшают электронную плотность в бензольном кольце и снижают скорость реакции электрофильного замещения по сравнению с незамещенным бензолом.
Заместители II рода направляют замещение преимущественно в мета-положение:
NO2 |
|
NO2 |
||||
|
|
H2SO4 |
(конц.) |
|||
|
+ HNO3 (конц.) |
|
|
|
|
+ H2O |
|
|
|||||
|
|
|
|
|||
|
|
|
|
|
|
NO2 |
нитробензол |
|
|
м-динитробензол |
|||
Глава 14
216
Следует отметить, что описанная выше ориентация замещения не является абсолютной, а свидетельствует лишь о предпочтительном направлении реакции с преобладающим образованием того или иного изомера. Так, при нитровании нитробензола образуется 93 % мета-, 6 % орто- и 1 % парадинитробензола.
Механизм влияния заместителей в бензольном кольце на направление и скорость реакций электрофильного замещения можно объяснить с учетом электронных эффектов, которые играют существенную роль как в распределении электронной плотности в стационарном состоянии молекулы (статический фактор), так и в стабилизации образующихся в процессе реакции σ-комплексов (динами-
ческий фактор).
Заместители I рода (кроме галогенов) за счет +I-или +М-эффекта проявляют электронодонорные свойства. Они повышают электронную плотность на всех атомах углерода бензольного кольца, но в большей степени на углеродных атомах в орто- и пара-положениях (статический фактор):
|
|
CH3 +I-эффект |
|
|
OH +M-эффект |
||
|
|
|
|
||||
δ– |
δ– |
δ– |
|
δ– |
|||
|
|||||||
|
δ– |
|
δ– |
||||
|
|
||||||
|
|
|
|
||||
δ– |
|
δ– |
|
||||
Это является причиной облегчения электрофильного замещения в сравнении с реакциями SE у незамещенного бензола и преимущественной атаки электрофильной частицей орто- и пара-положений.
Заместители II рода, наоборот, за счет –I- или –М-эффектов проявляют электроноакцепторные свойства, вызывая общее уменьшение электронной плотности в бензольном кольце, но в большей степени это влияние сказывается в орто- и пара-положениях. Поэтому они затрудняют реакции электрофильного замещения вообще и особенно с участием орто- и пара-положений. В результате замещение протекает преимущественно в мета-положении:
|
|
|
|
H |
|
O |
|
CCl3 –I-эффект |
|
С –M-эффект |
|||
|
|
|
|
|||
δ+ |
|
δ+ |
δ+ |
|
δ+ |
|
|
|
|||||
|
δ+ |
|
δ+ |
|||
|
δ+ |
|
δ+ |
|||
Необходимо отметить, что наряду со статическим фактором существенное, а в некоторых случаях решающее влияние на направление электрофильного замещения оказывает динамический фактор. Его сущность определяется влиянием имеющегося в бензольном кольце заместителя на устойчивость образующегося в момент реакции того или иного σ-комплекса. Из всех возможных σ-комплексов для молекулы энергетически более выгодны те, в которых имеется возможность дополнительной делокализации положительного заряда за счет заместителя. Эти σ-комплексы обладают меньшей энергией, а следовательно, они более устойчивы
ипоэтому их образование в ходе реакции будет более предпочтительным.
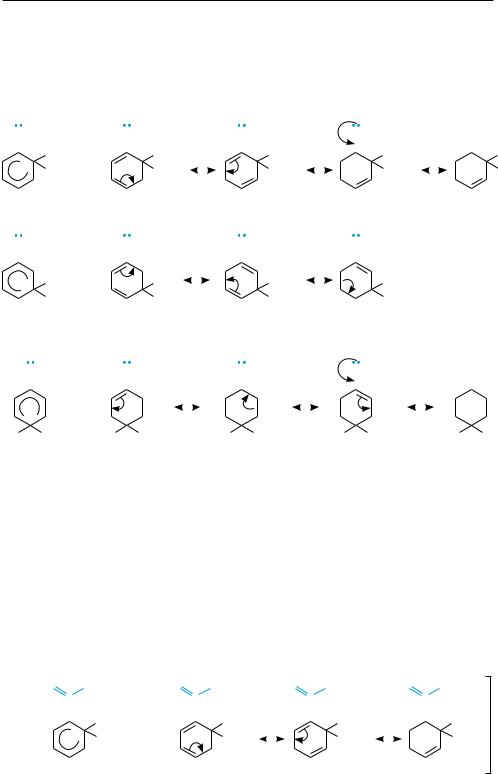
Вреакциях SЕ заместители I рода вследствие своих электронодонорных свойств повышают устойчивость всех σ-комплексов по сравнению с незамещен-
аромаТические угЛеВодороды. одноЯдерные арены
217
ным бензолом и, таким образом, увеличивают скорость реакции, но в большей степени они стабилизируют σ-комплексы, отвечающие продуктам орто- и пара- замещения. Например, при нитровании метоксибензола каждый из σ-комплек- сов, образующихся в результате орто-, мета- и пара-замещения, стабилизирован за счет делокализации положительного заряда между атомами углерода бензольного кольца (граничные структуры I, II, III):
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
+ |
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
OCH3 |
|
|
|
|
|
OCH3 |
|
|
|
|
|
OCH3 |
|
|
|
|
OCH3 |
|
|
|
|
|
|
|
OCH3 |
|||||||||||||
|
|
|
|
H |
≡ |
|
|
|
|
|
H |
|
|
|
|
|
|
H |
|
|
|
+ |
H |
|
|
|
|
|
|
|
|
H |
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||
+ |
|
NO2 |
|
|
|
|
|
NO2 |
|
|
|
|
|
|
NO2 |
|
|
|
|
|
NO2 |
|
|
|
|
|
|
|
|
NO2 |
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
+ |
|
|
|
+ |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
σ-комплекс |
|
|
|
I. |
|
|
|
II. |
|
|
III. |
|
|
|
|
|
|
IV. |
||||||||||||||||||||||
ïðè о-замещении |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
OCH3 |
|
|
|
|
|
OCH3 |
|
|
|
|
|
OCH3 |
|
|
|
|
OCH3 |
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||
|
|
|
|
H |
≡ |
|
|
|
|
+ H |
|
|
+ |
|
|
|
H |
|
|
|
|
|
H |
|
|
|
|
|
|
|
|
|
|
|
||||||
+ |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||
|
|
|
|
NO2 |
|
|
|
|
|
|
NO2 |
|
|
|
|
|
|
NO2 |
+ |
NO2 |
|
|
|
|
|
|
|
|
|
|
|
|||||||||
σ-комплекс |
|
|
|
I. |
|
|
|
II. |
|
|
III. |
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||
ïðè м-замещении |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
+ |
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
OCH3 |
≡ |
|
|
|
|
OCH3 |
|
|
|
+ |
|
OCH3 |
|
|
|
|
OCH3 |
|
|
|
|
|
|
|
OCH3 |
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||
|
|
|
+ |
+ |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
+ |
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
H |
|
NO2 |
|
H |
|
|
|
NO2 |
|
|
H |
|
|
NO2 |
|
H |
NO2 |
|
H NO2 |
|||||||||||||||||||||
σ-комплекс |
|
|
|
I. |
|
|
|
II. |
|
|
III. |
|
|
|
|
|
|
IV. |
||||||||||||||||||||||
ïðè п-замещении |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
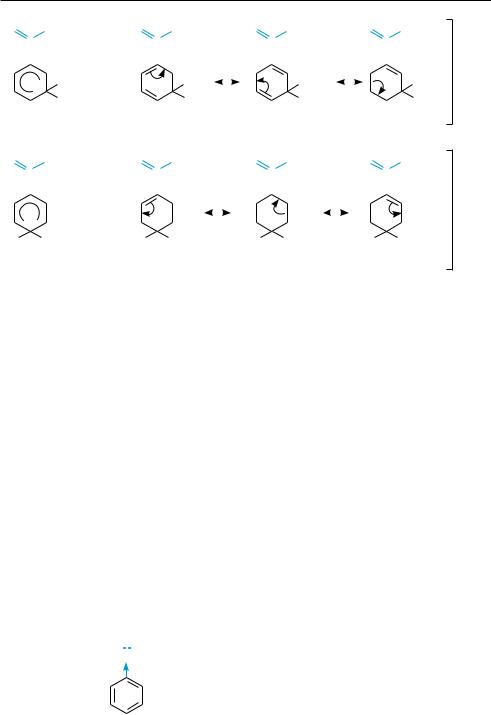
Но в σ-комплексах при орто- и пара-замещении положительный заряд может быть дополнительно делокализован с участием неподеленной пары электронов атома кислорода метоксигруппы (граничная структура IV). Поэтому образование их в ходе реакции более предпочтительно. В результате образуются преимущественно продукты орто- и пара-замещения.
Заместители ІІ рода вследствие своих электроноакцепторных свойств дестабилизируют в той или иной мере все три возможных σ-комплекса и тем самым затрудняют электрофильное замещение в сравнении с незамещенным бензолом. Однако σ-комплекс в мета-положении дестабилизируется в меньшей степени, чем σ-комплекс в орто- и пара-положениях.
Так, при нитровании нитробензола возможно образование следующих σ-ком- плексов:
O + |
O– |
|
O + |
O – |
|
O + |
O– |
|
O + O– |
||||||
N |
|
N |
|
N |
|
|
N |
||||||||
|
|
H |
|
|
|
H |
|
|
|
H |
|
|
|
|
+ H |
|
|
|
|
|
|
|
|
|
|
|
|||||
+ |
NO2 ≡ |
|
|
|
NO2 |
|
|
|
NO2 |
|
|
|
|
NO2 |
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
+ |
|
|
||||||||||
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
+ |
|
|
|
|
|
|
|
||
σ-комплекс |
|
I. |
|
|
II. |
|
|
III. |
|||||||
ïðè о-замещении |
|
|
|
|
|
|
|
|
|
|
|
|
|
||
Глава 14
218
O + |
O– |
|
|
O + |
O– |
|
|
O + |
O – |
|
O + |
O– |
|||||||||
N |
|
|
N |
|
|
|
N |
|
|
N |
|||||||||||
|
|
H |
≡ |
|
|
|
+ H |
+ |
|
|
|
H |
|
|
|
|
H |
||||
+ |
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
NO2 |
|
|
|
|
NO2 |
|
|
|
|
|
|
NO2 |
+ |
NO2 |
|||||
σ-комплекс |
|
|
I. |
|
|
|
|
|
II. |
|
|
III. |
|||||||||
ïðè м-замещении |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
O + |
O– |
|
|
O + |
O– |
|
|
O + |
O – |
|
O + |
O– |
|||||||||
|
|
|
|
|
|||||||||||||||||
N |
|
|
N |
|
|
|
N |
|
|
N |
|||||||||||
|
|
|
≡ |
|
|
|
|
|
|
|
+ |
|
|
|
|
|
|
|
|||
+ |
|
+ |
|
|
|
|
|
|
|
|
|
|
+ |
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
H |
NO2 |
|
|
H |
NO2 |
|
|
H |
NO2 |
|
H |
NO2 |
|||||||||
σ-комплекс |
|
|
I. |
|
|
|
|
|
II. |
|
|
III. |
|||||||||
ïðè п-замещении |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
Как видно, среди приведенных граничных структур (I—III), изображающих делокализацию положительного заряда в σ-комплексах, структура III при орто- замещении и структура II при пара-замещении содержат положительные заряды у соседних атомов. Такие структуры энергетически крайне не выгодны и вносят небольшой вклад в резонансный гибрид. Поэтому σ-комплексы с участием орто- и пара-положений дестабилизированы в большей степени, чем σ-комплекс
вмета-положении. В результате электрофильное замещение затруднено и протекает преимущественно в мета-положении.
Вбольшинстве случаев статический и динамический факторы действуют согласованно. Но если их влияние проявляется в противоположных направлениях, то решающее значение на направление электрофильного замещения оказывает динамический фактор. Наглядным примером могут служить арилгалогениды,
вкоторых атомы галогена проявляют электроноакцепторные свойства, но вместе с тем направляют электрофильное замещение в орто- и пара-положения. Причиной такого поведения галогенов в качестве заместителя является несогласованное действие статического и динамического факторов.
Как известно, атом галогена в бензольном ядре проявляет отрицательный индуктивный и положительный мезомерный эффекты, причем в статическом состоянии –I-эффект значительнее +М-эффекта. В результате происходит смещение электронной плотности бензольного кольца в сторону атома галогена и, следовательно, реакционная способность цикла по отношению к электрофильным реагентам снижается:
 Cl
Cl
δ+ –I-эффект >> +M-эффект
Следовательно, в статическом состоянии галогены, подобно ориентантам II рода, затрудняют электрофильное замещение.
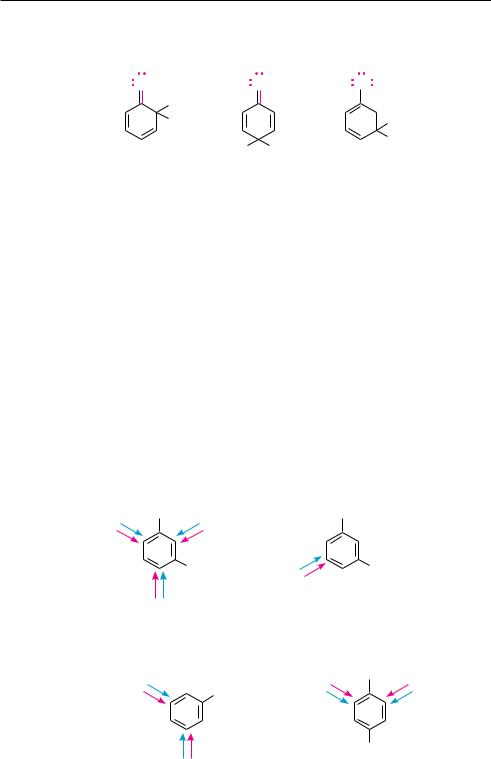
Однако в процессе реакции неподеленные пары электронов атома галогена, которые находятся в сопряжении с π-электронной системой бензольного кольца,
аромаТические угЛеВодороды. одноЯдерные арены
219
принимают участие в дополнительной стабилизации σ-комплексов, образующихся при орто- и пара-замещении, но не участвуют в стабилизации мета-σ-комп- лекса (о чем и свидетельствуют граничные структуры):
Cl+ |
Cl+ |
Cl |
H |
|
+ H |
E |
|
|
H |
E |
E |
|
Поэтому галогены выступают как заместители I рода и направляют электрофильное замещение в орто- и пара-положения.
Кроме заместителей I и II рода, имеется небольшое число заместителей, про-
являющих смешанное действие (—CH2NO2, —CH2Hal, —CH2OH, —CHHal2 и др.).
Эти заместители несколько затрудняют электрофильное замещение в бензольном ядре, но в результате реакции, как правило, образуется смесь примерно равных количеств орто-, мета- и пара-изомеров.
14.6.1. ориенТаЦиЯ В дизамещенных БензоЛа
При наличии в бензольном кольце двух заместителей их ориентирующее влияние осуществляется более сложно, но и в этом случае часто можно правильно предположить предпочтительное направление вхождения нового заместителя.
В зависимости от электронной природы заместителей и их взаимного распо-
ложения различают согласованную и несогласованную ориентации.
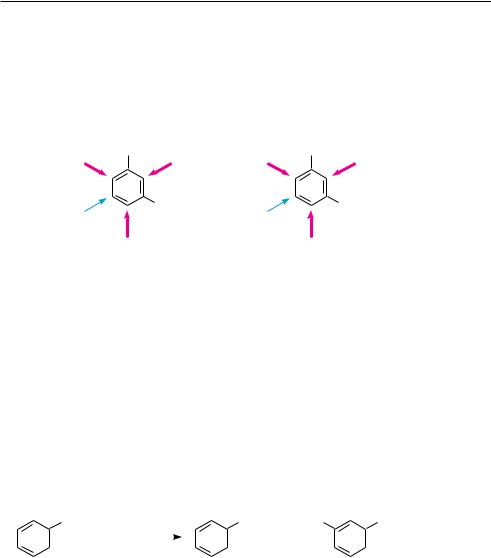
При согласованной ориентации оба имеющихся заместителя направляют новую группу в одни и те же положения бензольного кольца. Согласованная ориентация характерна для дизамещенных бензола, в которых:
заместители находятся в мета-положении относительно друг друга и принадлежат к ориентантам одного и того же рода (предпочтительные места вхождения нового заместителя указаны стрелками):
СH3 |
NO2 |
OH |
SO3H |
м-метилфенол |
м-нитробензолсульфокислота |
заместители находятся в орто- или пара-положении по отношению друг к другу, но один из них является заместителем I рода, а второй — заместителем
II рода.
OH
СOOH
 OH
OH
NO2
о-гидроксибензойная кислота; |
п-нитрофенол |
салициловая кислота |
|
Глава 14
220
При несогласованнной ориентации один из заместителей направляет новую группу в одни, а другой — в иные положения бензольного кольца. В результате, как пра-
вило, образуется несколько различных изомеров. Вместе с тем предпочтительное направление замещения можно определить, используя следующие правила:
1. Если один из заместителей является заместителем I рода, то преимущественное направление замещения определяет именно он:
OH |
OСH3 |
NO2 |
NO2 |
м-нитрофенол |
м-метоксинитробензол |
2. Если оба заместителя являются заместителями I рода, то преимущественное направление замещения определяется более сильным электронодонорным заместителем.
По силе ориентирующего влияния заместители I рода можно расположить в следующий ряд:
—O– > —NR2 > —NHR > —NH2 > —OH > —OR > —NHCOR > > —OCOR > —Alk > —F > —Cl > —Br > —I
Так, при нитровании 2-бромфенола образуются преимущественно 2-бром- 4-нитрофенол и 2-бром-6-нитрофенол.
OH |
|
|
OH |
|
OH |
||||||||||
|
|
Br |
|
|
|
|
|
|
Br |
O2N |
|
|
|
|
Br |
|
|
|
|
||||||||||||
2 |
|
|
+ 2HNO3 |
|
|
|
+ |
|
|
|
|
|
+ 2H2O |
||
|
|
|
|
||||||||||||
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
NO2 |
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
||||
2-бромфенол |
|
2-бром-4-нитрофенол |
2-бром-6-нитрофенол |
||||||||||||
3. Если оба заместителя являются заместителями II рода, электрофильное замещение осуществляется с большим трудом, а преимущественное место вхождения третьего заместителя определяется более сильным ориентантом.
По силе ориентирующего влияния в реакциях SE заместители II рода можно рас-
положить в следующий ряд:
—COOH > —SO3H > —CN > —NO2
Например, в о-нитробензойной кислоте замещение идет преимущественно в мета-положении относительно карбоксильной группы
