
304- Органическая химия_Черных В.П. и др_Х., 2007 -776с
.pdf
меТоды усТаноВЛениЯ сТроениЯ органических соединениЙ
111
Таблица 7.4
интервалы химических сдвигов протонов различного типа
Соединение |
Тип протона |
δ, млн–1 |
|||||
|
H2С—H |
0,8—1,0 |
|||||
|
|
|
|
|
|
|
|
Алканы* |
|
HС—H |
1,0—1,4 |
||||
|
|
|
|
|
|
||
|
|
|
|
С—H |
1,3—1,6 |
||
|
|
|
|
||||
|
|
|
|
|
|
||
Циклоалканы* |
|
HС—H |
1,4—1,8 |
||||
|
|
|
|
|
|
||
Этиленовые углеводороды |
=HС—Н |
4,3—5,4 |
|||||
|
|
|
|
|
|
||
=RС—Н |
5,1—6,0 |
||||||
|
|||||||
|
|
|
|
|
|
||
Ацетиленовые углеводороды |
|
—С—Н |
2,3—3,1 |
||||
|
|
|
|
|
|
||
Производные бензола |
—Сар—Н |
6,5—8,2 |
|||||
|
|
|
|
|
|
||
Гетероароматические соединения |
|
|
С—H |
6,0—9,2 |
|||
|
|
|
|
|
|
|
|
Альдегиды |
|
—С |
O |
9,0—10,0 |
|||
|
|
|
|
|
H |
|
|
|
|
|
|
|
|
||
Спирты** |
—С—О—Н |
1,0—4,5 |
|||||
Фенолы** |
—Сар—О—Н |
4,5—9,0 |
|||||
Кислоты** |
—С |
O |
|
10—13 |
|||
|
|
|
|
O—H |
|
||
Амины алифатические |
|
|
N—H |
0,5—2,0 |
|||
|
|
|
|
|
|
||
Амины ароматические |
Сар—N—H |
3,0—4,0 |
|||||
|
|
|
|
|
|
|
|
* Относятся также их производные, содержащие функциональные группы дальше чем через три С—С-связи от данных протонов.
** Химический сдвиг сильно зависит от природы растворителя и концентрации вещества.
для некоторых соединений наблюдаются существенные отклонения от этой зависимости вследствие значительного влияния кольцевых токов, которые возникают
вненасыщенных группировках, особенно в ароматических системах и соединениях с тройной связью. Такие токи могут как дезэкранировать протоны (ароматические соединения), так и экранировать их (соединения с тройной связью).
Большое значение при решении структурной задачи с помощью спектров ПМР имеет интенсивность сигналов, которая определяется площадью под резонансной кривой и является величиной, пропорциональной количеству протонов определен-
ного типа. В спектре ПМР интенсивность записывается в виде кривой, делающей
вобласти каждого сигнала ступеньку, высота которой пропорциональна площади соответствующего сигнала (рис. 7.7). Отношение высот ступенек на этой кривой показывает соотношение количества протонов различных типов.
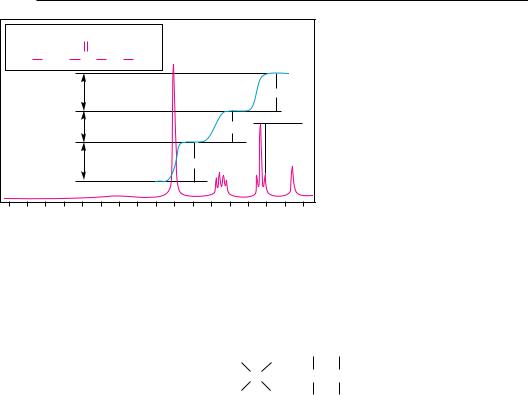
112 |
|
|
|
|
|
|
|
|
|
|
|
|
Глава 7 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Î |
|
|
Интегральная |
кривая |
Таким образом, количест- |
||||||
à |
á |
|
â |
во сигналов в спектре ПМР |
|||||||||
C |
Î |
â |
|
|
|
|
показывает, |
сколько |
групп |
||||
CÍ3 |
CÍ2 |
CÍ3 |
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
эквивалентных протонов со- |
|||
3 протона |
|
|
|
|
|
|
15 ìì |
держится в образце; хими- |
|||||
|
|
|
|
|
|
|
|
|
Jàá |
ческий сдвиг указывает на |
|||
2 протона |
|
|
|
10 ìì |
|
принадлежность |
протонов |
||||||
|
|
|
|
|
|||||||||
|
|
|
|
|
к определенной группировке, |
||||||||
|
|
|
|
|
|
|
|
|
|
||||
3 протона |
|
|
|
15 ìì á |
|
à |
|
ÒÌÑ |
а интенсивность |
сигнала — |
|||
|
|
|
|
|
определяет |
количество про- |
|||||||
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
тонов в каждой группировке. |
|||
8 |
7 |
6 |
5 |
4 |
3 |
2 |
|
1 |
0 –1 |
Ценную |
информацию |
||
|
о строении органического со- |
||||||||||||
|
|
|
|
|
Химический сдвиг |
δ, ìëí |
единения дает форма (струк- |
||||||
|
Рис. 7.7. ПМР-спектр метилпропионата |
|
|||||||||||
|
|
тура) сигналов спектра ПМР. |
|||||||||||
(Jаб — константа спин-спинового взаимодействия) |
Протоны одного типа, доста- |
||||||||||||
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
точно удаленные |
от |
других |
|
протонов в молекуле, дают резонансный сигнал в виде узкого пика с одним |
|||||||||||||
максимумом (синглетный сигнал). Если протоны различных типов (имеющие |
|||||||||||||
разное электронное окружение или геометрическое положение) разделены двумя |
|||||||||||||
|
|
|
|
|
|
|
|
|
H |
H |
|
|
|
или тремя ковалентными связями, |
C |
H, —С—С—, то резонансный сигнал |
|||||||||||
|
|
|
|
|
|
|
|
H |
|
|
|
|
|
проявляется в спектре не в виде синглета, а расщепляется на ряд линий различ- |
|||||||||||||
ной интенсивности, расположенных на равном расстоянии друг от друга. Такой |
|||||||||||||
сигнал называют мультиплетом, а явление — спин-спиновым взаимодействием. |
|||||||||||||
Спин-спиновое взаимодействие обусловлено взаимным влиянием магнитных по- |
|||||||||||||
лей соседних протонов и наблюдается только в том случае, когда протоны не |
|||||||||||||
эквивалентны и расстояние между ними не превышает двух-трех ковалентных |
|||||||||||||
связей. Расстояние между ближайшими линиями мультиплета измеряется в гер- |
|||||||||||||
цах и носит название «константы спин-спинового взаимодействия» (J). |
|
|
|||||||||||
Мультиплетность (М), то есть степень расщепления сигнала, зависит от |
|||||||||||||
количества соседних протонов и определяется |
по формуле |
M = n |
+ |
1, где |
|||||||||
п — количество соседних протонов. В приведенном на рис. 7.7 спектре ПМР |
|||||||||||||
метилпропионата протоны группы —ОСН3 |
не вступают в спин-спиновое взаимо- |
||||||||||||
действие и проявляются в виде синглета (в), три эквивалентных протона группы |
|||||||||||||
—СН3 |
имеют два соседних протона и в результате спин-спинового взаимодейс- |
||||||||||||
твия (n + 1 = 3) дают сигнал в виде триплета (а). Протоны метиленовой группы |
|||||||||||||
—СН2—, взаимодействуя с тремя протонами группы —СН3 (n + 1 = 4), проявля- |
|||||||||||||
ются в спектре в виде квартета (б). |
|
|
|
|
|
|
|
|
|||||
В более сложных случаях, когда расщепление сигнала вызвано спин-спино- |
|||||||||||||
вым взаимодействием с двумя или более группами неэквивалентных протонов, |
|||||||||||||
мультиплетность сигнала определяется произведением мультиплетностей, обу- |
|||||||||||||
словленных каждой из этих групп в отдельности. |
|
|
|
|
|||||||||
Мультиплетность и константа спин-спинового взаимодействия имеют важ- |
|||||||||||||
ное значение для структурного анализа. Мультиплетность указывает на число |
|||||||||||||
протонов вблизи от данного. Константа спин-спинового взаимодействия зависит |
|||||||||||||
меТоды усТаноВЛениЯ сТроениЯ органических соединениЙ
113
от природы химической связи и пространственного расположения взаимодействующих протонов, что позволяет применять спектроскопию ПМР для изучения стереохимических особенностей молекул.
7.2.4. масс-сПекТромеТриЯ
Масс-спектрометрия относится к деструктивным1 методам анализа. Она основана на ионизации молекул исследуемого вещества и регистрации спектра масс образовавшихся ионов. Существует несколько методов ионизации, но наиболее распространен в настоящее время так называемый метод электронного удара, когда вещество в газовой фазе подвергается бомбардировке пучком ускоренных электронов. В этих условиях первоначально из нейтральной молекулы (М) выбивается один электрон и образуется положительно заряженный ион — молекулярный
ион (катион-радикал М+), который затем претерпевает ряд последовательных
·
распадов с образованием более мелких положительно заряженных ионов (фрагментарных ионов) и нейтральных частиц:
М + е –2е |
+ |
фрагментарные ионы + нейтральные частицы. |
М · |
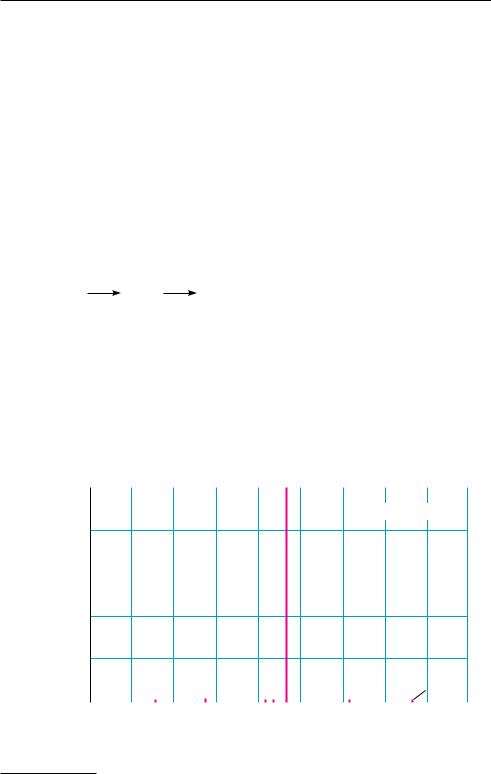
После ускорения в сильном электростатическом поле поток положительно заряженных ионов дифференцированно разделяется в переменном магнитном поле в зависимости от отношения их массы к заряду (т/z) и регистрируется в виде спектра. Ввиду того что обычно заряд иона равен единице, величина т/z является мерой массы частиц. В масс-спектре каждый положительно заряженный ион проявляется в виде отдельного сигнала (пика), положение которого определяется массой иона (точнее отношением массы к заряду), а интенсивность (высота) сигнала пропорциональна количеству ионов с данной массой (рис. 7.8).
Относительная интенсивность, %
+ |
–43 |
||
|
Ì • |
|
|
100 |
|
57 |
|
|
|
|
|
80 |
|
|
|
|
|
+ |
|
–43 |
|
|
|
|
|
|
CÍ3(ÑÍ2)4ÑÍ3 |
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
Ì • |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
43 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
60 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
+ |
–57 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
40 |
|
|
Ì • |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
+ |
|
|
|
|
|
|||
|
|
29 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Ì• |
|
|
|
|
|
||||
20 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
+ |
|
|
86 |
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Ì• –15 |
|
+ |
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
71 |
|
|
|
|
|
|
||||
0 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Ì |
• |
+1 |
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
20 |
|
30 |
40 |
|
|
50 |
60 |
70 |
80 |
90 |
|
100 |
||||||||||||
10 |
|
|
|
|
||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
m/z |
|||
Рис. 7.8. Масс-спектр гексана
1 Деструкция, то есть разрушение.

Глава 7
114
Ниже приведена фрагментация молекулярного иона гексана (числа под ионами обозначают m/z):
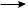 CH3CH2CH2CH2CH+2 + CH3
CH3CH2CH2CH2CH+2 + CH3
m/z 71
|
|
|
|
CH |
CH |
CH CH+ |
+ CH |
CH |
3 |
|
|
|
|
|
|||||||
3 |
2 |
2 |
2 |
2 |
|
|||||
[CH3CH2CH2CH2CH2CH3]· |
|
|
|
|
|
|
||||
+ |
|
|
|
|
m/z 57 |
|
|
|
|
|
 CH3CH2CH+2 + CH2CH2CH3
CH3CH2CH+2 + CH2CH2CH3
m/z 43
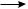 CH3CH+2 + CH2CH2CH2CH3
CH3CH+2 + CH2CH2CH2CH3
m/z 29
При низкой энергии пучка электронов (порядка 10 эВ) наиболее интенсивный пик в спектре, как правило, соответствует молекулярному иону исходной молекулы. При более высоких энергиях ионизации (обычно 70 эВ) интенсивность пика молекулярного иона падает за счет его дальнейшего распада. Направления распада молекулярного иона и последующие распады фрагментарных ионов определяются строением молекулы, поэтому масс-спектр характеристичен для каждого соединения. В целом распад ионов подчиняется обычным для органических реакций закономерностям и определяется местом локализации заряда и стабильностью образующихся при распаде частиц. Отношение массы к заряду для молекулярного иона соответствует молекулярной массе исследуемого вещества.
Масс-спектрометрию используют для установления структуры органических соединений, их идентификации и определения молекулярной массы веществ. Высокая чувствительность метода, а также то, что для получения результата достаточно небольшого количества вещества (вплоть до 10–12 г), позволяет широко применять масс-спектрометрию в судебной экспертизе.
7.2.5. диФракЦионные меТоды
Дифракционные методы исследования строения основаны на изучении распределения интенсивности рассеянного веществом излучения. Как правило, в этих методах используют рентгеновские лучи (рентгенография), ускоренные
Фемтосекундная спектроскопия
Последние достижения спектральной техники позволяют регистрировать процессы разрыва и образования ковалентных связей, происходящие в режиме реального времени (в нано- (10–9), пико- (10–12) и фемто- (10–15) секундных интервалах). В реагирующих молекулах перемещения атомов при разрыве и образовании ковалентных связей составляют лишь несколько ангстремов, а скорости достигают 1 км/с. В настоящее время лишь фемтосекундная спектроскопия позволяет регистрировать соответствующие молекулярные движения. На молекулы, находящиеся в вакуумной камере, лазером направляют два импульса. Мощный первый импульс переводит молекулы в возбужденное состояние, более слабый второй импульс — регистрирует изменения, происходящие в молекуле.
Данный метод применяют для изучения реакций в растворах, газах, на поверхности, а также в сложных природных структурах (белки, нуклеиновые кислоты и др.).

меТоды усТаноВЛениЯ сТроениЯ органических соединениЙ
115
электроны (электронография) или нейтроны (нейтронография). В результате интерференции (сложение волн) рассеянного излучения получается дифракционная картина — система максимумов и минимумов интенсивности, которую фиксируют на фотопленке в виде пятен с различной степенью затемнения или регистрируют другим способом. Расположение дифракционных максимумов и их интенсивность зависят от строения анализируемого вещества.
рентгеноструктурный анализ. Рентгеноструктурный анализ (рентгенография) — метод исследования пространственного расположения атомов в молекуле, основанный на изучении дифракции рентгеновских лучей, имеющих длины волн, соизмеримые
смежатомными расстояниями.
Спомощью рентгеноструктурного анализа исследуют главным образом вещества в кристаллической форме. Рентгеновские лучи рассеиваются в результате взаимодействия с электронными оболочками атомов вещества. На основании исследования дифракционной картины (рентгенограммы) строят карты электронной плотности молекулы, соединяя точки с одинаковой электронной плотностью непрерывной линией. Из этих же данных рассчитывают межатомные расстояния, валентные углы и строят пространственную модель молекулы.
Электронография. Метод основан на явлении дифракции ускоренных электронов на ядрах атомов. Анализ дифракционной картины (электронограммы) позволяет установить расположение атомов, межъядерные расстояния и валентные углы. Использование электронографии для больших органических молекул затруднено из-за сложности расшифровки дифракционной картины.
|
|
Глава 8 |
|
|
|
|
|
|
ОСНОВЫ ТЕОРИИ РЕАКЦИЙ |
|
|||
|
|
ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ |
|
|||
|
8.1. ЭНЕРГЕТИЧЕСКИЕ УСЛОВИЯ ПРОТЕКАНИЯ РЕАКЦИЙ |
|||||
|
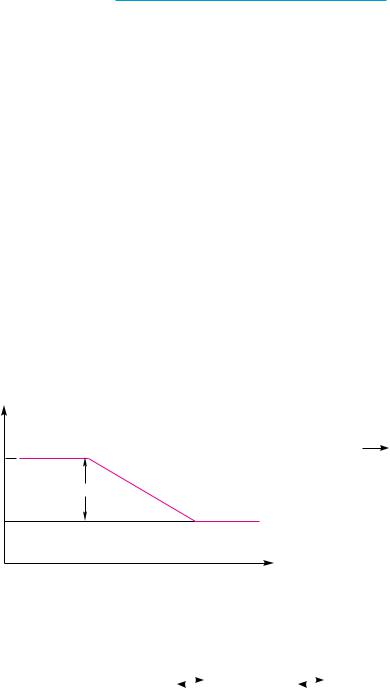
Возможность протекания той или иной реакции определяется не только хи- |
|||||
мической природой реагирующих молекул, но и рядом других факторов, среди |
||||||
которых важное значение имеют энергетические. Поскольку любая система стре- |
||||||
мится, как известно, к состоянию с возможно меньшей потенциальной энергией, |
||||||
реакция может проходить лишь при условии, если свободная энергия исходных |
||||||
веществ Gисх |
больше свободной энергии конечных продуктов Gкон |
реакции, то |
||||
есть когда изменение свободной энергии ∆G отрицательно (рис. 8.1). |
||||||
|
Однако отрицательная величина ∆G является необходимым, но недостаточ- |
|||||
ным условием для самопроизвольного протекания реакции. Обычно на пути |
||||||
к продуктам реакции молекулам исходных веществ приходится преодолевать |
||||||
энергетический барьер, называемый энергией активации Еа (рис. 8.2). |
||||||
|
Энергия активации необходима для осуществления активных столкновений |
|||||
реагирующих молекул, то есть столкновений, приводящих к химическому вза- |
||||||
имодействию. Максимум на энергетической диаграмме реакции (см. рис. 8.2) |
||||||
соответствует так называемому переходному состоянию, или активированному ком- |
||||||
плексу. Переходное состояние представляет собой предельно неустойчивое со- |
||||||
четание реагирующих молекул, образующееся в результате перераспределения |
||||||
|
|
|
электронной |
плотности химиче- |
||
G |
|
|
ских связей в молекулах реаген- |
|||
|
|
тов при их сближении. В реакции |
||||
энергия |
|
|
А + В—С |
А—В + С по мере |
||
Исходные |
сближения атома А с молекулой |
|||||
вещества |
|
В—С происходит ослабление свя- |
||||
Свободная |
–∆G |
|||||
|
зи В—С и одновременно начинает |
|||||
|
|
формироваться связь между ато- |
||||
|
Конечные |
мами А и В. |
В результате обра- |
|||
|
продукты |
зуется активированный комплекс |
||||
|
|
|||||
|
|
Ход реакции |
А---В---С, в котором вследствие |
|||
|
|
перераспределения |
электронной |
|||
|
Рис. 8.1. Изменение свободной энергии системы |
плотности атом В в равной степе- |
||||
|
|
в процессе реакции |
ни связан с атомами А и С. Акти- |
|||
|
|
|
||||
вированный комплекс находится в состоянии равновесия с исходными реагента- |
||||||
ми, а затем по мере дальнейшего уменьшения расстояния между атомами А и В |
||||||
синхронно протекают процессы образования связи А—В и разрыва связи В—С: |
||||||
А + В—С |
|
|
|
[А В С] |
|
|
|
А—В + С |
|
|
|
|
|||||
|
|
|
|
|
активированный комплекс (переходное состояние)

осноВы Теории реакЦиЙ органических соединениЙ |
117 |
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
Характер переходного состо- |
|
|
|
Переходное |
|
||||||
яния |
определяет |
селективность |
|
|
|
состояние |
|
||||
(избирательность) протекания ре- |
|
|
|
|
|
||||||
акции в каком-либо одном пре- |
|
|
|
|
|
||||||
обладающем направлении из не- |
|
|
|
|
|
||||||
скольких |
возможных. |
Чем |
ста- |
G |
|
Ea |
|
|
|||
бильнее |
переходное |
|
состояние, |
энергия |
|
|
|
||||
|
|
|
|
|
|||||||
тем |
меньше энергия |
|
активации, |
|
|
|
|
||||
а чем меньше энергия активации, |
|
|
|
|
|||||||
тем выше скорость реакции. |
|
Свободная |
Исходные |
|
|
|
|||||
Для двухстадийных или мно- |
вещества |
|
|
|
|||||||
гостадийных реакций |
|
характерно |
–∆G |
|
|
|
|||||
образование не только активиро- |
|
|
|
|
|||||||
|
|
|
|
|
|||||||
ванных комплексов, но и проме- |
|
|
|
Конечные |
|||||||
жуточных соединений (интерме- |
|
|
|
продукты |
|
||||||
диатов)1. Реакция, |
|
проходящая |
|
|
Ход реакции |
|
|||||
в две стадии (рис. 8.3), представ- |
|
|
|
||||||||
ляет собой по существу две отде- |
|
Рис. 8.2. Энергетическая диаграмма |
|
||||||||
льные реакции. |
|
|
|
|
|
для одностадийной реакции |
|
||||
|
|
|
|
|
|
|
|
|
|||
Двухстадийный процесс характеризуется наличием двух переходных состоя- |
|||||||||||
ний, которым соответствуют энергетические максимумы E1 |
и E2, а также проме- |
||||||||||
жуточного продукта. |
|
|
|
|
|
a |
a |
|
|||
|
|
|
|
|
|
|
|
||||
Стадию реакции, переходное состояние которой имеет наиболее высокую энер- |
|||||||||||
гию активации, называют лимитирующей стадией. |
|
|
|
||||||||
Эта стадия проходит с более низкой скоростью и определяет скорость реак- |
|||||||||||
ции в целом, поэтому часто ее называют скоростьопределяющей стадией. Впади- |
|||||||||||
на (провал) на кривой потенциальной энергии соответствует промежуточному |
|||||||||||
продукту. В отличие от активированного комплекса, промежуточный продукт |
|||||||||||
представляет собой реально суще- |
|
|
|
Переходные |
|
||||||
ствующее соединение с достаточ- |
|
|
1 |
|
|||||||
но высокой потенциальной энер- |
|
|
состояния |
|
|||||||
гией. Время жизни |
|
интермеди- |
|
|
|
2 |
|
||||
ата зависит от глубины впадины |
|
|
|
|
|||||||
|
|
|
|
|
|||||||
на |
энергетической |
|
диаграмме. |
G |
|
Eà1 |
E 2à |
|
|||
Если «провал» между двумя пе- |
|
|
|||||||||
реходными состояниями выражен |
энергия |
|
|
|
|
||||||
довольно отчетливо, промежуточ- |
|
Промежуточный |
|
||||||||
ный продукт можно реально вы- |
|
|
|||||||||
Свободная |
A + Â |
продукт |
|
||||||||
делить. Чаще интермедиат суще- |
Исходные |
(интермедиат) |
|
||||||||
ствует непродолжительное время, |
вещества |
–∆G |
|
|
|||||||
так |
как |
благодаря |
высокой |
ре- |
|
|
|
|
|||
акционной способности при не- |
|
|
|
|
|||||||
|
|
|
|
|
|||||||
большой энергии активации (Ea2) |
|
|
|
C + D |
|
||||||
он через переходное состояние 2 |
|
|
|
Конечные |
|||||||
превращается в конечный продукт |
|
|
|
продукты |
|||||||
|
|
|
|
|
|||||||
реакции. В качестве интермедиа- |
|
|
Ход реакции |
|
|||||||
тов в органических реакциях чаще |
|
Рис. 8.3. Энергетическая диаграмма |
|
||||||||
|
|
|
|
|
|
|
|
|
|||
1 |
От англ. intermediate — промежуточный. |
|
для двухстадийной реакции |
|
|||||||

Глава 8
118
всего выступают карбокатионы, карбанионы, свободные радикалы и σ-комп- лексы.
Более подробно энергетические и кинетические условия протекания реакций рассматриваются в курсе физической химии.
8.2. ПОНЯТИЕ О МЕХАНИЗМЕ РЕАКЦИИ
Общие схемы химических реакций, с помощью которых описывают превращения органических соединений, не отражают в полной мере реально протекающих при взаимодействии процессов. Большинство органических реакций проходит, как правило, в несколько элементарных стадий, совокупность которых составляет механизм реакции. Иначе говоря, механизмом реакции называют об-
щий путь, по которому осуществляется переход от исходных веществ к конечным продуктам реакции. Установление механизма реакции представляет довольно сложную задачу, решением которой занимается преимущественно физическая органическая химия. Для доказательства механизма реакции применяют химические методы (метод меченых атомов, изотопный метод, кинетические и стереохимические методы) и физические методы. Лучшим доказательством механизма реакции является выделение из реакционной среды промежуточных продуктов или обнаружение их с помощью физических методов. Механизм реакции должен объяснять все экспериментально полученные данные и включать сведения о том, каким образом, в какой последовательности и какие связи разрываются в ходе реакции, как образуются промежуточные и конечные продукты, из каких элементарных стадий состоит реакция, каковы относительные скорости каж-
дой стадии и т. д. Механизм реакции всегда следует рассматривать как гипотезу с достаточной степенью достоверности. Нет ни одного механизма, который был бы известен полностью. С появлением новых фактов механизм может уточняться и даже изменяться.
8.3. ТИПЫ МЕХАНИЗМОВ РЕАКЦИЙ
При рассмотрении типов механизмов реакций для удобства условно принято одно из реагирующих веществ называть субстратом, а другое — атакующим ре-
агентом.
В зависимости от способа разрыва связей в атакующем реагенте и субстрате различают три типа механизмов реакций: гомолитический (радикальный), гетеро-
литический (ионный) и перициклический (молекулярный).
Гомолитическим, или свободнорадикальным, называют механизм, в котором при разрыве связей в реагирующих молекулах у каждого из образующихся фрагментов остается по одному электрону. Такие частицы называют радикалами:
А·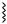 ·В
·В  А· + В·.
А· + В·.
Свободнорадикальный механизм обозначают символом R.
Гетеролитическим, или ионным, называют механизм, в котором при разрыве связей в реагирующих молекулах оба электрона остаются на одном из образующихся фрагментов. Такие частицы называют ионами:

осноВы Теории реакЦиЙ органических соединениЙ
119
А: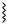 В
В  А– + В+.
А– + В+.
Реакции, протекающие по ионному механизму, в зависимости от электронной природы атакующего реагента делят на нуклеофильные (символ N ) и электрофильные (символ Е ). В нуклеофильных реакциях атакующим реагентом является нуклеофил (Nи), в электрофильных — электрофил (Е ).
Нуклеофильными1 (ищущими ядра) называют реагенты, которые отдают элек
тронную пару при образовании химической связи с субстратом.
К нуклеофильным реагентам относят анионы и нейтральные молекулы, содержащие атомы с неподеленными парами электронов или центры с повышенной электронной плотностью.
Типичными нуклеофильными реагентами являются:
1. Ионы, несущие отрицательный заряд (анионы): OH–, CN–, RO–, NH–2 ,
R—COO–, RS–, SH–, Cl–, Br–, I–, HSO3–, CNS– и др.;
2. Нейтральные молекулы, содержащие одну или несколько неподеленных пар электронов: NH3, R—NH2, R2NH, R3N, H2O, R—OH, R—O—R и др.;
3. Молекулы, имеющие центры с повышенной электронной плотностью (алкены, алкадиены, алкины, арены):
 C—С ,
C—С ,  C—C—C—С , —C—С—,
C—C—C—С , —C—С—,
Нуклеофилы способны образовывать ковалентную связь с субстратом, атакуя в его молекуле центры с пониженной электронной плотностью.
Электрофильными2 (ищущими электроны) называют реагенты, принимающие
электронную пару от субстрата при образовании с ним химической связи.
К электрофильным реагентам относят катионы и нейтральные молекулы, имеющие вакантную орбиталь или центры с пониженной электронной плотностью.
Типичными электрофильными реагентами являются:
1. Ионы, несущие положительный заряд (катионы): протон (Н+), катионы металлов (Мn+), арилдиазоний-катион (Ar—N+2 ), протонированный серы (VI) оксид (HSO3+), нитроил-ион (NO+2 ), нитрозил-катион (NO+) и др.;
2. Нейтральные молекулы, имеющие вакантную орбиталь: SO3, кислоты Лью-
иса (АlСl3, FeВr3, SnCl4, ВF3 и др.);
3. Молекулы, имеющие центры с пониженной электронной плотностью: гало-
δ+
генопроизводные углеводородов ( C—Hal), карбонилсодержащие соединения
δ+ O |
δ+ O |
δ+ O |
δ+ O |
δ+ |
O |
R—C |
, R—C |
, R—C |
, R—C |
, R—C |
и др., |
H |
R′ |
OH |
OR′ |
|
Hal |
а также галогены3 Cl2, Br2, I2.
Электрофильные реагенты способны образовывать ковалентную связь с субстратом, атакуя в его молекуле центры с повышенной электронной плотностью.
Электрофильные и нуклеофильные реакции, подобно процессам окисления и восстановления, неразрывно связаны между собой, то есть в зависимости
1 От лат. nucleus — ядро и греч. ϕιλια (филиа) — дружба, любовь. 2 От греч. ηλεκτροn — электрон и ϕιλια — дружба, любовь.
3 Галогены проявляют электрофильные свойства под влиянием катализатора или π-электронов атакуемого реагента, вызывающих поляризацию связи в молекуле.
Глава 8
120
от того, какое из реагирующих веществ принимается за атакующий реагент, а какое — за субстрат, одну и ту же реакцию можно назвать как электрофильной, так и нуклеофильной. Однако чаще всего субстратом считают вещество с более сложной структурой или вещество, молекулы которого представляют атом углерода для образования новой связи.
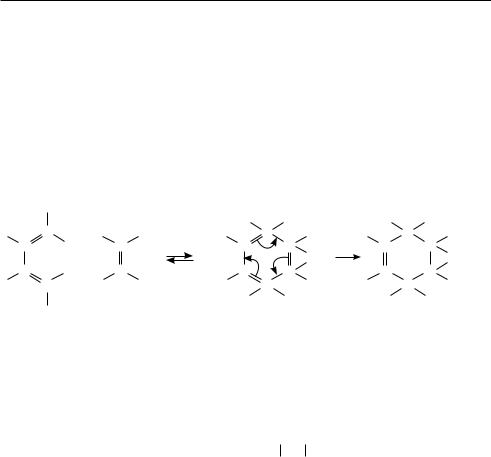
Кроме гомо- и гетеролитических известны реакции, протекающие по так называемому перициклическому (молекулярному) механизму. Молекулярный меха-
низм характеризуется одновременным (согласованным) разрывом и образованием связей в реагирующих молекулах. Молекулярные реакции протекают без образования ионов или радикалов, они сопровождаются синхронным перемещением электронов в субстрате и реагенте. Типичным примером молекулярной реакции
является присоединение диенов к алкенам: |
|
|
|
|
|
|||
C |
С |
C |
C |
С |
C |
C |
С |
C |
|
|
+ |
C |
|
|
C |
|
|
C |
C |
C |
C |
C |
C |
C |
||
|
|
|
|
|
|
|||
8.4. ТИПЫ ОРГАНИЧЕСКИХ РЕАКЦИЙ
Огромное количество органических реакций можно разделить на несколько основных типов.
1. Реакции присоединения (от англ. addition — присоединение, обозначают сим-
волом А или Ad):
A—В + Х—Y 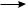 А—В
А—В
Х Y
Они характерны для соединений, имеющих кратные связи между атомами углерода, углерода и кислорода, углерода и азота, азота и азота, а также для соединений, содержащих атомы с неподеленными электронными парами и вакантными орбиталями.
Реакции присоединения могут происходить по следующим возможным механизмам:
а) электрофильное присоединение (АE);
б) нуклеофильное присоединение (АN);
в) радикальное присоединение (AR);
г) молекулярное (синхронное) присоединение.
2. Реакции замещения (от англ. substitution — замещение, обозначают символом S):
A—В + Х—Y 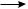 А—Х + В—Y
А—Х + В—Y
Они характерны для всех классов органических соединений и могут протекать по следующим механизмам:
а) электрофильное замещение (SE);
б) нуклеофильное замещение (SN); в) радикальное замещение (SR).
3. Реакции отщепления (элиминирования) (от англ. elimination — отщепление,
обозначают символом Е ):
