
ФЕДЕРАЛЬНОЕ АГЕНСТВО ПО ОБРАЗОВАНИЮ
ГОСУДАРСТВЕННОЕ ОБРАЗОВАТЕЛЬНОЕ УЧРЕЖДЕНИЕ
высшего профессионального образования
«САМАРСКИЙ ГОСУДАРСТВЕННЫЙ ТЕХНИЧЕСКИЙ УНИВЕРСИТЕТ»
Химико-технологический факультет
Кафедра технологии органического и нефтехимического синтеза
«РАСЧЕТЫ И ПРОГНОЗИРОВАНИЕ СВОЙСТВ ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ»
Курсовая работа
Выполнил студент
Научный руководитель
Работа защищена
«___»_________________20__г.
Оценка_____________________
САМАРА 2010
Соединения, для которых будут проводиться расчеты
|
№ |
Соединение |
Tb, К |
Tc, К |
Pc, bar |
Vc, см3/моль |
ω |
Zc |
|
1 |
2-метилгептан |
390,81 |
559,64 |
24,84 |
488 |
0,378 |
0,260 |
|
2 |
изо-пропилциклопентан |
399,6 |
601 |
29,6 |
|
0,240 |
|
|
3 |
дитретбутиловый эфир |
380,38 |
550 |
24 |
500 |
|
|
|
4 |
3-метилфенол |
475,4 |
705,8 |
45 |
310 |
0,464 |
0,241 |
Структурные формулы данных соединений
1) 2-метилгептан
CH3 – CH – CH2 – CH2 – CH2 – CH2 – CH3

CH3
2) изопропилциклопентан

3) дитретбутиловый эфир
CH3 CH3


CH3 – C – O – C – CH3


CH3 CH3
4) 3-метилфенол
 OH
OH
 CH3
CH3
![]()
1.1. 2-метилгептан
Для вычисления данных свойств методом Бенсона, построим таблицу вкладов.
|
Тип атома или группы |
Число |
Вклад |
Вклад в свойство |
||||
|
кДж/моль |
Дж/(моль·К) |
Дж/(моль·К) |
кДж/моль |
Дж/(моль·К) |
Дж/(моль·К) |
||
|
CH3 – (C) |
3 |
-42,19 |
127,29 |
25,91 |
-126,57 |
381,87 |
77,73 |
|
CH2 – (2C) |
4 |
-20,64 |
39,43 |
23,02 |
-82,56 |
157,72 |
92,08 |
|
CH – (3C) |
1 |
-7,95 |
-50,52 |
19 |
-7,95 |
-50,52 |
19 |
|
Сумма |
8 |
|
|
|
-217,08 |
489,07 |
188,81 |
|
Поправки |
|
3,35 |
-27,40 |
0 |
|
||
|
кДж/моль |
|
-213,73 |
|||||
|
Дж/(моль·К) |
461,67 |
||||||
|
Дж/(моль·К) |
188,81 |
||||||
Для вычисления энтальпии нужно рассмотреть четыре связи на гош-взаимодействия.
a b c d
CH3 – CH – CH2 – CH2 – CH2 – CH2 – CH3

CH3
a:

b: с: d:



В случаях b, c и d другие структуры не рассмотрены, потому что нужно учитывать структуру с наименьшим числом гош-взаимодействий, а поскольку в каждой из рассмотренных структур их число равно нулю, остальные рассматривать нецелесообразно. Таким образом, число гош-взаимодействий для молекулы составляет:
1 + 0 + 0 + 0 = 1, следовательно одна поправка на гош-взаимодействие.
Для вычисления энтропии нужно рассмотреть симметрию молекулы. Поправка, связанная с наличием в молекуле ахиральных атомов отсутствует, так как таких атомов в молекуле нет. Число осей внешней симметрии равно 1, а внутренней равно 3 (в молекуле присутствуют 3 -CH3 группы). В итоге, поправка на симметрию выглядит следующим
![]()
В теплоемкость поправок нет.
1.2. Изо-пропилциклопентан
|
Тип атома или группы |
Число |
Вклад |
Вклад в свойство |
||||
|
кДж/моль |
Дж/(моль·К) |
Дж/(моль·К) |
кДж/моль |
Дж/(моль·К) |
Дж/(моль·К) |
||
|
CH3 – (C) |
2 |
-42,19 |
127,29 |
25,91 |
-84,38 |
254,58 |
51,82 |
|
CH2 – (2C) |
4 |
-20,64 |
39,43 |
23,02 |
-82,56 |
157,72 |
92,08 |
|
CH – (3C) |
2 |
-7,95 |
-50,52 |
19 |
-15,9 |
-101,04 |
38 |
|
Сумма |
8 |
|
|
|
-182,84 |
311,26 |
181,9 |
|
Поправки |
|
33,07 |
96 |
-27,21 |
|
||
|
кДж/моль |
|
-149,77 |
|||||
|
Дж/(моль·К) |
407,26 |
||||||
|
Дж/(моль·К) |
154,69 |
||||||
Для вычисления энтальпии нужно рассмотреть одну связь на гош-взаимодействия (связь изо-пропильного радикала с циклом).
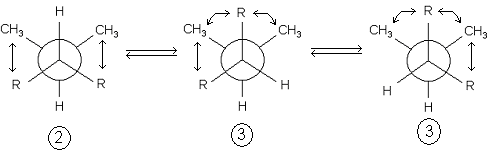
Таким образом, число гош-взаимодействий равно 2. К тому же, здесь имеет место поправка на цикл, которая составляет 26,37 кДж/моль. В итоге, поправка в энтальпию составляет 2·3,35 + 26,37 = 33,07 кДж/моль.
В энтропию здесь входят две поправки: на цикл (114,27 Дж/(моль·К)) и на симметрию.
Число внешних осей симметрии равно 1, внутренних – 2. В итоге, поправка на симметрию составляет: -18,27 Дж/(моль·К), а общая поправка в энтропию: 96 Дж/(моль·К). Поправки на ахиральность нет.
В расчет теплоемкости входит только поправка на цикл. Она составляет: -27,21 Дж/(моль·К).
1.3. Дитретбутиловый эфир
|
Тип атома или группы |
Число |
Вклад |
Вклад в свойство |
||||
|
кДж/моль |
Дж/(моль·К) |
Дж/(моль·К) |
кДж/моль |
Дж/(моль·К) |
Дж/(моль·К) |
||
|
CH3 – (C) |
6 |
-42,19 |
127,29 |
25,91 |
-253,14 |
763,74 |
155,46 |
|
C – (О,3C) |
2 |
-27,63 |
-140,48 |
18,12 |
-55,26 |
-280,96 |
36,24 |
|
О – (2C) |
1 |
-97,11 |
36,33 |
14,23 |
-97,11 |
36,33 |
14,23 |
|
Сумма |
9 |
|
|
|
-405,51 |
519,11 |
205,93 |
|
Поправки |
|
12,54 |
-78,83 |
0 |
|
||
|
кДж/моль |
|
-392,97 |
|||||
|
Дж/(моль·К) |
440,28 |
||||||
|
Дж/(моль·К) |
205,93 |
||||||
Для вычисления энтальпии нужно рассмотреть одну связь через кислород простого эфира. Если построить проекции Ньюмена, то каждая будет указывать на 6 гош-взаимодействий (это очевидно, поскольку каждый атом углерода связан с тремя -CH3 группами). Поэтому поправка в энтальпию будет составлять 6·2,09 = 12,54 кДж/моль. Других поправок нет.
Для расчета энтропии необходимо учесть только поправку на симметрию молекулы.
Число внешних осей симметрии равно 1 (проходит через кислород параллельно двум –CH3 группам каждого из третбутильных радикалов). Порядок этой связи равен 2. Число осей внутренней симметрии молекулы равно 8 (6 –CH3 групп и 2 третбутильных радикала). Таким образом, поправка в энтропию составляет:
![]()
В теплоемкость поправок нет.
1.4. 3-метилфенол
|
Тип атома или группы |
Число |
Вклад |
Вклад в свойство |
||||
|
кДж/моль |
Дж/(моль·К) |
Дж/(моль·К) |
кДж/моль |
Дж/(моль·К) |
Дж/(моль·К) |
||
|
Cb – (H) |
4 |
13,81 |
48,26 |
13,56 |
55,24 |
193,04 |
54,24 |
|
Cb – (C) |
1 |
23,06 |
-32,19 |
11,18 |
23,06 |
-32,19 |
11,18 |
|
CH3 – (Cb) |
1 |
-42,19 |
127,29 |
25,91 |
-42,19 |
127,29 |
25,91 |
|
Cb – (O) |
1 |
-3,77 |
-42,7 |
16,32 |
-3,77 |
-42,7 |
16,32 |
|
OH – (Cb) |
1 |
-158,64 |
121,81 |
18 |
-158,64 |
121,81 |
18 |
|
Сумма |
8 |
|
|
|
-126,3 |
367,25 |
125,65 |
|
Поправки |
|
0 |
-9,13 |
0 |
|
|
|
|
кДж/моль |
|
-126,3 |
|||||
|
Дж/(моль·К) |
358,12 |
||||||
|
Дж/(моль·К) |
125,65 |
||||||
Поправок в энтальпию и теплоемкость нет.
При расчете энтропии необходимо учесть только поправку на симметрию молекулы. Число внешних осей симметрии равно 1, а внутренних равно 3 (одна –CH3 группа). Таким образом, поправка составляет: -9,13 Дж/(моль·К).
![]()
Для расчета данных свойств при нестандартной температуре, построим следующую таблицу:
|
Тип атома или группы |
Кол-во, n |
Теплоемкость, Дж/(моль·К), соответствующей при температуре |
|||||
|
298К |
400К |
500К |
|||||
|
Парц. Вклад |
Вклад в св-во |
Парц. Вклад |
Вклад в св-во |
Парц. Вклад |
Вклад в св-во |
||
|
CH3 -(C) |
3 |
25,91 |
77,73 |
32,82 |
98,46 |
39,95 |
119,85 |
|
CH2 —(2C) |
4 |
23,02 |
92,08 |
29,09 |
116,36 |
34,53 |
138,12 |
|
CH — (3C) |
1 |
19 |
19 |
25,12 |
25,12 |
30,01 |
30,01 |
|
Σ1 - тепл-ть в-ва |
8 |
|
188,81 |
|
239,94 |
|
287,98 |
|
C |
8 |
9 |
72 |
12 |
96 |
15 |
120 |
|
H |
9 |
29 |
261 |
29 |
261 |
29 |
261 |
|
Σ2 тепл-ти эл-тов |
|
|
333 |
|
357 |
|
381 |
|
Σ1-Σ2 = Δcp |
|
|
-144,19 |
|
-117,06 |
|
-93,02 |
продолжение таблицы:
|
Теплоемкость, Дж/(моль·К), соответствующей при температуре |
|||||
|
600К |
730К |
800К |
|||
|
Парц. Вклад |
Вклад в св-во |
Парц. Вклад |
Вклад в св-во |
Парц. Вклад |
Вклад в св-во |
|
45,17 |
135,51 |
|
|
54,5 |
163,5 |
|
39,14 |
156,56 |
|
|
46,34 |
185,36 |
|
33,7 |
33,7 |
|
|
38,97 |
38,97 |
|
|
325,77 |
|
366,109 |
|
387,83 |
|
17 |
136 |
|
|
20 |
160 |
|
29 |
261 |
|
|
30 |
270 |
|
|
397 |
|
418,45 |
|
430 |
|
|
-71,23 |
|
-52,341 |
|
-42,17 |
Для вычисления энтальпии образования органических соединений при повышенной температуре и стандартном давлении используют уравнение Кирхгофа:
![]() ,
где ΔCp0 – разность
между теплоемкостями соединения и
простых веществ или элементов, которыми
представлено это вещество, причем каждый
элемент или простое вещество находится
в своем стандартном состоянии.
,
где ΔCp0 – разность
между теплоемкостями соединения и
простых веществ или элементов, которыми
представлено это вещество, причем каждый
элемент или простое вещество находится
в своем стандартном состоянии.
Данное уравнение можно преобразовать к виду:
![]()
Для вычисления энтропии образования органических соединений при повышенной температуре и стандартном давлении используют следующее уравнение:
![]()
Данное уравнение можно преобразовать к виду:
![]()
Здесь CpTi – теплоемкость вещества при температуре Ti.
В приведенной ранее таблице были рассчитаны ΔCpTi0 и CpTi при Ti = 298, 400, 500, 600, 730, 800 К. Значения теплоемкостей как вещества, так и элементов при температуре 730К были найдены с помощью линейной интерполяции. Далее составляем следующие две таблицы, где мы находим значения энтальпии и энтропии образования заданного соединения при 730К.
|
Диапазон темп, К |
|
ΔT, К |
X·ΔT, Дж/моль |
|
ln(ΔT) |
Y·ln(ΔT), Дж/моль·К |
|
298 - 400 |
-130,625 |
102 |
-13323,75 |
214,375 |
0,2944 |
63,1058 |
|
400 - 500 |
-105,04 |
100 |
-10504 |
263,96 |
0,2231 |
58,9010 |
|
500 - 600 |
-82,125 |
100 |
-8212,5 |
306,875 |
0,1823 |
55,9499 |
|
600 - 730 |
-61,7855 |
130 |
-8032,115 |
345,9395 |
0,1961 |
67,8439 |
|
|
Энтальпия |
Энтропия |
||
|
Значение интеграла |
-40,0723 |
кДж/моль |
245,8005788 |
Дж/(моль·К) |
|
Стандартное значение |
-227,4 |
кДж/моль |
423,64 |
Дж/(моль·К) |
|
Значение при 730К |
-267,4724 |
кДж/моль |
669,4405788 |
Дж/(моль·К) |
Значение интеграла для энтальпии получается суммированием чисел столбца X, а значение интеграла для энтропии – столбца Y. Конечные значения энтальпии и энтропии образования 2-метилгептана при температуре 730К получаются суммированием этих значений при стандартной температуре и значений интегралов.
3. Расчет критических (жидкость-пар) температуры, давления, объема ацентрического фактора для всех четырех заданных соединений
Для всех веществ расчет критических температуры, давления и объема произведем методами Лидерсена и Джобака. Расчет ацентрического фактора произведем с помощью уравнений Ли-Кеслера (используются критические параметры, рассчитанные с помощью метода Лидерсена) и Амброуза-Уолтона (используются критические параметры, рассчитанные с помощью метода Джобака).
Методы Лидерсена и Джобака – это аддитивные методы, в которых используются таблицы вкладов.
Формулы для расчета критических параметров методом Лидерсена:



Формулы для расчета критических параметров методом Джобака:


Ацентрический фактор рассчитывается по следующим формулам:
Формула Ли-Кеслера:

Формула Амброуза-Уолтона:

3.1. 2-метилгептан
Для расчета критических параметров построим две таблицы. Первая – таблица вкладов, вторая – таблица с расчетами критических параметров.
Метод Лидерсена:
|
Тип атома или группы |
Колич-во |
Температура |
Давление |
Объем |
|||
|
Парц. Вклад |
Вклад в св-во |
Парц. Вклад |
Вклад в св-во |
Парц. Вклад |
Вклад в св-во |
||
|
—CH3 |
3 |
0,02 |
0,06 |
0,227 |
0,681 |
55 |
165 |
|
—CH2— |
4 |
0,02 |
0,08 |
0,227 |
0,908 |
55 |
220 |
|
—CH— |
1 |
0,012 |
0,012 |
0,21 |
0,21 |
51 |
51 |
|
Сумма |
8 |
|
0,152 |
|
1,799 |
|
436 |
|
Tb, K |
Tc, K |
M |
Pc, атм |
Vc, см3/моль |
θ |
ω |
|
390,81 |
561,59 |
114 |
24,92 |
476 |
0,70 |
0,3684 |
Метод Джобака:
|
Тип атома или группы |
Колич-во |
Температура |
Давление |
Объем |
|||
|
tck, K |
Вклад в св-во |
pck, bar |
Вклад в св-во |
vck, см3/моль |
Вклад в св-во |
||
|
CH3(1) |
3 |
0,01 |
0,0423 |
-0,0012 |
-0,0036 |
65 |
195 |
|
CH2(2) |
4 |
0,02 |
0,0756 |
0 |
0 |
56 |
224 |
|
CH(3) |
1 |
0,02 |
0,0164 |
0,002 |
0,002 |
41 |
41 |
|
Сумма |
8 |
|
0,1343 |
|
-0,0016 |
|
460 |
|
Tb, K |
Tc, K |
N |
Pc, bar |
Vc, см3/моль |
θ |
τ |
f(0) |
f(1) |
ω |
|
390,81 |
561,86 |
26 |
25,56 |
477,5 |
0,70 |
0,30 |
-2,3504 |
-2,3598 |
0,3718 |
3.2. Изо-пропилциклопентан
Метод Лидерсена:
|
Тип атома или группы |
Колич-во |
Температура |
Давление |
Объем |
|||
|
Парц. Вклад |
Вклад в св-во |
Парц. Вклад |
Вклад в св-во |
Парц. Вклад |
Вклад в св-во |
||
|
—CH3 |
2 |
0,02 |
0,04 |
0,227 |
0,454 |
55 |
110 |
|
—CH2— (циклич.) |
4 |
0,013 |
0,052 |
0,184 |
0,736 |
44,5 |
178 |
|
—CH— | (ациклич.) |
1 |
0,012 |
0,012 |
0,21 |
0,21 |
51 |
51 |
|
—CH— | (циклич.) |
1 |
0,012 |
0,012 |
0,192 |
0,192 |
46 |
46 |
|
Сумма |
8 |
|
0,116 |
|
1,592 |
|
385 |
|
Tb, K |
Tc, K |
M |
Pc, атм |
Vc, см3/моль |
θ |
ω |
|
399,6 |
596,82 |
112 |
30,01 |
425 |
0,67 |
0,2762 |
Метод Джобака:
|
Тип атома или группы |
Колич-во |
Температура |
Давление |
Объем |
|||
|
tck, K |
Вклад в св-во |
pck, bar |
Вклад в св-во |
vck, см3/моль |
Вклад в св-во |
||
|
CH3(1) |
2 |
0,0141 |
0,0282 |
-0,0012 |
-0,0024 |
65 |
130 |
|
CH2(SS)(2) |
4 |
0,01 |
0,04 |
0,0025 |
0,01 |
48 |
192 |
|
CH(3) |
1 |
0,0164 |
0,0164 |
0,002 |
0,002 |
41 |
41 |
|
CH(SS)(3) |
1 |
0,0122 |
0,0122 |
0,0004 |
0,0004 |
38 |
38 |
|
Сумма |
8 |
|
0,0968 |
|
0,01 |
|
401 |
|
Tb, K |
Tc, K |
N |
Pc, bar |
Vc, см3/моль |
θ |
τ |
f(0) |
f(1) |
ω |
|
399,6 |
598,17 |
24 |
30,93 |
418,5 |
0,67 |
0,33 |
-2,6616 |
-2,7415 |
0,2761 |

 |
|
