
Шпаргалка К Первому Коллоквиуму По Химии (Наумов В. А.)
.docx1 Скорость реакции. Размерность.
-Изменение моляр.концент.одного из учавств.в реакции вещ.в единицу времени.
 ,
где
,
где
 - кол-во молекул, а Ф – объем реакционного
производства.
- кол-во молекул, а Ф – объем реакционного
производства.
При T=const,
скор.хим.реак.прямопропорц.произв.молярной конц.реагентов. Размер-кол-во незави-х парам., необх.для описания сост.объекта, или кол-ва степеней свободы физ-ой сис-мы.
1)В случаях гомогенн.реак. Ф=V(трехмерное простр.)
2)гетерог.реак.,идущих на поверхн.земли раздела фаз Ф=S(двухмер.простр.)
3)в одномерном простр.Ф=e
2. Как связана скорость реакции по разным веществам.
Раствор настолько хорошо перемеш., что конц-я независит от координат точки в простр. скорость реакции по i-ому вещ-ву равняется:
 ,если
i-ое
вещ-во исходное, то производная отриц,
а скор. Реа-и – величина полож., поэтому
для исходного вещ-ва в правой части
нужно поставить «-», а для продуктов
реакции не
нужно
ставить минус « - ».
,если
i-ое
вещ-во исходное, то производная отриц,
а скор. Реа-и – величина полож., поэтому
для исходного вещ-ва в правой части
нужно поставить «-», а для продуктов
реакции не
нужно
ставить минус « - ».
 =моль.
=моль.

3.Элементарная реакция. Чем отличается порядок реакции и молекулярность.
Столк.более3-х частиц практически невероятно.
Превращение при одном столк.неболее чем 3-х частиц, назыв. – элементарной реакцией.
В элементарных реакциях – порядок реакции равен стехиометрическому числу.
 - мономолекул.
реак. Число частиц участв. в одном акте
реак.назыв. молекулярностью
реакции.
- мономолекул.
реак. Число частиц участв. в одном акте
реак.назыв. молекулярностью
реакции.
(это понятие относ.только к элеме-м реак!)
4. Основной постулат химической реакции
Скор.реак.пропорциональна числу столк. молекул, откуда следовало, что для реакции
A+B+… =
= (4),
(4),
где n1, n2 порядок реакции
 -
общий порядок (суммарный).
-
общий порядок (суммарный).
k – константа скорости реакции.
(4) – выражает основной постулат формальной кинетики. Порядок реакции не имеет физич.смысла – это подгоночный коэффициент. Он может быть целым, дробным, «+», «-» и 0.
Пример:
5. Интегрирование прост-х кинет.урав.
Если найдена скор.реак.по одному из вещ., то скор.реак.по всем остальным вещ, можно вычислить с учетом стехиометрии реакции.
Пример:

(1) (2) (3)
 ;
;


 ;
;
 ;
;
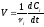 ;
;
6. Время полупревращения.
V – скор.реакции;k – константа скор; С – текущая концен.исходного вещ.;
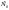 -
нач.концент.исходного вещ.;
-
нач.концент.исходного вещ.;
 - период
полупревращения, равный времени, за
которое концен.исходного вещ. уменьшается
в два раза.
- период
полупревращения, равный времени, за
которое концен.исходного вещ. уменьшается
в два раза.
Реакции нулевого порядка:
![]() ,
,
![]() ,
,
![]() ,
,
![]() ,
,
![]() ,
,![]()
Для реакции 0-ого порядка время прямопропорц.от С0!!!
Реакции первого порядка:
![]() ,
,
![]() ,
,
![]() ,
,
![]() ,
,
![]() ,
,![]()
![]()
Для реакции 1-ого порядка период полупревращения не зависит от С0!!!
Реакции второго порядка:
![]() ,
,
![]() ,
,
![]() ,
,
![]() ,
,
![]() ,
,
![]() .
.
Для реакции 2-ого порядка время обратнопропорционально С0!!!!
8. Влияние t на скорость реакции. Уравнение Аррениуса.
Скорость большинства хим.реак.с ростом темп.на 10K увеличиваются в 2-4 раза.
Уравнение
Аррениуса:
 (1),
где Е
– энергия активации, R
– газовая постоянная, T
– температура в Кельвинах.
(1),
где Е
– энергия активации, R
– газовая постоянная, T
– температура в Кельвинах.
k=1.387
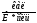 ,
[E]=кал/моль.
,
[E]=кал/моль.
 -
предэкспоненциальный множитель.
-
предэкспоненциальный множитель.
E=10…100 ккал/моль.
(1)
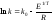 (2).
(2).
Линейное
преобразование уравнения (1).

Для
элем-ой реакции кинетика выражается :
 (3).
(3). ,
С=const.
,
С=const.
Часто и неэлементарная реакция моет формально списываться уравнением (3).
Уравнение (1) не работает для сложных реакций.
Если бы все молекулы сталкивались, то все реакции шли бы со скоростью взрыва.
9. Энтропия и энтальпийный фактор.
Энергия активации содержит энтальпийный фактор.
![]()
![]() С ростом величины
сместится х, скорость реакции этерификации
снижается. Следовательно, кроме
энергетического (энтальпийного) фактора
существует пространственный (энтропийный)
фактор.
С ростом величины
сместится х, скорость реакции этерификации
снижается. Следовательно, кроме
энергетического (энтальпийного) фактора
существует пространственный (энтропийный)
фактор.
Иными словами, кроме энтальпии активации надо учитывать энтропию активации, которая пропорциональна логарифму отношения:
ln .
Таким образом в уравнение Аррениуса
следовало бы вписать свободную степень
активации, т.е. изменение энтропии
Гиббса при образовании активированного
комплекса.
.
Таким образом в уравнение Аррениуса
следовало бы вписать свободную степень
активации, т.е. изменение энтропии
Гиббса при образовании активированного
комплекса.
 (5)
(5)
 (6).
(6).
E
– энтальпия активации ( ),
),
 ,
,
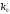 - пропорционально частоте столкновений.
- пропорционально частоте столкновений.
Энтропийный фактор
 снижает возможность прохождения
реакции.
снижает возможность прохождения
реакции.
Ориентация облегчается при наличии в системе катализатора, который кроме того, очень часто понижает и энергетический барьер.
Вот почему более 90% промышленных реакций – каталитический.
Действие катализаторов основано на том, что они уменьшают энергию активации реакции.
