
- •Контрольные задания по химии
- •1. Основные стехиометрические законы химии. Строение атома и химическая связь. Ионно-электронный метод уравнивания окислительно-восстановительных реакций
- •Основные формулы для расчетов
- •Примеры типовых расчетов
- •Варианты заданий для самостоятельной работы
- •2. Химическая термодинамика
- •2.1. Основные формулы для расчетов
- •2.2. Примеры типовых расчетов
- •3. Химическая кинетика
- •Основные формулы для расчетов
- •Примеры типовых расчетов
- •Варианты заданий для самостоятельной работы по химической термодинамике и кинетике
- •4. Жидкие растворы
- •Основные формулы для расчетов
- •Примеры типовых расчетов
- •Варианты заданий для самостоятельной работы
- •5. Электрохимия
- •Основные формулы для расчетов
- •Примеры типовых расчетов
- •Варианты заданий для самостоятельной работы
- •Список литературы
- •Приложения
- •1. Термодинамические величины для простых веществ и соединений
- •2. Стандартные электродные потенциалы
- •Содержание
- •198376, Санкт-Петербург, ул. Проф. Попова, 5
Министерство образования РФ
С анкт-Петербургский
государственный электротехнический
анкт-Петербургский
государственный электротехнический
университет «ЛЭТИ»

Контрольные задания по химии
Методические указания
для самостоятельной работы студентов
Санкт-Петербург
Издательство СПбГЭТУ «ЛЭТИ»
2003
У ДК 546(076.1)
ДК 546(076.1)

Контрольные задания по химии: Методические указания для самостоятельной работы студентов / Сост.: Г. Ф. Федотова, Т. Н. Кудряшова, О. Л. Байдакова,Н. П. Шкуряков, О. В. Альмяшева: Под ред. О. А. Лебедева. СПб.: Изд-во СПбГЭТУ «ЛЭТИ», 2003. 72 с.
Содержат примеры типовых расчетов и задания для самостоятельной работы по основным разделам курса.
Предназначены студентам дневной и заочной форм обучения.
Утверждено
редакционно-издательским советом университета
в качестве методических указаний
СПбГЭТУ «ЛЭТИ», 2003
Специфика курса физической химии такова, что восприятие его в значительной степени облегчается, если основные разделы подкреплены решением конкретных задач. Умение определять энергетические характеристики и направления физико-химических превращений, степень их протекания, скорость химической реакции, применять количественные законы для жидкого состояния вещества, объяснять электрохимические явления необходимо для подготовки инженеров всех специальностей СПбГЭТУ «ЛЭТИ». Для оказания помощи студентам в подготовке индивидуальных домашних заданий, способствующих глубокому усвоению теоретического материала по физической химии, в данных указаниях рассмотрены примеры решения типовых задач по основным разделам лекционного курса.
1. Основные стехиометрические законы химии. Строение атома и химическая связь. Ионно-электронный метод уравнивания окислительно-восстановительных реакций
Основные формулы для расчетов
Уравнение состояния идеального газа
![]()
где p− давление;
V − объем;
m − масса газа;
M− молярная масса газа;
n − число молей газа;
R− универсальная газовая постоянная, равная 8.3144 Дж/(моль ∙ К);
T− температура.
Следствие из закона Авогадро
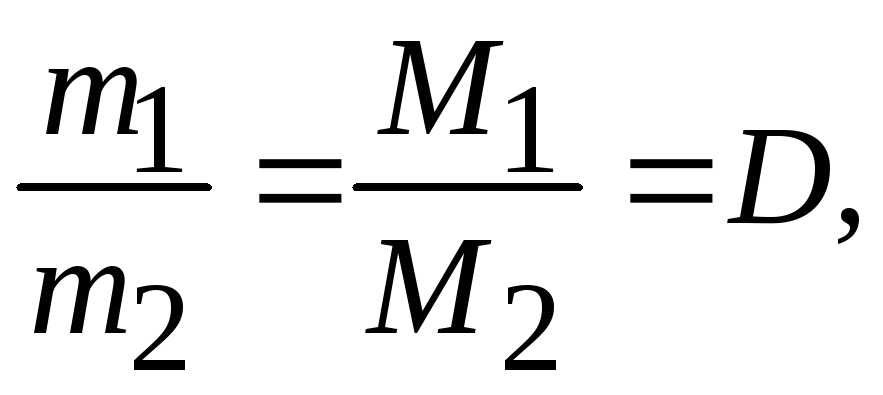 (1.1)
(1.1)
где m1,m2 − массы газов;
M1,M2− молярные массы газов;
D − относительная плотность первого газа по второму.
Закон эквивалентов
 (1.2)
(1.2)
где m1,m2 − массы взаимодействующих веществ;
Meq1,Meq2− молярные эквивалентные массы веществ.
Молярные эквивалентные массы веществ определяются по следующим соотношениям:

Примеры типовых расчетов
Пример 1.1. Массовая доля водорода в газообразном соединении углерода с водородом составляет 20 %. Плотность соединения по водороду равна 15. Вывести молекулярную формулу соединения.
Решение. Обозначим число атомов углерода и водорода в простейшей формуле соединения черезxиy. Так как атомные массы этих элементов равны, соответственно, 12 и 1, массы углерода и водорода в этом соединении относятся, как 12x:y. По условию задачи это соотношение равно 80 : 20. Следовательно,
![]()
Простейшая формула соединения CH3.Этой формуле отвечает относительная молекулярная масса, равная 15. Истинная молярная масса соединения вычисляется по соотношению (1.1):
![]()
Таким образом, истинная молярная масса вдвое больше молекулярной массы, вычисленной по простейшей формуле. Следовательно, молекулярная формула соединения C2H6.
Пример 1.2.Некоторое количество металла, молярная эквивалентная масса которого 0.028 кг/моль, вытесняет из кислоты 0.7∙10−3м3 водорода, измеренного при нормальных условиях. Определить массу металла.
Решение. При нормальных условиях 22.410−3м3водорода имеют массу 0.002 кг. Тогда масса выделенного по условию задачи водорода

По соотношению (1.2) определяется масса металла:

Пример 1.3.Закончить и уравнять ионно-электронным методом окислительно-восстановительную реакцию, протекающую в кислой среде:
KI + K2Cr2O7 + H2SO4 → I2 + Cr2(SO4)3 + …
Решение. Данное уравнение реакции перепишем в ионной форме:
K+ + I− + 2K+ + Cr2O72− + 2H+ + SO42− → I2 + 2Cr3+ + 3SO42− + …
и определим для восстановителя его окисленную форму
I− → I2,
а для окислителя − его восстановленную форму
Cr2O72− → 2Cr3+.
Для процессов окисления и восстановления необходимо сначала осуществить материальный баланс с помощью ионов H+иH2O, а затем баланс по электрическим зарядам. Полученные два уравнения следует просуммировать, умножив каждое из них на коэффициенты, подобранные так, чтобы число электронов, теряемых восстановителем, было равно числу электронов, приобретаемых окислителем. В результате, получаем ионное уравнение окислительно-восстановительной реакции:
3 2I− −
2ē → I2
2I− −
2ē → I2
1 Cr2O72− + 14H+ + 6ē → 2Cr3+ + 7H2O
6I− + Cr2O72− + 14H+ → 3I2 + 2Cr3+ + 7H2O.
Остается коэффициенты из ионного уравнения перенести в молекулярное уравнение реакции и уравнять ионы, не участвовавшие в окислительно-восстановительной схеме (K+иSO42−):
6KI + K2Cr2O7 + 7H2SO4 → 3I2 + Cr2(SO4)3 + 4K2SO4 + 7H2O.
Пример 1.4.Закончить и уравнять ионно-электронным методом окислительно-восстановительную реакцию, протекающую в щелочной среде:
Bi2O3 + Br2 + KOH → K3BiO4 + KBr + …
Решение.Перепишем данное уравнение реакции в ионной форме:
Bi2O3 + Br2 + K+ + OH− → 3K+ + BiO43− + K+ + Br− + …
и определим для восстановителя его окисленную форму
Bi2O3 → BiO43−,
а для окислителя − его восстановленную форму
Br2 → Br−.
Для процессов окисления и восстановления необходимо сначала осуществить материальный баланс с помощью ионов H+иH2O, а затем баланс по электрическим зарядам. Полученные два уравнения следует просуммировать, умножив каждое из них на коэффициенты, подобранные так, чтобы число электронов, теряемых восстановителем, было равно числу электронов, приобретаемых окислителем. В результате, получаем ионное уравнение окислительно-восстановительной реакции:
1 Bi2O3 + 10OH− −
4ē → 2BiO43−+ 5H2O
Bi2O3 + 10OH− −
4ē → 2BiO43−+ 5H2O
2 Br2 + 2ē → 2Br−
Bi2O3 + 2Br2 +10OH−→ 2BiO43− +4Br− + 5H2O.
Коэффициенты из ионного уравнения перенесем в молекулярное уравнение реакции и проверим, уравнялись ли при этом ионы, не принимавшие участия в окислительно-восстановительной схеме (K+):
Bi2O3 + 2Br2 + 10KOH → 2K3BiO4 + 4KBr + 5H2O.
