
- •Частная микробиология
- •3. S. Aureus как возбудитель специфических интоксикаций. Варианты интоксикаций, клинические проявления. Механизм действия токсинов. Иммунитет против стафилококковых интоксикаций.
- •Факторы патогенности n. Gonorrhoeae. Патогенез гонококковой инфекции, особенности течения у мужчин и женщин, исходы. Бленнорея новорожденных (эпидемиология, профилактика).
- •Общая характеристика рода Shigella (морфология, тинкториальные свойства). Культуральные свойства. Возбудители дизентерии (виды). Эпидемиология и патогенез дизентерии.
Общая характеристика рода Shigella (морфология, тинкториальные свойства). Культуральные свойства. Возбудители дизентерии (виды). Эпидемиология и патогенез дизентерии.
Семейство: Enterobacteriaceae Род: Shigella Виды: S.dysenteriae – 12 сероваров (На 4 группы по O-антигену) S.flexneri – 9 сероваров S.Boydii – 18 сероваров S. sonnei – 1 серовар ( К-антиген) Морфология и тинкториальные свойства: Грамотрицательны, неподвижны, спор и капсул не образуют, хорошо растут на простых питательных средах. Большинство имеют пили. По антигенной структуре шигеллы обладают О- и К-антигенами. Термостабильный соматический О-антиген обусловливает развитие интоксикационного синдрома и определяет серологическую специфичность шигелл. К-антигены являются оболочечными структурами (S.sonnei). О-антиген шигелл содержит эпитопы разной специфичности, включая видоспецифические эпитопы.
Культуральные свойства: Факультативные анаэробы. Хорошо культивируются на простых питательных средах. На плотных средах образуют мелкие гладкие блестящие колонии, на жидких – диффузное помутнение. Жидкой середой является селенитовый бульон. У S.sonnei отмечена при росте на плотных средах S-,R-диссоциация. Обладают сильной сахаролитической активность. Среда Олькеницкого – этап накопления чистой культуры (ферментация глюкозы и лактозы, газообразование CO2, синтез сульфита железа)
Возбудители дизентерии (виды): S.dysenteriae – 12 сероваров (На 4 группы по O-антигену) S.flexneri – 9 сероваров S.Boydii – 18 сероваров S. sonnei – 1 серовар ( К-антиген) Эпидемиология и патогенез дизентерии: Вызывают шигеллез, антропонозная инфекция с фекально-оральным механизмом передачи. Наиболее частые возбудители S.flexneri и S.dysenteriae серовара 1, последний вызывает длительную пролонгированную эпидемию. Характерен контактно-бытовой путь.Протекает тяжело и часто заканчивается летально. Быстрое формирование антибиотикорезистентности у S.dysenteriae. Для S.flexneri характерен водный путь передачи. S.sonnei вызывает шигеллез в легкой форме, часто в виде бактерионосительства. Передается алиментарно через молочные продукты. Осложнение шигеллезов – кишечный дисбактериоз. Летальность 0,3 %.
Шигеллезы – инфекционные заболевания, характеризующиеся поражением толстой кишки с развитием колита и интоксикацией организма. Проникнув через М-клетки в подслизистую, шигеллы взаимодействуют с макрофагами, вызывают их апоптоз. В результате идет выделение цитокинов ИЛ-8, который инициирует развитие воспалительного процесса в подслизистой оболочке и как следствие воспалительной диареи. Апоптоз фагоцитов позволяет шигеллам проникнуть в эпителиальные клетки с базальной стороны. Межклеточное распространение приводит к развитию эрозий. При гибели шигелл выделяется шига- и шигаподобные токсины, их действие (разрушение колоноцитов) вызывает кровь в испражнениях. Патологический процесс ограничивается толстой кишкой. Бактериемии не наблюдается. При шигеллезе вызванным S.dysenteriae 1-серовара, шига-токсин попадает в кровь и вызывает поражение гломерулов почки (кровь в моче). Воспаленный эндотелий сужает сосуды увеличивая скорость кровотока. Это приводит к повышению динамического давления, вызывая обнажение рецепторов для мультимерного фактора Виллебранда, который вызывает аггрегацию тромбоцитов, приводящую к окклюзии сосудов и развитию уремии.
Shigella spp. как возбудители инфекции (клинические проявления, исходы заболевания). Шигеллы, продуцирующие токсин Шига. Характеристика токсина, механизм его действия, местный и системный эффекты. Постинфекционный иммунитет. Принципы лабораторной диагностики шигеллеза.
Для заболевания характерно повышение температуры тела до 38-390С, боли в животе, диарея. Испражнения жидкие, с примесью слизи и крови (гемоколит). Характерны болезненные тенезмы – безуспешные позывы к дефекации. Наиболее тяжелую форму дизентерии вызывают S. dysenteriae (группа А). Могут быть осложнения – кишечные кровотечения, коллапс, перфорация кишечника, парапроктиты. Бывают более легкие, стертые и атипичные формы дизентерии, которые трудно диагностировать. Иногда заболевание переходит в хроническую форму или формируется носительство. Исходы: выздоровление, формирование бакстерионосительства, переход в хроническую форму, летальный. S. dysenteriae серовара 1 продуцирует белковый токсин Шига , остальные шигеллы продуцируют шигаподобные токсины. Токсин Шига кодируется хромосомным геном stx. Эти токсины состоят из субъединиц А и 5 рецепторных субъединиц В. Субъединица В имеет сродство и связывается с гликолипидом Gb3 мембраны клетки, а затем субъединица А проникает внутрь клетки и необратимо блокирует синтез белка на рибосомах (цитотоксическое действие). Шига- и шигаподобные токсины накапливаются в периплазматическом пространстве клетки и выделяются в окружающую среду после гибели шигелл. У шигелл, отличных от S.dysenteriae серовара 1, шигаподобных токсинов вырабатывается в 1000 раз меньше, поэтому ареал действия токсина ограничивается стенкой кишечника (местный эффект). У S.dysenteriae серовара 1 токсин попадает в кровь и наряду с эндотелием подслизистой оболочки поражает гломерулы почки, вследствие чего, помимо кровавого поноса, развивается гемолитический уремический синдром с почечной недостаточностью. (Эндотоксин защищает шиггелы от действия низких значение pH и желчи) Постинфекционный иммунитет: В защите от инфекции основаня роль принадлежит секреторным IgA, предотвращающим адегзию, и цитотоскической антителозависимой активности интраэпителиальных лимфоцитов, которые вместе с секреторным IgA уничтожают шигеллы. АТ не обладают протективными свойствами. После перенесенного заболевания иммунитет непрочный и непродолжительный. Чаще всего он видо- и типоспецифичен.
Принципы лабораторной диагностики шигеллеза: 1. Бактериологический (культуральный) метод: испражнения засевают на дифференциально-диагностические среды. Для культивирования используют среды Эндо (Плоскирева, Левина и др.) Большинство не способны сбраживать лактозу и поэтому на среде Эндо образуют бесцветные-прозрачные колонии (исключ. S.sonnei-ферментация лактозы через 2-3 суток). Затем на скошенный агар Олькеницкого, где шигеллы вызывают изменение цвета (ферментируют глюкозу без газа).
Для дифференциации от других лактозонегативных проводят изучение биохимической активности. 2. Иммунологический (серологический) метод: если есть антитела в сыворотке, то наблюдается РНГА. Ставят также парные сыворотки. Увеличение титра в 4 и более раз свидетельствует об острой инфекции.
Общая характеристика E.coli (таксономия, морфология, тинкториальные свойства). Культуральные свойства. Эшерихии как возбудители внекишечных пиогенных инфекций (ГВИ): эпидемиология, факторы патогенности. Принципы лабораторной диагностики. семейство Enterobacteriaceae род Escherichia вид E.coli
Грамотрицательные прямые палочки размерами, в мазках располагаются одиночно, не образуют спор, перитрихи (редко неподвижны); большинство штаммов имеет микрокапсулу (некоторые – капсулу), реснички. Имеют Н, О , К –антигены и по ним делятся на более 200 сероваров. К-антиген маскирует О-антиген (феномен О-инагглютинабельности). О-антиген выявляется при разрушениее К-антигена кипячением.
Культуральные свойства: Факультативные анаэробы. Хорошо растут на простых питательных средах. На плотных средах образуют колонии в R- и S-формах (среда Эндо МакКонки – красные с металлическим блеском лактазоположительные колонии) На жидких средах образуют диффузное помутнение и придонный осадок (Мясопептонный бульон) Ферментация глюкозы с образованием кислоты и газа, ферментация лактозы, не образуют сероводород, продуцируют индол.
Эшерихии как возбудители внекишечных пиогенных инфекций (ГВИ): эпидемиология, факторы патогенности: (штаммы нормальной микрофлоры)
Инфекции урогенитального тракта: 1. P-пили уропатогенных штаммов E.coli для адгезии на эпителии урогенитального тракта 2. Контактная болезнетворность: адегзия вызывают активацию эпителиальных клеток, что приводит к секреции провоспалительных цитокинов и индукции воспаления Неонатальный менингит: 1. Капсула К1 типа – обеспечивают выраженную резистентность к опсонофагоцитарным реакциям Нозокомиальные (внутригоспитальные) инфекции: 1. Потенциальная инвазивность (наличие адгезинов, резистентность к опсонофагоцитарным реакциям и др.) 2. Эндотоксин
Принципы лабораторной диагностики: Бактериологический метод: материал при кишечных эшериозах – испражнения, при парентеральных – материал из соответствующего инфекционного очага (моча, отделяемое раны, кровь, ликвор). Материал засевают на дифференциальные лактозосодеражщие среды, после инкубации при 37 C отбираются колонии, которые подвергаются идентификации до видам и с определением их серологического варианта.
Эшерихии как возбудители острых кишечных инфекций (ОКИ). Основные экологические группы диареегенных эшерихий: энтеропатогенные, энтероинвазивные, энтеротоксигенные, энтерогеморрагические (факторы патогенности внутри группы, механизм патогенеза, тип диареи). Понятие об иммунодоминатном фенотипе.
Патогенные эшерихии отличаются от условно-патогенных возможностью синтеза факторов патогенности, которые генетически связаны с наличием островков патогенности, конвертирующих фагов и плазмид вирулентности. Вызывают остро-кишечные инфекции. 1. Энтеропатогенные Факторы патогенности: пили 4 типа (адгезины) Механизм действия: пили/адгезины служат каналами для поступления в клетку бактериальных эффекторных белков, которые вызывают изменение клеточного цитоскелета, что выражается в деполимеризации актина и потере микроворсинок. Потеря адсорбирующих ворсинок ведет к диарее секреторного типа за счет нарушения электролитного баланса и мальасорбции Тип диареи: функциональная (секреторная) диарея. 2. Энтероинвазивные Факторы патогенности: адгезины, способность к инвазии Механизм действия: проникают и размножаются в эпителиоцитах толстого кишечника, вызывая их деструкцию Тип диареии: деструктивная диарея (инвазивного типа). 3. Энтеротоксигенные Факторы патогенности: адгезины, термостабильный (ST) и термолабильный (LT) токсины Механизм действия токсинов: LT вызывает повышение внутриклеточного уровня циклического аденозинмонофосфата (цАМФ). ST усиливает синтез циклического гуанозинмонофосфата (цГМФ). Действие токсинов приводит к гиперсекреции электролитов и воды и вызывают диарею секреторного типа Тип диареи: функциональная (секреторная) диарея.
4. Энтерогеморрагические Доминантный иммунофенотип – O157:H7-серогруппа, ее штаммы имеют плазмиду (мол.масса 60 МДа), в которой расположены гены для ряда других потенциальных факторов вирулентности (энтерогемолизины), однако их значение в болезнетворности ЭГКП подлежит уточнению; Иммунофенотипирование — это идентификация и/или подсчет групп лейкоцитов при помощи моноклональных антител, которые образуются против антигенов клеточной поверхности. Эта процедура позволяет судить о их типе и функциональном состоянии (лейкозы). К зоонозной инфекции скорей всего относят (крупно-рогатый скот) Факторы патогенности: цитолизины (шигоподобный токсины, или веротоксины) Механизм действия: местный эффект (геморрагический колит) и системные эффекты (поражение почек, ЦНС, внутрисосудистый гемолиз). Токсины нарушают синтез белка, что ведет к некрозу клеток.
Общая характеристика рода Salmonella (таксономия, морфология, тинкториальные свойства). Культуральные свойства. S.enterica. Особенности внутривидовой классификации. Спектр заболеваний, вызываемых сальмонеллами. Сальмонеллы - возбудители пищевой токсикоинфекции (гастроэнтерита): факторы патогенности, патогенез, постинфекционный иммунитет. Семейство Enterobacteriaceae Род Salmonella Вид S. enterica Серовары: 1) S. typhi – брюшной тиф 2) S. parathyphi A, S. parathyphi B – Паратиф А , Паратиф Б 3) S. enteritidis - сальмонеллез
Морфология и тинкториальные свойства: Грамотрицательные подвижные палочки. Капсулу не образуют. Спор не образует. Перетрихи (множественные пили и жгутиков). Культуральные свойства: Факультативные анаэробы. Хорошо растут на простых питательных и желчесодержащих средах. На среде Эндо – бесцветные лактозонегативные колонии. Селективные среды – среда Плоскирева, сальмонелла-шигелла агар, висмут-сульфит агар и др. На среде Эндо сальмонеллы образуют бесцветные, иногда розоватые прозрачные колонии, на среде Плоскирева – бесцветные, мутноватые. На висмут-сульфит агаре S. typhi и S. paratyphi В образуют черные колонии с металлическим блеском.
Особенности внутривидовой классификации: Вид S. enterica разделяется на 5 серогрупп - A, B, C, D, E и на более чем
2000 серотипов на основании О - (липополисахарид наружной
мембраны) и Н- (жгутикового) антигенов. Антигенная структура. Классификация по Кауфману-Уайту:
О-антиген – термостабильный ЛПС наружной
мембраны; по его специфичности выделяют
серогруппы
Н-антиген – термолабильный жгутиковый белок
флагеллин, может существовать в двух фазах (его синтез кодируется двумя независимым генами, работа одного исключает работу другого); по
его специфичности выделяют серовары
У Сальмонеллы Тифи в микрокапсуле есть Vi-антиген, который препятствует агглютинации культур сальмонелл (экранирование) и ингибирует действие сывороточных белков, блок комплемента (фактор патогенности) + O-инагглютинабельность.
В основе этой классификации лежит подразделение сальмонелл на серологические группы по общности строения O-антигена и внутри серогруппы – на серовары в соответствии с различиями в строении H-антигена: S.paratyphi A Серогруппа: A
По O-антигену: 1, 2, 12 По H-антигену: фаза 1 – а , фаза 2 –
S.paratyphi B Серогруппа: B
По O-антигену: 1, 4, 5, 12 По H-антигену: фаза 1 – b , фаза 2 – 1, 2
S.choleraesuis/S.paratyphi C Серогруппа: С1
По O-антигену: 6, 7/6, 7 (Vi) По H-антигену: фаза 1 – c , фаза 2 – 1, 5
S.enteritidis/S.typhi Серогруппа: D1
По O-антигену: 1, 9, 12/9, 12 (Vi) По H-антигену: фаза 1 – g, m/ d , фаза 2 –
Спектр заболеваний, вызываемых сальмонеллами:
В зависимости от источника инфекции, путей передачи, особенностей патогенеза и форм проявления инфекционного процесса среди заболеваний, вызываемых сальмонеллами, различают системные инфекции (S.typhi – брюшной тиф; S.paratyphi A/B – паратиф А и Б; сальмонеллезные гастроэнтериты – много возбудителей: S.enteritidis/S.choleraesuis/S.typhimurium и др.; госпитальный (нозокоминальный) сальмонеллез – полиантибиотикорезистентные штаммы S.enteritidis/S.choleraesuis/S.infans и др.
Сальмонеллы - возбудители пищевой токсикоинфекции (гастроэнтерита): факторы патогенности, патогенез, постинфекционный иммунитет:
Факторы патогеннности: Факторы адгезии: Пили, белки наружной мембраны
Факторы инвазии: Белки наружной мембраны-
инвазины способствуют трансцитозу через м-клетки
Антифагоцитарные: белки наружной мембраны,
супероксиддисмутаза – влияет на способность сохраняться и размножаться в макрофагах
Эндотоксин – в случае бактериемии вызывает развитие лихорадки, при критической концентрации в кишечники активирует каскад арахидоновой кислоты, в результате увеличивается синтез ПГ и как следствие повышается уровень цАМФ, приводяий к нарушению водно-солевого баланса кишечника и развитию диареии.
Экзотоксины: LT и ST симулируют активность
аденилатциклазы и отвечают за секреторную
диарею

Механизм и путь передачи: больной и носитель , фекально оральный, входные ворота это тонкий кишечник Иммунитет при сальмонеллезах непродолжительный, ненапряженный, серовароспецифический.
Возможны повторные заболевания, а также формирование длительного бактерионосительства.
Сальмонеллы - возбудители брюшного тифа и паратифов. Эпидемиология (источники инфекции, механизм передачи). Факторы патогенности S.Typhi. Патогенез брюшного тифа. Специфическая профилактика. Принципы лабораторной диагностики брюшного тифа.
S. typhi – брюшной тиф S. parathyphi A, S. parathyphi B – Паратиф А , Паратиф Б
Эпидемиология:
Антрпонозы (только человек). Источник инфекции – больной или бактерионоситель.
Путь передачи – фекально-оральный, алиментарный. Основную роль играет фекальное загрязнение источников водоснабжения. Случаи заболевания брюшным тифом наблюдаются в течение всего года, но
пик заболеваемости приходится на конец весны – лето
Факторы патогенности: Фимбрии и белки наружной мембраны – факторы
Адгезии + микрокапсула;
Эндотоксин (ЛПС) – лихорадка, сыпь;
Антифагоцитарный фактор - Vi антиген, капсульный полисахарид, подавляет комплемент Третья секреторная система – отвечает за проникновение в клетку, предотвращает переваривание МБ внутри клетки
Патогенез:
После попадания в ЖКТ часть сальмонелл погибает в кислом содержимом желудка; часть попадает в тонкий кишечник
После адгезии сальмонелла захватывается М-клеткой и
транспортируется в подслизистую в лимфоидные клетки (Пейеровы бляшки)
Благодаря антифагоцитарным факторам сальмонелла размножается в лимфоцитах и попадает в лимфоток, далее в кровоток; = Инкубационный период
В крови часть сальмонелл будет разрушена (факторы естественной резистентности) и высвободится эндотоксин = Начало заболевания
Оставшиеся сальмонеллы проникают в органы ретикуло-эндотелиальной системы, где клеточный иммунный ответ приведет к развитию гранулем;
В печени сальмонеллы по желчным протокам достигают желчного пузыря, где активно размножаются (и могут сохраняться годами);
С порциями желчи сальмонеллы вновь попадают в тонкий кишечник, но взаимодействуют уже с сенсибилизированной слизистой;
Результатом станет гибель энтероцитов и изъязвление слизистой;
В течение примерно 3 недель язвы зарубцовываются, и наступает выздоровление;
Возможные осложнения – перфорация кишечника, кишечное кровотечение, метастатические абсцессы.
(из тетради) поглощение Тифи – по лимфе в мезентериальные л/у – лимфат.грудной проток (первичная бактериемия) – размножение в макрофагах (печень, селезенка, костный мозг) – желчный пузырь (холецистит, бактерионосительство) – по желчи реинфекция кишечника – тонкий кишечникк (антитела усиливают разрушения бактерий + макрофаги с Т-хелперами, а они стимулируют макрофаги) макрофаги разрушают эпителий при повторном попадании – воспаление, некроз Пейеровых бляшек – диарея, геморрагия, перфорация кишечника, выделение бактерий с фекалиями Вторичная бактериемия – лихорадка, сыпь, инфицирование других органов Специфическая профилактика: ВОЗ рекомендованы две вакцины: Живая пероральная вакцина – содержит живые Salmonella typhi штамм Ty21a (сальмонеллы
также доставляются в Пейеровы бляшки, но самоуничтожаются после 4-5 деления) Инактивированная брюшнотифозная химическая вакцина для в/мышечного введения
(содержит О-антиген и Vi-антиген) Специфической профилактики паратифов нет.
Принципы лабораторной диагностики брюшного тифа: Учитывая цикличность течения заболевания, материал для исследования и метод исследования определяется стадией течения болезни: 1 неделя Материал: кровь
Метод исследования: бактериологический (гемокультура) 2 неделя Материал: испражнения, моча Метод исследования: бактериологический (копрокультура, уринокультура) Конец 2-ой недели Материал: сыворотка Метод исследования: серологические методы 3 неделя Материал: испражнения, моча; сыворотка Метод исследования: бактериологический (копрокультура, уринокультура); серологические методы
Общая характеристика V. cholerae (таксономия, морфология, тинкториальные свойства). Внутривидовая классификация. Культуральные свойства. Экология и эпидемиология (резервуары инфекции и механизм передачи). Клинические проявления и возможные исходы заболевания. Специфическая профилактика.
семействоVibrionaceae
pод Vibrio
вид V. cholerae.
Морфология и тинкториальные свойства: Грамотрицательная палочка в форме запятой. Не образует спор и капсулы. Монотрих, чрезвычайно подвижный холерный вибрион.
Антигенная структура: обладает O- и H-антигенами. По O-антигену (типоспецифический) выделяют более 200 серогрупп, возбудителями холеры являются O1 и O139. Внутри серогруппы O1 идет деление на биотипы: классический и Эль-Тор, а они делятся на серотипы (серовары).В зависимости от сочетания A,B и C субъединиц O-антигена происходит подразделение на серовары (серотипы): Огава (AB), Инаба (AC) и Гикошима (ABC). H-антиген является общеродовым антигеном (видоспецифический)
Культуральные свойства: Факультативный анаэроб, но предпочитает аэробные условия роста, поэтому на поверхности жидкой питательной среды образует пленку. Растет на простых питательных средах. Для оптимального роста требуется 0,5 % NaCl. На среде 1% щелочной пептонной воде образует пленку через 6-8 часов, быстро растет (pH оптимум 8,5 – 9,0; T=37C) TCBS-среда (тиосульфат-цитратный сахарозо-желчесодержащий агар) – элективная среда, образует колонии желтого цвета Щелочной агар (твердая среда) используют для субкультивирования, образуют мелкие, прозрачные голубоватые колонии Биохимические свойства: Б/Х активны. Оксидазоположительны. Ферментируют глюкозу, сахарозу, крахмал, маннозу, лактозу (медленно). Обладает нитроредуктазной активностью. Холерный вибрионы различаются по чувствительности к бактериофагам. Классический вибрион лизируется бактериофагами 4 групы, вибрион биовара Эль-Тор – бактериофагами 5 группы. Дифференциация среди биоваров возбудителей холеры проводится по б/х свойствам, а также по способности гемолизировать эритроциты баран, агглют.куриных эритроцитов, чувствительность к полимиксину и чувствительность к бактериофагам.
Экология и эпидемиология (резервуары инфекции и механизм передачи):
Входные ворота: слизистая оболочка тонкого кишечника. Источник – больной человек или носитель, а также водная среда и гидробионты. Механизм и путь передачи: фекально-оральный, водный (основной), алиментарный, иногда контактный. Чувствителен к дезинфектантам (исключ.четвертич.амины), УФ-лучам, высушиванию, кислым значения pH, нагреванию и АБ. Высокая восприимчивость. Носительство Эль-Тора встречается чаще, чем классического. Антропонозно-сапронозная инфекция: Эль-Тор способен к существованию в воде в симбиозе с гидробионтами, водорослями и в неблагоприятных условиях может переходить в некультивируемую форму. Раньше был только в Индии, затем распространение вышло за пределы и достигло Европы и Америки. Человечество пережило 6 пандемий холеры, вызванных классическим биоваром. 7 пандемия была вызвана Эль-Тором, затем пандемия O139, у него измененная антигенная структура. Эпидемия этого штамма распространилась на другие страны, в том числе и на Россию.
Признак |
V. cholerae, классический биовар |
V. cholerae, биовар Эль-Тор |
Серогруппа О139 |
Гемолиз эритроцитов барана |
— |
+ |
— |
Реакция Фогеса-Проскауэра |
± (чаще –) |
± (чаще +) |
± (чаще +) |
Чувствительность к полимиксину В (50ЕД) |
+ |
— |
— |
Агглютинация куриных эритроцитов |
— |
± (чаще +) |
± (чаще +) |
Чувствительность к классическому монофагу |
+ |
— |
— |
Чувствительность к монофагу Эль-Тор |
— |
+ |
|
Клинические проявления и возможные исходы заболевания:
Инкубационный период 2ч-6 дней. Развивается остро, T=38-39 C, рвота, понос, боли в животе, тенеземы. Стул имеет вид рисового отвара. Резкое обезвоживание приводит к нарушениям деятельности сердечно-сосудистой и дыхательной систем, развитию почечной недостаточности (ДВС-синдром, сепсис, гиповолемический шок). При отсутствии лечения болезнь может перейти в стадию холерного алгида, характерным признаком является снижение температуры до 34 С. При отсутствии его лечения – летальный исход. При инфицировании и протекании болезни не происходит повреждения тканей, поэтому все системы органов полностью функциональны после излечения.
Специфическая профилактика: Применяют холерную убитую вакцину и комплексный препарат, состоящий из холергена-анатоксина и О-антигена сероваров Огава и Инаба. Выполнение санитарно-гигиенических требований и проведение карантинных мероприятий. Для лечения проводится патогенетическая терапия, направленная на нормализацию водно-солевого обмена, и этиотропная антибиотикотерапия.
Факторы патогенности V. cholerae. Генетические основы токсигенности. Экологически зависимая ко-экспрессия генов вирулентности. Характеристика холерогена (строение, механизм действия, клетки-мишени). Патогенез холеры. Принципы лабораторной диагностики холеры.
Главными факторами
патогенности являются холерный
энтеротоксин (СТ), токсин ко-регулируемые
пили (Тср), нейраминидаза и растворимая
гемагглютининпротеаза.
Пили
4 типа – обеспечивают
колонизацию микроворсинок тонкой кишки,
участвуют в образовании биопленок на
поверхности панциря гидробионтов,
являются рецепторами для конвертирующего
бактериофага СТХ
Холерный
энтеротоксин – белок, синтез которого
осуществляется геномом, локализованном
на бактериофаге СТХ (То есть, гены,
кодирующие холерный
токсин ( ctxAB ),
располагаются на участке хромосомной
ДНК. Этот участок называют элементом
CTX. У нетоксигенных штаммов элемент СТХ
отсутствует). Развитие холеры возникает
вследствие синергического эффекта
многих генов, включая гены колонизационных
факторов, прежде всего tcp
(токсин ко-регулируемые пили).
Координированная экспрессия
генов ctxAB
и tcp
контролируется в составе регулона
(несколько оперонов
(комплекс генов на участке генома,
кодирующих ферменты/белки, входящие в
одну функциональную группу или относящиеся
к этапам одного биохимического процесса
у прокариот), управляемых общим фактором)
тремя регуляторными генами toxS,
toxT
и toxR,
последний является глобальным
геном-регулятором. Его повреждение/отсутствие
у штаммов имеющих гены ctxAB
и tcp,
обусловливает слабую вирулентность
или авирулентность у холерного вибриона
и снижение продукции энтеротоксина и
пилей. Присутствие в геноме вибрионов
указанных генов и их эффективная
экспрессия обеспечивают развитие
инфекционного процесса при заражении
человека.
Таким образом, если внешний
фактор действуют на регулон, то происходит
ко-экспрессия группы генов, детерминирующих
несколько факторов (ко-экспрессия генов,
детерминирующих одновременный синтез
адгезинов Тср и экзотоксина у Vibrio
cholerae )
Токсин
состоит из 1 субъединицы A
( 2 полипептидные цепочки связанные
между собой дисульфидными мостиками)
и 5 субъединиц B
(5 одинаковых полипептидов связаны друг
с другом нековалентной связью в виде
кольца).
B
субъединицы ответственны за связывание
токсина с рецептором, которым является
мносиаловый ганглиозид GM1 (эпителиальные
клетки слизистой оболочки тонкой кишки).
Для того чтобы они провзаимодействовали
нужно отщепить сиаловую кислоту
нейраминидазой,
которая способствует реализации действия
токсина.
Затем субъединица A
проникает в клетку, активирует
аденилатциклазу делая ее постоянно
активной, следствием чего повышается
уровень синтеза цАМФ. Под ее влиянием
изменяется активный транспорт ионов.
В области крипт эпителиоцитами усиленно
выделяются ионы Cl-,
а в области ворсинок затрудняется
всасывание Na
и Cl,
что составляет осмотическую основу для
выделения в просвет кишечника
воды.
Растворимая
гемагглютинпротеаза
– важная роль в откреплении возбудителя
от поверхности кишечника в результате
ее деструктивного действия на рецепторы
кишечного эпителия, давая возможность
возбудителю инфицировать новые участки
тонкой кишки.
Эндотоксин
– активирует каскад арахидоновой
кислоты, запускает синтез ПГ, а их
результатом действия является сокращение
гладкой мускулатуры кишечника и развитие
тенезм. Угнетает фагоцитоз и понижает
кровяное давление + добавочные
белковые токсины
(zonulo
и энтеротоскины), которые участвуют в
увеличении проницаемости стенки
кишечника.

Принципы лабораторной диагностики холеры: Выделение и идентификация возбудителя. Материал: испражнения, рвотные массы, пищевые продукты, вода, гидробионты, смывы с объектов окр.среды. Бактериологический: накопление на щелочно –пептонной воде, затем посев на тиосульфат-цитратный-сахарозо-желчесодержащий агар (TCBS-агар) или просто на щелочной агар Серологический: развернутая Агглютинация на стекле с О1 и О139-сыворотками и изучается БХ активность и чувствительность к бактериофагам + ПЦР и РИФ для экспресс диагностики.
Общая характеристика рода Clostridium (таксономия, морфология, тинкториальные свойства, физиология, экология). C. difficile (таксономия, морфология, тинкториальные свойства), факторы патогенности. Патогенез заболевания. Принципы лабораторной диагностики и терапии.
Семейство Bacillaceae Род Clostridium (веретено) Морфология и тинкториальные свойства: Граммположительные (синие), форма бактерий может сильно изменяться под влиянием различных факторов (крупные палочки, кокки, нитевидные бактерии и т.д.) Все, кроме C.perfringes, подвижны, перитрихи. Не имеют капсул (исключ. C.perfringes). Споры округлой или овальной формы (поперечник споры больше поперпечинка клетки поэтому она со спорой похожа на веретено). Сапрофиты (процессы гниения и брожжения). Патогенные продуцируют высокоактивные экзотоксины.
Физиология: Облигатные анаэробы (живут только в условиях крайне низкого О2, в почве и кишечнике). На кровяном агаре клостридии образуют колонии, окруженные зоной полного или частичного гемолиза. На среде Вильсона-Блера (железо-сульфитный агар для патогенных анаэробов) в процессе роста клостридий сернокислый натрий восстанавливается с образованием сернистого железа. На этой среде C. perfringens образуют черные колонии. В среде Китта-Тароцци рост клостридий сопровождается помутнением среды и активным газообразованием. По сахаролитической и протеолитической активности разные виды клостридий различаются друг от друга. Наиболее характерным признаком для них является способность вызывать масляно-кислое брожение и анаэробный распад углеводов с образованием масляной кислоты и газов.
Экология: Являются почвенными сапрофитами (участвуют в процессах гниения и брожжения, питаются мертвыми органическими веществами). Обладают неодинаковой болезнетворностью. Лишь
немногие из них вступают в прижизненные контакты с человеком и животными, обладая
условной патогенностью. Присутствие болезнетворных клостридий в кишечнике (в том
числе человека) не может поколебать отношения к ним как к сапрофитам: здесь они тоже
питаются органическими остатками, не инвазируя живой ткани. Следует скорее говорить
о том, что клостридии охотно меняют независимый образ жизни на симбиоз,
перекладывая на хозяина заботы о взаимоотношениях с внешней средой. Оказавшись на
свободе, они не только выживают в виде спор, дожидаясь очередной вегетации в
организме хозяина, но и активно размножаются. Клостридии вызывают три смертельно опасных заболевания — газовую гангрену
(C. perfringens и другие гистотоксические клостридии), столбняк (C. tetani) и ботулизм (C.
botulinum). Кроме того, они причастны к патологии пищеварительного тракта, включая
относительно доброкачественные энтероколиты и деструктивные процессы, требующие
активного врачевания (С. perfringens, C. difficile). Патогенность связана со способностью
продуцировать мощные токсины, которые образуются в инфицированном организме или
во внешней среде (C. botulinum). Инвазивность почти всегда ограничена, и даже при
массивных поражениях (газовая гангрена) носит вторичный характер, следуя за
анаэробным повреждением тканей. Не случайно о клостридиях говорят как о
некропаразитах, подчеркивая их неспособность к размножению в живых, хорошо
снабжаемых кровью тканях.
C. difficile (таксономия, морфология, тинкториальные свойства): Семейство Bacillaceae Род Clostridium (веретено) Вид C.difficili Представляют собой спорообразующие грамположительные палочки, споры расположены субтерминально, подвижны. Некоторые штаммы образуют тонкую капсулу. Возбудитель обладает жгутиковыми АГ и соматическими АГ клеточной стенки. Антигенными свойствами обладают токсины. C. difficile имеют общий для всех штаммов антиген (фермент глютамат-дегидрогеназу), что используется для их видовой идентификации. Как и другие клостридиальные возбудители, это строгие анаэробы. Хорошо растут на кровяном агаре в анаэробных условиях. Гемолиза не дают. В качестве селективной и одновременно дифференциально-диагностической среды используют желточный цефокситин-циклосерин-фруктозный агар (ЦЦФА) с индикатором нейтральным красным. Антибиотики цефокситин и циклосерин подавляют рост большинства сопутствующей микрофлоры. Через сутки культивирования обнаруживается рост округлых желтых колоний (разлагают фруктозу) среднего размера с характерным резким запахом. Способны ферментировать многие углеводы (глюкозу, фруктозу, маннитол и др.) Разжижают желатин.
Сочетание ферментации маннитола с разжижением желатина отличают C. difficile от других клостридий. Факторы патогенности: Возбудитель псевдомембразнозного колита. Основная причина заболевания – применение антибиотиков. Экзотоксин A – обладает энтеротоксичность, является причиной развития диареи. Апоптоз энтероцитов под действием токсина ведет к повышению проницаемости кишечного эпителия. Стимулирует продукцию провоспалительных цитокинов и хемокинов клетками кишечника, что приводит к инфильтрации кишечной стенки нейтрофилами и лимфоцитами с развитием активного воспаления. Экзотоксин B – цитотоксин, вызывает воспаление тканей в кишечнике. Активирует апоптоз энтероцитов и стимулирует разрушение межклеточных соединений в кишечном эпителии. Госпитальные штаммы C. difficile часто проявляют множественную устойчивость к антибиотикам.
Патогенез: Механизм передачи фекально-оральный. Важным фактором передачи инфекции является контаминация рук медперсонала возбудителем. Основной фактор риска заболеваний – это пребывание пациента в стационаре и его лечение антибиотиками, в первую очередь β-лактамами широкого спектра действия (амоксициллин, ампициллин, цефалоспорины) Пусковым фактором процесса является антибиотикотерапия. Препараты подавляют нормальную микрофлору толстого кишечника, резко уменьшают его колонизационную резистентность и создают условия для адгезии и дальнейшего активного размножения C. difficile. Возбудитель колонизирует эпителий толстого кишечника, размножается и выделяет токсины. Их прямой цитотоксический эффект, а также действие факторов воспаления приводят к разрушению эпителия и нижележащих слоев. Воспалительный процесс ведет к появлению фибринозных отложений в стенке кишечника (отсюда «псевдомембранозный колит»). Повреждение клеток и повышение проницаемости эпителия ведет к накоплению жидкости в просвете кишечника, нарушение всасывания углеводов и реабсорбции ионов приводит к развитию осмотической диареи. Диарея может быть геморрагической, что обусловлено кровоизлияниями в кишечную стенку и просвет кишечника. При возникновении псевдомембранозного колита появляется лихорадка, лейкоцитоз, воспаление прогрессирует вплоть до перфорации кишки и развития перитонита, что может привести к летальному исходу. Возможны рецидивы заболевания. Для новорожденных детей, у которых еще не сформировался нормальный микробиоценоз в кишечнике, характерна высокая высеваемость токсигенных штаммов C. difficile (иногда свыше 50%). Однако заболевания у них обычно не развиваются, что связывают с отсутствием рецепторов для токсинов возбудителя.
Принципы лабораторной диагностики и терапии: Материалом для исследования являются фекалии. Проводят бактериологическое исследование, выделяя возбудителя на чистую культуру; а также определяют наличие токсинов A и B в фекалиях методом ИФА (обнаружение общего АГ возбудителя – фермента глютамат-дегидрогеназы) Для лечения используют ванкомицин, метронидазол. Отменить предшествующие антибиотики. Специфическая профилактика отсутствует, неспецифическая сводится к проведению рациональной антибиотикотерапии и предупреждению развития дисбактериоза кишечника.
Основные возбудители газовой анаэробной инфекции. Экология и эпидемиология возбудителей. Факторы патогенности C.perfringens. Патогенез заболевания. Особенности специфического и этиотропного лечения.
Возбудителей газовой гангрены принять делить на три группы: первая является более патогенной и может вызвать газовую гангрену (C.perfringens, C.novyi и C.septicum). Вторая менее патогенная (C.histolyticum) и третья маловирулентна и не способна вызвать развитие газовой гангрены (C.tertium). По спектру продуцируемых токсинов различают пять серотипов C.perfringes
— A, B, C, D, E
Экология и эпедимиология: Источником клостридиальной инфекции являются человек и животные, в желудочно-кишечном тракте которых обитают клостридии. Естественным резервуаром инфекции и фактором передачи служит инфицированная почва. Механизм заражения – контактный. Путь передачи – раневой. Входные ворота инфекции – поврежденная кожа. Характерно быстрое распространение болезненного отека мягких тканей с их разрушением и общей интоксикацией организма. Накапливаются газообразные продукты и вызывают зловонный запах.
Восприимчивость человека к анаэробной клостридиальной инфекции высокая, заболеваемость значительно возрастает во время военных действий. В мирное время основными группами риска являются работники сельского хозяйства, строительные и дорожные рабочие.
Факторы патогенности C.perfringens: Альфа-токсин (фосфолипаза С, лецитиназа) - продуцируют только
клостридии типа А. Разрушает мембраны миоцитов, вызывая цитолиз.
b-Токсин обладает выраженным некротическим действием на ткани, вызывает некротический энтерит (Тип D) Энтеротоксин – вызывает пищевые отравления; нарушает проницаемость слизистой тонкого кишечника (A, C, D) Тета-токсин, или перфринголизин (чувствительный к кислороду гемолизин, похожий на О-стрептолизин стрептококка) - повышает проницаемость капилляров, обладает цитотоксической активностью в отношении миокардац (тип A) Эпсилон-токсин – увеличивает сосудистую проницаемость ЖКТ Йота-токсин – некротизирующая активность и усиление сосудистой проницаемости ДНКаза или ню-токсин Коллагеназа или каппа-токсин Гиалуронидаза или мю-токсин
Патогенез: 1)Попадание спор в рану 2)При создании анаэробных условий – прорастание спор в вегетативные формы 3)Выработка ферментов и экзотоксинов Местное действие: отек и сдавление тканей; некроз тканей (мышцы – вид вареного мяса); газообразование с гнилостным запахом (крепитация, расслоение мышц)
Общее действие ( токсинемия ) : выраженная интоксикация, нейротоксическое действие токсинов
Особенности специфического и этиотропного лечения: Лечение заключается в обработке ран, раннем введении с профилактической целью поливалентной антитоксической очищенной концентрированной сыворотки по 10 тыс. ME. С лечебной целью эту дозу увеличивают в 5 раз (по 50 тыс. ME каждой сыворотки) и применяют антибиотики. Лечение только одной сывороткой не дают нужного эффекта, комплексное применение антитоксической сыворотки и антибиотиков снижают летальность.
Общая характеристика C. tetani (таксономия, морфология, тинкториальные свойства, экология). Характеристика токсина (строение, мишени, механизм действия). Патогенез и клинические проявления столбняка. Специфическая терапия и профилактика (экстренная и плановая) заболевания.
Семейство Bacillaceae Род Clostridium (веретено) Вид C.tetani Столбняк — острое инфекционное заболевание из группы раневых анаэробных инфекций, характеризующееся поражением нейротоксином двигательных клеток спинного и головного мозга, что проявляется в виде судорог поперечнополосатой мускулатуры. Грамположительная подвижная палочка с закругленными концами. Образует круглые терминальные споры. Перетрих. Строгий анаэроб, чувствителен к кислороду. Капсулы нет. Хорошо растет в глубоких пробирках жидких питательных средах. Антигенная структура неоднородна и определяется наличием термолабильных жгутиков H-антигенов и групповых соматических O-антигенов. По H-антигену 10 сероваров. Штаммы всех сероваров вырабатывают один и тот же токсин, который полностью нейтрализуется противостолбнячной сывороткой, полученной при иммунизации животных токсином любого штамма.
Характеристика токсина (строение, мишени, механизм действия): Главным фактором патогенности является сильнейший экзотоксин, состоящий из двух фракций: Тетаноспазмин ( нейротоксин ) – полипептид, играет ведущею роль в патогенезе столбняка (см. ниже). Данный токсин разрушает нейробелки пресинаптических мембран преимущественно во вставочных нейронах ЦНС. Продукция тетаноспазмина кодируется плазмидными генами, отсюда разные штаммы возбудителя значительно отличаются по вирулентности. Тетанолизин ( цитотоксин ) – проявляет гемолитическое, кардиотоксическое и летальное действия, вызывает развитие местных некротических поражений. Растворяет эритроциты. Способен поражать также вегетативную нервную систему и ядра продолговатого мозга, что может вызывать метаболические нарушения, гемодинамические расстройства, приводить к отеку мозга, некрозу в мышцах. В патогенезе заболевания играет менее важную роль.
Патогенез и клинические проявления столбняка: 1) Попадание спор в рану 2) При создании анаэробных условий – прорастание спор в вегетативные формы (возбудитель не покидает рану, т.к. лишен инвазивности ) 3) Выработка экзотоксинов : тетаноспазмина, тетанолизина 4) Тетаноспазмин фиксируется на поверхности отростков нервных клеток, проникает в них (за счёт эндоцитоза ) и путём ретроградного аксонного транспорта достигает мотонейронов ЦНС 5) Подавление высвобождения тормозных нейромедиаторов ( глицина и ГАМК ) в синапсах 6) Усиливается некоординированное поступление двигательных импульсов от мотонейронов к мышцам через нервно-мышечные синапсы 7) Постоянное тоническое напряжение скелетной мускулатуры и периодические тетанические судороги в ответ на различные раздражители 8) Поражение дыхательного и сосудодвигательного центров Первыми симптомами столбняка являются мышечные боли и напряженность мышц на месте ранения или травмы, затем наступают напряжение и тризм жевательных и мимических мышц лица «Сардоничиеская улыбка». Постепенно нарастает ригидность, спазмы и судороги мышц грудной стенки, живота и конечностей (нисходящий столбняк). Все мышцы напряжены, тело вытягивается, становится совершенно прямым и неподвижным – «столбняк» Развиваются судороги мышц, которые возникают при малейшем раздражении: легком стуке, вспышке света, дуновении ветра и т.д. T=39-42 C, смерть наступают при асфиксии. Основные симптомы представляют собой прямое следствие поражения двигательных нервных центров, спинного и головного мозга. Токсин поступает в ЦНС по периферическим двигательным нервам и эндоневральным периферическим сосудам.
Специфическая терапия и профилактика (экстренная и плановая) заболевания: Плановая: в соответствии с календарем прививок: детей вакцинируют с 3 месяцев жизни 3-кратно с интервалом 1,5 месяца вакциной АКДС (адсорбированная коклюшно-дифтерийно-столбнячная вакцина). Вторая ревакцинация проводится в 6 лет, третья ревакцинация – в 16 лет вакциной АДС – М. Последующие ревакцинации проводят каждые 10 лет ассоциированными препаратами (АДС или АДС-М)
Экстренная: Первичная обработка раны и одновременная специфическая иммунопрофилактика. В зависимости от предшествующей привитости пациентов различают 3 варианта: 1. пассивную иммунизацию противостолбнячной лошадиной сывороткой ( вводят по Безредке – дробный метод, чтобы не было аллергии ) или противостолбнячным иммуноглобулином человека 2. активно-пассивную профилактику, состоящую из одновременного введения противостолбнячной сыворотки или иммуноглобулина и АС-анатоксина ; 3. экстренную ревакцинацию АС-анатоксином для стимуляции иммунитета у ранее привитых лиц.
В целях профилактики осложнений применяют также антибиотики. Лечение: рану обкалывают противостолбнячной лошадиной сывороткой, затем проводят тщательную ревизию и хирургическую обработку раны с широкими лампасными разрезами (для создания аэробных условий), удалением инородных тел, некротизированных тканей. Для нейтрализации столбнячного экзотоксина в кровотоке однократно вводят внутримышечно 50 000 МЕ противостолбнячной сыворотки с предварительным проведением пробы по Безредке или 1500 - 10 000 ЕД (средняя доза 3000 ЕД) специфического иммуноглобулина.
Общая характеристика C. botulinum (таксономия, морфология, тинкториальные свойства, экология). Характеристика токсина (варианты, строение, мишени, механизм действия). Условия накопления токсина в пищевых продуктах. Патогенез заболевания, клинические проявления ботулизма. Принципы лабораторной диагностики и специфического лечения.
Семейство Bacillaceae Род Clostridium (веретено) Вид C.botulinum Морфология и тинкториальные свойства: Грамположительная палочка с закругленными концами. Спора располагается субтерминально (похож на теннисную ракетку). Перитрих. Очень подвижные и могут в виде спорт жить даже в безвоздушном пространстве. Строгий (облигатный) анаэроб. Нет капсулы. 8 серологических вариантов ботулинического токсина — A, B, C1, C2, D, E, F, G. Токсины С, D и Е закодированы в умеренных фагах, остальные — в хромосоме.
Культуральные свойства: Облигатный анаэроб, культивируются на кровяном агаре (неправильной формы отростки окруженные зоной гемолиза) и средах для анаэробов (Китта-Тароцци – выпадение в осадок, запах прогорклого масла). На желатине образуют прозрачные колонии, которое в дальнейшем становятся мутными с отростками в виде шипов.
Экология: Резервуаром возбудителей ботулизма в природе являются теплокровные, реже холоднокровные, животные, в кишечнике которых находятся клостридии, выделяющиеся с испражнениями во внешнюю среду. Сам возбудитель не вызывает заболевание, вызывает его токсин. Для этого нужно его размножение возбудителя с накоплением ботулотоксина в среде с маленьким количеством кислорода (ветчина, колбасы, консервы, соленая рыба), а также в консервированных овощах, фруктах, грибах. Источник – кишечник травоядных, рыб, ракообразных. Споры могут быть в воде, почве. Механизм и путь передачи – перорально: фекально-оральный ? , алиментарный. Резистентны к высокой температуре. C. botulinum обитают в кишечнике животных, рыб, молллюсков, раков, оттуда попадают в почву с фекалиями. Споры клостридий длительное время находятся в окружающей среде без потери жизнеспособности.
Для размножения возбудителям необходимы анаэробные условия. Такие условия создаются при консервировании грибов, приготовлении мясных и рыбных и консервов, особенно в домашних условиях.
Характеристика токсина (варианты, строение, мишени, механизм действия): 8 вариантов соотвественно ( A –высокая летальность) Главный фактор патогенности – экзотоксин (один из самых сильных ядов, известных человечеству) Токсин состоит из 2-ух субъединиц: одна отвечает за адсорбцию на рецепторах чувствительных клеток, другая – за проникновение внутрь путем эндоцитоза. Проникнув из кишечника в кровь, токсин поступает в периферические нервные окончания, где блокирует слияние синаптических пузырьков с мембраной. Токсин термолабилен и легко разрушается при кипячении. Этот фермент с высокой специфичностью гидролизует белки пресинаптических мембран нейромышечных синапсов (везикуло-ассоциированный протеин, синаптобревин, целлюбревин и др.). При этом блокируется накопление и выделение нейромедиатора ацетилхолина, что приводит к нисходящему мышечному параличу. Наличие генов, кодирующих экзотоксин ботулизма, связано с наличием бактериофага в геноме бактерий. Отсюда изредка ботулизм может вызываться и другими родственными видами клостридий – C. baratii и C. butyricum, имеющими данные гены.
Патогенез: Алиментарный путь передачи приводит к развитию пищевого ботулизма – наиболее частой формы болезни. Редко возможен раневой ботулизм. Эта форма возникает при загрязнении некротизированных тканей раны почвой.
Представляет опасность ботулизм новорожденных. Он связан с длительным выживанием возбудителя в кишечнике детей до 6 месяцев жизни, где отсутствует полноценная нормальная микрофлора. В этом случае возбудитель продуцирует токсин непосредственно в кишечнике.
Ботулинический токсин обладает нейротропностью. Он попадает с пищей в кишечник и адсорбируется на клетках эпителия. После активации под действием протеаз быстро всасывается через стенку желудка и тонкого кишечника в кровь и обусловливает длительную токсинемию. Токсин накапливается в периферических нервных окончаниях мотонейронов передних рогов спинного мозга и бульбарных отделов ЦНС. При этом он попадает в нервно-мышечные синапсы и ингибирует кальций-зависимое освобождение ацетилхолина. В результате наступает симметричный вялый нисходящий паралич мышц.
Клинические проявления: Зависят от вида пищевого продукта (отравленного) и от резистентности макроорганизма. Начинается остро и протекает по типу пищевой интоксикации, в дальнейшем поражаются бульбарные нервные образования, нарушается зрение, возникает асфиксия. Летальность 60% - больной может погибнуть от паралича дыхательных мышц и сердечной недостаточности. При попадании в рану возникает раневой ботулизм, который проявляется по типу пищевой интоксикации. У новорожденных возбудитель проникает через пупочный канал. Кроме поражения ЦНС, ботулотоксин вызывает периферические нарушения нервно-мышечной передачи, которые проявляются вялостью движений, развитием параличей мышц (глазных, глоточных, гортанных, шеи, конечностей, диафрагмы).
При воздоровлении от ботулизма происходит постепенная медленная регенерация синапсов пораженных нейронов.
Принципы лабораторной диагностики и специфического лечения: Биологический метод: Для идентификации токсина используют классическую реакцию нейтрализации на мышах и РНГА с антительным диагностикумом (РОНГА) и ИФА. Методы выделения культур C.botulinum принципиально сходны с таковыми при выделении других патогенных клостридий. Бактериологический метод: Материал засевают на среду Китта-Тароцци, далее производят пересев в высокий столбик сахарного агара, а затем идентифицируют культуру. В реакции нейтрализации определяют экзотоксин. Токсигенность культуры может быть подтверждена при помощи ПЦР.
Больным с ранними признаками ботулизма, а также лицам, принимавшим зараженную пищу, вводят гетерологичную противоботулиническую антитоксическую сыворотку. Когда неизвестен серовар токсина, вводят поливалентную сыворотку против токсинов А, В, С, Е, а после определения типа экзотоксина – соответствующую моновалентную.
Комплексное лечение ботулизма включает промывание желудка и другие методы детоксикации, инфузионную терапию, при необходимости выполняется искусственная вентиляция легких. Антибиотики неэффективны.
Для специфической профилактики возможно применение анатоксинов типов А, В, Е, в том числе в составе ряда ассоциированных вакцин + экспериментальный препарат Botox™. Постинфекционный иммунитет отсутствует (протективный не формируется). Антитела, которые вырабатываются в течение заболевания, направлены против определенного серовара токсина.
Общая характеристика B.anthracis (таксономия, морфология, тинкториальные свойства). Культуральные свойства. Экология возбудителя, принцип и механизмы передачи инфекции. Факторы патогенности, характеристика полифункционального токсина. Основные клинические формы сибирской язвы, исходы инфекции. Принципы лабораторной диагностики и специфической профилактики.
Семейство Bacillaceae
род Bacillus Вид Bacillus anthracis (Сибирская язва)
Морфология и тинкториальные свойства: Гр+, палочки с обрубленными концами, располагаются длинными цепочками (стрептобациллы), образуют эндоспоры (центральное расположение), не имеет жгутиков, есть капсула, неподвижны. Аэробы. Сапроноз (споры могут годами жить в почве, трупах, мерзлоте и факторы окр.среды играют важную роль в передаче заболевания). Антигенная структура: О-АГ (группоспецифический – родовой соматический полисахардный антиген) и К-АГ (видоспецифический – белковый капсульный антиген), протективный АГ, связанный с белковым экзотоксином. Капсульные антигены полипептиды, соединенные с молекулами D-глутаминовой кислоты. К-АГ и экзотоксин кодируются плазмидами, потеря которых делает бактерии авирулентными. Культуральные свойства: Аэробы. Хорошо растут на простых питательных средах. Можно выращиваться на сыром или вареном картофеле, соломе, экстрактах злаков и бобовых. T=35-37 C на плотной, 32-33 C на жидкой. pH 7,2-8,6. На плотных среда образуют крупные, с неровными краями, шероховатые матовые колонии (R-форма). На жидких средах дают придонный рост в виде комочка ваты, не вызывая помутнения среды. Под лупой колони имеют коричневый бугристый цвет в центре и светлую периферию и окруженную кайму образованную пучками нитей клеток. Напоминает гриву льва или голову медузы (колонии крупные, белые и шероховатые). На свернутой лошадиной сыворотке дают S-формы, а R-форма патогенная для человека. На средах содержащих пенициллин образуют сферопласты, расположенные цепочкой и напоминающее «жемчужное ожерелье» (разрушается клеточная стенка)
Бактерии способны продуцировать гемолизин, но на кровяном агаре гемолиз либо отсутствует, либо проявляется очень медленно. (Для диагностики используют кровяной агар – гемолиз отсутствует).
Выраженная сахаролитическая и протеолитическая активность. Гидролизуют крахмал. Разлагает глюкозу, лактозу и мальтозу до кислых продуктов без газообразования. Экология: Входные ворота – поврежденная кожа и слизистые.
Экологической нишей являются крупный рогатый скот (овцы, козы, лошади, олени, свиньи, верблюды, буйволы) Источник инфекции – больные животные (крупный рогатый скот). Человек является биологическим тупиком. Как для всех зоонозов характерна множественность механизмов передачи: чаще контактный, реже алиментарный, фекально-оральный, трансмиссивный, аэрогенный (воздушно-пылевой) и другие пути при уходе за животными, убое, переработке мяса и его употреблении. Восприимчивость относительно невысокая.
Факторы патогенности, характеристика полифункционального токсина: Пептидная капсула – обладает антифагоцитарной активностью (синтезируется большое количество) Экзотоксин - Токсин состоит из 3 структурных компонентов, выполняющих разные функции:
Отечный фактор (EF) – проявляет эффект аденилатциклазы, повышает концентрацию цАМФ и вызывает отеки;
Протективный антиген (PA) – защитные свойства, иммуногенное действие;
Летальный фактор (LF) – проявляет цитотоксический эффект и вызывает отек легких, вызывает гиперпродукцию интерлейкинов. Эти компоненты по отдельности не способны проявлять токсическое действие. Эти факторы в основном и определяют вирулентность возбудителя.
Основные клинические формы сибирской язвы, исходы инфекции: Кожная форма. Заражение происходит через прямой контакт и укусы мух. Инкубационный период составляет 1-7 дней. У входных ворот возбудителя появляется красное пятно, переходящее в папулу медно-красного цвета, возникает зуд. Папула переходит в везикулу с серозным, затем геморрагическим содержимым. Образуется карбункул с черным струпом, присоединяется отек, интоксикация. Прогноз при своевременном лечении благоприятный. Легочная форма. Заражение происходит при аспирации (попадании возбудителя или его спор через верхние дыхательные пути). Инфицированные травоядные и почва – резервуар. Появляются катаральные явления со стороны верхних дыхательных путей, слезотечение, подъем температуры до 400С. Развивается пневмония, часто сменяющаяся токсическим отеком легких, в мокроте появляется кровь. Даже при назначении антибиотиков летальность при данной форме может превышать 40-50%. Без лечения возбудитель диссеминирует по организму, при этом летальность значительно увеличивается.
Орофарингальная и кишечная форма. Развивается редко. Возникает при алиментарном пути заражения (глотании). Характерными признаками являются лихорадка, озноб, рвота, диарея с кровью, боли в животе, на коже геморрагии. Смерть может наступить через 3-5 дней от начала заболевания. Летальность при данной форме составляет 25-60%
Принципы лабораторной диагностики и специфической профилактики: Бактериологический метод: материалом для исследования при кожной форме служит содержимое везикул, пустул, карбункула, отделяемое язвы или отторгнутый струп. Перед взятием материала кожу очищают спиртом вокруг пораженного места и берут содержимое стерильной
пипеткой. При кишечной форме берут испражнения больного. При легочной форме
материалом для исследования служит мокрота. Во всех случаях при подозрении на
сибирскую язву от больного следует взять кровь.
Изучение материала начинают с бактериоскопии. Из доставленного в лабораторию
материала (мокрота, кровь и др.) готовят мазки, окрашивают по Граму, Романовскому-
Гимзе.
Возбудитель сибирской язвы хорошо растет на питательных средах общего
назначения. Исследуемый материал засеивают на чашки с МПА или кровяным агаром.
Экспресс-диагностика: Для выявления антигенов в клиническом материале B. anthracis используется иммунофлюоресцентный анализ, ИФА, ПЦР.
Для профилактики используется вакцина сибиреязвенная живая сухая для накожного
или подкожного применения. Вакцинация производится двукратно с интервалом в 20-30
суток по эпидемиологическим или профессиональным показаниям, создает напряженный
иммунитет продолжительностью до 1 года.
Для лечения применяется гипериммунная противосибиреязвенная лошадиная сыворотка
и противосибириязвенный лошадиный иммуноглобулин. Сыворотка вводится подкожно,
дробно (во избежание анафилаксии).
Лабораторные методы санитарного и эпидемиологического контроля.
Реакция преципитации по Асколи. В шерсти, коже и органах животных, погибших от
сибирской язвы, содержится сибиреязвенный антиген, характеризующийся высокой
термостабильностью. В тех случаях, когда выделить возбудитель из исходного материала
трудно или невозможно (загрязненность материала, гнилостное разложение, термическая
обработка и т.д.), а также для целей санитарного контроля за поступающим на
производство животным сырьем широко применяют реакцию преципитации
(кольцепреципитации, термопреципитации) по Асколи.
Для выявления ДНК B. anthracis в органах животных и объектах внешней среды
используется метод полимеразной цепной реакции (ПЦР).
Общая характеристика C. diphtheriae (таксономия, морфология, тинкториальные свойства). Культуральные свойства. Характеристика основных биоваров. Эпидемиология дифтерии (механизмы и пути передачи), основные клинические проявления. Этапы диагностики дифтерии (определение токсигенности).
Семейство Corynebacteriaceae Род Corynebacterium (булава) Вид C.diphtheriae
Морфология и тинкториальные свойства: Грамположительные. Факультативные анаэроб или аэроб. Спор и капсул не образуют. Неподвижные, полиморфные палочки с булавидными концами (утолщены за счет наличия зерен волютина). По окраске Нейссера – зерна окрашиваются в коричневый цвет, а тело бактерий в желто-зеленый цвет. Очень устойчива во внешней среде (аж до 5 месяцев на предметах быта). Не обладает кислотоустойчивостью. Имеет микрокапсулу с входящим в ее состав корд-фактором. В состав клеточной стенки входит большое количество липидов + миколовые кислоты (некислотоустойчивые коринеформные). Характерен полиморфизм размеров и формы. В мазке напоминают латинские буквы L, X, V, Y или растопыренные пальцы рук. Это связанно с особенностью деления клетки, что отличает возбудителей дифтерии от других коринобактерий, которые раполагаются в микропрепаратах в виде частокола, не имеют зерен волютина или их слишком много. О-антиген – общий с микобактериями и нокардиями К-антиген – несколько десятков сероваров Антигенный состав дифтерийной палочки неоднороден и её серологическая классификация не общепринята. Культуральные свойства: Факультативный анаэроб. На простых питательных средах дифтерия не растет. Для первичного посева используют дифференциально-диагностические среды, содержащие гемолизированную кровь (барана, лошади и др.) и 0,03-0,04% теллурита калия или натрия, которые подавляют рост сопутствующей микрофлоры (среду Клауберга), на которых дифтерия образует колонии черного цвета (селективная среда). Для элективных сред используют сывороточный агар или свернутую кровяную сыворотку с добавлением сахарного бульона (элективная среда Ру – Леффлера). Он опережает в росте банальную микрофлору и вырастает в виде желтых колоний с гладкой или слегка зернистой поверхностью.
Характеристика основных биоваров:
Дифференциально-диагностические признаки дифтерии: не ферментируют сахарозу и не разлагают мочевину, продуцируют фермент цистиназу (расщепляет цистин до сероводорода, которые реагирует с уксуснокислым свинцом и вызывает почернение сывороточного агара с образованием сернистого свинца – положительная проба Пизу) Вид C.diphtheriae по культурально-биохимическим свойствам можно подразделить на 4 биовара: gravis, mitis, intermedius и belfanti, что важно с эпидемиологической точки зрения. В связи с тем что наиболее стабильным дифференцирующим признаком является тест на крахмал, по этому показателю все возбудители дифтерии делятся на два биовара: gravis (тяжелый) и mitis (облегченный). Штаммы не ферментирующие крахмал – mitis, а ферментирующие – биовар gravis. 1. gravis (R-формы): крупные, с неровным краем серые, гемолиз –, исчерченная поверхность
2. mitis (S-формы): мелкие круглые, с ровным краем, черные, гемолиз + (окружены зоной гемолиза)
Эпидемиология дифтерии (механизмы и пути передачи), основные клинические проявления:
Антропонозная инфекция. Источником инфекции являются больные и носители токсигенных штаммов C.diphtheriae. Заражение происходит воздушно-капельным путем – аэрозольным (не исключены контактно-бытовой и алиментарный пути передачи инфекции). Наиболее восприимчивы дети (непрямой путь через игрушки). Среди взрослых в риске работники общественного питания и торговли, школ, детских и медицинских учреждений.
Входными воротами являются слизистые оболочки ротоглотки – «дифтерийный круп» (небные миндалины и окружающие их ткани), носа, гортани, трахеи, а также слизистые оболочки глаз и половых органов, поврежденные кожные покровы, раневая или ожоговая поверхность, опрелости, незажившая пупочная ранка. Дифтерия ротоглотки чаще, это способствует воздушно-капельный путь передачи, тропизм к слизистой и барьерная функция лимфоидного глоточного кольца.
Токсинемическая инфекция (микроб в месте входных ворот, а клиника связана с действием белкового бактериального токсина). Проявления на системном уровне: структурные и функциональные поражения миокарда (основная причина летального исхода), демиелинизация нервных волокон (причина параличей и парезов), поражение почек (нефриты), поражение надпочечников (острая надпочечниковая недостаточность – ОНН) Высокая чувствительность к дифтерийному токсину миоцитов сердца и
нервных клеток объясняется повышенным содержанием в них гепаринсвязывающего
эпидермального ростового фактора.
Этапы диагностики дифтерии (определение токсигенности): Основной – бактериологический (больные с острыми воспалительными явлениями в носоглотке и с подозрением на дифтерию). Слизь и пленки из очагов воспаления, а также секрет из очагов патологического процесса. Для определения биовара дифтерийных палочек изучают ферментативную активность. Для определение биовара также возможно использовать ПЦР.
Самым важным критерием постановки диагноза «дифтерия» является определение
токсигенности чистой культуры в реакции преципитации по Оухтерлони (метод двойной
диффузии в агаре).
Полоску фильтровальной бумаги смачивают антитоксической дифтерийной сывороткой
и помещают на поверхность агара. На расстоянии 5-10 мм с обеих сторон в виде бляшек
засевают исследуемую культуру. О выделении токсина судят через 24-48 часов по появлению
полос преципитации между посевами культур и полоской фильтровальной бумаги.
Через 48 часов при наличии положительного результата в пробе на токсигенность и
данных определения ферментативных свойств может быть выдан окончательный положительный
ответ. Если через 24 часа обнаружены типичные палочки дифтерии, но проба на токсигенность
дала отрицательный результат, то исследование продолжают и ставят повторную пробу на
токсигенность с чистой культурой; она и является решающей, в этом случае дают ответ:
«Выделена палочка дифтерии, токсигенная (или нетоксигенная)».
Факторы патогенности C. diphtheriae. Дифтерийный токсин (строение, мишени, механизм действия). Генетические основы токсигенности. Дифтерия как мономолекулярная интоксикация, патогенез (проявления на местном и системном уровне). Постинфекционный иммунитет. Специфическая профилактика и специфическое лечение.
Пили – способствуют адгезии микробов в месте входных ворот инфекции Нейраминидаза – фактор распространения, отщепляет от поверхностных рецепторов сиаловую кислоту. Это модифицирует клеточную поверхность, подготваливая ее рецепторы для прикрепления дифтерийного токсина. Лиаза – расщепляет N-ацетилнейраминовую кислоту на пируват, который стимулирует рост C.diphtheriae Гиалуронидаза – расщепляет гиалуроновую кислоту соединительной ткани. В последствиии повышается проницаемость кровеносных сосудов и выход плазмы за их пределы, что ведет к отеку окружающих тканей. Дермонекротоксин – вызывает некроз клеток в месте локализации возбудителя. Вышедший за пределы сосудов фибриноген плазмы, контактирует с тромбокиназой и превращается в фибрин, что является сущностью дифтеритического воспаления.
Находясь внутри дифтеритической пленки они защищены от действия эффекторов иммунной системы макроорганизма. Размножаясь, они образуют в большом количестве основной фактор патогенности – дифтерийный гистотоксин.
Дифтерийный гистотоксин – синтезируется в виде единой полипептидной цепи (протоксина), который активируется под действием протеолитических ферментов, что ведет к образованию A – B-фрагментов токсина. Фрагмент B отвечает за специфическое взаимодействие с ганглиозидными рецепторами клетки и учавствует в образовании транспортного канала для фрагмента A. Активированный фрагмент A отвечает за токсичность.
Внутри пораженных клеток фрагмент A обладает ферментативной АДФ-рибозилтрансферазной активностью. Его мишень – фактор элонгации EF-2 (трансфераза-2), необходимый для построения пептидных цепей на рибосомах эукариотической клетки. Блокада фермента ведет к нарушению синтеза белка на стадии элонгации и гибели клеток в результате некроза. Дифтерийный гистотоксин обладает специфичностью действия, поражая клетки сердечно-сосудистой, нервной систем, почек и надпочечников.
Способность к продукции дифтерийного гистотоксина детерминирована tox-геном, локализованным в ДНК лизогенного фага. Заболевания вызывают только токсигенные штаммы. Нетоксигенный могут только персистировать в респираторном тракте человека. Бактериальная клетка сохраняет определенный контроль над токсинообразованием,
продуцируя особый белок, который в присутствии ионов железа (Fe2-) подавляет
транскрипцию tox-гена. Если содержание железа в среде падает ниже определенного
уровня, образование токсина усиливается. Дифтерия как мономолекулярная интоксикация, патогенез (проявления на местном и системном уровне): Дифтерия — заболевание человека, обусловленное дифтерийным токсином (ДТ), т. е. по своей сути мономолекулярная интоксикация Своевременное введение антител, нейтрализующих токсин (их вводят в виде антитоксической сыворотки или антитоксического иммуноглобулина), обрывает симптомы заболевания, а в опытах на животных предупреждает развитие местных поражений и смертельной интоксикации. Размножение бактерий почти всегда ограничивается слизистыми оболочками, не выходя за пределы эпителиального барьера. Однако токсин, секретируемый возбудителем, преодолевает этот рубеж и через регионарный лимфоидный барьер проникает в кровяное русло, поражая органы, которые наиболее интенсивно снабжаются кровью и содержат максимальное число рецепторов к токсину. Патогенез: Болезнь сопровождается выраженной интоксикацией, токсин распространяется лимфогенным и гематогенным путем, поражаются паренхиматозные органы, сердечно-сосудистая и центральная нервная системы. Увеличивается проницаемость сосудов, появляются местные отеки. При дифтерии зева может возникнуть отек слизистых гортани и голосовых связок, что приводит к асфиксии (удушью) и гибели больных без оказания срочной помощи. У входных ворот за счет выделения токсина и его цитопатического действия повреждаются эндотелиоциты, увеличивается проницаемость сосудистой стенки, усиливается экссудация.
Содержащийся в плазме фибриноген превращается в фибрин под действием тромбопластина из пораженных клеток. Развивается активное фибринозное (или дифтеритическое) воспаление, образуется плотно спаянный с подлежащими тканями налет, возникает регионарный лимфаденит.
Для локализованной формы характерен ограниченный очаг поражения, фибринозный налет на относительно бледных миндалинах, зеве, температура – 37,2-37,50С, интоксикация слабо выражена (дифтерия зева, носа, гортани, гораздо реже – глаз, кожи).
При генерализованная форме налеты выходят за пределы очага поражения, в процесс вовлекаются другие ткани и органы, температура 38-390С, интоксикация, головная боль, лимфоузлы болезненны, увеличены, поражаются миокард, почки, надпочечники, ЦНС, выражена интоксикация. Структурные и функциональные поражения миокарда (основная причина летального исхода); Демиелинизация нервных волокон (причина параличей и парезов) Поражение почек (нефриты); Поражение надпочечников (острая надпочечниковая недостаточность – ОНН)
Постинфекционный иммунитет: После перенесенного заболевания формируется длительный и напряженный гуморальный антитоксический иммунитет. В отличие от него, антибактериальный иммунитет при дифтерии ненапряженный и серовароспецифичный. Наличие антитоксического иммунитета не препятствует формированию носительства токсигенных штаммов C.diphtheriae. Специфическая профилактика и специфическое лечение: 1. Дифтерийный анатоксин. Входит в состав комплексной вакцины и анатоксина:
- АКДС (адсорбированная (на адъюванте) коклюшно-дифтерийно-столбнячный вакцина).
Вакцинация плановая, проводится трехкратно, начиная с 3-х месяцев.
- АДС (адсорбированный дифтерийно-столбнячный анатоксин) и АДС-М (для ослабленных
детей) используется для ревакцинации
2. Антитоксическая противодифтерийная сыворотка, получаемая путем гипериммунизации
лошадей дифтерийным анатоксином (для лечения).
Общая характеристика микобактерий (морфология, тинкториальные свойства), экологические группы. Признаки микобактерий, связанные с особенностями строения клеточной стенки. Культуральные свойства. Микобактерии, вызывающие туберкулез. Факторы патогенности M. tuberculosis.
Семейство Mycobacriaceae Род Mycobacterium Вид M.tuberculosis Все микобактерии по патогенности распределяются на 3 группы: - патогенные микобактерии (возбудители туберкулеза и лепры); - потенциально патогенные (атипичные) микобактерии (возбудители микобактериозов – патологических процессов, поражающих легкие, лимфатические узлы и кожу); - сапрофитные микобактерии (непатогенные). Туберкулез у человека может быть вызван следующими видами микобактерий: M. tuberculоsis (палочка Коха, человеческий вид - вызывает заболевание в 92% случаев), М. bоvis (бычий вид - вызывает заболевание в 5% случаев), М. аfriсаnum (промежуточный вид - вызывает заболевание в 3% случаев, особенно в Южной Африке). Морфология и тинкториальные свойства: Грамположительные. Выраженный полиморфизм (палочки длинные и тонкие, короткие и толстые, изогнутые с гомогенной или зернистой цитоплазмой). Неподвижны. Спор не образуют. Есть оболочка, напоминающая микрокапсулу. Клеточная стенка имеет сложное строение. Первичный каркас – связанные пептидогликаны. Его дублирует слой арабиногалактанов, формирующий полисахаридную строму клетки. Миколовые кислоты присутствуют в виде свободных сульфолипидов и корд-фактора (агглютинация бактерий происходит за счет поверхностных липидов), благодаря которому они растут в виде кос или жгутов (похож на мицелий грибов под микроскопом). Уникальность миколовых кислот делает их мишенью для химиопрепаратов. Поверхностный слой гликолипидов – микозиды (антигенные свойства). Липоарабиноманан – заякорен на плазматической мембране, пронизывает клеточную сетнку и выходит на поверхность. Его манозные радикалы (терминальные фрагменты) подавляют активацию Т-лимфоцитов, что ведет к нарушению иммуного ответа на микобактерии. Клеточная мембрана и слои клеточной стенки пронизаны каналами или порами для транспорта веществ.
Из-за большого количества липидов в клеточной стенке, содержащих миколовую кислоту, они плохо воспринимают анилиновые красители. Применяют окраску по Цилю–Нильсену, в основе принцип термокислотного протравливания (ярко-красных кислотоустойчивых палочек, расположенных поодиночке или небольшими скоплениями) (Высокое содержание липидов определяет спиртоустойчивость, щелочеустойчивость и кислотоустойчивость микобактерий, затрудняет окрашивание микобактерий обычными методами, обусловливает вирулентность и длительную сохраняемость микобактерий в окружающей среде. Кроме того, липиды экранируют бактериальную клетку, подавляют фагоцитоз, блокируют активность клеточных ферментов, а терминальные фрагменты липоарабиноманнана подавляют активацию Т-лимфоцитов и лейкоцитов. Благодаря полиморфизму могут образовываться различные морфовары, которые обладают низкой метаболической активностью и длительно персистируют в макроорганизме в макрофагах, они не чувствительные к противотуберкулезным препаратам. Но их реверсия может привести к их вирулентности и возникновению обострения заболевания).
К антигенным структурам относятся туберкулопротеины (основной химический компонент), углеводы и липиды. К ним образуются антипротеиновые, антиполисахаридные и антифосфатидные антитела. Туберкулопротеины являются основными носителями антигенных свойств. Высокотоксичны, вызывают развитие реакции гиперчувствительности IV типа.
Культуральные свойства: Облигатные аэробы. Мезофилы (умеренная температура). Растут медленно из-за наличия в клеточной стенке липидов, замедляющих обмен веществ с окружающей средой (медленный рост). Селективная среда Левенштейна-Йенсена для выращивания микобактерий: колонии сухие, морщинистые, крошащиеся, кремового цвета, с запахом опавшей листвы.
Резистентность: Из всех не образующих спор бактерий микобактерии являются самыми устойчивыми к действию неблагоприятных факторов окружающей среды. В высохшей мокроте больного микробные клетки сохраняют жизнеспособность и вирулентность в течение 5-6 месяцев. При кипячении погибают через 5-7 минут. Сухой жар выдерживают до 60 минут. На предметах больного сохраняются более 3 месяцев. В почве сохраняются до 6 месяцев, в воде – до 15 месяцев, в навозе – 2 года. При кашле, чихании, разговоре в выдыхаемом воздухе больного туберкулезом содержатся частицы диаметром около 10 мкм (капельные ядрышки). Жидкое содержимое таких частиц в атмосферном воздухе испаряется, поэтому подобные частицы длительное время остаются во взвешенном состоянии. Каждая частица может содержать от 3 до 10 клеток M. tuberculosis. Пылевые частицы меньше капельных ядрышек, способны повторно подниматься в воздух, находиться длительное время в дисперсном состоянии и обусловливать воздушно-пылевой путь инфицирования. При аэрогенном заражении частицы размером более 5 мкм задерживаются в полости носа, а мелкие частицы (около 1 мкм) могут достигать альвеол
Факторы патогенности: У бактерий отсутствуют факторы инвазии, токсины. Микобактерии захватываются макрофагами легких и размножаются в фагоцитах, избегая внутриклеточного переваривания. - корд-фактор (основной) – гликолипид клеточной стенки, вызывающий повреждение клеточных мембран (обусловливает “скученный рост” бактерий в жидких средах в виде извилистых тяжей);
- липиды – вызывающие появление многочисленных гигантских клеток;
- сульфатиды - усиливающие токсическое и антифагоцитарное действие корд-фактора, препятствующие слиянию фагосомы с лизосомой;
- липоарабиноманнан (LAM) – гетерополисахарид, подавляющий активацию Т-лимфоцитов и лейкоцитов, вызывающий секрецию макрофагами ФНО (под действием ФНО развивается лихорадка, отмечается снижение веса) и ИЛ-10 (тормозит пролиферацию Т-клеток);
- микозиды – специфические воска, образующие защитный экран на поверхности клетки.
Взаимоотношение M. tuberculosis с макрофагами. Этапы образования гранулемы и туберкула. Понятие о «первичном» и «вторичном» туберкулезе. Эпидемиология и патогенез «первичного» туберкулеза. Первичный туберкулезный комплекс, исходы инфекции.
Микобактерии захватываются макрофагами легких и размножаются в фагоцитах, избегая внутриклеточного переваривания. Микобактерии являются факультативными внутриклеточными паразитами и персистируют внутри макрофагов. Персистенция бактерий приводит к развитию хронического гранулематозного воспаления.
Этапы образования гранулемы и туберкула: 1. Попадание микобактерий в организм аэрогенным путем.
2. Поглощение бактерий макрофагами.
3. Формирование в макрофагах фагосом, внутри которых происходит размножение возбудителя. 4. Трансформация активированных макрофагов, внутри которых находятся живые микобактерии, в эпителиоидные клетки. Гибель части макрофагов с образованием казеозных некротических масс. 5. Слияние эпителиоидных клеток друг с другом и образование гигантских клеток Пирогова-Лангханса. 6. Окружение очага снаружи лимфоидными клетками, в том числе Т-лимфоцитами. 7. Отграничение гранулемы от здоровых тканей пролиферирующими фибробластами.
Таким образом, формирование гранулемы представляет собой реакцию гиперчувствительности замедленного типа (ГЗТ). Эпидемиология: Резервуаром и источником туберкулезной инфекции являются больные люди, животные и птицы. Основным источником инфекции является больной человек, распространяющий микобактерии (бацилловыделитель). В патогенезе первичного туберкулеза у детей наиболее значимыми являются пути первичного экзогенного инфицирования. При этом наиболее частым механизмом заражения является аэрогенный, а входными воротами – слизистая оболочка полости рта, миндалины, бронхи и легкие. При аэрогенном механизме заражение происходит как воздушно-капельным, так и воздушно-пылевым путем. Реже заболевание возникает при реализации алиментарного (мясо, молоко) (через пищеварительный канал), контактного и внутриутробного (трансплацентарного) пути передачи возбудителя, когда входными воротами служит слизистая оболочка кишечника или другие органы. Причем при алиментарном заражении для развития заболевания требуется значительно большее количество возбудителя, чем при аэрогенном инфицировании. Иногда наблюдается заражение контактно-бытовым путем через поврежденные кожные покровы и слизистые оболочки при использовании предметов больного человека (одежды, посуды, книг и др.) или при уходе за больными животными Туберкулез распространен повсеместно. Росту заболеваемости туберкулезом способствуют неблагоприятные социально-экономические факторы и широкое распространение штаммов с множественной устойчивостью к антибиотикам
Патогенез:
Гистологически гранулема выглядит в виде очага, содержащего внутри некротизированные казеозные массы. В последующем гранулема уплотняется, и ее соединительнотканная оболочка обызвествляется. В результате этого формируется первичный туберкулезный очаг - очаг Гона. При прогрессировании заболевания казеозные массы под действием протеолитических ферментов подвергаются разжижению, в результате чего в легких образуются полости – каверны, а на слизистых оболочках и коже – язвы. При высокой резистентности организма гранулема замещается соединительной тканью и кальцифицируется. В случае недостаточной активации макрофагов размножение микобактерий происходит в геометрической прогрессии. Фагоцитирующие клетки не справляются с большим количеством бактерий и погибают. При этом в межклеточное пространство поступают медиаторы воспаления и протеолитические ферменты, которые повреждают прилегающие ткани. В этом случае первичное инфицирование переходит в клинически выраженное заболевание. Первый период возникает в ответ на первичное экзогенное заражение ранее неинфицированных людей, то есть развивается в результате первого проникновения вирулентных микобактерий в кровь (первая встреча с возбудителе). Этот период может завершиться развитием первичного туберкулеза и спонтанным излечиванием. При первичном туберкулезе в зоне внедрения возбудитель захватывается макрофагами, в результате чего развивается гранулематозная реакция. Затем микобактерии преодолевают этот барьер, проникают в регионарные лимфатические узлы, кровь и различные органы. Первичный туберкулез в результате экзогенного заражения развивается у 7-10% инфицированных лиц, остальные переносят первичную туберкулезную инфекцию без клинических проявления и спонтанно излечиваются. При спонтанном излечивании формируется обызвествленный первичный туберкулезный комплекс (“окаменевший” очаг воспаления, в котором длительное время сохраняется возбудитель в дремлющем состоянии). У таких людей формируется приобретенный иммунитет. Сохранение возбудителя в очагах персистенции не только поддерживает иммунитет, но одновременно создает риск эндогенного инфицирования. Второй период связан с вторичным экзогенным или эндогенным инфицированием микобактериями, сохранившимися в первичном очаге. То есть вторичный туберкулез возникает в иммунном организме у ранее инфицированных людей. При этом развиваются разнообразные вторичные формы туберкулеза (острая очаговый, фиброзно-очаговый, инфильтративный, туберкулома, казеозная пневмония, острый кавернозный, фиброзно кавернозный, цирротический). Эндогенная реактивация микобактерий может наступить в течение любого срока после первичного туберкулеза (от нескольких недель до многих лет и десятков лет) в результате неблагоприятных социально-экономических условий, недостаточности питания, приема иммунодепрессантов, сопутствующих заболеваний (в частности, диабета). Вторичный туберкулез почти всегда начинается в верхушках легких. Вторичный туберкулез протекает хронически.


Первичный туберкулезный комплекс, исходы инфекции: Первичный туберкулезный комплекс – это локальная форма первичного туберкулеза, характеризующаяся триадой: формирование очага в легких, увеличением регионарных лимфоузлов (лимфаденит) и соединяющей их лимфангоитической дорожкой (лимфангит). 1. Затихание процесса (заживление) – инкапсуляция, петрифиация, оссификация 2. Прогрессирование процесса – гематогенная генерализация, лимфожелезистая генерализация, рост первичного аффекта, смешанные формы 3. Хроническое течение первичного туберкулезного комплекса (вспышки и затихания)
Полное рассасывание, фиброз, кальцинат, туберкулема (казеозный «творожистый некроз» очаг, опухоль) Профилактика: Туберкулинотерапия и вакцина туберкулезная (БЦЖ) ( вакцина БЦЖ) и вакцина БЦЖ-М (для щадящей
первичной иммунизации) для внутрикожного ведения.
Принципы лабораторной диагностики: Бактериологический, экспресс-диагностика (микроскопирование, ПЦР) Скрининг: реакция Манту (Положительная реакция указывает на аллергическое
состояние (ГЗТ), которое может возникать в следующих случаях:
при наличии туберкулёзного процесса в организме после первичного инфицирования (через 3-8 недель после заражения) организма), Диаскинтест
Лечение: Две группы: 1) противотуберкулезные изониазид, рифампицин, пиразинамид (первый ряд препаратов). Для тех у кого туберкулез выявлен впервые, а возбудитель чувствителен к данным препаратам. Препараты второго ряда: протионамид, этионамид, рифабутин, аминосалициловая кислота, циклосерин, фторхиноолы. Они называются резервными. Для лечения когда возбудитель устойчив к препаратам первого ряда или при непереносимости этих препаратов. + иммуномодуляторы.
Эпидемиология «вторичного» туберкулеза. Особенности формирования гранулемы при «вторичном» туберкулезе, патогенез, клинические проявления, исходы заболевания. Особенности иммунитета при туберкулезе. Скрининговые тесты. Принципы лабораторной диагностики и специфическая профилактика туберкулеза.
Так же как и первичный, чаще всего возникает у лиц со сниженным иммунитетом, а также у носителей больших ОИТБ (очагово-инфильтративный туберкулез легких), контактных, социально дезадаптированной (маргинальной) части населения. Вторичный туберкулез имеет преимущественно легочную локализацию и имеет наклонность к прогрессирующему течению.
ВТОРИЧНЫЙ ТУБЕРКУЛЁЗ – развивается у пациентов: 1) инфицированных МБТ или 2) перенесших первичный туберкулёз и имеющих в легких или других органах остаточные пост-туберкулёзные изменения Заболевание развивается в результате: ЭКЗОГЕННОЙ СУПЕРИНФЕКЦИИ (новое заражение МБТ) ЭНДОГЕННОЙ РЕАКТИВАЦИИ (обострение остаточных туберкулёзных изменений)
Всегда начинается на фоне сформированной ГЗТ! Вторичный туберкулез – иммунопатология. Воспалительная реакция излишне выражена, и может захватывать области, выходящие за зону присутствия микроба и вызывать повреждение собственных тканей.
Особенности формирования гранулемы при «вторичном» туберкулезе: (см. 35 вопрос «этапы») При вторичном туберкулезе патологическая анатомия и гистология в активных очагах воспаления обнаруживают сливающиеся гранулемы, в центре которых находится казеозный некроз.
Патогенез, клинические проявления, исходы заболевания: (см. 35 вопрос) Второй период связан с вторичным экзогенным или эндогенным инфицированием микобактериями, сохранившимися в первичном очаге. То есть вторичный туберкулез возникает в иммунном организме у ранее инфицированных людей. При этом развиваются разнообразные вторичные формы туберкулеза (острая очаговый, фиброзно-очаговый, инфильтративный, туберкулома, казеозная пневмония, острый кавернозный, фиброзно кавернозный, цирротический). Эндогенная реактивация микобактерий может наступить в течение любого срока после первичного туберкулеза (от нескольких недель до многих лет и десятков лет) в результате неблагоприятных социально-экономических условий, недостаточности питания, приема иммунодепрессантов, сопутствующих заболеваний (в частности, диабета). Вторичный туберкулез почти всегда начинается в верхушках легких. Вторичный туберкулез протекает хронически.
Клинические проявления: - подкашливание, кашель с мокротой - кровохарканье (деструкция кровеносных сосудов) - боль в грудной клетке - повышение температуры тела, ночные поты (интоксикация) - слабость - постепенно нарастающая одышка - снижение массы тела
Исходы: Острый очаговый, как правило, благоприятен: рассасывание очага с формированием фиброза, уплотнение и кальцинация очага. Однако без лечения болезнь прогрессирует в инфильтративный туберкулез, туберкулому, кавернозный туберкулез легких. Туберколома заживает (характерно только для мелких) или прогрессирует в казеозную пневмонию, фиброзно-кавернозный, цирротический туберкулез. Фиброзно очаговый заживляется, затихает воспаление, развивается фиброзная капсула, казеозные массы очага уплотняются, петрифицируются. При прогрессировании развивается кавернозный туберкулез, казеозная пневмония, инфильтративный туберкулез. Инфильтративный заживает, постепенно рассасывается, отграничение и уплотнение казеозного очага, инкапсулируется и обызвествляется. Инфильтрат формируется в очаговый туберкулез или остаточные туберкулезные изменения. Прогрессирование заканчивается кавернозным туберкулезом, фиброзно-кавернозным туберкулезом, казеозной пневмонией. Казеозная пневмония проявляется в легких рубцах, инкапсулируется, кальцифинируется кистозные полости. Прогрессирует в кавернозный, фиброзно-кавернозный и цирротический туберкулез. Острый кавернозный заживает, рубцуется, образуются кистозные полости. Хронизируется в фиброзно-кавернозный. Прогрессирует в казеозную пневмонию. Умирают от пневмосклероза, сердечно-легочной недостаточности, формирования легочного сердца, разрыв каверн, профузное легочное кровотечение, присоединение вторичной инфекции, дыхательная недостаточность. Фиброзно-кавернозный при инволюции заживает (длительное лечение или хирургия), однако развивается инвалидизация больных с сердечно-легочной недостаточностью. При прогрессировании развивается характер терминальной вспышки. Цирротический исход неблагоприятный (легочное кровотечение, амилоидно-липоидный нефроз, хроническая легочная недостаточность). Причина смерти больных легочным туберкулезом в настоящее время заключается в легочно- сердечной недостаточности, кровотечениях, амилоидозе и осложнениях послеоперационного периода у больных с тяжелым кавернозным процессом.
+ Исход зависит от активности Т-хелперов, которые активируют фагоцитарную активность макрофагов и активность Т-киллеров. Интенсивное размножение микобактерий ведет к гибели фагоцитирующих клеток и активации супрессоров, что вызывает развитие вторичного иммунодефицита и иммунной толерантности. С микробиологических позиций выздоровление от туберкулеза не происходит!
Особенности иммунитета: Иммунитет при туберкулезе имеет ряд особенностей. Он начинает формироваться через 4-8 недель после первичного инфицирования. Формируется как клеточный, так и гуморальный иммунитет. Приобретенный клеточный иммунитет проявляется тем, что после первой встречи с возбудителем в организме формируется состояние повышенной чувствительности (сенсибилизация). Макрофаги, поглотившие микобактерии туберкулеза, экспрессируют на своей поверхности антигены микобактерий в виде пептидов и выделяют в межклеточное пространство интерлейкин-1, который активирует Т-лимфоциты (CD4+). Благодаря этому организм приобретает способность быстро связывать новую дозу возбудителя и удалять ее из организма. Гуморальный иммунитет проявляется синтезом антител к антигенам микобактерий. Образуются циркулирующие иммунные комплексы (ЦИК), с помощью которых антигены элиминируются из организма. Итого: формируется в ответ на проникновение в организм микобактерий в процессе инфекции или вакцинации и носит нестерильный - инфекционный характер (сохраняется до тех пор, пока в организме есть возбудитель), что обусловлено длительнной персистенции L-форм бактерий в макроорганизме. После освобождения организма от микобактерий иммунитет быстро исчезает. Решающую роль играют клеточные факторы иммунитета (см.выше)
Скрининговые тесты: Тесты для отбора людей с подозрением на туберкулез: Реакция Манту (позитивный результат – диаметр зоны воспаления более 10-15 мм) и Диаскин-тест (состоит из двух белков, которые отсутствуют у M.bovis и непатогенных микобактерий, т.е. более специфичен и точен на M.tuberculosis и сводит на минимум ложноподобные реакции – наличие инфильтрата любого размера) – до 14 лет. Флюорография. Принципы лабораторной диагностики и специфическая профилактика туберкулеза: Материал для исследования. При легочной форме туберкулеза чаще всего исследуют
мокроту, промывные воды бронхов; промывные воды желудка (у детей). При другой
локализации процесса забирают гной, спинномозговую жидкость, мочу, экссудат из
полостей, биоптаты тканей, испражнения и пр.
Бактериологический: Посев производят на элективную плотную среду Левенштейна-Иенсена или Финна-II. Колонии микобактерий, видимые невооруженным глазом, появляются через 3-6 недель. 12-15 дней. На плотных питательных средах микобактерии обычно растут в виде сухих, морщинистых R-колоний (реже S –колоний) кремового цвета (цвет слоновой кости).
Экспресс-диагностика: а) Микроскопическое исследование: чувствительность микроскопии ниже, чем у культурального метода, но компенсируется быстротой (от 1 часа) и доступностью.
б) Идентификация специфических фрагментов ДНК M. tuberculosis (IS 6110) в полимеразной цепной реакции (ПЦР).
Вакцина туберкулезная (БЦЖ) ( вакцина БЦЖ) и вакцина БЦЖ-М (для щадящей первичной иммунизации) для внутрикожного ведения.
Вакцина БЦЖ применяется для плановой вакцинации в странах с высоким уровнем заболеваемости туберкулезом.
Общая характеристика хламидий (морфология, особенности пептидогликана, экология), классификация (примеры родов и видов). C. pneumoniae: эпидемиология, факторы патогенности, патогенез заболевания, особенности антибиотикотерапии, диагностики. C. psittaci: эпидемиология, особенности течения заболевания, исходы заболевания.
Морфология и тинкториальные свойства: Грамотрицательные мелкие кокковидные (шаровдной или овоидной формы) облигатно-паразитические бактерии (Не образуют АТФ, получают из митохондрий хозяина). Не образуют спорт, не имею жгутиков и капсулы. Основной метод окраски по Романовскому-Гимзе (зависит от жизненного цикла: элементарные тельца в пурпурный цвет на фоне голубой цитоплазмы, а ретикулярные тельца в голубой цвет). Клеточная стенка не содержит типичного пептидогликана (в составе отсутствует N-ацетилмурамовая кислота). В состав клеточной стенки входит двойная наружная мембрана, которая включает в себя ЛПС и белки. Она все равно обладает ригидностью (прочностью определяют пептиды). Размножается бинарным делением. Плеоморфные (Неоднородность в ходе репликативного цикла). Мельчайший бактериальный геном. На искусственных питательных средах не размножаюся, их можно культивировать только в живых клетка (энергетические паразиты, культура клеток HeLa). АГ структура: группоспецифический липогликопротеид, видоспецифический АГ.
Хламидии обладают родоспецифическими, видоспецифическими и типоспецифическими антигенами. Родоспецифический антиген представляет собой поверхностный ЛПС клеточной стенки, термостабильный. Он является общим для всех видов хламидий. Этот антиген используется при диагностике заболеваний иммунофлюоресцентными методами со специфическими антителами. Видоспецифические антигены представляют собой белки клеточной стенки, термолабильные. У разных видов хламидий они различные. Типоспецифические антигены являются белками. Они различны у разных сероваров хламидий. По их наличию у C. trachomatis выделяют 15 сероваров (возбудители трахомы – серовары А, В, Ва, С; возбудители урогенитального хламидиоза – серовары D, E, F, G, H, I, J, K; возбудитель венерической лимфогранулёмы – серовары L1, L2, L3); у C. psittaci выделяют 13 сероваров; у C. pneumoniae выделяют 4 серовара (TWAR, AR, KA, CWL). Белки MOMP и ОМР2 содержат родо-, видо- и типоспецифические эпитопы, что обусловливает возможность появления перекрестных реакций.
Экология:
Весьма распространены. Главные их хозяева – человек, птицы и млекопитающие. Возбудитель неустойчив во внешней среде (чувствителен к высокой температуре и высушиванию – падение вирулентности при низкой температуре и инактивация при высокой). Погибают под воздействием УФ-облучения и от контакта с этиловым эфиром и 70% этанолом. C.trachomatis имеет тропизм к слизистой оболочке эпителия урогенитального тракта, может оставаться там локально или распространяться по всей поверхности ткани. Возбудитель венерической лимфогранулемы имеет тропизм к лимфоидной ткани. C.pneumoniae размножается в альвеолярных макрофагах, моноцитах и эндотелиальных клетках сосудов; Возможно также системное распространение инфекции C.psittaci вызывают инфекцию в различных типах клеток, включая мононуклеарные фагоциты.
У хламидий уникальный жизненный цикл, идёт смена фаз: элементарных и ретикулярных телец: Элементарные тела:
-мелкие
-обеспечивают выживание вне клетки
-инфекционная форма
-лишены метаболической активности (инертны) – не размножаются Ретикулярные тела: -большие -чувствительный к окр среде -неинфекционная форма -метаболически активны TWAR у пневмонии!!!

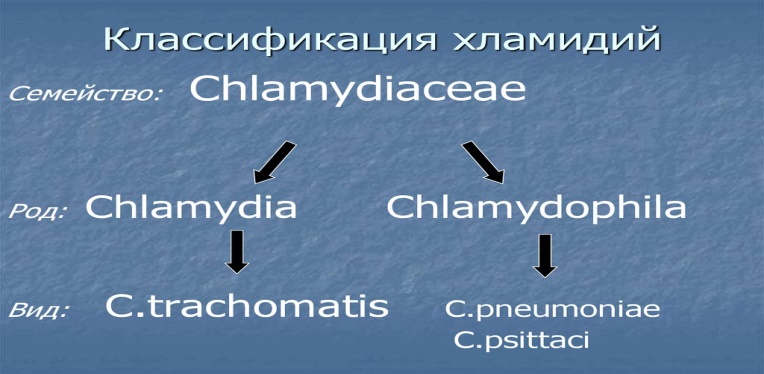 C.
pneumoniae: эпидемиология,
факторы патогенности, патогенез
заболевания, особенности антибиотикотерапии,
диагностики:
Возбудитель
респираторного хламидиоза, характеризующегося
пневмонией, бронхитом и общей интоксикацией.
Элементарные тельца прикрепляются к
эпителиальным клеткам респираторного
тракта.
Человек – единственный
источник инфекции. Механизм заражения
– воздушно-капельный. Восприимчивость
высокая. Чаще в холодное время года.
Возможно бессимптомное носительство.
Распространение идет медленно. Высокая
инвазивность.
C.
pneumoniae: эпидемиология,
факторы патогенности, патогенез
заболевания, особенности антибиотикотерапии,
диагностики:
Возбудитель
респираторного хламидиоза, характеризующегося
пневмонией, бронхитом и общей интоксикацией.
Элементарные тельца прикрепляются к
эпителиальным клеткам респираторного
тракта.
Человек – единственный
источник инфекции. Механизм заражения
– воздушно-капельный. Восприимчивость
высокая. Чаще в холодное время года.
Возможно бессимптомное носительство.
Распространение идет медленно. Высокая
инвазивность.
Факторы патогенности: Компоненты поверхности клетки (пептиды – комплементарные нейраминовой кислоте: адгезины и антифагоцитарное действие) Экзотоксины Эндотоксин ЛПС – блокирует фагосомо-лизосомальное слияние в фагоцитах Относительная резистентность к антибиотикам Отсутствие пептидогликана Внутриклеточные паразиты Метаболическая инертность элементарных телец
Патогенез: Внедряясь в легочную ткань и размножаясь, хламидии вызывают гибель клеток (разрыв мембраны и ослабление конструктивного метаболизма зараженных клеток) и тяжелое воспаление легких – формирование очагов некротического гранулематозного поражения с множественными кровоизлияниями. Инфекция может проявляться как затяжное острое респираторно заболевания, сочетающееся с пневмонией.
Особенности антибиотикотерапии: При бессимптомной форме инфекции (носительство) лечение, как правило, не проводится, и только при возникновении рецидива или формировании хронических форм болезни назначается соответствующая терапия. При легком течении назофарнгеальных форм терапию ограничивают симптоматическими средствами. При среднетяжёлых и тяжелых формах показано этиотропное лечение. Курс 10-14 дней, так как короткие циклы не приводят к санации и не препятствуют рецидивированию или хронизации процесса. Антибиотики: макролиды, фторхинолоны и тетрациклины. Антитела C.pneumoniae ассоциированы с хронической коронарной болезнью и острым инфарктом миокарда (атеросклероз и ИБС). C.pneumoniae обнаружена в бляшках коронарных артерий и аорты, но не в нормальных сосудах. Проникновение в стенку сосудов говорит о повышенной инвазивности C.pneumoniae и возможности дистантных осложнений при поражениях респираторного тракта. Диагностика: Серологический метод: антитела в сыворотке крови можно обнаружить спустя 3 недели после начала заболевания с помощью ИФА и РИФ. При первичной инфекции определяются IgM, при реинфицировании – IgG. Применяется ПЦР. Возможно микроскопическое исследование мазков из мокроты, окрашенных по Романовскому-Гимзе. Бактериологическое исследование не проводится. Специфическая профилактика еще не разработана. Иммунитет не формируется.
C. psittaci: эпидемиология, особенности течения заболевания, исходы заболевания: Орнитоз – антропозоонозное заболевание, характеризующееся первичным поражением респираторных органов, а также нервной системы, паренхиматозных органов, с явлениями общей интоксикации. Источник инфекции – дикие, домашние и декоративные птицы – инфицированные или бессимптомные носители. От человека к человеку очень редко передается (случайный хозяин) Механизм заражения: респираторный (воздушно-капельный и пылевой-зараженные выделениями птиц) Восприимчивость высокая. Профессиональное заболевание – люди работающие на птицефермах и владельцы декоративных птиц. Глазные и генитальные хламидии являются строгими эпителиальными паразитами, лишенными способности инвазировать глубже лежащие ткани ХВЛГ-лимфогранулема (как и C.psittaci) обладают повышенной вирулентностью и способны выходить за пределы слизистых оболочек, поражая регионарные л/у. Особенности жизнедеятельности хламидий обусловливают специфику течения орнитоза. К таким особым свойствам относятся способность возбудителя к размножению внутри клеток, образованию L-формы и сохранению вирулентности в различных условиях, выделению экзо- и эндотоксина, тропизм к клеткам респираторного тракта и системы мононуклеарных фагоцитов и т. д. Входными воротами для возбудителя являются слизистые оболочки респираторного траката. Возбудитель размножается в эпителии бронхиального дерева, в альвеолярном эпителии, а также в макрофагах. Развивается воспаление, происходит разрушении клеток, возникают бактериемия, токсинемия, аллергизация макроорганизма, поражение паренхиматозных органов. В клинической картине орнитоза симптомы поражения бронхов и легких имеют ведущее значение. Возникают осложнения со стороны ССС (тромбофлебит, миокардит), ЦНС и др. Возможна генерализованная форма хламидийной инфекции. Две клинической формы: Атипичная гриппоподобная пневмония (выс.температура, кашель, суставные боли) – чаще Тифоподобная форма (тяжелая интоксикация без респираторного синдрома) – смертность 20%
Заболевание начинается остро с повышения температуры, продолжается от 2 дней до 1 месяца и более. Прогноз благоприятный. При современных методах лечения летальность менее 1%. Возможны рецидивы и хронизация процесса.
C.trachomatis: общая характеристика (морфология, особенности пептидогликана, экология). Патогенетическая характеристика серотипов. Трахома и генитальный хламидиоз (эпидемиология, патогенез, клинические проявления). Синдром Рейтера. Патология новорожденных. Этиотропная терапия, иммунитет, принципы лабораторной диагностики.
Трахома – хроническое заболевание, характеризующееся поражением конъюнктивы и роговицы глаз, приводящее к слепоте. При трахоме поверхность конъюнктивы выглядит бугристой в результате гранулематозного воспаления. Морфология и тинкториальные свойства: Грамотрицательные мелкие кокковидные (шаровдной или овоидной формы) облигатно-паразитические бактерии (Не образуют АТФ, получают из митохондрий хозяина). Не образуют спорт, не имею жгутиков и капсулы. Основной метод окраски по Романовскому-Гимзе (зависит от жизненного цикла: элементарные тельца в пурпурный цвет на фоне голубой цитоплазмы, а ретикулярные тельца в голубой цвет). Клеточная стенка не содержит типичного пептидогликана (в составе отсутствует N-ацетилмурамовая кислота). В состав клеточной стенки входит двойная наружная мембрана, которая включает в себя ЛПС и белки. Она все равно обладает ригидностью (прочностью определяют пептиды). Размножается бинарным делением. Плеоморфные (Неоднородность в ходе репликативного цикла). Мельчайший бактериальный геном. На искусственных питательных средах не размножаюся, их можно культивировать только в живых клетка (энергетические паразиты, культура клеток HeLa). АГ структура: Хламидии обладают родоспецифическими, видоспецифическими и типоспецифическими антигенами. Родоспецифический антиген представляет собой поверхностный ЛПС клеточной стенки, термостабильный. Он является общим для всех видов хламидий. Этот антиген используется при диагностике заболеваний иммунофлюоресцентными методами со специфическими антителами. Видоспецифические антигены представляют собой белки клеточной стенки, термолабильные. У разных видов хламидий они различные. Типоспецифические антигены являются белками. Они различны у разных сероваров хламидий. По их наличию у C. trachomatis выделяют 15 сероваров (возбудители трахомы – серовары А, В, Ва, С; возбудители урогенитального хламидиоза – серовары D, E, F, G, H, I, J, K; возбудитель венерической лимфогранулёмы – серовары L1, L2, L3); у C. psittaci выделяют 13 сероваров; у C. pneumoniae выделяют 4 серовара (TWAR, AR, KA, CWL). Белки MOMP и ОМР2 содержат родо-, видо- и типоспецифические эпитопы, что обусловливает возможность появления перекрестных реакций.
Экология: Резервуар – эпителий конъюнктивы человека. Сугубо местный процесс. Источник – только человек (больной или носитель). Путь передачи – контактный (прямой и контактно-бытовой). Факторы передачи: грязные руки, платки, полотенца Весьма распространены. C.trachomatis имеет тропизм к слизистой оболочке эпителия урогенитального тракта, может оставаться там локально или распространяться по всей поверхности ткани. Возбудитель венерической лимфогранулемы имеет тропизм к лимфоидной ткани. В настоящее время известно 14 сероваров биовара C.trachomatis, которые вызывают более 20 нозологических форм: Серовары A,B,Ba,C вызывают трахому и конъюнктивит с внутриклеточными включениями Серовары D,G,H,I,J,K вызывают урогенитальный хламидиоз, конъюнктивит, пневмонию новорожденных, синдром Рейтера Серовары L1,L2,L2a,L3 – вызывают венерическую лимфогранулему.
Трахома и генитальный хламидиоз (эпидемиология, патогенез, клинические проявления): Эпидемиология: Антопронозные инфекции, передающиеся контактно-бытовым путем, восприимчивость высокая у детей особенно. Выявляются семейные очаги заболевания. Заболевание эндемического характера – Афирка, Азии и Южная америка с низким уровнем жизни и санитарной культуры населения (ТРАХОМА). Путь заражения контактый (половой) + контактно-бытовой (попадание на слизистую оболочку глаз при купании в бассейне). Встречается очень часто, вызывает воспалительные заболевания мочеполовой системы вызываются хламидиями, но может протекать бессимптомно (УРОГЕНИТАЛЬНЫЙ ХЛАМИДИОЗ). Источник инфекции – больной человек. Путь заражения контактно-половой, значительно реже контактно-бытовой. Инфекция эндемичная в странах с жарким климатом – в Юго-Восточной Азии, Центральной и Южной Америке, единичные случаи встречаются повсеместно. Восприимчивость населения всеобщая (ВЕНЕРИЧЕСКАЯ ЛИМФОГРАНУЛЕМА) Патогенез: (ТРАХОМА) Возбудитель в форме элементарных телец проникает через слизистые оболочки глаз и размножается внутриклеточно. Развивается фолликулярный керато-конъюнктивит, который прогрессирует и заканчивается образованием рубцовой соединительной ткани, которая приводит к слепоте. Часто активируется условно-патогенная флора и воспалительный процесс приобретает смешанный характер.
(УРОГЕНИТАЛЬНЫЙ ХЛАМИДИОЗ) C.trachomatis поражает эпителий слизистой оболочки урогенитального тракта. У мужчин инфицируется уретра, а у женщин – шейка матки. Отмечается зуд, слизисто-гнойные выделения. В дальнейшем наблюдается восходящая инфекция и развивается мужское и женское бесплодие. (ВЕНЕРИЧЕСКАЯ ЛИМФОГРАНУЛЕМА) Входными воротами инфекции являются слизистые оболочки половых органов, где и размножаются хламидии. На половых органах появляются язвочки. Затем микробы проникают в регионарные (обычно паховые) лимфатические узлы. Воспаленные лимфоузлы вскрываются с образованием свищей с гнойным отделяемым. Через несколько месяцев появляются деструктивные изменения в окружающих тканях – проктиты, абсцессы прямой кишки. Хламидиозы протекают в виде микст-инфекции, в ассоциации с гонококками и другими патогенными и условно-патогенными возбудителями. Инфицирование беременной представляет опасность как для нее, так и для плода: преждевременные роды, послеродовые осложнения, у новорожденных может отмечаться конъюнктивит, менингоэнцефалит, сепсис, пневмонии (заражение через прохождении ребенка через родовой канал инфицированной матери). Наряду с поражением отдельных органов для хламидиозов характерны также проявления системного типа – синдром Рейтера (Триада признаков). Он характеризуется поражением мочеполовых органов (простатит), заболеванием глаз (конъюнктивит) и суставов (артрит). Болезнь протекает с ремиссиями (при хронической симптомы ослабевают/исчезают) и повторными атаками. Развитие заболевания связано с хламидийными антигенами, которые провоцируют иммунопатологические процессы у генетически предрасположенных лиц (70% заболевших имеют антиген гистосовместимости HLA B27).
Патология новорожденных: Источником инфекции для новорожденного является инфицированная мать.
Заражение плода хламидиями возможно по периодам:
интранатально (контактный путь инфицирования и восходящий)
антенатально (в результате аспирации околоплодных вод и попадания возбудителя на слизистые оболочки конъюнктивы, дыхательных путей, вульвы и уретры, ЖКТ),
Наиболее часто у новорожденных встречается хламидийный конъюнктивит (бленорея) с включениями (офтальмохламидиоз) и атипичная пневмония (респираторный хламидиоз). Реже, при инфицировании в антенатальный период, развивается генерализованная инфекция с поражением легких, сердца, органов пищеварения, а также энцефалопатия с повторяющимися приступами судорог и апное.
Этиотропная терапия, иммунитет, принципы лабораторной диагностики:
Антибиотики группы тетрациклина, интерферон, эритрцомицин (венер.лимфогранулема), индукторы интерферона и иммунмодуляторы. Макролиды, фторхинолоны (длительно при урогенитальном хламидиозе 14-21 день) – курсовая, цикловая терапия. Иммунитет после трахомы и урогинетальном хламидиозе не вырабатывается. При урогенитальном хламидиозе в крови инфицированных людей обнаруживаются специфические антитела, которые не имеют защитной функции. После венерической лимфогранулемы возникает стойкий иммунитет. Для диагностики трахомы исследуют соскобы с конъюнктивы. Окрашивают по Романовскому-Гимзе, в мазках обнаруживаются цитоплазматические включения фиолетового цвета с красным центром около ядра – тельца Провацека-Хальберштедтера. Для обнаруживания антигена проводят РИФ и ИФА. Возможно выделение возбудителя в культуре клеток in vitro (культура клтоек HeLa-229 и др.). При урогенитальном хламидиозе – соскобы с эпителия уретры, цервикального канала, конъюнктивы. Наиболее достоверный метод – комплексное определение иммуноглобулинов классов M, G, A в РНГА, РИФ и ИФА. Применяется ПЦР и метод ДНК-гибридизации. При венерической лимфогранулеме – гной из бубонов, биоптат пораженных лимфоузлов. Проводят микроскопию мазков-отпечатков, выделяют возбудителя на культурах клеток и в куриных эмбрионах. Серологическим методом определяют антитела в реакции РИФ. С помощью аллергической пробы устанавливают наличие ГЗТ к антигенам возбудителя (внутрикожная проба Фрея). Отличия от гонореи: длительный инкубационный период (2-3 недели), более слизистые выделения, мало «гнойных клеток».
M. pneumoniae как возбудитель респираторного микоплазмоза. Общая характеристика. Эпидемиология, факторы и механизмы патогенности, иммунологически-опосредованная болезнетворность. Варианты заболеваний. Понятие об «атипичной» пневмонии (примеры возбудителей).
Класс Mollicutes (мягкокожие) Семейство Mycoplasmatacea Род Mycoplasma (Вид M.pneumoniae, M.hominis, M.genitalium) Род Ureaplasma (Вид U.urealiticum)
Морфология: Грамотрицательные. Спор и капсул не образуют. Атипичные бактерии – прокариоты без клеточной стенки (не способны синтезировать диаминопимелиновую кислоту). Нет пептидогликана: не чувствительны к антибиотикам (подавляющих синтез клеточной стенки – пенициллины и др.), осмотически неустойчивы, пластичны (проходят через бактериальные фильтры), полиморфы (груша, нити, гантеля, зерна, глобула). Трехслойная липидная мембрана! Некоторые имеют углеводную микрокапсулу. Могут размножаться как бинарным делением так и распадом нитей на кокковидные клетки + процесс, сходный с почкованием (процесс делением цитоплазма отстает от процесса репликации). Факультативные анаэробы (паразиты), источник энергии – глюкоза. Антропоноз. Они гидролизуют с помощью уреаплазмы мочевину. Сапрофиты почвы и воды. Человек – естественный хозяин. В основном условно-патогенные. Некоторые виды способны к движению, механизм неизвестен. Являются факультативными паразитами (не могут самостоятельно синтезировать холестерин, то есть ауксотрофы по стеролам – мембранные паразиты!). Очень прихотливые, растут на комплексных питательных среда с холестерином. Дают мелкие колонии с плотным врастающим в агар центром и светлой периферией (яичница-глазунья) Антигенами микоплазм являются белки-адгезины, фосфолипиды, гликолипиды, полисахаридные компоненты. Адгезины микоплазм имеют высокую гомологию к структурным белкам млекопитающих, что позволяет им уклоняться от иммунной системы хозяина (антигенная мимикрия). Эпидемиология: Источник инфекции – больные в остром периоде заболевания или носители, перенесшие острую или бессимптомную инфекцию. Путь передачи воздушно-капельный. Контакт длительный, в закрытых коллективах. Возраст 5-18 лет. Особенностями респираторного микоплазмоза являются относительно слабая контагиозность и высокая частота бессимптомных и легких форм инфекции.
Факторы и механизмы патогенности: Лишен инвазивности (не выходит за пределы респираторного тракта) Токсинов дистантного действия – нет Низкая инфекционная доза Сложно устроенные полярные адгезиновые комплексы (белок P1) Продукты метаболизма – образование перекиси водорода и перекисных радикалов сопровождается повреждением мембраны клетки хозяина, что вызывает тесное слияние мембран при прикреплении микоплазм. При этом происходит подавление защитной функции мерцательного эпителия. Эндотоксины – обусловливают пирогенный эффект, лейкопению, тромбогеморрагические поражения, коллапс, отек легких. Ферменты агрессии – фосфолипаза, АТФаза, протеаза, нуклеаза, нейраминидаза, ДНКаза – вызывают локальные клеточные разрушения Гемолизины – лизируют эритроциты + цитотоксическое действие на эпителиальные клетки Капсулоподобная оболочка – повышает прочность микроба и придает ему иммуносупрессорную активность (искусственное угнетения иммунитета). Прямой патогенез: Возбудитель внедряется между ресничками и прикрепляется к мембране эпителиоцитов Зацепившись за рецепторы, внедряется в плазматическую мембрану, этому способствуют заостренные концы филаментозных форм, в состав которых входит белок P1. Прочное закрепление гарантирует устойчивость к вымыванию с обратным током слизи и доступ к клеточным метаболитам (продуктам питания). Результат – повреждение эпителиоцитов (инвазия не идет глубже плазматическое мембраны, это редкое исключение). Повреждение плазматической мембраны приводят к глубоким изменениям клеточного метаболизма – нарушению энергозависимых функций реснитчатого аппарата – обездвиживание ресничек – подавление мукоцилиарного транспорта, т.е. процесса самоочищения слизистой оболочки респираторного тракта. Адгезия микоплазм к эпителиальным клеткам приводит к инвагинации клеточных мембран и делает находящиеся в них микоплазмы недоступными воздействию антител, комплемента и других защитных факторов. Заимствует стеролы. Экзотоксин возбудителя оказывает токсическое действие на микроциркуляторное русло, нервную систему. Лихорадка до 4 недель, умеренная интоксикация, нередко больные переносят заболевание на ногах. Возможны гематогенная диссеминация в суставы, костный мозг, мозговые оболочки, а также развитие иммунопатологических процессов.
Иммунологически-опосредованная болезнетворность: 1. Гиперчувствительность замедленного типа 2. Циркулирующие иммунные комплексы – отлагаясь на мембранах микрососудов индуцируют воспалительное поражение внутренних органов, кожи (экзамнтемы), коагулопатию 3. Белки со свойствами суперантигенов – гиперстимуляция Т- и B-лимфоцитов, вброс цитокинов + синдром полиорганных расстройств
Клиника:
1.
БЕССИМПТОМНО или обычная простуда при
адгезии к эпителиоцитам носовой
полости
2. Острый катар верхних
дыхательных путей (фарингит, рино,
ларингофарингит)
3. Бронхит, трахеит
20-60%%
4. Первичная (атипичная) пневмония
5-33% - не вторичная инфекция, болели
здоровые люди и не поддавалась лечению
пенициллином (атипичная) + у больных в
крови обнаруживалсь холодовые
гемагглютинины, которые агглютинировали
0-эритроциты при 4 С, но не 37С. Характерный
признак – сухой малопродуктивный кашель
(ходячая пневмония). Если
развитие атипичной пневмонии не связано
с другим заболеванием, такая пневмония
носит название первичной (ПАП)
Иммунитет:
непродолжительный иммунитет, антитела
не участвуют в защите + перекретный
(антигенная однородность M.pneumoniae)
+ IgA
респираторных секретов – блокируют
адгезины и обрывают инфекцию в самом
начале.
Лабораторная
диагностика: ПЦР , с
учетом способности персистенции ее
выделение не является 100% подтверждением
острой микоплазменной инфекции.
Лечение:
макролиды, тетрациклины или фторхинолоны

Классификация урогенитальных микоплазм. Общая характеристика. Эпидемиология. Факторы и механизмы патогенности U.urealyticum. Эпидемиология. Патология и бактериносительство, возможные последствия. Особенности этиотропной терапии микоплазмозов. Принципы лабораторной диагностики, трактовка анализа.
Виды: Ureaplasma urealyticum/parvum/cati/canigenitalum/gallorale/filinum/diversum Клинически важными считаются два вида, на которые проводятся лабораторные анализы: U.parvum (parvum это биовар по старой классификации U.urealyticum) – серотипы 1, 3, 6 и 14 U.urealyticum (биовар Т-960) – серотипы 2, 4, 5, 7, 8, 9, 10, 11, 12, 13 Насчитывается 14 серотипов, отличающиеся составом белков мембран.
К возбудителям урогенитальных микоплазмозов относят M.hominis, U.urealyticum, M.genitalium и M.fermantans. Общие для всех микоплазм свойства: отсутствие КС; чрезвычайно простая организация клетки (ЦПМ, нуклеоид, рибосомы); наименьший размер прокариот размер генома; потребность в стеролах Особенности уреаплазм: очень мелкие колонии (меньше, чем у других микоплазм); способность гидролизовать мочевину (уреазная активность); требовательность к составу питательной среды pH 6,0-6,5, что ниже, чем для остальных микоплазм, на агаровой среде лучше растут в атмосфере, содержащей 5% CO2 и 95% N2; быстрый рост (стационарная фаза достигается за 16-18 часов); низкий титр КОЕ (колониеобразующие единицы, т.е. жизнеспособные). Эпидемиология: Источник инфекции – инфицированный человек. Микоплазмы, вызывающие урогенитальные заболевания, передаются половым путем и контактно-бытовой. Возможны вертикальный путь передачи, а также инфицирование плода во время родов при прохождении через инфицированные родовые пути (развитие внутриутробной инфекции плода). Могут присутствовать у клинически здоровых лиц (так что не патогенные! часто могут быть при воспалительных заболеваниях гениталий и у беременных, у лиц с повышенной сексуальной активностью и у женщин детородного возраста), оппуртунистические патогенны – опасны для лиц с ослаблением местного и общего иммунитета. Инфицируют половой тракт на всем его протяжении – от влагалища до органов малого таза. Патология: Либо здоровое носительство 50% либо первичная/вторичная (оппортунистическая) патогенность, которая у женщин (> M.hominis) вызывает: уретрит, вагинит, эндометрит, инфекция органов малого таза (фалопиевы трубы, яичники и придатки), может развиться плацентарная инфекция и возможные осложнения: бесплодие, внематочная беременность, спонтанный аборт, преждевременная роды. У мужчин (U.urealyticum/U.parvum): уретрит, простатит, эпидидимит (воспаление придатка семенника), мочекаменная болезнь) Носительство бессимптомно или сопровождается воспалительными процессами гениталий (ж), приводящих к бесплодию, прерыванию беременности и патологии плода. У мужчин уретриты, простатиты и бесплодие (м). Факторы и механизмы патогенности U.urealyticum:
Комплекс адгезинов – к эпителиальным клеткам, эритроцитам и сперматозоидам IgA протеаза – расщепляет IgA человека на 2 фрагмента. В результате этого иммуноглобулины теряют способность связывать антигены уреаплазм и предотвращать развитие инфекции. У других микоплазм такая протеаза не обнаружена. Мембранные фосфолипазы A1, A2 и C (фосфолипазная активность различается в зависимости от серотипа) – при инфицировании плода и плаценты гидролизуют фосфолипиды мембраны клеток плаценты; приводит к увеличению количества свободной арахидоновой кислоты; к активации синтеза простагландинов; причина спонтанных абортов, мертворождения, преждевременных родов, патологии плода и беременности.
Уреаза (U.urealyticum) – при гидролизе мочевины образуется аммиак, оказывает токсический эффект на клетки-мишени
Входными воротами инфекции является слизистая оболочка урогенитального тракта. Поражаются уретра, влагалище и другие органы мочеполовой системы.
Очень часто острая инфекция во время терапии не приводит к элиманации возбудителя,а переходит в латентную инфекцию (персистенция), а активируется под влиянием различных факторов (присоединение инфекции другой природы, изменение физиологического и иммунного статуса организма).
Особенности этиотропной (на причину – возбудитель) терапии микоплазмозов: Резистентны к АБ, подавляющим синтез клеточной стенки (ее у них нет!!!), (B-лактамные антибиотики и ингибиторы синтеза пептидогликана) но чувствительны к ингибиторам белкового синтеза (макролиды, тетрациклины «доксициклин» эффективный) В очагах поражения они нередко существуют с хламидиями, герпесвирусами, с гонококками нацеливаясь на уничтожение одного возбудителя, обычно действуют и на сопутствующие. По сравнению с M.pneumoniae генитальные микоплазмы более вариабельны по чувствительности к антибиотикам, а устойчивость к тетрациклину от 2 до 20% и эритромицину распространена достаточно широко. Принципы лабораторной диагностики, трактовка анализа: Бактериологический: материалом служат соскобы со слизистой оболочки уретры, влагалища, моча. Принято считать, что микоплазмы причастны к развитию воспалительного процесса, если их титр в исследуемых пробах превышает 10^4 КОЕ/мл. Выявление микробных антигенов и нуклеиновых кислот в ПЦР, РИФ (прямой). Выявление антител в сыворотке не надежно, так как они часто обнаруживаются у здоровых людей, а острые инфекции (особенно U.urealyticum) не всегда сопровождается повышением их титра (серологические исследования РПГА и ИФА). Наиболее важный контингент для анализа это беременныые женщины ,так как возможны тяжелые последствия урогенитального микоплазмоза. Микробиологические признаки должны быть подкреплены данными об активности воспалительного процесса. Только в этом случае активная антибактериальная терапия. Иммунитет не формируется. Гуморальные антитела не являются протективными. Специфическая профилактика не разработана, важны меры неспецифической профиалктики.
Общая характеристика риккетсий (морфология, тинкториальные свойства, особенности экологии), основные родовые таксоны. R.prowazekii: эпидемиология, факторы патогенности, патогенез заболевания. Проявления и исходы (клинические и микробиологические) эпидемического сыпного тифа. Болезнь Брилла-Цинссера. Лабораторная диагностика.
 Морфология
и тинкториальные свойства:
Грамотрицательные,
мелкие палочки. Полиморфны. Аэробы. Нет
спор, жгутиков и капсулы. Есть микрокапсула
(внешний слой аморфного материала).
Размножаются бинарным делением. Плохо
окрашиваются (удерживают основной
фуксин, чаще красят по Здродовскому,
риккетсии в ярко-розовый цвет, цитоплазма
голубая, ядра синие). Не размножаются
на питательных средах, ауксотрофы по
НАД. Только в клеточных культурах –
легкие белых мышей и др. Подвижны
благодаря жгутикоподобным образованиям
(актиновым хвостам). Есть волосовидные
придатки или фимбрии. У некоторых бывают
вегативные и покоящиеся формы. Слабо
устойчивы, но хорошо переносят
высушивание!!!
Наружная мембрана:
ЛПС (Антигенные свойства – основа
для разделения на 2 группы: сыпного тифа
и пятнистых лихорадок)
Основные белки
– видоспецифичные АГ:
Морфология
и тинкториальные свойства:
Грамотрицательные,
мелкие палочки. Полиморфны. Аэробы. Нет
спор, жгутиков и капсулы. Есть микрокапсула
(внешний слой аморфного материала).
Размножаются бинарным делением. Плохо
окрашиваются (удерживают основной
фуксин, чаще красят по Здродовскому,
риккетсии в ярко-розовый цвет, цитоплазма
голубая, ядра синие). Не размножаются
на питательных средах, ауксотрофы по
НАД. Только в клеточных культурах –
легкие белых мышей и др. Подвижны
благодаря жгутикоподобным образованиям
(актиновым хвостам). Есть волосовидные
придатки или фимбрии. У некоторых бывают
вегативные и покоящиеся формы. Слабо
устойчивы, но хорошо переносят
высушивание!!!
Наружная мембрана:
ЛПС (Антигенные свойства – основа
для разделения на 2 группы: сыпного тифа
и пятнистых лихорадок)
Основные белки
– видоспецифичные АГ:
протеин А (ompA) – иммунодоминантный белок группы пятнистых лихорадок
протеин B (OmpB) – типичный автотранспортный белок, присутствует у обеих групп. Особенности экологии:
симбионты кровососущих членистоногих, способны передаваться от родителей потомству (трансовариальная передача). Иногда происходит заражение человека при укусе, инфицированным членистоногим, т.е. заражение человека не занимает важного места в этом цикле (человек – случайный хозяин!!!)
R.prowazekii: эпидемиология, факторы патогенности, патогенез заболевания: Антропоноз, является возбудителем сыпного тифа. В организме вши риккетсии размножаются в эпителии кишечника, вызывая его разрушение (несовершенная адаптация) и гибель инфицированных переносчиков. Риккетсии в высоких концентрациях содержатся в фекалиях вшей. Источник инфекции: человек (больной, носитель) Механизм передачи: трансмиссивный Вектор (переносчик): вша платяная (Pediculus humanus) Уровень инфекции: эпидемия Условия, способствующие заражению – социальное неблагополучие
Эндотоксин-ЛПС (Гр -)
Фосфолипаза - повреждение мембран клеток хозяина
Прямое повреждение клеток, вследствие облигатного внутриклеточного паразитизма
Гиперчувствительность
Пили – адгезия
Адгезины риккетсий rOmpA у возбудителей клещевых риккетсиозов и rOmpB у риккетсий группы сыпного тифа участвуют во взаимодействии бактерий с клетками млекопитающих. В частности белок rOmpB участвует в процессе “поглощения” риккетсий эукариотическими клетками
Микрокапсула обусловливает механизм “реактивации” риккетсий, то есть восстановления вирулентности штаммов


Проявления и исходы (клинические и микробиологические) эпидемического сыпного тифа: Характерна триада симптомов: температура, сыпь и головная боль.
Начало заболевания острое, клинические проявления обусловлены генерализованным поражением эндотелиальных клеток кровеносных сосудов. В результате этого формируется розеолезная и петехиальная сыпь на кожных покровах (рисунок 24). Рисунок 24 – Сыпь при эпидемическом сыпном тифе. Болезнь протекает тяжело, с высокой температурой, симптомами поражения сердечно-сосудистой и нервной систем (падение артериального давления, бред, психоз и т. д.). Летальность без лечения ранее составляла от 20% до 80%. Иммунитет после заболевания развивается напряженный, длительный, но возможны рецидивы болезни (болезнь Брилля-Цинссера).
Болезнь Брилла-Цинссера: Рецедив эпидемического сыпного тифа, возникающий у переболевших через месяцы – десятки лет (эндогенная реактивация персистентного возбудителя). При наличии платяных вшей больной болезнью Брилла может явиться исходным звеном эпидемической цепи вспышки сыпного тифа.( а может и неверно, т.к. только в 3-5% новый эпидемиологический цикл). • Отсутствие вектора • Спорадические случаи • Легкая и средней степени тяжести по клинике • Нарастание титра только IgG • При снижении защитных сил организма (возраст) Клинически острая инфекция носит циклический характер после инкубации 10-12 дней. Длительная лихорадка, появление розеолезной-петехиальной или папулезной сыпи, резкие изменения нервной (до менингоэнцефалита) и сердечно-сосудистой систем, тифозным статусом, наличием осложнений. Клиническая картина аналогичная таковой при острой форме, но клинические проявления менее выражены.
Лабораторная диагностика: 1. Экспресс метод (обнаружение риккетсий в материале от больного с помощью специальных методов окрашивания) - МФА, РНГА с иммуноглобулиновым диагностикумом для выявления риккетсий группы СТ (сыпного тифа). ДНК можно выявить с помощью ПЦР с последующей идентификацией путем определения нуклеотидных последовательностей ампликона. 2. Культивирование (трудоемкий и опасный) – только в специальных лабораториях, так как II группа патогенности 3. Серологический метод (определение IgM и IgG) – РНГА, ИФА, РА, РСК, РНИФ Специфическая профилактика: Вакцины: • Убитая • Живая аттенуированная по эпидпоказаниям Вирусология
Paramyxoviridae. Классификация. Характеристика вириона, антигенная структура. Механизм репликации парамиксовирусов. «Респираторные» парамиксовирусы, представители, спектр заболеваний, вызываемых парамиксовирусами.
Cемейство:
Paramyxovirinae
Род:
Классические возбудители
респираторной патологии:
1.
Respirovirus (вирусы парагриппа 1, 3)
2.
Rubulavirus (вирус паротита и вирусы парагриппа
2, 4)
Возбудители системных заболеваний,
для них характерна патогенетически
значимая вирусемия:
3. Morbillivirus (вирус
кори)
4. Pneumovirus (респираторно-синцитиальный
вирус)
 внеклеточная
форма существования вируса - инфекционная
Структура: оболочечный (сложный
вирус) – окружен оболочкой с
гликопротеиновыми шипами; вирион
сферической формы; под оболочкой
находится нуклеокапсид спиральный,
состоящий из нефргаментированной
линейной однонитевой минус-РНК, связанной
с белками: нуклеопротеином (NP,
или N), стабализирующим
геном; полимеразой-фосфопротеином (P)
и большим L-белком-полимеразой.
Под оболочкой вириона вириона
находится матриксный (M)
белок. Оболочка вириона содержит шипы
– два гликопротеина: белок слияния (F)
– вызывает слияние мембран вируса и
клетки; прикрепительный белок (обозначается
по разному для представителей семейства)
– HN (обладает гемагглютинирующей
и нейраминидазной активностью), H
и G.
F-белок
активируется расщеплением клеточной
протеазой на 2 субъединицы (F1
и F2).
внеклеточная
форма существования вируса - инфекционная
Структура: оболочечный (сложный
вирус) – окружен оболочкой с
гликопротеиновыми шипами; вирион
сферической формы; под оболочкой
находится нуклеокапсид спиральный,
состоящий из нефргаментированной
линейной однонитевой минус-РНК, связанной
с белками: нуклеопротеином (NP,
или N), стабализирующим
геном; полимеразой-фосфопротеином (P)
и большим L-белком-полимеразой.
Под оболочкой вириона вириона
находится матриксный (M)
белок. Оболочка вириона содержит шипы
– два гликопротеина: белок слияния (F)
– вызывает слияние мембран вируса и
клетки; прикрепительный белок (обозначается
по разному для представителей семейства)
– HN (обладает гемагглютинирующей
и нейраминидазной активностью), H
и G.
F-белок
активируется расщеплением клеточной
протеазой на 2 субъединицы (F1
и F2).
Вирусы рода
Rubulavirus кроме F
и HN, содержат трансмембранный
белок SH.
 Их
попадание в организм индуцирует
образование нейтрализующих (протективных)
анитет, которые нацелены на свободные
вирионы и на зараженные клетки,
экспрессирующие оболочечные антигены.
Особенно важны анти-F
антитела, они препятствует распространению
вируса на соседние клетки.
По
антигенным свойствам HN
– прикрепление вирионов к клеточным
рецепторам, NP,
и F-белков
различают 4 основных серотипа вирусов
параграппа: ВПГЧ-1,2,3,4. У трех имеется
общие антигены с вирусом эпидемического
паротита. 1 и 2 склеивают разные эритроциты
(человека, кур, морской свинки и др.), 3
не агглютинирует эритроциты кур, 4
склеивает только эритроциты морской
свинки.
У кори антигены это H,
F
и гемолизин. Имеет общие антигены с
вирусом чумы собак и крупно рогатого
скота. Обладает геммагглютинирующей и
гемолитической активность. Нейраминидазы
нет.
У РСВ это гликопротеин G
(шипы отвечают за связь с рецепторами
клетки) и F
(слияние с мембранами клетки). В результате
вызванного вирусом слияния клеток
образуется синцитий. Гемагглютинин
отсутствует. По поверхностному антигену
можно различить три серотипа РСВ.
Механизм репликации парамиксовирусов:
(-РНК)
– транскрипция – иРНК – трансляция –
белок
Их
попадание в организм индуцирует
образование нейтрализующих (протективных)
анитет, которые нацелены на свободные
вирионы и на зараженные клетки,
экспрессирующие оболочечные антигены.
Особенно важны анти-F
антитела, они препятствует распространению
вируса на соседние клетки.
По
антигенным свойствам HN
– прикрепление вирионов к клеточным
рецепторам, NP,
и F-белков
различают 4 основных серотипа вирусов
параграппа: ВПГЧ-1,2,3,4. У трех имеется
общие антигены с вирусом эпидемического
паротита. 1 и 2 склеивают разные эритроциты
(человека, кур, морской свинки и др.), 3
не агглютинирует эритроциты кур, 4
склеивает только эритроциты морской
свинки.
У кори антигены это H,
F
и гемолизин. Имеет общие антигены с
вирусом чумы собак и крупно рогатого
скота. Обладает геммагглютинирующей и
гемолитической активность. Нейраминидазы
нет.
У РСВ это гликопротеин G
(шипы отвечают за связь с рецепторами
клетки) и F
(слияние с мембранами клетки). В результате
вызванного вирусом слияния клеток
образуется синцитий. Гемагглютинин
отсутствует. По поверхностному антигену
можно различить три серотипа РСВ.
Механизм репликации парамиксовирусов:
(-РНК)
– транскрипция – иРНК – трансляция –
белок
 Для
репликации и транскрипции необходима
РНК-зависимая РНК-полимераза (в составе
вириона).
Геном (-РНК) не способен
выполнять функцию иРНК. Поэтому в
цитоплазме на матрице (–РНК) сначала
синтезируется (+РНК) с помощью полимеразы
(транскриптазы). Короткие нити принимают
участие в синтезе ферментов и белков
для дочерних популяций. Полные нити
служат матрицей для синтеза молекул
(–ДНК) дочерних вирионов. Последние
транспортируются к клеточной мембране
и высвобождаются захватывая при этом
ее фрагмент, он служит для вирусной
частицы суперкапсидом.
Синтез мРНК
совершается раздельно для каждого
белка. Образование репликативной РНК
начинается после накопления вирусных
белков, подавляющих преждевременную
терминацию (-РНК) на внутренних участках
матрицы.
Для
репликации и транскрипции необходима
РНК-зависимая РНК-полимераза (в составе
вириона).
Геном (-РНК) не способен
выполнять функцию иРНК. Поэтому в
цитоплазме на матрице (–РНК) сначала
синтезируется (+РНК) с помощью полимеразы
(транскриптазы). Короткие нити принимают
участие в синтезе ферментов и белков
для дочерних популяций. Полные нити
служат матрицей для синтеза молекул
(–ДНК) дочерних вирионов. Последние
транспортируются к клеточной мембране
и высвобождаются захватывая при этом
ее фрагмент, он служит для вирусной
частицы суперкапсидом.
Синтез мРНК
совершается раздельно для каждого
белка. Образование репликативной РНК
начинается после накопления вирусных
белков, подавляющих преждевременную
терминацию (-РНК) на внутренних участках
матрицы.
«Респираторные» парамиксовирусы, представители, спектр заболеваний, вызываемых парамиксовирусами: Respirovirus (вирусы парагриппа 1, 3) – парагрипп – острая инфекционная болезнь, характеризующаяся катаральным проявлением верхних дыхательных путей; развивается ларинготрахеобронхит, бронхиолит, пневмония. Morbillivirus (вирус кори) – корь – острая антропонозная инфекционная болезнь, характеризующаяся лихорадкой, катаральным воспалением слизистых оболочек верхних дыхательных путей и глаз, а также пятнисто-папулезной сыпью на коже. Вначале (катаральный период) отмечается интоксикация, ринит, фарингит, конъюнктивит, фотофобия и повышение температуры тела. Затем появляется сыпь. Возбудитель подавляет иммунитет, в частности активность T-лимфоцитов, что способствует появлению осложнений в виде пневмоний, воспаления среднего уха и др. Редко развивается энцефалит.
Pneumovirus (респираторно-синцитиальный вирус) – вызывает заболевания нижних дыхательных путей у новорожденных и детей раннего возраста. Вирусы вызывают гибель эпителиальных клеток верхних дыхательных путей. Развивается отек, утолщается стенка бронха, закупоривается просвет слизью и клетками слущенного эпителия. Образуются иммунные комплексы, обусловливающие иммунопатологические реакции. Процесс быстро распространяется на нижние дыхательные пути. Развиваются вторичные бактериальные инфекции с признаками трахеобронхита и пневмонии. Наиболее тяжко заболевание протекает при преобладании Th-2 иммунного ответа с высоким уровнем в крови IgA и IgE.
Вирус кори и вирус эпидемического паротита. Классификация вирусов (семейство, род). Характеристика вириона, антигенная структура. Эпидемиология заболеваний. Патогенез инфекций, тканевой тропизм, клинические проявления, исходы, возможные осложнения. Постинфекционный иммунитет. Специфическая профилактика кори и эпидемического паротита.
Cемейство: Paramyxovirinae Род: Классические возбудители респираторной патологии: 1. Respirovirus (вирусы парагриппа 1, 3) 2. Rubulavirus (вирус паротита и вирусы парагриппа 2, 4) Возбудители системных заболеваний, для них характерна патогенетически значимая вирусемия: 3. Morbillivirus (вирус кори)
Морфология вируса кори типична для парамикросвирусов. Геном – однонитевая, нефрагментированная (- РНК). Кроме нуклеокапсидного белка имеется матриксный (М) белок и поверхностные гликолизированные белки липопротеиновой оболочки – гемагглютинин (H) и белок слияния (F), гемолизин. Вирион паротита тоже сходен с другими парамиксовирусами. Он полимофрный, но чаще имеет сферическую форму. Вирион содержит NP-белок, соединенный с геномом – однонитевой нефрагментированной линейной ( –РНК). Снаружи вирион покрыт оболочкой с гликопротеиновыми шипами (HN- и F-белки).
Эпидемиология: Паротит: Источник инфекции – больной человек, выделяющий вирус за 2 дня до начала болезни и в течении 9 дней болезни. Передается воздушно-капельным путем или через загрязненные слюной предметы. Наиболее восприимчивы дети 5-15 лет, могут и взрослые. Корь: Распространена повсеместно. Высокая восприимчивость и контагиозность. Болеют дети 4-5 лет и реже взрослые, которые не болели в детстве. Источник инфекции – больной человек, выделяющий вирус в последние 2 дня инкубационного периода и до 4 дней после появления сыпи. Основной путь инфицирования воздушно-капельный, реже контактный (тесный).
Патогенез инфекций, тканевой тропизм, клинические проявления, исходы, возможные осложнения: КОРЬ: Входные ворота для возбудителя – слизистые оболочки верхних дыхательных путей и глаз. После репродукции в эпителиальных клетках и региональных лимфатических узлах он поступает в кровь (вирусемия) и поражает эндотелий кровеносных капилляров, что сопровождается появлением папулезной сыпи. Развиваются отек и некротические изменения тканей. Вначале (катаральный период) отмечается интоксикация, ринит, фарингит, конъюнктивит, фотофобия и повышение температуры тела. Затем появляется сыпь. Возбудитель подавляет иммунитет, в частности активность T-лимфоцитов, что способствует появлению осложнений в виде пневмоний, воспаления среднего уха и др. Редко развивается энцефалит и подострый склерозирующий панэнцефалит (ПСПЭ) – медленная вирусная инфекция с летальным исходом в результате поражения ЦНС, гибели нейронов. Развиваются двигательные и психические расстройства. Иммунитет пожизненный (через 1-2 дня IgM, а потом IgG, которые передаются плоду и защищают 6 месяцев – пассивный иммунитет).
ЭПИДЕМИЧЕСКИЙ ПАРОТИТ: Входные ворота инфекции – верхние дыхательные пути. Вирусы размножаются в эпителии слизистых оболочек верхних дыхательных путей и, возможно, в околоушных железах. Затем они поступаю в кровь и разносятся по организму, попадая в яички, поджелудочную и щитовидную железы, мозговые оболочки и другие органы, вызывая их воспаление. Болезнь продолжается около недели (повыш.температура, головная боль, недомогание). Воспаляются одна или обе околоушные железы. Развиваются осложнения – орхит (что приводит к бесплодию), менингит, менингоэнцефалит, панкреатит. Нередко наблюдается бессимптомное лечение. Иммунитет после перенесенной болезни вырабатывается пожизненный. Специфическая профилактика кори и эпидемического паротита: Моно- и ассоциированные вакцины для плановой и экстренной профилактики кори и паротита:
Вакцина живая коревая.
Паротитная культуральная живая вакцина (активный иммунитет_
Вакцина паротитно-коревая культуральная живая сухая
Ассоциированная вакина против кори, паротота, краснухи.
Иммуноглобулины:
Нормальный иммуноглобулин человека для лечения кори и ослабленным детям не позднее 7-го дня инкубационного периода (иммуномодуляторы и рибавирин)
Специфический иммуноглобулин для лечения паротита
Вирус/заболевание |
Парагрипп |
РС-вирус |
Корь |
Паротит
|
Материал для исследования |
Слизь, смыв из дыхательных путей, мокрота |
Отделяемое носоглотки., ткань легких |
Смыв носоглотки, соскобы с элементов сыпи, кровь, моча |
Слюна, цереброспинальная жидкость, моча, сыворотка крови |
Культивирование |
Первичные культуры клеток |
Культуры клеток почек обезьян |
Культуры клеток почек обезьян |
Культуры клеток куриных фибробластов или куриный эмбрион |
Вирусологический анализ. Идентификация вирусов. |
РТГА, РСК, РБН |
РСК, РБН |
РТГА, РСК, РБН
|
РТГА, РСК, РБН |
Серодиагностика. Выявление антител. Реакции с парными сыворотками |
РТГА, ИФА, РСК, РБН. |
РСК, ИФА, РБН |
ИФА, РТГА, РСК Высокий титр IgM и низкий титр IgG в острый период Инфекции
|
ИФА, РТГА, РСК, РБН Высокий титр IgM и низкий титр IgG в острый период инфекции |
Экспресс-диагностика |
РИФ |
РИФ |
РИФ, ПЦР |
РИФ, ПЦР |
Примечание |
Диагностика проводится редко |
В случае затруднений в диагностике по клинической картине заболевания |
||
ИФА- иммуноферментный анализ
РТГА- реакция торможения гемагглютинации
РНГА- реакция непрямой гемагглютинации
РСК- реакция связывания комплемента
РИФ- реакция иммунофлуоресценции
РБН- реакция нейтрализации в биологических пробах (биологической нейтрализации).
ПЦР- полимеразная цепная реакция
Orthomyxoviridae. Классификация (типы, субтипы). Характеристика вириона, антигенная структура. Особенности репликации вируса (зоны депротеинизации, репликации РНК). Патогенез гриппа: входные ворота инфекции, клеточные мишени, возможные осложнения. Мишени для этиотропной терапии гриппа А. Принципы лабораторной диагностики.
Грипп
– острое инфекционное вирусное
заболевание человека, характеризуется
поражением респираторного тракта,
лихорадкой, общей интоксикацией и
нарушением деятельности СС и НС.
семейство
Orthomyxoviridae
род Influenzavirus A, вирус тип А
(серотип А)
род Influenzavirus B, вирус тип В
род Influenzavirus С, вирус тип С
 По
антигенной структуре тип А подразделяется
на подтипы, а они на множество вариантов.
A
(тип нуклеинового материала)/Fulian
(происхождение) /411 (порядковый номер
штамма)/2002 (год выделения) /(H3N2)
– подтип вируса-антигенная характеристика
поверхностных структур (гемаглютинин
и нейраминидаза)
По
антигенной структуре тип А подразделяется
на подтипы, а они на множество вариантов.
A
(тип нуклеинового материала)/Fulian
(происхождение) /411 (порядковый номер
штамма)/2002 (год выделения) /(H3N2)
– подтип вируса-антигенная характеристика
поверхностных структур (гемаглютинин
и нейраминидаза)
Имеет сферическую форму. Вирион представляет собой нуклеокапсид, покрытый липопротеиновой оболочкой. Имеет средние размеры. Как и все вирусы облигатные внутриклеточные паразиты существуют в двух разных формах: внутриклеточные для репликации, а внеклеточные для передачи инфекционного начала (вирион), имеет все структурные компоненты. 1. Геном вируса гриппа представлен однонитчатой сегментированной (-РНК). (А-8 сегментов, B-8 сегментов и C-7 сегментов). Каждый сегмент кодирует отдельный белок (4 и 6 кодируют поверхностные антигены, они важнее). РНК определяет высокую изменчивость, то есть информация которая закодирована в геноме. 2. Капсид состоит из нуклеопротеина (NP) – структурная и регуляторная роль. А также белки (P) и ферменты РНК-полимеразного комплекса, которые соединены с каждым сегментом. PB1 (P1), PB2 (P3) – основные, щелочные и PA (P2) – кислотные свойства. На основе каждого из сегментов создается комплементарная мРНК для синтеза вирусных белков. Нуклеокапсид (РНК+NP+P) – «кор» - совокупность нуклеиновой кислоты покрытой капсидом. У вируса гриппа – спиральный тип симметрии нуклеокапсида. Являеется сложным вирусом.
M-матриксный белок – изнутри выстилает суперкапсид. Стабилизирует вирион и учавствует в сборке вирусных частиц (стыковка капсида и суперкапсида при почковании вириона). Отличается у типов A, B и C. 3. Суперкапсид – наружная липопротеиновая оболочка (двойной слой липидов и имеет клеточное происхождение – формируется из мембраны поврежденной клетки хозияна). Чувствительна к эфиру. Его пронизывают гликопротеиновые шипы, которые погружены в билипидный слой и состоят из гемагглютинина (HA, больше чем NA) и нейраминидазы (NA, у типа C нет сегмента кодирующего). Антигены: Внутренние – нуклепротеин NP, РНК-полимеранызный комплекс (3) и белок M. Определяют тип/вид, то есть типоспецифические Наружные – гемагглютинин 16 вариантов (H1, H2, H3) и нейраминидазы 9 вариантов (N1, N2) определяют внутри типа субтиповые варинаты. Вирусы типа A – H1N1, H3N2 и H2N2. Являются протективными антигенами (те антигены, в ответ на которые образуются защитные антитела).
Особенности
репликации вируса (зоны депротеинизации,
репликации РНК):
(-РНК)
– транскрипция – иРНК – трансляция –
белок
 1.
Прикрепление (гемагглютин к специфическим
рецепторам хозяина – сиаловая кислота)
2.
Проникновение путем эндоцитоза (простые
вирусы эндоцитозом, а сложные – слиянием
мембран). Тут не исключение, но проникает
как простой будучи сложным. Формирование
эндосомы.
3. Кислая среда внутри
фагосомы меняет конформаци H
(обретает активность после ограниченного
протеолиза): обнажает пептиды (F-белки),
вызывающие слияние вирусной и
фаголизосмальной мембран (H-фактор
слияния). То есть геммаглютинин отвечает
за адгезию и является фактором слияния
мембран. Как флешка, если не обнажить
участок, то не будет взаимодействия.
(Step
by
step
– это этапы взаимодействия вируса с
мембраной, лекция)
4. Депротеинизация
– нуклеокапсид освобождается от
суперкапсида (внутри эндосомы в результате
активации клеточными ферментами
поверхностого антигена гемагглютинина,
на рисунке типа часть суперкапсида
октрывается и образует общую дырку с
эндосомой). Получается слияние,
взаимодействия и депротеинизация.
5.
Нуклеокапсид выходит в цитоплазму.
Вместе с M-белком
транспортируется в ядро!!! (На ядерной
мембране окончательная депротеинизация
и в ядро только функционально активный
нуклеокапсид без M-белка).
Вирус гриппа реплицируется в ядре!
6.
Синтез нуклеиновых кислот вируса в ядре
клетки хозяина!
7. Синтез белка идет
в цитоплазме. Готовые мРНК переправляются
в цитоплазму, где транслируются на
рибосомах в вирусные белки.
8. Часть
синтезированных белков (полимеразные
комплексы) и структурный белок
(нуклеопротеин) вновь переходят в ядро
и идет сборка новых вирионов по принципу
самосборки (образование нуклеокапсидов
в ядре!!!)
Гемагглютинин и нейраминидаза
(поверхностные, та самая еще одна часть)
включаются в мембрану клетки хозяина
– фргаменты будущего суперкапсида.
9.
С внутренней стороны бислоя присоединяется
M-белок,
то есть определяет закрепление новых
«дочерних» нуклеокапсидов в зоне, через
которую они будут покадать клетку путем
почкования (типично для оболочечных
вирусов)
10. Выход из клетки путем
почкования (вирус получает суперкапсид
с H
и N).
Сбрасывание усиливается нейраминидазой
(разьединяет контакты вирусной частицы
от клетки хозяина).
Репликация
происходит достаточной быстро, потомство
через 6-8 часов в октиллион 10^8 вирусных
частиц.
Функции H:
рецепторная, фактор слияния, главный
протективный АГ, определяет пандемичность
вируса
Функции NA:
фактор распространения – расширяет
зону инфекции, протективный АГ, определяет
пандемические и эпидемические
свойства
Патогенез
гриппа: входные ворота инфекции, клеточные
мишени, возможные осложнения:
(лекция)
Входные ворота – это верхние дыхательные
пути (эпителиоциты слизистой), но вирус
может проникнуть сразу в альвеолы, что
вызывает развитие первичной пневмонии.
Повреждение эпителиоцитов приводит
к индукции воспалительной реакции
(задействованы макрофаги и лимфоциты)
Секреция
цитокинов
Общая интоксикация и
поддержание местного воспалительного
процесса
(Реже) вирус проникает
в кровоток (через поврежденные
эпителиальные барьеры) и вызывает
виремию
Активизирует систему
протеолиза и вызывает повреждение
эндотелия капилляров
Повышается
проницаемость сосудов и серозных
оболочек
Геморрагии и нарушение
гемодинамики с расстройствами
микроциркуляции – геморрагическая
пневмония и отек легких
(Учебник)
Первичная репродукция вирусов происходит
в клетках эпителия респираторного
тракта. Инфицированные клетки начинают
вырабатывать интерферон, оказывающий
неспецифическое противовирусное
действие.
Развиваются отек, набухание
базальной мембраны, происходит десквамация
клеток поверхностного эпителия. Через
поврежденные эпителиальные барьеры
вирус гриппа A
проникает в кровоток и вызывает виремию.
Всасывание продуктов распада клеток
также оказывает токсическое и
сенсибилизирующее действие на организм.
Вирус активирует систему протеолиза
и вызывает повреждение эндотелия
капилляров. Это повышает проницаемость
сосудов и серозных оболочек, что вызывает
геморрагии и нарушение гемодинамики с
расстройствами микроциркуляции.
При
гриппе также развивается транзиторный
вторичный иммунодефицит, что предрасполагает
к развитию вторичной бактериальной
инфекции.
Вирус гриппа нейротропен,
возможен нейротоксикоз, в резульате
чего может наступить смерть (чаще у
детей). Опасное осложнение – геморрагическая
пневмония и отек легких. Геморрагический
синдром – кровоизлияния в кожу. Бывает
абдоминальный сиднром – боли в животе,
тошнота, диарея, рвота. Грипп A
может осложняться нарушениями функций
нервной, сердечно-сосудистой систем,
печени, почек и др. Грипп B
протекает легче, может сопровождаться
глазной болезнью, конъюнктивитом, не
обладает нейротропностью. Грипп C
протекает легко.
Также осложнением
бывает вторичная бактериальная
бронхопневмония – летальна, вызывают
пневмококк, палочка инфлюэнцы, золотистый
стафилококк. Развивается в зонах
выраженного повреждения эпителия, а
симптомы возникают в период рековалесценции
от гриппа (вторая волна). Обычно у пожилых
и хронически больных ДС, ССС.
Мишени
для этиотропной терапии гриппа А:
Вирусы
не имеют клеточного строения, анатибиотики
для бактериальных инфекций – бесполезны.
Вирусы облигатные внутриклеточные
паразиты, тесно взаимодействуют с
клеткой и какой-либо этап не блокирую,
то можно навредить хозяину!
Блокаторы
депротеинизации:
ремантадин – блокирует ионные каналы
белка M2
и изменение pH
лизосом (у B
нет такого белка, только для типа A).
Лечение эффективно только первые 48ч,
нельзя детям и беременным, токсическое
действие на печень и почки.
Ингибиторы
нейраминидазы:
озельтамивир (тамифлю) – связывает
стабильные участки N,
одинаковые у всех вирусов гриппа и
блокируют выход нового потомства и
инфицирование новых. Эффективен при
раннем лечении не позднее 36 часов.
При
присоединение бактериальной инфекции
– назначают антибиотики.
1.
Прикрепление (гемагглютин к специфическим
рецепторам хозяина – сиаловая кислота)
2.
Проникновение путем эндоцитоза (простые
вирусы эндоцитозом, а сложные – слиянием
мембран). Тут не исключение, но проникает
как простой будучи сложным. Формирование
эндосомы.
3. Кислая среда внутри
фагосомы меняет конформаци H
(обретает активность после ограниченного
протеолиза): обнажает пептиды (F-белки),
вызывающие слияние вирусной и
фаголизосмальной мембран (H-фактор
слияния). То есть геммаглютинин отвечает
за адгезию и является фактором слияния
мембран. Как флешка, если не обнажить
участок, то не будет взаимодействия.
(Step
by
step
– это этапы взаимодействия вируса с
мембраной, лекция)
4. Депротеинизация
– нуклеокапсид освобождается от
суперкапсида (внутри эндосомы в результате
активации клеточными ферментами
поверхностого антигена гемагглютинина,
на рисунке типа часть суперкапсида
октрывается и образует общую дырку с
эндосомой). Получается слияние,
взаимодействия и депротеинизация.
5.
Нуклеокапсид выходит в цитоплазму.
Вместе с M-белком
транспортируется в ядро!!! (На ядерной
мембране окончательная депротеинизация
и в ядро только функционально активный
нуклеокапсид без M-белка).
Вирус гриппа реплицируется в ядре!
6.
Синтез нуклеиновых кислот вируса в ядре
клетки хозяина!
7. Синтез белка идет
в цитоплазме. Готовые мРНК переправляются
в цитоплазму, где транслируются на
рибосомах в вирусные белки.
8. Часть
синтезированных белков (полимеразные
комплексы) и структурный белок
(нуклеопротеин) вновь переходят в ядро
и идет сборка новых вирионов по принципу
самосборки (образование нуклеокапсидов
в ядре!!!)
Гемагглютинин и нейраминидаза
(поверхностные, та самая еще одна часть)
включаются в мембрану клетки хозяина
– фргаменты будущего суперкапсида.
9.
С внутренней стороны бислоя присоединяется
M-белок,
то есть определяет закрепление новых
«дочерних» нуклеокапсидов в зоне, через
которую они будут покадать клетку путем
почкования (типично для оболочечных
вирусов)
10. Выход из клетки путем
почкования (вирус получает суперкапсид
с H
и N).
Сбрасывание усиливается нейраминидазой
(разьединяет контакты вирусной частицы
от клетки хозяина).
Репликация
происходит достаточной быстро, потомство
через 6-8 часов в октиллион 10^8 вирусных
частиц.
Функции H:
рецепторная, фактор слияния, главный
протективный АГ, определяет пандемичность
вируса
Функции NA:
фактор распространения – расширяет
зону инфекции, протективный АГ, определяет
пандемические и эпидемические
свойства
Патогенез
гриппа: входные ворота инфекции, клеточные
мишени, возможные осложнения:
(лекция)
Входные ворота – это верхние дыхательные
пути (эпителиоциты слизистой), но вирус
может проникнуть сразу в альвеолы, что
вызывает развитие первичной пневмонии.
Повреждение эпителиоцитов приводит
к индукции воспалительной реакции
(задействованы макрофаги и лимфоциты)
Секреция
цитокинов
Общая интоксикация и
поддержание местного воспалительного
процесса
(Реже) вирус проникает
в кровоток (через поврежденные
эпителиальные барьеры) и вызывает
виремию
Активизирует систему
протеолиза и вызывает повреждение
эндотелия капилляров
Повышается
проницаемость сосудов и серозных
оболочек
Геморрагии и нарушение
гемодинамики с расстройствами
микроциркуляции – геморрагическая
пневмония и отек легких
(Учебник)
Первичная репродукция вирусов происходит
в клетках эпителия респираторного
тракта. Инфицированные клетки начинают
вырабатывать интерферон, оказывающий
неспецифическое противовирусное
действие.
Развиваются отек, набухание
базальной мембраны, происходит десквамация
клеток поверхностного эпителия. Через
поврежденные эпителиальные барьеры
вирус гриппа A
проникает в кровоток и вызывает виремию.
Всасывание продуктов распада клеток
также оказывает токсическое и
сенсибилизирующее действие на организм.
Вирус активирует систему протеолиза
и вызывает повреждение эндотелия
капилляров. Это повышает проницаемость
сосудов и серозных оболочек, что вызывает
геморрагии и нарушение гемодинамики с
расстройствами микроциркуляции.
При
гриппе также развивается транзиторный
вторичный иммунодефицит, что предрасполагает
к развитию вторичной бактериальной
инфекции.
Вирус гриппа нейротропен,
возможен нейротоксикоз, в резульате
чего может наступить смерть (чаще у
детей). Опасное осложнение – геморрагическая
пневмония и отек легких. Геморрагический
синдром – кровоизлияния в кожу. Бывает
абдоминальный сиднром – боли в животе,
тошнота, диарея, рвота. Грипп A
может осложняться нарушениями функций
нервной, сердечно-сосудистой систем,
печени, почек и др. Грипп B
протекает легче, может сопровождаться
глазной болезнью, конъюнктивитом, не
обладает нейротропностью. Грипп C
протекает легко.
Также осложнением
бывает вторичная бактериальная
бронхопневмония – летальна, вызывают
пневмококк, палочка инфлюэнцы, золотистый
стафилококк. Развивается в зонах
выраженного повреждения эпителия, а
симптомы возникают в период рековалесценции
от гриппа (вторая волна). Обычно у пожилых
и хронически больных ДС, ССС.
Мишени
для этиотропной терапии гриппа А:
Вирусы
не имеют клеточного строения, анатибиотики
для бактериальных инфекций – бесполезны.
Вирусы облигатные внутриклеточные
паразиты, тесно взаимодействуют с
клеткой и какой-либо этап не блокирую,
то можно навредить хозяину!
Блокаторы
депротеинизации:
ремантадин – блокирует ионные каналы
белка M2
и изменение pH
лизосом (у B
нет такого белка, только для типа A).
Лечение эффективно только первые 48ч,
нельзя детям и беременным, токсическое
действие на печень и почки.
Ингибиторы
нейраминидазы:
озельтамивир (тамифлю) – связывает
стабильные участки N,
одинаковые у всех вирусов гриппа и
блокируют выход нового потомства и
инфицирование новых. Эффективен при
раннем лечении не позднее 36 часов.
При
присоединение бактериальной инфекции
– назначают антибиотики.
Influenzavirus A. Шифт- и дрейф-вариации: причины, механизм. Участие антигенов суперкапсида в возникновении новых субтипов и эпидемических штаммов. Актуальные (современные) субтипы вируса гриппа А. Протективные антигены вируса. Варианты и состав вакцин. Иммунитет. Проблемы вакцинопрофилактики.
Изменчивость высокая и определяется двумя процессами: антигенный дрейф (происходит постоянно) и шифт (редко, тип A). Дрейф – это незначительные изменения структуры гемагглютинина/нейраминидазы, которые происходят часто и обусловлены точечными мутациями в участках генома вируса, которые отвечают за синтез и структуру детерминат поверхностых антигенов. Шифт – это появление новой разновидности гемагглютинина/нейраминидазы, которые обусловлены пересортировкой и полной заменой гена, кодирующего эти антигены. Имеет генетическую детерминацию, в результате рекомибнаций, происходящих при попадании в одну клетку двух разных подтипов вирусов. Источинком новых подтипов могут быть вирусы гриппа животных. Имеет экологическую детерминацию, результат экологически зависимой перетасовки генов. Результат дрейфа: новый серовариант, незначительно отличается от исходного штамма, изменения не выходят за пределы подтипа. Вызывает периодически эпидемии, определят трудности получения надежной вакцины и поддерживает эпидемическую значимость циркулирующих субтипов. Результат шифта: новый подтипа, сопровождается сменой субтипов поверхностных белков вириона (шифт-вариант). Вызывает пандемии. Актуальные (современные) субтипы вируса гриппа А: В последние годы в эпидемическом процессе одновременно участвуют вирусы гриппа A (H3N2 и H1N1), а также вирус гриппа типа B. Поэтому такие разновидности вирусов включены в состав современных вакцин для профилактики гриппа.
Протективные антигены вируса: Внутренние – нуклепротеин NP, РНК-полимеранызный комплекс (3) и белок M. Определяют тип/вид, то есть типоспецифические Наружные – гемагглютинин 16 вариантов (H1, H2, H3) и нейраминидазы 9 вариантов (N1, N2) определяют внутри типа субтиповые варинаты. Вирусы типа A – H1N1, H3N2 и H2N2. Являются протективными антигенами (те антигены, в ответ на которые образуются защитные антитела). Функции H: рецепторная, фактор слияния, главный протективный АГ, определяет пандемичность вируса Функции NA: фактор распространения – расширяет зону инфекции, протективный АГ, определяет пандемические и эпидемические свойства. Варианты и состав вакцин: 1. Живые: вакцина гриппозная аллантоисная живая интраназальна/подкожная 2. Инактивированные: цельновирионные, сплит-вакцины, и химические Живые вакцины создают наиболее полноценный, в том числе местный, иммунитет. Однако они и инактивированные цельновирионные или убитвые вакцины могут вызывать аллергию у лиц с повышенной чувствительностью к куриному белку. Субъединичные или химические вакцины содеражать только протективные антигены. Сплит-вакцины – расщепленные, содержат поный набор вирусных антигенов, но их них удалены липиды внешней оболочки, чтобы уменьшить пирогенный эффект, то есть высокоочищеные и разрушенные вирусы. Состав вакцин сезона 2019/2020 гг: A/Брисбан/02/2018/H1N1 – pdm09-подобный вирус A/Канзас/14/2017/H3N2 – подобный вирус B/Колорадо/06/2017/(Линия B/Victoria/2/87) Вирус типа B/Пхукет/3073/2013/(Линия B/Ямагата/16/88)
Сезон 2014/2015 гг: A/Калифорния/7/2009/H1N1 – «свиной грипп» с 2010 года входит в вакцинацию A/Техас/50/2012/H3N2 и B/Массачусетс/2/2012 (он входит в вакцину соответственно уже три года). Иммунитет: Иммунитет стойкий, но типоспецифический. Во время забоелвания участвуют факторы неспецифической защиты организма, a-интерферон, специфические IgA в секрета респираторного тракта, которые обеспечивают местный иммунитет. Протективные антитела появляются на 7-8 день и достигает максимального уровня через 2-3 недели. В ходе реконвалесценции важна роль клеточного иммунитета (NK-клетки и специфические цитотоксичческие Т-лимфоциты). Единственное надежное средство – создание коллективного иммунитета (массования вакцинация) Неспецифическая профилактика: карантин и разобщение Специфическая: вакцина перед началом эпидемического сезона (сентябрь-середина ноября).
Проблемы вакцинопрофилактики: -Вакцина против гриппа обновляется каждый год и должна содержать наиболее распространенные разновидности вируса в этому году на основе рекомендаций ВОЗ -Прогнозы ВОЗ не обладают абсолютной точностью -Невозможность оперативного реагирования в случае развития пандемии гриппа, так как на создание вакцины требуется минимум полгода без четких данных об эффективности - Вакцинация действует только на определные вирусы гриппа и не действует на остальных возбудителей гриппа и ОРВИ (которых более 200) - Трудность планирования вакцинальной кампании, так как эпидемии каждый год начинаются в разное время - Не может применяться экстренно (должна применяться минимум за 2 недели до эпидемии).
Picornaviridae. Классификация (наиболее значимые родовые таксоны). Характеристика вириона, антигенная структура. Механизм репликации вируса. Род Rhinovirus и род Enterovirus (представители, эпидемиология, спектр заболеваний, проблемы вакцинации). Политропность вирусов Коксаки и ЕСНО.
Семейство Picornaviridae (самый маленький вирус человека) Роды:
1.
Enterovirus:
вирусы полиомиелита (C:
3 серотипа), вирусы Коксаки A,
вирусы Коксаки B,
вирусы ECHO
– механзим передачи: фекально-оральные
и возможен воздушно-капельный. Входные
ворота: эпителий ЖКТ
2. Rhinovurus:
вирусы вызывают, главным образом,
инфекции дыхательных путей, включая
насморк
3. Hepatovirus:
вызывают гепатит A,
представитель – вирус гепатита A
4.
Apthovirus: вызывают афтозные поражения кожи
и слизистых. Представитель- вирус
ящура
5. Cardiovirus:
вызывают энцефаломиокардит животных
(грызунов)
Характеристика
вириона, антигенная структура:
Безоболочечный
(простой) вирус, капсид имеет кубический
тип симметрии (тип икоссаэдра). Вирион
представлен нуклеокапсидом. Геном
вируса имеет одну нитевую (+РНК), которая
стабилизирована белком VPg.
РНК вируса окружена капсидом состоящим
из четырех протеинов (1,2,3,4). Первые 3
образуют наружнюю оболочку капсида, 4
выстилает внутренюю часть
капсида.
Отличительная особенность
пикорновирусов является стабильная
антигенная структура: антигеном считаются
все белки капсида в совокупности, как
единый антиген. Антигенная структура
не консервативна, значит антиген мы
можем говорить что вирус обладает
антигенным консервативным.

Вирус полиомиелита простой, но имеет необычный механизм проникновения РНК в клетку: 1. Сначала происходит рецепторное взаимодействие между капсидом вируса и пермиссивной клеткой, которое вызывает конформационные изменения в оболочке вируса. Изменение приводит к тому, что конформация капсидных белков открывается канал, через который выходит наружу РНК вируса
2.После обнажения вирусной РНК она может впрыскиваться внутрь клетки хозяина в цитозоль, т.е. вирус действуют аналогично бактериофагам. Подобный вариант инфицирования невсегда удачный и этом может быть одной из причин бессимтомным течением полиомиелита.
Механизм
репликации вируса:
(+РНК)
– трансляция – белок

Попадая в клетку, вирионная РНК выполняет функции информацинной (матричной РНК). Такие (+РНК) вирусы напрямую транслируют свою геномную молекулу с образованием вирусных белков. Клеточные рибосомы связываются с вирионной РНК, образуя крупные полирибосомы, которые продуцируют полипротеин. Подвергаясь действию протеаз, одновременно образуется полимераза и полипротеин продуцирует структурные и неструктурные белки. Новые (+РНК) синтезируются благодаря неструктурной РНК-зависимой РНК-полимеразе. Она образует комплементарную (-РНК), которая используется для репликации (+РНК). Вновь образованные (+РНК) включаются в состав новых вирионов или выполняют функции мРНК.
Особенности репликации: 1. Подобно РНК-вирусам полиовирусы реплицируются в цитоплазме (орто – в ядре, пара – в цитоплазме) 2. Занимает 5-10 часов, затем массовый выход который приводит к повреждению мембраны клетки и лизису клетки хозяина 3. Вирусы полиомиелита обладаюют из других пикорнавирусов наибольшее цитопатической активностью
Род Rhinovirus и род Enterovirus (представители, эпидемиология, спектр заболеваний, проблемы вакцинации): Риновирусы: наибольшее число серотипов среди пикорнавирусов вызывающих ОРВИ (115 серотипов), рецептором риновирусов является межклеточная адгезивная молекула I (ICAM-I), которая экспрессируется на эпителиальных клетках, фибробластах и эндотелиальных клетках. Механизм передачи: аэрозольный и контактно-бытовой. Проникают через нос, полость рта, конъюнктиву. Процесс начинается в верхних дыхательных путях. Вызывают воспалительные заболевания верхних дыхательных путей. Осложнения риновирусных инфекций у взрослых встречаются редко; у детей иногда развиваются бронхиты, синуситы и отиты. Лечение риновирусных инфекций симптоматическое. Вакцинопрофилактика риновирусных инфекций невозможна ввиду большого числа серологических вариантов возбудителя. Энтеровирусы: группа вирусов, обитающая преимущественно в кишечнике человека и вызывающая разнообразные по клиническим проявлениям болезни человека. Род представлен вирусом полиомиелита (C: 3 серотипа), вирусом Коксаки A, вирусом Коксаки B, вирусом ECHO и энтеровирусами A, B, C и D, состоящими из серотипов. Распространены повсеместно. Преимущественно поражают детей. Источник инфекции – больные и носители. Из организма больного возбудители выделяются с носоглоточной слизью и фекалиями, а из организма вирусоносителя – с фекалиями. Передаются через воду, почу, пищевые продукты, предметы обихода, загрязненные руки, через мух. Первые 1-2 недели энтеровирусы выделяются из носоглотки, обусловливая воздушно-капельный путь передачи.
Возбудитель проникает в организм через слизистые оболчоки носоглотки и тонкой кишки, размножается в их эпителиальных клетках и регионарных лимфатических узлах, затем попадает в кровь. Последующее распространение определяется их свойствами и состоянием больного. Вызывают заболевания, характеризующиеся многообразной клиникой, так как могут поражать различные органы и ткани: ЦНС, сердце, органы дыхания, пищеварительный тракт (рвота, диарея), кожные (сыпь, гиперемия) и слизистые покровы.
Для профилактики энтеровирусных инфекций (за исключением полиомиелита) специфические средства не применяют (так как в окружающей среде присутствует более 70 серотипов этих вирусов, а иммунизация возможна лишь к определенному виду). Большее значение имеет неспецифическая профилактика. Детям общавшись с больным рекомендуют пить препараты интерферона. Стойкий иммунитет.
Политропность вирусов Коксаки и ЕСНО: Вирусы – лидеры по политропности среди пикорнавирусов Коксаки (название города), ECHO (кишечные цитопатические вирусы-сироты человека) Основные заболевания, ассоциированные с вирусами (90% инфекций – инаппарантные (безсимптомные) или субклинические) Коксаки A (24 серотипа) – герпангина, кожные экзантемы, острый геморрагический конъюнкитвит, острые кишечные заболевания (ОКЗ) Коксаки B (6 серотипов) – полиомиелитподобные энтеровиусы с максимальной кардиотропностью (перикардит, миокардит, плевродиния – эпидемическая миалгия) Общее – асептический менингит и др. (энцефалит, параличи, ОРЗ, гепатиты) ECHO (34 серотипа) – асептический менингит и др. (параличи, энцефалиты, экзантемы, перикардиты и миокардиты, респираторные заболевания, диарею новорожденных, эпидемическую миалгию, гепатиты)
Вирусы полиомиелита. Классификация (семейство, род), экология и эпидемиология. Патогенез полиовирусной инфекции. Зоны первичной репликация вируса. Понятие о первичной и вторичной вирусемии. Механизм повреждения клеток. Основные варианты инфекции, возможные исходы. Принципы лабораторной диагностики. Специфическая профилактика. Семейство Picornaviridae (самый маленький вирус человека) Род Enterovirus: вирусы полиомиелита (C: 3 серотипа), вирусы Коксаки A, вирусы Коксаки B, вирусы ECHO – механзим передачи: фекально-оральные и возможен воздушно-капельный. Входные ворота: эпителий ЖКТ
Полиомиелит – острое лихорадочное заболевание, которое иногда сопровождается поражением серого вещества спинного мозга и ствола головного мозга, в результате чего развиваются вялые параличи и парезы мышц ног, туловища, рук.
Экология и эпидемиология: Заболевание регистрируется повсеместно. Источник инфекции - больной человек или носитель. Механизмы передачи – фекально-оральный, не исключается аспирационный (аэрогенный) механизм. Пути передачи - водный, пищевой, предметно-бытовой, воздушно-капельный, воздушно-пылевой. Входные ворота – слизистые оболочки кишечника и носоглотки. Вирус полиомиелита появляется в отделяемом носоглотки через 36 часов, а в испражнениях – через 72 часа после заражения и обнаруживается в носоглотке в течение одной недели, а в испражнениях – в течение 3-6 недель. Наибольшее выделение вируса происходит в течение первой недели заболевания. Заболевают преимущественно дети до 10 лет. Отмечается летне-осенняя сезонность заболевания. Обладает высокой усточивостью: низкие температуры, высушивание, морозы, в почве до полугода. При комнатой температуре – несколько дней.
Патогенез
полиовирусной инфекции. Зоны первичной
репликация вируса. Понятие о первичной
и вторичной вирусемии. Механизм
повреждения клеток:
Входными воротами ворота – слизистые оболочки верхних дыхательных путей и пищеварительного тракта. Первичная репродукция вирусов происходит в лимфатических узлах глоточного кольца и тонкой кишки. Это обусловливает обильное выделение вирусов из носоглотки и с фекалиями еще до появления клинических симптомов болезни. Из лимфатической системы вирусы проникают в кровь (виремия), а затем в ЦНС (1-2% случаев), где избирательно поражают клетки передних рогов спинного мозга (двигательные нейроны серого вещества) – паралитическая форма полиомиелита, так как характерен нейротропизм! В результате этого возникают параличи мышц. В случае накопления в крови вирус-нейтрализующих антител, блокирующих проникновения вируса в ЦНС, ее поражения не наблюдается. Первичная репликация вируса происходит в эпителии ротовой полости и глотки, лимфатических узлах глоточного кольца, в эпителии и пейеровых бляшках тонкого кишечника (Больше все таки в лимфоидной ткани) У некоторых больных вирусы из лимфатической системы проникают в кровь. Развивается первичная вирусемия (виремия, то есть распространение именно по крови). В этом случае возникают симптомы заболевания, которое называется “малой болезнью”. Отмечаются кратковременная лихорадка, фарингит, небольшой кашель, насморк. На этой стадии заболевание в большинстве случаев заканчивается (абортивная или легкая форма полиовирусной инфекции). Поскольку симптомы сходны с ОРЗ. У части больных при размножении вирусов во внутренних органах развивается повторная вторичная (основная) вирусемия (то есть поражение именно тканей). При этом на фоне “малой болезни” развиваются симптомы воспаления мозговых оболочек (менингеальная форма). Эта форма заболевания протекает без параличей и обычно также заканчивается полным выздоровлением. Основные варианты инфекции, возможные исходы: Poliovirus (3 серотипа) У 95% отмечается бессимптомная (инаппарантная) инфекция – полностью выздорваливают У 4% отмечается абортивная инфекция ( «малая болезнь» ) – полностью выздоравливают У 1% отмечается паралитический полиомиелит – 50% полностью выздоравливают (пораженные нервные клетки не погибают и постепенно восстанавливают свою функцию), 25% сохраняют дееспособность (односторонняя атрофия, паралич), 25% становятся недееспособными (множественные параличи, контрактуры). В таких случаях нервные клетки погибают и замещаются глией. Исход паралитических форм прямо пропорционален уровню вирусемии и обратно пропорционален уровню иммуного ответа. Редко, пациенты погибают (паралич дыхательных мышц, диафргамы) И непаралитический полиомиелит (асептический менингит и энцефалит) – симптомы сохраняются 2-10 дней с последующим полным выздоровлением. У них наиболее выраженая нейротропность среди пикорнавирусов. Принципы лабораторной диагностики. Специфическая профилактика:
Экспресс-диагностика: основана на обнаружении специфических участков РНК вируса в материале при помощи полимеразной цепной реакции (ПЦР).
Иммунологический метод (серодиагностика): при серологической диагностики исследуют парные сыворотки от больного. Обнаружение противовирусных антител и сероконверсию проводят в реакции нейтрализации ЦПД - «цветная проба» ( см. ниже)
Вирусологический (культуральный) метод: для выделения вирусов у больных исследуют кровь, испражнения, секрет из носоглотки.
Культивирование проводят в первичных тканевые культурах.
При культивировании вирусов in vitro изменения клеток, их гибель и нарушение монослоя. Эти изменения видны при микроскопировании соответствующих тканевых культур.
Для идентификации выделенного вируса используют серотипирование при помощи иммунных сывороток к разным серотипам. Сотипирование проводят в реакции нейтрализации цитопатического действия вируса (ЦПД) с помощью, так называемой, «цветной пробы».
Цветная проба основана на учете изменения красного цвета питательной среды. Реакцию ставят в пробирках с питательной жидкой средой для культивирования клеток человека (например, питательная среда DMEM), содержащей индикатор феноловый красный. Среда необходима для роста и размножения культуры клеток человека. Под влиянием продуктов метаболизма живых клеток рН среды изменяется в кислую сторону, и среда приобретает желтый цвет. Если клетки были инфицированы вирусом, обладающим ЦПД, то культура погибает, и цвет среды остается неизменным, т.е. красным.


Полный курс вакцинации состоит из трех прививок и проводится детям первого года
жизни в возрасте 3 - 4,5 - 6 месяцев. Ревакцинация состоит из трех прививок и проводится
дважды на втором году жизни (в 18 и 20 месяцев) и в 14 лет.
Важно: первая и вторая вакцинации (в 3 мес. и 4,5 мес.) проводятся инактивированной
вакциной для профилактики полиомиелита (ИПВ). Третья вакцинация (в 6 мес.) и
последующие ревакцинации против полиомиелита проводятся детям оральной живой
полиомиелитной вакциной (ОПВ) – Чумаков и Смородинцев
Лечение – патогенетическое (терапия, направленная на коррекцию нарушенных функций органов, нормализацию обмена веществ, повышение неспецифической резистентности и иммунной реактивности организма) Иммунитет пожизненый типоспецифический. Определяется вируснейтрализующими антителами, особенно местным секреторным антителам слизистой оболочки глотки и кишечника (местный иммунитет). Способствует вытеснению из циркуляции диких вирусов. Пассивный естественный имунитет сохраняется в течение 3-5 недели после рождения ребенка.
Вирус бешенства. Классификация (семейство, род). Характеристика вириона (морфология, строение). Механизм репродукции. Тканевой тропизм. Эпидемиология, резервуары бешенства в природе. Зависимость постэкспозиционной профилактики от категории контакта с предположительно бешеным животным. Работы Л.Пастера по вакцинации. Принципы лабораторной диагностики. Постморбидная диагностика.
Семейство
Rhabdovirideae
Род
Lyssavirus
Вид
Neuroryctes rabiei
Вирус бешенства –
вызывает бешенство, зоонозную инфекцию,
которая развивается после укуса или
ослюнения раны животным, инфицированным
возбудителем. В результате поражаются
нейроны ЦНС с развитием симптомов
возбуждени, параличом дыхательной и
глотательной мускулатуры. Болезнь
заканчивается летально.
 8
герпесвирусов человека по биологическим
свойствам разделены на три подсемейства
– альфа, бета и гамма.
Характеристика
вириона (морфология, строение):
8
герпесвирусов человека по биологическим
свойствам разделены на три подсемейства
– альфа, бета и гамма.
Характеристика
вириона (морфология, строение):

Вирион имеет форму пули. Рабдовирусы имеют двуслойную липопротеиновую оболочку и рибонуклеопротеин (нуклеокапсид) спиральной симметрии. Всего 5 белков. Изнутри оболочка высталана M-беком (составляет внутренний слой липопротеиновой оболочки (суперкапсида) вириона, связывая его с сердцевиной. Его функцией является стягивание звеньев рибонуклнопротеина симметрией)
, а снаружи от нее отходят шипы гликопротеина G (отвечает за адсорбцию и внедрение вируса в клетку, обладает антигенным и иммуногенным свойством). Рибонуклеопротеин состоит из геномной однонитевой линейной (-РНК) и белков N (укрывает как чехол РНК от собственной РНКазы), L-белка (обеспечивает инициацию синтеза РНК), NS-белок (обеспечивает элонгацию) – в совокупности функционируют как полимераза и P-белка (полимераза вируса) – внутренние белки. Рибонуклеопротеин является группоспецифическим антигеном.
Различают два идентичынх по антигенам вируса бешенства: дикий (уличный) и фиксированный вирус. Дикий циркулирует среди животных и патогенен для человек, а фиксированный получен Л.Пастером в виде антирабической вакцины многократным пассировнием дикого вируса через мозг кроликов. Он утратил патогенность для человека, не образует включений и не выделяется со слюной. Механизм репродукции: (-РНК) – транскрипция – иРНК – трансляция – белок Рабдовирусы связываются гликопротеинами оболочки с рецепторами клетки и проникают в нее путем клатрин-опосредованного эндоцитоза (т.е. образования покрытых оболочкой крупных эндосо - как простые вирусы. Формируется ранняя и поздняя эндосомы. Из поздней эндосомы рибонуклеопротеин попадает в цитоплазму (репликация в цитопламзе), где с помощью РНК-зависимой РНК-полимеразы синтезируются неполные (+РНК – 5 индвидуальных иРНК для синтеза вирусных белков и полные (+РНК) явлюящиеся матрицея для синтеза геномной РНК. Преобразованые в аппарате Гольджи вирусные белки включаются в плазмолемму клетки. Рибонуклеопротеин образуется путем взаимодействия геномной (-РНК) с белками N, P и L. Ключевую роль в сборке и почковании играет М-белок: до сих пор не обнаружены вирионы без М-белка. Он связывает рибонуклеопротеин и оболочку, кроме того, способен вызывать сворачивание удлиненных рибонуклеопротеиновых частиц с образованием той уплотненной конфигурации, которая присутствует в вирионах.
Вирусы выходят из клетки почкованием.
Тканевой тропизм:
Для вируса бешентсва характерна нейротропность. Нейротро́пный ви́рус способен поражать нервные клетки (нейроны). Из-за этого нейротропные вирусы оказываются недосягаемыми для иммунных клеток, так как иммунный ответ действует только в пределах кровеносной системы. Л. Пастер доказал тропизм возбудителя бешенства к ткани мозга и добился его ослабления путем пересевов (пассажей) от кролика к кролику при интрацеребральном введении мозговой суспензии.
Эпидемиология, резервуары бешенства в природе: Заболевание распространено практически во всех странах. По данным ВОЗ, ежегодно в мире от бешенства умирает более 55 тысяч человек. Бешенство относится к типичным зоонозным инфекциям. Резервуаром возбудителя в природе являются плотоядные животные и летучие мыши, а в населенных пунктах – домашние плотоядные (собаки, кошки) и сельскохозяйственные животные. В связи с этим различают два типа бешенства - природное бешенство (дикое, лесное) и городское бешенство (антропургическое). Источником инфекции в очагах природного бешенства являются лисы, волки, енотовидные собаки, песцы, шакалы, барсуки, грызуны, летучие мыши. Источником инфекции в очагах городского бешенства являются собаки и кошки, чаще других передающие возбудителя. Из домашних животных бешенством болеют также лошади, свиньи, мелкий и крупный рогатый скот. Наибольшую эпидемическую опасность представляют больные собаки (до 90% всех случаев). Источником инфекции для человека являются животные, находящиеся в инкубационном периоде заболевания, или животные с выраженной клинической картиной болезни. У больного животного возбудитель накапливается в слюнных железах и выделяется со слюной. Механизм передачи возбудителя – контактный (при укусе или обильном ослюнении), аэрогенный (в пещерах, где живут летучие мыши), при трансплантации инфицированных тканей. Основной путь передачи - через укус больного животного. Возможно проникновение возбудителя в организм через повреждённую кожу (рану, царапину) при обильном ослюнении раны больным животным.
Зависимость
постэкспозиционной профилактики от
категории контакта с предположительно
бешеным животным:
Специфическое
антирабическое лечение (постэкпозиционная
профилактика, лечебно-профилактическая
иммунизация) осуществляется лицам,
пострадавшим от укусов подозрительных
на бешенство животных.
Постэкспозиционная
профилактика начинается до получения
результатов лабораторных исследований
животных. Для ее проведения используют
зарегистрированные иммунобиологические
препараты. При положительном результате
лабораторного исследования подозрительного
животного начатый курс специфического
лечения продолжают. Если животное,
находившееся под наблюдением, не
заболевает (не погибает) в течение 10
дней с момента нанесения повреждений
(ослюнения) человеку, то курс антирабического
лечения прекращается
после третьей
инъекции.

Работы Л.Пастера по вакцинации: Как уже говорилось выше различают два вируса бешенства: - дикий (уличный) вирус, циркулирующий среди животных, патогенный для человека; - фиксированный вирус бешенства, полученный Л. Пастером путем многократного пассирования дикого вируса через мозг кроликов. Фиксированный вирус утратил вирулентность для других видов животных и человека, не образует телец включений и не выделяется со слюной от больных животных. В 1880 г. Л. Пастер совместно с Э. Ру и Ш. Шамберланом начали работу по получению вакцины против бешенства. Суспензию головного мозга погибшей от бешенства собаки они ввели интрацеребрально кролику. От павшего животного они вновь готовили суспензию тканей мозга и вводили следующему кролику. В результате многочисленных пассажей (пересевов) в 1885 г. они получили вакцину против бешенства. В это время к Л. Пастеру обратились женщины, у которых бешеные собаки искусали детей. Это были Иосиф Мейстер (9 лет) и Жан-Батист Жюпиль (14 лет). Благодаря вакцинации оба мальчика были спасены. Пастеровские прививки против бешенства были признаны во всем мире и с 1888 г. во многих странах стали создаваться пастеровские станции для проведения прививок. В России первая пастеровская станция была создана в 1906 г. в Одессе И.И. Мечниковым и Н.Ф. Гамалея.
Постморбидная диагностика: При постмортальной диагностике обнаруживают эозинофилильные цитоплазматические включения в нейронах – тельца Бабеша (виропласты, формируется в ходе репродукции и обнаруживаются только у трупа) – Негри в мазках-отмечатках или срезах ткани головного мозга (гипокампа, пирамидальных клеток коры большого мозга и клеток Пуркинье мозжечка). Включения выявляют методами окраски по Романовскому-Гимзе, Манну, Туревичу, Муромцеву и др. Вирусные антигены в клетках обнаруживают с помощью РИФ. Кроме этого выделяют вирус из мозга и подчелюстных слюнных желез: мышей-сосунков заражают интрацеребрально. Вирус идентифицируют с помощью ИФА, а также в РН на мышах.
Вирус бешенства. Патогенез заболевания (условия инфицирования, входные ворота, пути распространения, патогенетически значимые мишени). Клинические проявления, исход инфекции. Специфическая профилактика (экстренная и плановая).
После попадания
вируса в поврежденные наружные покровы
он реплицируется персистируя в месте
внедрения. Затем вирус связывается с
рецепторами нервно-мышечных синапсов
и проникает в нервные окончания. После
этого вирус мигрирует центростремительно
аксонально-ретроградно по аксоплазме
периферических нервов в ЦНС, где
размножается в нейронах дорсальных
ганглиев спинного, а затем и головного
мозга. От клетки к клетке вирус передается
через синаптические соединения.
Пораженные клетки подвергаются
дистрофическим, воспалительным и
дегенеративным изменениям.
Из
центральной нервной системы вирус
центробежно или гематогенным путем
распространяется по всему организму и
проникает в различные ткани, в том числе
в слюнные железы и роговицу.
Наличие
вируса в высоком титре в слюнных железах
обусловлено их богатой иннервацией. В
крови вирус не обнаруживается.

Клинические провления, исход инфекции: У людей выделяют следующие периоды (стадии) заболевания: 1. инкубационный период (6 дней – 3 месяца, иногда до года и более) 2. продромальный период (стадия предвестников) – длится 1-4 дня 3. стадия возбуждения – длится 4-7 дней 4. стадия параличей - смерть наступает через 5-7 дней от начала болезни от паралича дыхательного и сосудистого центров
1. Длительность инкубационного периода зависит от локализации раны (удаленности раны от головного мозга). Короткий инкубационный период наблюдается при множественных укусах в лицо, голову, шею. Длительный инкубационный период наблюдается при укусах в конечности. 2. В месте укуса появляются ноющие боли, зуд, боли по ходу нервов. Отмечаются субфебрильная температура, головная боль. Развивается чувство дискомфорта, раздражительность, бессонница, беспричинный страх, тревога. 3. В этот период отмечаются судороги, затруднение глотания, спазмы мышц глотки и гортани, шумное дыхание, слуховые и зрительные галлюцинации. Судороги усиливаются при попытке пить, при виде льющейся воды (гидрофобия), от дуновения воздуха (аэрофобия), яркого света (фотофобия), шума (акустофобия), громкого звука (фонофобия) и других воздействий. Первый клинически выраженный приступ болезни (“пароксизм бешенства”) чаще развивается внезапно под влиянием какого-либо раздражителя. Приступ характеризуется вздрагиванием всего тела, вытягиванием рук вперед, отклонением головы назад. Приступ длится несколько секунд и сопровождается болезненными судорогами мышц глотки, приводящими к одышке. После окончания приступа больные приходят в состояние покоя. Если смерть не наступает во время очередного приступа, болезнь переходит в паралитический период. 4. В этот период приступы гидрофобии и аэрофобии прекращаются. Больные начинают пить и есть. Исчезают страх и возбуждение. Появляется надежда на выздоровление. Такое улучшение продолжается в течение 1- 3 дней. Однако затем развиваются вялость, апатия, нарушается сердечно-сосудистая деятельность, появляются параличи глазных мышц, мышц конечностей, наблюдается дисфункция тазовых органов. Смерть наступает через 5-7 дней от начала болезни от паралича дыхательного и сосудистого центров. Продолжительность болезни составляет 5-8 дней, иногда - до 10-12 дней. Прогноз заболевания неблагоприятный, летальность достигает 100%.
Специфическая профилактика (экстренная и плановая): Лицам, получившим множественные укусы или повреждения опасной локализации: промывание раны водой с мылом, обработка спиртом/йодом, края раны иссекают и в первые 3 дня не зашивают. Предварительно вводят антирабичекий иммуноглобулин (сыворокту), а затем проводят курс вакцинации. Антитела появляются лишь через 3 недели. При ранениях неопасной локализации проводят только вакцинацию. Иммунитет сохраняется на протяжении года. Иногда вакцина Л.Пастера давала тяжелые аутоиммунные поствакцинальные осложнения (эцефалиты и др.). В связи с этим в настоящее время используют культуральную вакцину – на основе вируса, адаптированного к культуре тканей. Профилактика бешенства включает целый комплекс мероприятий. Регистрация и вакцинация домашних животных, карантиннные мероприятие при импорте животных, отлов и стерилизация бродячих собак. Имеется положительный опыт путем скармливания диким животным приманок, содержащих вакцину. Перспективным выглядит рекомбинантные оральные вакцины с использованием в качестве вектора вируса осповакцины, экспрессирующего ген протективного G-протеина вируса бешенства (генно-инженерная вакцина, содержащая гликопротеин G вируса).
Herpesviridae (виды). Характеристика вириона (морфология, строение). Этапы и механизмы репродукции. Причины относительной автономности вируса. Принцип взаимоотношения герпесвирусов с хозяином, механизм персистенции. Возможные места персистенции у разных представителей семейства. Мишени для противовирусной терапии.
Семейство Herpesviridae Роды: 1. Simplexvirus: Вирус простого герпеса (тип 1) – нейроны ганглиев тройничного нерва Вирус простого герпеса (тип 2) – нейроны поясничных ганглиев 2. Varicellovirus Вирус ветрянной оспы - опоясывающего герпеса – ганглии спиномозговые (корешки), тройничного и лицевого нервов 3. Lymphocryptovirus Вирус Эпштейн-Барр – лимфоидные органы, B-лимфоциты, эпителий носоглотки 4. Cytomegalovirus Цитомегаловирус – железистая ткань почки (почечные канальцы), лейкоциты, эпителий, слюнные железы 5. Roseolovirus Герпес вируса человека (тип 6) Герпес вируса человека (тип 7) Герпес вируса человека (тип 8)
Характеристика
вириона (морфология, строение):
(гликопротеиновые
шипы встроить внутрь суперкапсида,
чтобы они торчали). Капсорме тоже не
забывать обозначить круглешками типа

Геном – двухспиральная линейная молекула ДНК (2 линии). Она необычна, в ее строение уникальные последовательности, прямые и ивертированные повторы, а также короткие и длинные компоненты. Необычность вирусной ДНК исключает возможность ее репликации клеточной ДНК-полимеразой: для этого вирусы пользуются собственным ферментом ДНК-зависимой ДНК-полимеразой – неструктурный белок, появляется только при репликации, в состав внеклеточного вириона он не входит (вирусоспецифическаая мишень для современных противогерпетических препаратов, так как этот фермент собственный и отличается от клеточного, а значит является мишенью – суперузкая направленность, так как только некоторые виды чувствительны, например, к ацикловиру). Капсид кубической симметрии, в основе лежит икасаэдр (шестигранник). Сложный (оболочечный) вирус. Суперкапсид – наружная оболочка, состоит из фрагментов ядерной и ЦМП, покрыт гликопротеиновыми шипами. Между капсидом и суперкапсидом находится аморфный слой – тегамент, содерижт белки, необходимые для инициации (запуска) репликативного процесса (содержит нужные белки). Герпесвирусы неотличимы друг от друга под микроскопом – одинаковое строение (хрен увидешь VPg1234 белки). Но можно отличить по антигенным особенностям вирионных белков и степени гомологии ДНК (не идентичины! Одни короче, одни длинее) Причины относительной автономности вируса: Высокая генетическая емкость ДНК позволяет кодировать 70-100 белков ( ½ неструктурные, которые участвуют в репродукции и ½ структурные, которые включаются в состав вириона). Учитывая такое большое количество белков, которые кодируются данным геномом можно говорить о относительной независиомсти/ автономоности (транскрипция/репликация) от клетки хозяина (сколько бы не кодировал, все равно остается облигатным внутриклеточным паразитом, не сможет реплицировать). Этапы и механизмы репродукции: Как и у других ДНК-вирусов – воспроизведение вируса внутри клетки хозяина (6 этапов). 1. Прикрепление суперкапсидных гликопротеинов к чувствительным клеткам (адгезия) 2. Проникновение путем слияния мембран (прикрепляются к тропным клеткам) как сложный вирус 3. Кор (сердцевина) сложного вируса освобождается (раздевание) от суперкапсида и транспортируется в ядро!!! 4. Собственно производство нуклеиновой кислоты и синтез белка: У вирусов две основные цели (создать белки + копии дочерних нуклеиновых кислот, собрать это и вынести), но у герпеса характерна при репликации фазность транскрипции. Фазность транскрипции – последовательность событий включает транскрипцию-трансляцию разных генов (сверх-ранних, ранних и поздних генов d, B и Y – не путать с классификацией) Фазность транкрипции: - белки тегамента запускают экспрессии (инициируют) - 5 сверхранних генов, это активирует - 12 ранних генов, их продуктам являются регуляторные гены из которых получаются поздние гены и также несут в себе информацию о ферментах репликации (для вирусной ДНК) – неструктурные белки - далее включаются поздние гены, кодирующие – структурные белки вириона У вируса существует саморегуляция генома: находясь внутри нервных ганглий – он не реплицируется, он там себя регулирует. Если проходит экспрессия сверхранних генов, то это для того чтобы получить d или сверхранние белки, которые будут подавлять возможность вируса выходить на периферию (слизистая губы). В нейронах вирус не размножается (т.к. транскрипция его генов здесь заблокирована). Экспрессируется лишь ограниченная (лимитированное) число вирусных генов, продукты которых сдерживают активность вирусной ДНК. 5. Сборка нуклекапсидов в ядре (включения тоже в ядре) 6. Выход – «почкованием» через участки ядерной мембраны, в которые предварительно включаются вирусные белки (обретают суперкапсид). Часть зрелых вирионов высвобождается из клеток. Те, которые не вышли почкованием, они связываются с соседними клетками и начинается очередной репликативный цикл и это способствует формированию многоядерных клеток (синцития, симпластов, поликарионов).
Симпласт – нежизнеспособен и внутри симпласта вирус недоступен для антител! (проблема для иммунной системы). Локализация виропласта (место сборки, где образуются нуклеокапсиды) – ядро (внутриядерные ацидофильные включения). Это признак характерный для цитопатического эффекта, как образование симпласта. Патогенез: Первичная контаминация часто бессимптомная; Болезнетворность связана с длительной, часто пожизненной персистенцией герпесвирусов в организме хозяина
Принцип
взаимоотношения герпесвирусов с
хозяином, механизм персистенции.
Возможные места персистенции у разных
представителей семейства:

Для
сохранения в организме вирусы пользуются
излюбленными типами клеток, сохраняясь
в них в виде копий кольцевидных ДНК
(автономно от хромосом) – в обычной
жизни геном является у герпесвирусов
линеным, а в клетке в виде копий
кольцевидных ДНК!
Места персистенции
разных представителей семейства см.выше
в таксономии!
В основе персистенции
у них неинтегративная вирогения:

Мишени для противовирусной терапии: Этиотропное лечение: необычность вирусной ДНК исключает возможность ее репликации клеточной ДНК-полимеразой: для этого вирусы пользуются собственным ферментом ДНК-зависимой ДНК-полимеразой – неструктурный белок, появляется только при репликации, в состав внеклеточного вириона он не входит (вирусоспецифическаая мишень для современных противогерпетических препаратов, так как этот фермент собственный и отличается от клеточного, а значит является мишенью – суперузкая направленность, так как только некоторые виды чувствительны, например, к ацикловиру).
Herpes simplex virus – 1 и 2. Классификация (семейство, род). Экология, эпидемиология. Мишени для репликации и персистенции вирусов. Клинические проявления (при первичной инфекции и рецидиве). Факторы, способствующие реактивации. Герпесвирусная инфекция новорожденных: эпидемиология, клинические проявления, исходы. Этиотропная терапия.
Семейство
Herpesviridae
Роды:
1.
Simplexvirus:
Вирус
простого герпеса (тип 1) – нейроны
ганглиев тройничного нерва
Вирус
простого герпеса (тип 2) – нейроны
поясничных ганглиев
Экология,
эпидемиология:
Источником
инфекции является инфицированный
человек (больной или вирусоноситель).
Основные механизмы передачи инфекции
– контактный и вертикальный. Реже
возможна реализация аэрогенного
механизма воздушно-капельным путем.
Основным путем передачи ВПГ-1 является
непосредственный контакт (например,
при поцелуях), а основным путем
инфицирования ВПГ-2 является половой.
ВПГ-1 обычно проникает через эпителий
слизистой оболочки ротовой полости и
носоглотки, а ВПГ-2 – через эпителий
половых органов. Однако известны случаи
генитальной инфекции, вызванной ВПГ-1,
после орального полового акта.
Возможно
перинатальное заражение при прохождении
плода по родовым путям инфицированной
матери. Внутриутробное заражение
наблюдается редко.
Первичное заражение
вирусом простого герпеса типа 1, как
правило, происходит в раннем детстве –
от 6 месяцев до 2 лет (до 6 месяцев организм
ребенка защищен антителами матери).
Однажды попав в организм человека, вирус
простого герпеса через нервные окончания
проникает в нервные ганглии, откуда
периодически мигрирует на периферию,
вызывая рецидивы заболевания.
Мишени
для репликации и персистенции
вирусов:
 Через
нервные окончания он проникает в
региональные ганглии чувствтельных
нервов (ганглии тройничного нерва), где
сохраняется в ядрах нейронов в виде
ДНК.
При реактивации он периодических
выходит на периферию, бессимптомно
выделяясь в слюну или повреждая
эпителиоциты в зоне иннерваии зараженными
нейронами. А также полсе реактивации в
тройничном ганглии он может пойти по
восходящему пути в головной мозг –
Через
нервные окончания он проникает в
региональные ганглии чувствтельных
нервов (ганглии тройничного нерва), где
сохраняется в ядрах нейронов в виде
ДНК.
При реактивации он периодических
выходит на периферию, бессимптомно
выделяясь в слюну или повреждая
эпителиоциты в зоне иннерваии зараженными
нейронами. А также полсе реактивации в
тройничном ганглии он может пойти по
восходящему пути в головной мозг –
энцефалит (смертельно опасно, бывает редко) У ВПГ-2 – нейроны поясничных ганглиев (ганглии крестцово-подвздошного сочленения). Рецидив генитального герпеса сопровождается появлением на половых органах болезненных везикул. У 40-75% женщин отмечается бессимптомное течение генитального герпеса.
Клинические проявления (при первичной инфекции и рецидиве): Вообще ВПГ-1 и ВПГ-2 – 50% гомологичны, как 2 брата, различаются они по экологии, антигенным свойствам и патогенезу. Для ВПГ-1 характерно заражение в раннем возрасте, может иметь клинические проявления и завершается вирусной персистенцией. Первичная инфекция при заражении ВПГ-1 обычно происходит в детском возрасте при контакте с инфицированной слюной. Инфицирование вирусом простого герпеса 2 типа происходит в период полового созревания. После проникновения в эпителий слизистых оболочек возбудитель активно размножается в эпителиальных клетках. При размножении вируса инфицированные клетки погибают с образованием везикул. Через некоторое время верхушка везикулы вскрывается и формируется язвочка, которая в последующем покрывается корочкой и заживает без оставления рубца. Первичная инфекция проявляется в виде лабиального или генитального герпеса. Рецидивирующий герпес наблюдают часто, но далеко не у всех инфицированных лиц. Пусковыми механизмами для рецидивирующего герпеса являются переохлаждение, лихорадка, избыточная инсоляция, травма, стрессовые ситуации и др. При этом вирусные частицы по центробежным нейронам достигают нервных окончаний, откуда проникают в эндотелий капилляров кожи и эпителиальные клетки, репродуцируются в них и вызывают появление везикул. Интервал между действием стресс-факторов и проявлением клинических симптомов составляет от 2 до 5 дней. ВПГ-1: на пораженных участках отмечается зуд, жжение, жгучая боль, отечность. Основным симптомом заболевания является образование пузырьков, наполненных жидкостью. Болезнь сопровождается лихорадкой. Со временем везикулы лопаются и образуются болезненные эрозии (язвы), на которых в последующем образуются корочки. Чаще всего развивается лабиальный герпес. Постепенно эрозии эпителизируются. После подсыхания пузырьков и отторжения корочек рубцы не образуются. Продолжительность заболевания не превышает 2-3 недель. Нередко высыпания рецидивируют на одном и том же мест. ВПГ-2: тропизм к эпителию генитальной сферы. Заражение происходит при достижение половой зрелости при половых контактах. Поражение генитального герпеса проявляется в образовании везикул, которые быстро изъязвляется. У мужчин чаще поражаются головка и тело полового члена, у женщин – половые губы и влагалище. Везикулёзная жидкость содержит большое количество вируса, поэтому для больного характерна высокая контагиозность. При генитальном герпесе часто наблюдается увеличение региональных лимфатических узлов. Рецидив генитального герпеса сопровождается появлением на половых органах болезненных везикул. Везикулы появляются через 2-3 дня на эритематозно-отечной слизистой оболочке и коже полового члена, вульвы, влагалища, шейки матки, промежности. Они болезненны, сопровождаются жжением. Через 1-2 дня везикулы лопаются, изъязвляются и покрываются корочкой. Подобно ВПГ-1, вирус обычно не вызывает поражений, транспортирует свою ДНК в региональные (сакральные) ганглии задних корешков спинного мозга.
Факторы, способствующие реактивации: Этому способствуют такие факторы как авитаминоз, иммунодефицит, перегрев или переохлаждение организма, физические или психоэмоциональные нагрузки, воспалительные процессы, вредные привычки и др. Герпесвирусная инфекция новорожденных: эпидемиология, клинические проявления, исходы: Новорожденный может заразиться неонатальным герпесом (герпесом новорожденных) при прохождении родовых путей инфицированной матери (перинатальное инфицирование – транспланцентарный механизм передачи и интранатальное инфицирование). Инфицирование новорожденных также возможно во время бессимптомной ВПГ-персистенции у матери. В этом случае заболевание обнаруживается на 6 день после родов в виде генерализованного герпеса – от множественного поражения кожи и слизистых до поражения внутренних органов и некротических изменений головного мозга и внутренних органов. Неблагоприятый прогноз: может привести к умственному недоразвитию, уродствам или летальному исходу (в тяжелых случаях 100%). В/в инъекции ингибиторов вирусной ДНК-полимеразы наполовину снижают число фатальных исходов, но у выживших нередко остаются нервно-психические расстройства. Угроза настолько серьезна, что беременным женщинам с генитальным герпесом рекомендуется кесарево сечение, чтобы исключить контакт новорожденного с вирусом. Этиотропная терапия: Иммунитет клеточный, главная роль принадлежит цитотоксическим Т-лимфоцитам. Необычность вирусной ДНК исключает возможность ее репликации клеточной ДНК-полимеразой: для этого вирусы пользуются собственным ферментом ДНК-зависимой ДНК-полимеразой – неструктурный белок, появляется только при репликации, в состав внеклеточного вириона он не входит (вирусоспецифическаая мишень для современных противогерпетических препаратов, так как этот фермент собственный и отличается от клеточного, а значит является мишенью – суперузкая направленность, так как только некоторые виды чувствительны, например, к ацикловиру (валацикловир, рибавирин, ганкцикловир – в тяжелых случаях перорально/инъекции).
Varicella-zoster virus. Классификация (семейство, род). Характеристика вириона (морфология, строение). Экология, эпидемиология. Значимый резервуар для персистенции вируса. Клинические проявления первичной инфекции и эндогенного рецидива. Факторы, способствующие реактивации. Возможность специфической профилактики. Этиотропная терапия.
Семейство Herpesviridae Роды: 2. Varicellovirus Вирус ветрянной оспы - опоясывающего герпеса – ганглии спиномозговые (корешки), тройничного и лицевого нервов
Ветрянную оспу и опоясывающий герпес вызывает один и тот же вирус. В отличие от других герпесвирусов, первичное инфицирование V-Z-вирусом редко остается бессимптомным! (ТОЛСТУЮ СТРЕЛКУ ВНИЗ при схеме взаимоотношений – клинически значимая инфекция, опять же нет вирусологического излечения, тобишь персистенция)) Характеристика вириона (морфология, строение): Структура VZV сходна со строением других герпесвирусов. Он имеет самый малый геном.
Геном – двухспиральная линейная молекула ДНК (2 линии). Она необычна, в ее строение уникальные последовательности, прямые и ивертированные повторы, а также короткие и длинные компоненты. Необычность вирусной ДНК исключает возможность ее репликации клеточной ДНК-полимеразой: для этого вирусы пользуются собственным ферментом ДНК-зависимой ДНК-полимеразой – неструктурный белок, появляется только при репликации, в состав внеклеточного вириона он не входит (вирусоспецифическаая мишень для современных противогерпетических препаратов, так как этот фермент собственный и отличается от клеточного, а значит является мишенью – суперузкая направленность, так как только некоторые виды чувствительны, например, к ацикловиру). Капсид кубической симметрии, в основе лежит икасаэдр (шестигранник). Сложный (оболочечный) вирус. Суперкапсид – наружная оболочка, состоит из фрагментов ядерной и ЦМП, покрыт гликопротеиновыми шипами. Между капсидом и суперкапсидом находится аморфный слой – тегамент, содерижт белки, необходимые для инициации (запуска) репликативного процесса (содержит нужные белки). Патогенез: Первичная репликация в эпителии верхних отделов респираторного тракта, и регионарных л/у. Попадает в КРОВОТО и поэтому распростраянется с кровью по всему организму. Главная мишень для репликации – клетки базального слоя эпидермиса (эпителиотропный вирус, вместе с ВПГ) Экология, эпидемиология: Антропоноз. Переболевает большинство населения. Инкубационный период 10-20 дней, обычно болеют дети, путь пердачи – воздушно-капельный. Источник инфекции - больной человек или вирусоноситель. Возможна передача вируса трансплацентарным и контактным (с отделяемым везикул) путями. Трансплацентарное заражение плода происходит редко и возможно у женщин, заболевших ветряной оспой во время беременности. Ветряной оспой чаще болеют дети в возрасте от 2 месяцев до 10 лет. Опоясывающим герпесом болеют взрослые, перенесшие в детстве ветряную оспу. Рост заболеваемости ветряной оспой отмечается в холодное время года. Восприимчивость к вирусу ветряной всеобщая. Высокая контагиозность, но не такая как у Кори. Значимый резервуар для персистенции вируса: После выздоровления вирус ветряной оспы не удаляеся из организма, а проникает в регионарные ганглии чувствительных нервов и персистирует в нейронах в виде геномной молекулы. Поскольку при ветряной оспе поражаются разные участки тела, вирус проникает в нервные ганглии всех уровней спинного мозга (корешки), а также в ганглии тройничного и лицевого нервов. Чаще всего вирус сохраняется в поясничных ганглиях. В результате это создает основу для реактивации вируса через несколько лет после переболевания ветряной оспой у взрослого человека развивается опоясывающий герпес.
Клинические проявления первичной инфекции и эндогенного рецидива: Инкубационный период при ветряной оспе 2 недели. Болезнь характеризуется лихорадкой, папулезновезикулезной сыпью на коже туловища, шеи, лица и конечностей, иногда на слизистых оболочках половых органов и полости рта. Сыпь похожа на высыпания при натуральной оспе (отсюда произошло название болезни). Через 1-3 дня после появления пузырьки лопаются и подсыхают, покрываясь корочкой. После отпадения корочек рубцы не остаются в отличие от натуральной оспы. У детей в возрасте от 2 месяцев до 1 года и у взрослых ветряная оспа протекает тяжело, возможны разнообразные осложнения, присоединение пиогенной инфекции. Летальность при ветряной оспе составляет 0,01-0,05%. Ветряная оспа у женщин в первые три месяца беременности может привести к уродствам плода. Опоясывающий герпес (лишай) развивается в результате реактивации вируса, сохранившегося в нервных ганглиях. Вначале появляются нечеткие розовые пятна, а через 18-24 часа на месте пятен образуются болезненные везикулы, похожие на сыпь при ветряной оспе. Однако сыпь при опоясывающем герпесе локализуется на ограниченном участке, чаще на одной стороне грудной клетки или на животе по ходу чувствительных нервов. Заболевание сопровождается выраженным болевым синдромом – жгучей болью на пораженной области по ходу нервов. Так как при ветряной оспе высыпания локализуются по всему телу, то вирус может сохраниться в любых нервных ганглиях. Поэтому при опоясывающем герпесе возможны высыпания по ходу тройничного нерва, на ушной раковине и на других участках тела. Поражения исчезают в течение 2-4 недель. Заболевание заканчивается выздоровлением. Больной опоясывающим герпесом заразен. У неиммунных лиц после контакта с больным опоясывающим герпесом развивается клиника типичной ветряной оспы. То есть более опасно заболевание лишь для больных с дефектами иммунитета.
Факторы,
способствующие реактивации:
Жирная
стрелка к первичной патологии, и тонкая
к эндогенному рецидиву, поскольку редко,
чуть ли не в пенсионном возрасте.
 Реактивации
вируса способствуют различные заболевания,
переохлаждение, перегревание, травмы,
снижающие общую резистентность организма.
Солнечный загар, ослабление иммунитета,
эмоциональный стресс, гормональные
изменения, одиночество ,
инфекции.
Реактивации
вируса способствуют различные заболевания,
переохлаждение, перегревание, травмы,
снижающие общую резистентность организма.
Солнечный загар, ослабление иммунитета,
эмоциональный стресс, гормональные
изменения, одиночество ,
инфекции.
Возможность специфической профилактики. Этиотропная терапия: В очагах ветряной оспы ослабленным детям можно вводить препараты иммуноглобулина. Разработа живая ослабленная (аттенуированная) вакцина для VZV с 12 месяцев. Лечение специфического нет, оно симптоматическое. Элементы сыпи смазывают перманганатом калия или спиртовым растовром бриллиантового зеленого. Применяют ацикловир, видарабин, а также интерфероны, интерфероногены и другие иммуномодуляторы. Иммунитет эффективен в отношении экзогенного вируса (связан с антителами), то есть пожизненный, препятствует повторной инфекции, НО не к эндогенному рецидиву! От опоясывающего герпеса он не защищает (рецидива) Нестерильный (вирус постоянно присутствует), гуморальный (то есть, основан на эффекторах гуморального специфического иммунитета, вирус в крои и его могут нейтрализовать только равные молекулы по молекулярной массе). Возможно формировнием исскуственным путем (вакцинация).
Cytomegalovirus: эпидемиология, варианты инфекции. Цитомегаловирус (ЦМВ) как этиологический фактор TORCH-инфекций. Принципы диагностики ЦМВ-инфекции. Epstein-Barr virus: эпидемиология, значимый резервуар для персистенции, результат взаимоотношений с В-лимфоцитами, клинические варианты инфекции, этиотропная терапия.
Семейство Herpesviridae Роды: 4. Cytomegalovirus Цитомегаловирус – железистая ткань почки (почечные канальцы), лейкоциты, эпителий, слюнные железы Цитомегаловирус – вызывает у человека цитомегаловирусную инфекцию (ЦМВ-инфекцию), характеризующуюся поражением многих органов и тканей и протекающую с разными клиническими проявлениями - от пожизненной латентной инфекции до тяжелой острой генерализованной формы с детальным исходом у людей с иммунодефицитами. Свое название вирус получил от наличия в пораженных тканях цитомегалов – гигантских клеток с внутриядерными включениями. Цитомегаловирус имеет структуру, типичную для других герпесвирусов. В составе суперкапсидной оболочки имеется несколько гликопротеинов. Эпидемиология, варианты инфекций: ЦМВ-инфекция имеет широкое распространение. Для цитомегаловируса характерно сродство к тканям слюнных желез. Источник инфекции – инфицированный человек. Механизмы передачи вируса - контактный, аэрогенный, парентеральный, вертикальный. Пути заражения – контактнобытовой, половой, воздушно-капельный, гемотрансфузионный, трансплантационный, трансплацентарный. Заражение происходит через инфицированную кровь, слюну, мочу, сперму, грудное молоко, при прохождении родовых путей, через загрязненные предметы обихода, при пересадке органов и др. Входными воротами инфекции служат кожа, слизистые оболочки дыхательных путей, плацента. При трансплацентарном инфицировании развивается врожденная цитомегалия. ЦМВ-инфекция считается одной из распространенных ВИЧассоциированных инфекций.
Инкубационный период для острой ЦМВ-инфекции составляет от 20 до 60 дней. При остром течении отмечаются симптомы ОРВИ: общее недомогание, повышенная температура тела, быстрая утомляемость, интоксикация, слабость, озноб, головная боль, боль в мышцах, насморк, увеличение слюнных желез. При генерализованной форме ЦМВ-инфекции поражаются надпочечники, почки, печень, селезенка, поджелудочная железа, легкие. Цитомегаловирус способен размножаться практически во всех клетках организма (лейкоциты, моноциты, макрофаги, клетки эндотелия, эпителиальные, нервные клетки, фибробласты). Поэтому при ЦМВ-инфекции отмечаются разнообразные клинические проявления. Цитомегаловирус (ЦМВ) как этиологический фактор TORCH-инфекций: Внутриутробные инфекции (ВУИ) (или, врожденные инфекции) – группа инфекционно-воспалительных заболеваний плода и детей раннего возраста, которые развиваются в результате внутриутробного инфицирования плода. Из-за низкой специфичности клинических проявлений врожденных инфекций, для обозначения ВУИ неустановленной этиологии используется термин «TORCH-синдром», включающий первые буквы латинских названий наиболее часто определяемых врожденных инфекций: T - токсоплазмоз (Тoxoplasmоsis), О - другие инфекции (Оther diseases), т. е. те, которые также могут передаваться вертикально и приводят к развитию ВУИ (сифилис, листериоз, вирусные гепатиты, хламидиоз, ВИЧ-инфекция, микоплазмоз, энтеровирусы и парвовирус В и др.). R - краснуха (Rubella), С - цитомегалия (Cytomegalia) Н - герпес (Herpes). Врожденная цитомегаловирусная инфекция: При инфицировании на ранних сроках беременности: возможны тератогенные эффекты с развитием диси гипоплазии органов плода. По сравнению с другими вирусами (вирус краснухи и др.), ЦМВ характеризуется менее выраженным тератогенным эффектом. Манифестное течение ВУИ в неонатальный период: наблюдаются редко и не превышают 10%. Характеризуются выраженной симптоматикой и тяжелым течением (часто отмечаются желтуха, кахексия, микро- и гидроцефалия, повреждение внутренних структур глаза , гепатоспленомегалия, поражения нервной системы, геморрагический синдром, тромбоцитопения, новорожденные отстают в умственном развитии и теряют слух из-за поражения центров слухового нерва и другие пороки.
Высокий уровень летальности (>30%). Принципы диагностики ЦМВ-инфекции: Исследуют кровь, грудное молоко, мочу, слюну, отделяемое
цервикального канала и спинномозговую жидкость.
Для выявления вируса в материале часто используют ПЦР. Возможно выявление специфических антител в сыворотке крови (ИФА)
Вирусологическое исследование направлено на выделение вируса в культуре клеток фибробластов человека с последующей идентификацией с помощью РИФ, ИФА и ПЦР. Молекулярно-генетическое исследование проводят с помощью ПЦР: определяют присутствие в исследуемом материале вирусной ДНК.
Epstein-Barr virus: эпидемиология, значимый резервуар для персистенции, результат взаимоотношений с В-лимфоцитами, клинические варианты инфекции, этиотропная терапия: Семейство Herpesviridae Роды: 3. Lymphocryptovirus Вирус Эпштейн-Барр – лимфоидные органы, B-лимфоциты, эпителий носоглотки Вирус Эпштейна-Барра – вызывает инфекционный мононуклеоз, а также лимфопролиферативные болезн. Инекционный мононуклеоз протекает с интоксикацией, поражением нёбных и глоточных миндалин, увеличением лимфатических узлов, печени, селезенки, изменениями в крови.
Эпидемиология: антитела к вирусу имеются у большинтсва населения. Источник инфекции – больной человек или вирусоноситель. Вирус передается воздушно-капельным путем, при контакте через слюну. Значимый резервуар для персистенции: после первичного размноженияв эпителии носоглотки ВЭБ взаимодействует в молекулой CD21 B-лимфоцита и, проникнув в клетку, вызывает разномножение B-лимфоцитов, персистируя в них. Особенно много инфицированных B-лимфоцитов находится в небных миндалинах. ВЭБ обуславливает латентную инфекцию в лимфоидной ткани, эпителиальных клетках рта и глотки, слюнных желез. Он вызывает бессимптомную, хроническую или острую инфекцию (в виде инфеционного мононуклеоза), а также лимфопролиферативные болезни. Клинические варианты инфекции: Инфекционный мононуклеоз характеризиуется высокой лихорадкой, недомоганием, лимфаденопатией, фарингитом, спленомегалией и изменениями крови. Мононуклеоз обусловлен появлением многочисленных бластоподобных мононуклеаров. Хроническая инфекция может сопровождаться низкой лихорадкой, головной болью и воспалением горла. ВЭБ может индуцировать лимфопролиферативные болезни и способствовать развитию опухолей. Причиной лимфомы Беркитта – являются трансформированные B-лимфоциты, она ассоциирована с малярией в Африке. Последовательности ДНК ВЭБ содержат и опухолевые клетки назофарингеальной карциномы. У реципиентов трансплантата после иммуносупрессивной терапии может развиться посттрансплантационная лимфопролиферативная болезнь - B-клеточная лимфома вследствии контакта с ВЭБ или реактиваии латентного статуса. Этиотропная терапия: Лечение и специфическая профилактика не разработаны. Необычность вирусной ДНК исключает возможность ее репликации клеточной ДНК-полимеразой: для этого вирусы пользуются собственным ферментом ДНК-зависимой ДНК-полимеразой – неструктурный белок, появляется только при репликации, в состав внеклеточного вириона он не входит (вирусоспецифическаая мишень для современных противогерпетических препаратов, так как этот фермент собственный и отличается от клеточного, а значит является мишенью – суперузкая направленность, так как только некоторые виды чувствительны, например, к ацикловиру (валацикловир, рибавирин, ганкцикловир – в тяжелых случаях перорально/инъекции).
Вирусы иммунодефицита человека (ВИЧ). Классификация. Характеристика вириона, антигенная структура. Тропность вируса. Механизм рецепции, особенность репродукции. Роль вирусных ферментов. Главные резервуары репликативной и персистентной ВИЧ-инфекции. Механизм персистенции вирусов на уровне клетки.
Семейство Retroviridae (ретро – ревертаза=обратная транскриптаза = РНК-завис.ДНК-полимераза) Подсемейство Orthoretrovirinae Род Lentivirus Выделяют два типа вируса: ВИЧ-1 и ВИЧ-2, которые отличаются по структурным и антигенным характеристикам. Кроме человека, к ним восприимчивы только шимпанзе,
но и они заражаются на непродолжительное время без клинических последствий. ВИЧ-1 подразделяются на несколько групп: М, N, O и Р. Причиной более 90% случаев заболевания у человека являются представители группы М. Внутри группы М (англ. main – основная) выделяют 11 подтипов (A, B, C, D, E, F, G, H, I, J, K). Вирус подтипа А, например, широко распространен в России
Характеристика
вириона, антигенная структура:
 Вирусная
частица имеет сферическую форму в
которой хорошо контурируется
Вирусная
частица имеет сферическую форму в
которой хорошо контурируется
нуклеокапсидная сердцевина (кор), окруженная наружной оболочкой (суперкапсидом) – сложный (оболочечный) вирус.
Сердцевина зрелого вириона имеет коническую форму и расположена эксцентрично; геном
представлен двухнитевым (+РНК) – ретроРНК и состоит из 3 основных структурных генов (gag, pol, env) и 7 регуляторных и функциональных генов (tat, rev, nef, vif, vpr, vpu, vpx). Кроме того в состав вириона входят ферменты – обратная транскриптаза (участвует в синтезе ДНК на матрице РНК), РНКаза, эндонуклеаза/интеграза (катализирует встраивание образованной ДНК в хромосому клетки-хозяина) и протеаза. Все это находится внутри белкового чехла (капсида). Капсид имеет кубический тип симметрии и состоит из белка p24. Липидная оболочка (суперкапсид) происходит из плазматической мембраны клетки, в которой реплицируется вирус, а гликопротеиновые шипы представлены вирусными белками gp120 и gp41, которые имеют общий предшественник – gp160. Gp120 располагается на поверхности оболочки вируса, а gp41 – внутри нее. С внутренней стороны к суперкапсиду прилегает матриксный каркас, образованный белком р17.
Антигенная
структура ВИЧ. У ВИЧ главными антигенами
являются группоспецифические (gag)
и видоспецифические антигены (сердцевинный
или ядерный антиген р24), а также
типоспецифические антигены (оболочечные
антигены gр41 и gр120). Для ВИЧ характерна
высокая антигенная изменчивость. В
результате сбоев обратной транскриптазы
из организма больного можно выделить
серологически различные клоны вируса.
Тропность
вируса:
 Главной
мишенью является – хелперная субпопуляция
T-лимфоцитов
(хелперы несут на себе рецептор CD4,
который связывается с gp120
ВИЧ-белком (специфичная
связь, определяющая ВИЧ-цитотропность).
Происходит репликативный выход
вируса.
Мононуклеарные фагоциты: 40%
крови и тканевых макрофагов содержит
CD4
Не имеют CD4
рецепторов, но чувствительны к ВИЧ (M
клетки слизистой прямой кишки и
сперматозоиды) – CD4
позитивиные клетки.
Главной
мишенью является – хелперная субпопуляция
T-лимфоцитов
(хелперы несут на себе рецептор CD4,
который связывается с gp120
ВИЧ-белком (специфичная
связь, определяющая ВИЧ-цитотропность).
Происходит репликативный выход
вируса.
Мононуклеарные фагоциты: 40%
крови и тканевых макрофагов содержит
CD4
Не имеют CD4
рецепторов, но чувствительны к ВИЧ (M
клетки слизистой прямой кишки и
сперматозоиды) – CD4
позитивиные клетки.
В одних клетках он может только находиться (клетки слизистых оболочек, нервных и мышечных тканей), а в другие он использует для своего размножение (клетки иммунной системы T-хелперы и др.), которые должны бороться с вирусами. При половых контактах первыми клетками с которыми взаимодействует ВИЧ – дендритные клетки, а они передаю вирус Т-хелперам. Гликопротеин gр 120 служит для прикрепления вириона к рецептору CD4 (специфичная связь, определяющая ВИЧ-цитотропность) и корецепторам или помощникам на поверхности инфицируемой клетки. Вирусы, имеющие сродство к рецепторам макрофагов, называются М-тропными. Вирусы, имеющие сродство к рецепторам Т-клеток, называются Т-тропными.
Механизм
рецепции:
Есть
опосредованная ВИЧ-рецепция (макрофаги
и B-лимфоциты связываются
с вирионами, покрытых антителами и
C3-фактором
комлпемента).
Кофакторы рецепции
(ко-рецепция) ВИЧ:
 Кофакторы рецепции (чтобы попасть
в клетку):
Кофакторы рецепции (чтобы попасть
в клетку):
gp41 – обеспечивает слияние клеточной и вирусный мембран благодаря связыванию с F-пептидом клеток 2 хемокинвых рецептора (CXCR4 и CCR5 – ко-рецепторы) – вместе с CD4 они взаимодействуют с gp120, раскрывая функции слияния gp41. Хемокины блокируют этот процесс, задерживая размножение ВИЧ в лимфоузле. Вирус подходит к клетке, gp120 соединяется с CD4, начинается его конформация и он еще и взаимодействует с хемокиновыми рецепторами. Это способствует его соскальзыванию с трансмембраного белка на который он был насажен – gp41. После того как он связалася тем временем gp41 освобождается и ее активи-центр (конечный отдел, окончание ее) выполняет функцию белка слияния, стимулируя привязку двух мембран и провоцирует слияние. После слияния внутренее содеражимое вириона (капсид и нуклеиновая кислота) попадают внутрь клетки мишени. Особенность репродукции:
(+РНК)
– обратная транскрипция – ДНК –
транскрипция – иРНК – трансляция –
белок


Ретровирусы отличаются тем, что после проникновения генетическая информация с РНК переписывается на ДНК. ДНК интегрирует с клеточным геномом (прогеном) и в его составе участсвует с образованием иРНК, необходимой для синтеза вирусных белков.
Вирионные белки синтезируются в виде предшественников, которые подвергаются протеолизу (действие вирионной протеазы) с образованием структурных компонентов. Одновременно продуцируется репликативная форма РНК, которая включается в состав новых вирионов.
Весь жизненный цикл: Проникшая в цитоплазму клетки сердцевина вириона на пути к ядру подвергается депротеинизации, в результате чего высвобождается геномная РНК и связанные с ней компоненты сердцевины. После этого с помощью вирусной обратной транскриптазы на матрице одноцепочечной вирусной РНК происходит синтез комплементарной двухцепочечной ДНК. Этот процесс происходит в цитоплазме лимфоцита и требует наличия следующих компонентов: вирусной РНК, транспортной РНК – праймера, обратной транскриптазы и нуклеозидов цитоплазмы клетки. Нуклеозиды в избытке содержатся именно в лимфоцитах. В результате обратной транскрипции образуется провирус (вирусная ДНК), который транспортируется в ядро клетки и встраивается в ядерную ДНК с помощью вирусного фермента интегразы. В дальнейшем провирус является матрицей для синтеза геномной РНК дочерних вирионов и иРНК, обеспечивающей синтез белков дочерних вирионов. Синтезированные в ядре иРНК транспортируются в цитоплазму клетки, где на рибосомах синтезируются вирусные структурные и регуляторные белки. После этого молекулы геномной РНК и вирусные белки транспортируются к местам сборки дочерних вирионов. Вначале формируется сердцевина вирионов, которая переносится к модифицированной клеточной плазматической мембране, в которую предварительно встроились гликопротеиновые шипы. Вирионы выходят из клетки путем почкования, при этом сердцевина вируса “одевается” в измененную плазматическую мембрану клетки
Роль вирусных ферментов: Капсид имеет форму усеченного конуса и состоит из белка р24. Внутри капсида находится белково-нуклеиновый комплекс, состоящий из вирусного генома, ферментов (обратной транскриптазы, протеазы и интегразы) и белка р7. Геном ВИЧ представлен двумя молекулами однонитевой плюс-РНК. Ферменты участвуют в процессах репродукции ВИЧ внутри инфицированной клетки. В частности, обратная транскриптаза (РНКзависимая ДНК-полимераза) участвует в синтезе ДНК на матрице РНК; интеграза катализирует встраивание образованной ДНК в хромосому клетки-хозяина; протеаза расщепляет синтезируемые полипротеины на структурные белки. Справа и слева РНК-геном имеет длинные концевые повторы (LTR - long terminal repeat), которые управляют продукцией дочерних вирионов и активируются как белками вируса, так и белками инфицированной клетки. Нуклеокапсидный белок р7 служит для связи капсида с геномом. В капсиде находится также молекула затравочной РНК.
Главные резервуары репликативной и персистентной ВИЧ-инфекции: ВИЧ может проникать в различные клетки организма человека (точнее, в те клетки, на поверхности которых есть особый участок – рецептор CD-4). Но в одних клетка он может только находиться (это клетки слизистых оболочек, нервных и мышечных тканей), другие же он использует для своего размножения. Коварство вируса иммунодефицита заключается в том, что для своего размножения он использует клетки иммунной системы человека – Тпомощники (Т-хелперы или CD-4), то есть именно те клетки, которые и должны бороться с вирусами. Механизм персистенция – интегративная вирогения (рядом с хромосомой м/б, то есть на геноме клетки хозяина). Взаимоотношения ВИЧ с макрофагами складываются иначе, чем с Т-лимфоцитами. Они слабо поддерживают репликацию вируса, а главное не погибают от нее. Возможно, это связано с тем, что, закончив дифференцировку, макрофаги не пролиферируют (не размножаются). Поэтому вирус не получает в них полноценного набора кофакторов транскрипции, который имеется в активированных Т-лимфоцитах. Но именно это делает мононуклеарные фагоциты едва ли не главным хранилищем латентного вируса. Не вызывая прямого повреждения, ВИЧ тем не менее заметно влияет на функции макрофагов. В них усиливается продукция цитокинов (в том числе активаторов Т-лимфоцитов) и снижается способность к представлению антигенов. Это чревато негативными последствиями. В первом случае возрастает опасность цитокининдуцированной репликации ВИЧ в CD4 Т-клетках, во втором — снижается и без того ослабленный потенциал иммунной системы. Существуют ко-факторы заражения, а также механизмы, поддерживающие HIV-персистецию + агрессивность HIV-персистенции. Механизм персистенции вирусов на уровне клетки: Обязательным условием болезнетворности ВИЧ является пожизненная персистенция возбудителя в организме человека. В ее основе лежит интегративная вирогения, т.е. включение вирусного генома в хромосомный аппарат клетки-хозяина. Но в отличие от других вирусов, склонных к латенции, интеграция ВИЧ непрерывно сочетается с его репликацией. Это делает персистенцию агрессивной, определяя патогенез ВИЧ-инфекции. Сопряжение между репликацией вируса и хронической активацией иммунной системы по сути и есть та основа, на которой эволюционирует ВИЧ-патология. Поэтому агрессивность ВИЧ-инфекции (она определяет продолжительность инкубационного периода) во многом зависит от антигенных и других стимулирующих нагрузок, испытываемых CD4 Т-лимфоцитами. Это так называемые кофакторы ускорения, приближающие терминальную фазу заболевания. Потенцирующее действие оказывают сопутствующие инфекции, особенно если их возбудители привносят с собой поликлональные активаторы Т-лимфоцитов (суперантигены). Ускоряющий эффект посторонних вирусов может быть связан с трансактивацией ВИЧ-провируса. Таким эффектом обладает цитомегаловирус — один из наиболее вероятных кофакторов ВИЧ-инфекции. Агрессивность ВИЧ-персистенции во многом зависит от изменчивости вирионных антигенов, которая обеспечивает высокую устойчивость вируса к эффекторам иммунитета. В нейтрализации свободных вирионов почти все зависит от антител против оболочечных гликопротеинов, прежде всего gp120. Обновление поверхностных структур достигается благодаря высокой мутабельности env-гена, кодирующего суперкапсидные белки вириона, прежде всего вариабельные участки gp120. Наконец, чувствительность к антителам ослабляют клеточные белки, которые включаются в состав вирусной оболочки и прикрывают ее собственные структуры. Все это ведет к тому, что лишь немногие из антител обладают вируснейтрализующими свойствами, т.е. способны инактивировать инфекционный потенциал вируса. В некоторых исследованиях была описана способность ВИЧ-1 избегать действия ЦТЛ(цитотоксических Т-лимфоцитов) за счет отбора «ускользнувших» мутантов, мутации которых затрагивают распознаваемый эпитоп. Такие генетические мутации, вызывающие изменение вирусных белков, часто встречаются и могут находиться под влиянием давления со стороны иммунной системы, особенно CD8+-цитотоксических Т-клеток.
Патогенез ВИЧ-инфекции. Факторы и механизмы, способствующие персистенции вирусов. Агрессивность персистенции. Кофакторы «ускорения» инфекции. Причины иммунодефицита при ВИЧ-инфекции. Механизмы повреждения CD4 Т-лимфоцитов и ускользания от эффекторов иммунной системы.
Вирус иммунодефицита человека с помощью гликопротеина gр120 присоединяется к СD4-рецептору и одному из корецепторов (CXCR4 или CCR5) на поверхности клеток (Т-лимфоциты, тканевые макрофаги, моноциты, дендритные клетки, клетки нейроглии, клетки Лангерганса, эпителиальные клетки кишечника и шейки матки). Затем вирус проникает внутрь клеток и размножается в них. В результате этого клетки разрушаются или теряют свои функциональные свойства, происходит накопление вируса в органах и тканях. При ВИЧ-инфекции снижается число СD4-лимфоцитов, нарушается функция В-лимфоцитов, подавляется функция естественных киллеров, нарушается синтез комплемента, лимфокинов и других факторов, регулирующих иммунные реакции организма. В результате этого развивается иммунодефицит и присоединяются вторичные заболевания инфекционной и неинфекционной природы, в том числе злокачественные опухоли. Прогрессирующее уменьшение количества СD4-клеток обусловлено различными механизмами (апоптоз, образование синцития, аутоиммунные реакции, инфицирование клеток-предшественников). Факторы и механизмы, способствующие персистенции вирусов. Агрессивность персистенции. Кофакторы «ускорения» инфекции: Факторы и механимы персистенции (ЛЕКЦИЯ): 1. Интегративная вирогения – обязательный этап репликации вируса 2. Негативный самоконтроль репликации (поэтому и нужна интегративная вирогения, там где есть все необходимые белки для этого в активноделящихся клетках) 3. Значительная популяция клеток, поддерживающих персистенцию 4. Изменчивость вируса. Высокая частота спонтанных мутаций 5. Ускользание от эффекторов иммунитета Агрессивноть персистенции (ЛЕКЦИЯ): Приводит к необратимым патологическим изменениями в организме (не можем избавиься от него) Причины: 1. Высокий уровень продуктивной (репликативной) ВИЧ-инфекции в метаболически активных клетках 2. Поражение Т-хелперов и/или блокада их функций приводит к нарушению работы иммунной системы 3. Изменчивость (мутабельность) ВИЧ обеспечивает ускользание от иммунной защиты. Обязательным условием болезнетворности ВИЧ является пожизненная персистенция возбудителя в организме человека. В ее основе лежит интегративная вирогения, т.е. включение вирусного генома в хромосомный аппарат клетки-хозяина. Но в отличие от других вирусов, склонных к латенции, интеграция ВИЧ непрерывно сочетается с его репликацией. Это делает персистенцию агрессивной, определяя патогенез ВИЧ-инфекции. Сопряжение между репликацией вируса и хронической активацией иммунной системы по сути и есть та основа, на которой эволюционирует ВИЧ-патология. Поэтому агрессивность ВИЧ-инфекции (она определяет продолжительность инкубационного периода) во многом зависит от антигенных и других стимулирующих нагрузок, испытываемых CD4 Т-лимфоцитами. Это так называемые кофакторы ускорения, приближающие терминальную фазу заболевания. Потенцирующее действие оказывают сопутствующие инфекции, особенно если их возбудители привносят с собой поликлональные активаторы Т-лимфоцитов (суперантигены). Ускоряющий эффект посторонних вирусов может быть связан с трансактивацией ВИЧ-провируса. Таким эффектом обладает цитомегаловирус — один из наиболее вероятных кофакторов ВИЧ-инфекции. Агрессивность ВИЧ-персистенции во многом зависит от изменчивости вирионных антигенов, которая обеспечивает высокую устойчивость вируса к эффекторам иммунитета. В нейтрализации свободных вирионов почти все зависит от антител против оболочечных гликопротеинов, прежде всего gp120. Обновление поверхностных структур достигается благодаря высокой мутабельности env-гена, кодирующего суперкапсидные белки вириона, прежде всего вариабельные участки gp120. Наконец, чувствительность к антителам ослабляют клеточные белки, которые включаются в состав вирусной оболочки и прикрывают ее собственные структуры. Все это ведет к тому, что лишь немногие из антител обладают вируснейтрализующими свойствами, т.е. способны инактивировать инфекционный потенциал вируса. Ко-факторы (ЛЕКЦИЯ): Вирус поступает в кровь, затем пассивно попадает в лимфоидную ткань, где находит свои мишени. При заражении через слизистые оболочки часть вирионов доставляется в лимфатические узлы дендритными клетками.
-аккумуляция дендритных клеток в зоне воспаление слизистых оболочек при сопутствующих инфекциях гениталий (микробная нагрузка) -активация Т-хелперов при контакте с профессиональной АПК (дендритной клеткой) Причины иммунодефицита при ВИЧ-инфекции: 1. Сокращение чиcленности CD4 Т-лимфоцитов.
2. Нарушение (дисрегуляция) межклеточных взаимодействий Тh с другими клетками иммунного ответа (экранирование CD4 свободным вирусныим белком gp120 снижает число функционально активных CD4 рецепторов).
3. Дисбаланс в системе продукции цитокинов (изменение соотношения субпопуляций Т-лимфоцитов из-за «предпочтений» вируса инфицировать определенные варианты клеток).
4. Изменение функций макрофагов (снижается способность к представлению антигена, фагоцитозу, меняется способность к продукции цитокинов). Механизмы повреждения CD4 T-лимфоцитов: Прямая деструкция зараженных клеток Апоптоз. Инфицированные Т-клетки экспрессируют на своей мембране вирусный гликопротеин gр120. Экспрессированный гликопротеин взаимодействует с молекулами СD4 на других инфицированных или неинфицированных Т-клетках. В результате этого стимулируется “запрограммированная” гибель клеток. Образование синцития. Экспрессия гликопротеина gр120 на мембранах инфицированных Т-клеток вызывает слияние мембран нескольких клеток, несущих на своей поверхности молекулы СD4. В результате этого образуется синцитий. Образование синцития характерно для поздней стадии развития ВИЧ-инфекции. Аутоиммунные реакции. Экспрессия гликопротеина gр120 на мембране инфицированных Т-клеток обусловливает активацию цитотоксических лимфоцитов (ЦТЛ) и реакцию антителозависимой цитотоксичности. В результате этого инфицированные СD4-клетки погибают. Инфицирование клеток-предшественников. ВИЧ инфицирует не только зрелые Т-клетки, но и клетки-предшественники Т-лимфоцитов в вилочковой железе и костном мозге. В результате этого нарушаются процессы пролиферации и дифференцировки СD4-клеток. После того как число CD4+ Т-лимфоцитов становится ниже 200 в 1 мкл крови, система клеточного иммунитета перестает защищать организм. Ускользания от эффекторов иммунной системы: В некоторых исследованиях была описана способность ВИЧ-1 избегать действия ЦТЛ(цитотоксических Т-лимфоцитов) за счет отбора «ускользнувших» мутантов, мутации которых затрагивают распознаваемый эпитоп. Такие генетические мутации, вызывающие изменение вирусных белков, часто встречаются и могут находиться под влиянием давления со стороны иммунной системы, особенно CD8+-цитотоксических Т-клеток. Для ретровирусов используется понятие квазивидов, подразумевающее, что уже первое потомство отличается от родителей (лат. quasi — почти, как будто). Это означает, что ВИЧ существует в виде популяций, состоящих из множества такого рода вариантов. Даже при бессимптомной инфекции ВИЧ подвергается непрерывной репликации, создавая мобильное потомство, готовое противостоять экологическому прессу хозяина. Особенно демонстративны эпитопные перестройки главного поверхностного антигена, gp120. В его структуре кроме относительно стабильных (консервативных) участков имеется несколько гипервариабельных доменов, подверженных высокой изменчивости. На этой основе формируются варианты ВИЧ, которым не страшны антитела и цитотоксические CD8 Т-лимфоциты, индуцированные их прародителями. Выживание таких ускользающих мутантов (англ. escape mutants) — один из главных механизмов ВИЧ-персистенции и камень преткновения на пути создания вакцины.
Основные фазы развития ВИЧ-инфекции и их характеристика. Динамика изменений иммунных показателей и концентрации вируса в ходе заболевания. СПИД-ассоциированные заболевания (примеры). Мишени для этиотропной терапии. Алгоритм лабораторной диагностики ВИЧ-инфекции. Проблемы специфической вакцинации.
Первичная инфекция (2-4 недели): 1. Проникновение вируса в лимфатические узлы, репликация в первичных мишенях. Гематогенный путь распространения в другие ткани.
2. Высокий уровень ВИЧ-вирусемии.
3. Нет клинической специфики (широкий спектр возможных симптомов)
4. Быстрая (недели) самокупируемость (совпадает с появлением первых антител).
Латентный период (хроническая фаза) 6-10 лет: 1. Латенция (интегративная инфекция) только на уровне отдельных клеток, часть клеток поддерживает репликацию вируса (продуктивная инфекция).
2. Макрофаги и клетки лимфатических узлов - главный резервуар вируса.
3. Серопозитивность.
4. Прогрессирующее снижение количества CD4 Т-лимфоцитов
СПИД – 2-3 года: 1. Клинически значимый иммунодефицит- клиническая ("спидовая" ) специфика. Чередование обострений и ремиссий сопутствующих заболеваний.
2. Резкое снижение (абсолютное и относительное) количества CD4 Т-лимфоцитов.
3. Падение уровня антител.
4. Высокий уровень ВИЧ-вирусемии.

Т-хелперы нужны для стимуляции B-лимфоцитов, а их потомки плазмоциты нужны для синтеза антитела. Не сдерживаясь АТ вирус снова поступает в кровоток.
СПИД-ассоциированные заболевания (примеры): - это группа болезней инфекционной и неинфекционной природы, которые закономерно наблюдаются у зараженных ВИЧ на определенной стадии синдрома иммунодефицита.
1. Разнообразные оппортунистические инфекции (полиэтиологичность).
Причины: нарушения в Т-зависимом иммунитете, присутствие (персистенция ) микробов-оппортунистов в организме здоровых людей
2. Онкологические заболевания: саркома Капоши (герпесвирус 8), В-лимфомы (герпесвирусы 6, 7)
3. Неврологические проявления: СПИД-ассоциированная энцефалопатия
4. Интестинальные проявления: хроническая диарея, кахексия

Мишени для этиотропной терапии:
ингибиторы обратной транскриптазы
- нуклеозидные (НИОТ)
- ненуклеозидные (нуклеотидные) ингибиторы
ингибиторы протеазы
ингибиторы интегразы
ингибиторы хемокиновых рецепторов
Алгоритм лабораторной диагностики ВИЧ-инфекции: Материал для анализа: кровь, сыворотка, плазма крови
1 этап: Выявление вирусспецифических антител ВИЧ 1/ 2 (ИФА)
Антитела могут не выявляться в начале инкубационного периода, а также в терминальной фазе
СПИДа вследствие нарушений гуморального звена иммунитета
«Серонегативное окно» – от момента заражения до 3-х недель - 3 месяцев.
2 этап:
Ответ отрицательный:
Для подтверждения выявляют маркеры репликации вируса
- белок капсида р24 (ИФА), если «+» (см.ответ положительный)
- РНК (ПЦР) (чаще используют для оценки эффективности антивирусной
терапии), если «+» (см.ответ положительный)
Ответ положительный:
Для подтверждения (т.е. исключения ложнопозитивного результата) используют иммуноблотинг, который позволяет выявить спектр антител к разным антигенам
Иммуноблоттинг — высокочувствительный метод выявления белков, основанный на сочетании электрофореза и ИФА или РИА. В положительном контроле и исследуемом образце присутствуют полосы антител к следующим антигенам: gp120 p68 p51 gp 41 p31 p24 p17
Положительный результат - обнаружение в сыворотке антител к вирусным гликопротеинам (gp 41, gp120) с наличием дополнительных антител к внутренним белкам вируса.
При ВИЧ-инфекции отмечается увеличение спектра антител к разным антигенам при
повторных исследованиях ( качественная сероконверсия )
Проблемы специфической вакцинации: Высокая антигенная изменчивость суперкапсидных гликопротеинов ВИЧ, прежде всего gp120. Опыты с нейтрализацией вируса в культурах клеток и на ВИЧ-инфицированных шимпанзе показывают, что протективный эффект против лабораторных штаммов не гарантирует защиты от клинических (диких, или полевых) изолятов. Проверка эффективности вакцин также сопряжена с большими трудностями. Экспериментальные модели, дублирующие инфекцию человека (СПИД обезьян и кошек), приносят пользу, но имею очевидные ограничения. Шимпанзе восприимчивы к ВИЧ, но клинические инфекция у них не проявляется. Испытания на людях сопряжены с серьезными этическими проблемами. Не ясен вопрос о возможности унификации (общему, целому) вакцин при разных способах инфицирования. К примеру, вакцины на основе оболочечных антигенов предупреждают развитие инфекции при внутривенном введение (опыты на шимпанзе), но длительность эффекта и его надежность при мукозальной инвазии (половой путь) остаются неясными.
В
перспективе делать вакцины на основе
цитотоксических Т-лимфоцитов, они более
консервативны, чем структуры, возбуждающие
синтез антител, а значит будут более
универсальны, т.е. менее зависимы от
изменчивости вируса (так как некоторые
люди излечивались от ВИЧ на самом начале
инфекции. У таких людей серонегативность
сочетается с наличием анти-ВИЧ CD8
Т-лимфоцитов).

Возбудители вирусных гепатитов: классификация. Сравнительная характеристика "парентеральных" и "кишечных" вирусов гепатитов человека: морфология, эпидемиология, способность к персистенции, возможные осложнения, специфическая профилактика. Механизм повреждения гепатоцитов.

 A,С,
E
– простые, не персистируют. B
и D
– сложные, персистируют
D
– не может быть без B
(не несет генетической информации и
просто ворует суперкапсид).
У E
высокая летальность 20-25% по отношению
к беременным женщинам.
A,С,
E
– простые, не персистируют. B
и D
– сложные, персистируют
D
– не может быть без B
(не несет генетической информации и
просто ворует суперкапсид).
У E
высокая летальность 20-25% по отношению
к беременным женщинам.
Механизм повреждения гепатоцитов: повреждение гепатоцитов в результате реакции Т-клеток на инфекцию.
Hepatitis A virus. Классификация (семейство, род). Характеристика вириона, антигенная структура. Эпидемиология. Патогенез. клинические проявления, исходы инфекции. Постинфекционный иммунитет. Специфическая профилактика. Материал для исследования, зависимость методов диагностики от стадии заболевания.
Семейство Picornaviridae
Род Hepatovirus
Вид вирус гепатита А (1 серотип)
Характеристика
вириона, антигенная структура:

 Форма
– сферическая, кубический тип симметрии
(икосаэдр) – простой вирус (без
суперкапсида)
Геном – однонитевая
(+РНК) содержит геном-связывающий протеин
VPg
VP123
– поверхностные белки капсида (содержат
антитело-связывающие участки) –
рецепторная функция (протективные
антигены в сумме)
VP4
– внутренний белок капсида
Капсидные
бкли объединяются в понятие «антиген
вируса гепатита A»
- HAAg.
HAV
включает 7 генотипов, имеющих до 85%
РНК-гомологии. Большинство инфекции
связано с вирусами 1 и 3 генотипов.
Генотипировние не имеет большгого
практического значения, так как все
штаммы HAV
имеют единый серотип HAAg,
который детерминирует образование
вируснейтрализующих
антител.
Эпидемиология:
Источником
инфекции являются больные люди как
с выраженными, так и с бессимптомными
формами инфекции.
Механизм заражения
- фекально-оральный. Вирусы выделяются
с фекалиями, начиная со второй половины
инкубационного периода и в начале
клинических проявлений: в это время
больные наиболее опасны для окружающих.
С появлением желтухи интенсивность
выделения вирусов снижается.
Основной
путь передачи инфекции – водный.
Факторами передачи являются вода,
пищевые продукты, предметы обихода,
грязные руки; в детских коллективах -
игрушки, горшки.
Болеют преимущественно
дети в возрасте от 4 до 15 лет.
Устойчив
в окружающее среде – 5 мин в
кипятке
Патогенез:
Первичным
местом размножения вируса является
эндотелий тонкой кишки. Оттуда он
попадает в портальный кровоток и печень,
так как обладает гепатотропизмом.
Повреждение гепатацитов возникает не
за счет прямого цитотоксического
действия, а в результате иммунопатологических
механизмов.
Основная
мишень действия – клетки печени, где в
цитоплазме происходит репродукция
вируса. Гепатоциты могут поражаться
натуральными киллерами
NK, которые в активированном
состоянии взаимодействуют с гепатоцитами,
вызывая их разрушение. Активация NK
происходит под действием интерферона.
Поражение гепатоцитов приводит к
нарушению белкового, углеводного и
пигментного обмена и сопровождается
желтухой. Далее вирус с желчью попадает
в просвет кишечника и выделяется с
фекалиями за 12-14 дней
до появления клинических симптомов и
желтухи!
Форма
– сферическая, кубический тип симметрии
(икосаэдр) – простой вирус (без
суперкапсида)
Геном – однонитевая
(+РНК) содержит геном-связывающий протеин
VPg
VP123
– поверхностные белки капсида (содержат
антитело-связывающие участки) –
рецепторная функция (протективные
антигены в сумме)
VP4
– внутренний белок капсида
Капсидные
бкли объединяются в понятие «антиген
вируса гепатита A»
- HAAg.
HAV
включает 7 генотипов, имеющих до 85%
РНК-гомологии. Большинство инфекции
связано с вирусами 1 и 3 генотипов.
Генотипировние не имеет большгого
практического значения, так как все
штаммы HAV
имеют единый серотип HAAg,
который детерминирует образование
вируснейтрализующих
антител.
Эпидемиология:
Источником
инфекции являются больные люди как
с выраженными, так и с бессимптомными
формами инфекции.
Механизм заражения
- фекально-оральный. Вирусы выделяются
с фекалиями, начиная со второй половины
инкубационного периода и в начале
клинических проявлений: в это время
больные наиболее опасны для окружающих.
С появлением желтухи интенсивность
выделения вирусов снижается.
Основной
путь передачи инфекции – водный.
Факторами передачи являются вода,
пищевые продукты, предметы обихода,
грязные руки; в детских коллективах -
игрушки, горшки.
Болеют преимущественно
дети в возрасте от 4 до 15 лет.
Устойчив
в окружающее среде – 5 мин в
кипятке
Патогенез:
Первичным
местом размножения вируса является
эндотелий тонкой кишки. Оттуда он
попадает в портальный кровоток и печень,
так как обладает гепатотропизмом.
Повреждение гепатацитов возникает не
за счет прямого цитотоксического
действия, а в результате иммунопатологических
механизмов.
Основная
мишень действия – клетки печени, где в
цитоплазме происходит репродукция
вируса. Гепатоциты могут поражаться
натуральными киллерами
NK, которые в активированном
состоянии взаимодействуют с гепатоцитами,
вызывая их разрушение. Активация NK
происходит под действием интерферона.
Поражение гепатоцитов приводит к
нарушению белкового, углеводного и
пигментного обмена и сопровождается
желтухой. Далее вирус с желчью попадает
в просвет кишечника и выделяется с
фекалиями за 12-14 дней
до появления клинических симптомов и
желтухи!
 Объем
повреждения печени почти всегда
ограничен, не выходя за рамки фокального
некроза. Антитела появляются уже в
инкубационном периоде, блокируя
распространение вируса. Клиническое
выздоровление знаменует полное
освобождение от HAV
ВИРОГЕНИЯ -
форма сосуществования вируса с клеткой,
при которой геном вируса включается в
хромосому клетки (провирус – фрагмент
ДНК). Возможно копирование ДНК вместе
с репликацией самой клетки, но не
образуется новых вирионов (интегративная).
Могут накапливаться продукты, которые
обладают автономным синтезом: HBsAg
и HBx.
Клинические
проявления, исходы инфекции:
Инкубационный
период составляет от 15 до 50 дней, чаще
около 1 мес.
Начинается остро с
повышения температуры и явлений со
стороны ЖКТ (тошноты, рвоты и др.). Возможно
появление желтухи на 5-7-й день.
Основными
клиническими симптомами гепатита А
являются желтуха кожи и склер, которые
развиваются в результате выхода в
кровоток из поврежденных гепатоцитов
желчных пигментов и билирубина. Циркуляция
в крови желчных кислот нередко приводят
к раздражению ими нервных окончаний в
коже и развитию кожного зуда. Так как
желчные пигменты и билирубин находятся
в кровотоке и выводятся из организма
через почки, моча приобретает темный
цвет (цвет темного пива или крепко
заваренного чая). При этом кал
обесцвечивается - ахоличный или собачий
кал (бесцветный).
Клиническое
течение, как правило, легкое, без особых
осложнений, у детей то 5 лет обычно
бессимптомное.
Продолжительность
заболевания 2-3 недели. Хронические формы
и персистенция вируса
не развиваются.
Фульминантный гепатит (массивный некроз
гепатоцитов) наблюдается исключительно
редко.
Объем
повреждения печени почти всегда
ограничен, не выходя за рамки фокального
некроза. Антитела появляются уже в
инкубационном периоде, блокируя
распространение вируса. Клиническое
выздоровление знаменует полное
освобождение от HAV
ВИРОГЕНИЯ -
форма сосуществования вируса с клеткой,
при которой геном вируса включается в
хромосому клетки (провирус – фрагмент
ДНК). Возможно копирование ДНК вместе
с репликацией самой клетки, но не
образуется новых вирионов (интегративная).
Могут накапливаться продукты, которые
обладают автономным синтезом: HBsAg
и HBx.
Клинические
проявления, исходы инфекции:
Инкубационный
период составляет от 15 до 50 дней, чаще
около 1 мес.
Начинается остро с
повышения температуры и явлений со
стороны ЖКТ (тошноты, рвоты и др.). Возможно
появление желтухи на 5-7-й день.
Основными
клиническими симптомами гепатита А
являются желтуха кожи и склер, которые
развиваются в результате выхода в
кровоток из поврежденных гепатоцитов
желчных пигментов и билирубина. Циркуляция
в крови желчных кислот нередко приводят
к раздражению ими нервных окончаний в
коже и развитию кожного зуда. Так как
желчные пигменты и билирубин находятся
в кровотоке и выводятся из организма
через почки, моча приобретает темный
цвет (цвет темного пива или крепко
заваренного чая). При этом кал
обесцвечивается - ахоличный или собачий
кал (бесцветный).
Клиническое
течение, как правило, легкое, без особых
осложнений, у детей то 5 лет обычно
бессимптомное.
Продолжительность
заболевания 2-3 недели. Хронические формы
и персистенция вируса
не развиваются.
Фульминантный гепатит (массивный некроз
гепатоцитов) наблюдается исключительно
редко.
Постинфекционный
иммунитет:
После
инфекции формируется стойкий пожизненный
иммнитет, связанный с IgG.
В начале заболевания в крови появляются
IgM,
которые сохраняются в организме 4-6
месяцев и имеют диагностическое значение.
У детей первого года жизни обнаруживают
антитела, полученные от матери через
плаценту.
Помимо общего гуморального,
развивается местный иммунитет в
кишечнике.
Специфическая
профилактика:
Активная:
инактивированная культуральная
концентрированная вакцинна. Разработана
также рекомбинантная генно-инженерная
вакцина
Пассивная:
иммуноглобулин
человека нормальный
Материал
для исследования, зависимость методов
диагностики от стадии заболевания:
Материалом
для исследования служат кровь и
испражнения. Диагностика основана на
определении следующих маркеров:
-
выявление в сыворотке крови IgМ и суммарных
иммуноглобулинов (IgG+IgM) с помощью ИФА,
РИА;
Этими же методами можно обнаружить
вирусный антиген в фекалиях.
Вирусологическое
исследование не проводят из-за отсутствия
методов, доступных для практических
лабораторий.

 Лечение
– симптопатическое.
Лечение
– симптопатическое.
Период болезни |
Вирус/HAAg в фекалиях (ИФА, ПЦР) |
IgM антитела к НAAg (ИФА) |
IgG антитела к НААg (ИФА) |
Инкубационный период |
+ |
+ |
- |
Острая инфекция |
- |
+ |
+
|
Реконвалесценция и элиминация возбудителя |
- |
+/- (снижение титра)
|
+ нарастание титра |
Постинфекционный период |
- |
- |
+ |
Hepatitis B virus. Классификация (семейство, род). Характеристика вириона. Функции структурных и неструктурных белков. Особенности репликативного цикла. Эпидемиология. Вирусологические и клинические исходы инфекции, возможные осложнения. Специфическая профилактика. Основные сывороточные маркеры инфекции, их значение в диагностике.
Семейство
Hepadnaviridae
Род
Orthohepadnavirus
Харатеристика
вириона. Функции структурных и
неструктурных белков:

Сложный (оболочечный) вирус сферической формы: снаружи имеет суперкапсид, которой состоит из трех белков S, M и L, их экспрессия дает 3 продутка: HBsAg-S (70% - главный оболочечный ген), HBsAg-M и HBsAg-L – поверхностные белки. HBcAg или «кор-анитген» - главный белок нуклеокапсида, или сердцевиды. Внутри сердевины находятся ДНК-полимераза - HBpol(ревертаза), протеинкиназа и концевой белок HBe-антигена. HBe – антиген (продукт распада. При остром ВГВ обнаруживается совместно с ДНК HVB и ДНК-полимеразой) также является сердцевиным антигеном, производным HBc-антигена (маркер репликации и высокой контагиозности больного) HBx-антиген – трансактиватор, накопление которого в крови связывают с развитием первичного рака печени Геном - двунитевая дефектная ДНК. Сердцевина имеет кубический тип симметрии. Плохо культивируется
в клеточных культурах. Склонность к персистенции. Механизм персистенции – интегративная вирогения.
HBsAg – обеспечивает избирательное прикрепление вируса к мембране гепатоцитов, возможно за счет связывания с полимеризованным сывороточным альбумином. Содержит протективные B-эпитомы и индуцирует синтез антител, блокирующих прикрепление вируса к рецепторам гепатоцитов. Автономная продукци вне зависимости от других белков. Является универсальным индикатором на любой стадии инфекции. Может вбрасывать в кровь без вириона, как gp120 у ВИЧ. Он оттягивает на себя АТ, поэтому часть АТ будет занята «пустышкой». Является протективным антигеном – синтез защитных антител от инфекции (антитела защищают от вируса) HBcAg – кодируется C-геном, которому прилежит небольшой, но функционально значимый фрагмент ДНК – пре-с. От того, с какого участка пре-с начинается транскрипция мРНК, зависит качество и судьба HBcAg. Один из его вариантов входит в состав вирионного нуклеокапсида, другой (гидрофобный) включается в клеточные мембраны гепатоцитов и служит объектом для распознания и атаки Т-лимфоцитами. В кровь не секретируется и в свободном состоянии не определяется. HBeAg (неструктурный) – важный для диагностики и для репликации вируса. Образуется в результате протеолиза/аутопротеолиза кор-антигена, встроенного в клеточные мембраны. Отличается от кор-антигена по B-эпитопам (т.е. к каждому из них образуется собственные антитела), но содержит общие с ним T-эпитопы. Не входит в состав вириона, а выделяется в кровь, где его содержание коррелирует с активностью вирусной репликации.
HBxAg (неструктурный) – определяется в сыворотке (крови) и печени при высоком уровне репликации. Выполняет функции транскактиватора вирусных и клеточных антигенов, способствуя развитию патологического процесса в печени. Его производные определяются в мембране гепатоцитов почти у половины больных хроническим гепатитом, являясь объектом для цитотоксических Т-лимфоцитов. Участвует в индукции злокачественного перерождения (инсерционный мутагене) HBV-инфицированных гепатоцитов, активируя клеточные онкогены и блокируя антионкогенные (апоптозиндуцирующие) белки, в частности p53. HBVpol (полимераза) – полифункциональный фермент, входящий в состав сердцевины. Продукт самого крупного, p-генаа, перекрывающего s- и c-локусы. Обладает активностью ДНК-полимеразы, обратной транскриптазы и РНК-азы. Играет ключевую роль на всех этапах репликации вируса.
Особенности репликативного
цикла:
 Репродукция
вируса гепатита В начинается со
специфического связывания L-гликопротеина
с клеточными рецепторами и проникновения
сердцевины вируса путем эндоцитоза
внутрь клетки. После этого происходит
слияние суперкапсидной оболочки с
мембраной эндосомы и высвобождение
нуклеокапсида в цитоплазму клетки.
Освободившийся нуклеокапсид
транспортируется к ядру клетки. В
нуклеоплазму проникает вирусная геномная
ДНК/
В ядре ДНК-полимераза
достраивает брешь (+ДНК), в результате
формируется двунитевая, суперспирализованная
молекула ДНК, после чего возможно
развитие двух типов инфекции: продуктивная
и интегративная.
Геном
гепаднавирусов устроен своеобразно.
Он состоит из двух ковалентно незамкнутых
Репродукция
вируса гепатита В начинается со
специфического связывания L-гликопротеина
с клеточными рецепторами и проникновения
сердцевины вируса путем эндоцитоза
внутрь клетки. После этого происходит
слияние суперкапсидной оболочки с
мембраной эндосомы и высвобождение
нуклеокапсида в цитоплазму клетки.
Освободившийся нуклеокапсид
транспортируется к ядру клетки. В
нуклеоплазму проникает вирусная геномная
ДНК/
В ядре ДНК-полимераза
достраивает брешь (+ДНК), в результате
формируется двунитевая, суперспирализованная
молекула ДНК, после чего возможно
развитие двух типов инфекции: продуктивная
и интегративная.
Геном
гепаднавирусов устроен своеобразно.
Он состоит из двух ковалентно незамкнутых
нитей ДНК, одна из которых (плюс-нить) недостроена, т.е. короче другой (минус-нити) на
20-30%. Ликвидация этого дефекта является обязательным этапом репликации вируса и
обеспечивается вирионной ДНК-полимеразой после проникновения вируса в ядро
гепатоцитов.
Репликация HBV происходит необычно. Это единственный из ДНК-вирусов человека,
который реплицируется с подключением механизма обратной транскрипции по схеме
ДНК → РНК → ДНК (рис. 3). После достраивания в ядре дефектной ДНК-нити: ДНК
используется клеточной РНК-полимеразой в качестве матрицы для синтеза полной РНК-
копии –– прегенома (pgRNA). Одновременно образуются и более короткие РНК, которые
подвергаются трансляции, обеспечивая синтез вирусных белков. pgRNA
транспортируется в цитоплазму и после объединения с капсидом переписывается в ДНК,
т.е. подвергается обратной транскрипции. РНК разрушается, и на свободных участках
ДНК строится вторая (дефектная) ДНК-нить.
Все перечисленные этапы – 3 функции (достраивание дефектной ДНК-нити, обратная транскрипция, разрушение pgRNA, синтез дефектной ДНК-нити) обеспечиваются общим ферментом –– вирионной полимеразой. Полифункциональность снижает точность ферментативных реакций. Весомость ошибок возрастает, если они (как в данном случае) допускаются при репликации. С этим, в частности, может быть связана высокая мутационная изменчивость HBV, которая накладывает серьезный отпечаток на взаимоотношения с хозяином. Механизм обратной транскрипции сближает гепаднавирусы с ретровирусами. По этой причине их даже предложено называть параретровирусами.
Процесс репликации заканчивается сборкой суперкапсида. Кор одевается наружной
оболочкой, используя для этого внуриклеточные мембраны аппарата Гольджи с
встроенными в них HВsAg (S, L и М), и высвобождается из клетки.
Эпидемиология: Антропоноз ( больные люди, носители)
Источник
инфекции – только человек. Вирус
обнаруживается в различных секретах.
Механизмы
передачи – парентеральный, контактный.
Пути передачи – трансфузионный
(переливание крови или ее компонентов),
инъекционный, шприцевой (опосредованный
контакт с кровью больного), половой
(гомо- и гетеросексуальные контакты),
возможна передача инфекции от матери
к плоду (вертикальная передача).
У
инфицированных лиц вирус находится во
всех биологических жидкостях (кровь,
слюна, моча, сперма, вагинальный секрет,
синовиальная жидкость, цереброспинальная
жидкость, грудное молоко), но в разных
количествах.
Основной фактор передачи
– кровь. Зараженными могут быть взятые
для пересадки ткани и органы.
Гепатит
В протекает в острой, хронической форме
и в виде вирусоносительства (малоактивного
хронического гепатита). Именно лица с
хроническими формами гепатита В и
носители вируса являются основными
источниками этой инфекции.
Вирусологические
и клинические исходы инфекции, возможные
осложнения:
Заболевание
может протекать во всех формах:
бессимптомной, безжелтушной, желтушной.
Выздоровление наблюдается в 90% случае.
10% - острое забоелвание может переходить
в хроничекую форму.

- полное выздоровление; - носительство HBs-антигена (здоровое носительство), при котором функция печени восстанавливается полностью, но в крови сохраняется HBs-антиген; - хронический персистирующий гепатит (ХПГ), при котором клинические симптомы отсутствуют, в крови HBs-антиген, на биопсии - вялотекущий гепатит; - хронический активный гепатит (ХАГ), при котором отмечается клиника гепатита, в крови присутствуют HBs-антиген, HBе-антиген, антитела к HBс антигену. Может развиваться как обострение ХПГ или сразу после острого гепатита; - цирроз печени; - первичный рак печени - гепатоцеллюлярная карцинома После заболевания развивается длительный иммунитет, который может быть пожизненным. Он обусловлен вируснейтрализующими антителами к HBs-антигену.
Специфическая профилактика: Активная иммунизация - использование рекомбинантных генно-инженерных вакцин, содержащих НВs-антиген Пассивная иммунизация – специфическкий иммуноглоубилн (HBIg)
Основные
сывороточные маркеры инфекции, их
значение в диагностике:

Маркеры/ Период инфекции |
HBsAg |
HBeAg |
анти-HBs антитела
|
Продромальный период и острая инфекция |
+ Часто обнаруживается еще до клинических симптомов |
+ Маркер активности вирусной репликации. |
-
|
Реконвалесценция и элиминация возбудителя |
- Исчезает через 4-6 мес после заражения, что считается критерием выздоровления. |
- Быстрое исчезновение (до 2 мес.) отражает окончание вирусной репликации. |
+ Появление антител совпадает с началом элиминации вируса. Антитела сохраняются пожизненно |
Хроническая инфекция (спустя 6 мес- 1 год после инфицирования) –персистенция вируса |
+ может обнаруживаться при хронической или бессимптномной инфекции |
+ Маркер активности вирусной репликации. |
- Отсутствие антител показывает, что имеет место персистенция вируса |
Антигенные маркеры: - HBs-антиген является маркером как острой, так и хронической инфекции. Он обнаруживается в инкубационном периоде заболевания (спустя 6 недель после инфицирования) и присутствует в крови в течение длительного времени (на протяжении многих лет). Длительное выявление HBsAg в сыворотке крови (свыше 6 месяцев после появления клинических симптомов заболевания) свидетельствует о формировании хронической инфекции; - HBe-антиген обнаруживается в остром периоде заболевания или в период обострения хронического процесса (“маркер инфекционности”) и свидетельствует об активной репликации вируса. При острой инфекции он появляется в сыворотке крови вслед за HBs-антигеном; - HBc–антиген в сыворотке крови не определяется, его можно обнаружить только в составе вирусных частиц (постифекционный иммуните?) Антительные маркеры: - Антитела против HBsAg свидетельствуют о выздоровлении пациента. Эти антитела циркулируют в организме в течение длительного времени (в течение всей жизни). Наличие антител против HBsAg у вакцинированных лиц в концентрации 10 МЕ/л свидетельствует об успешной иммунизации (поставакциональный иммунитет?) - Антитела против HBeAg персистируют в организме многие годы и означают реконвалесценцию или ремиссию. Завершение острого процесса. - Антитела класса IgM против HBcAg отмечаются в остром периоде заболевания или в стадии обострения. - Антитела класса IgG против HBcAg обнаруживаются как у больных острой формой, так и у лиц с хронической формой заболевания, а также у лиц, перенесших гепатит В и выздоровевших, то есть эти антитела свидетельствуют об имеющемся или перенесенном гепатите В. - Антитела HBx – появление совпадает с элиманицей вируса из организма - Антитела HBpol – отражают активность хронического процесса, но не коррелируют с очищением печени от вируса при остром гепатите Таким образом, у выздоровевших пациентов отмечаются только антитела к HBs-антигену, у носителей - HBs-антиген и антитела к HBs-антигену, у больных - HBе-антиген, в остром периоде болезни определяются антитела к HBс-антигену (сам HBс-антиген в сыворотке крови не определяется, он выявляется только в клетках печени). Существоет HBV-окно – это период когда гепатит B не диагностируется при помощи тестов на HBsAg и анти-HBs. То есть это освобождение от HBsAg, но антитела HBs вывляются с опозданием, спустя некоторое время после удаления из циркуляции HBsAg.
Hepatitis C virus. Характеристика вириона. Эпидемиология. Тканевой тропизм. Вирусологические и клинические исходы инфекции, возможные осложнения. Механизм персистенции и ускользания от эффекторов иммунной системы. Особенности иммунитета (антителообразования). Принципы лабораторной диагностики.
Семейство
Flaviviridae
(желтый)
Род Hepacivirus
“ласковый
убийца” из-за того, что он способен
маскироваться под видом других заболеваний
(бессимптомно) – 6 генотипов!
Характеристика
вириона:
 Вирус гепатита С имеет сферическую
форму. Сложный
(оболочечный) вирус как и гепатит B.
Геном вируса гепатита С представлен
однонитевой (+РНК). Геном покрыт капсидом.
Нуклеокапсид имеет кубический тип
симметрии. Тоже
склонен к персистенции как и B.
Обладают общей и сходной страгеии
взаимодействия с клеткой хозяина.
Снаружи
вирион окружен липидным суперкапсидом
с белковыми выступами Е1 и Е2.
В
геноме вируса зашифрована структура 9
белков: 3 структурных и 6 неструктурных.
В процессе репродукции вируса на
рибосомах синтезируется
полипептид-предшественник, который
нарезается на структурные и неструктурные
белки.
Структурные:
- белок С
- нуклеокапсидный (core - сердцевина)
р21/р22 (НСс-антиген);
- белок Е1 -
мембранный, суперкапсидный или оболочечный
белок (envelope - оболочка) gp35;
- белок Е2
- поверхностный, суперкапсидный или
оболочечный белок gp70.
Белки Е1 и Е2
обеспечивают связывание вируса с клеткой
макроорганизма и проникновение в
нее.
Неструктурные:
- белок NS1
(p7) - протеаза;
- белок NS2 (p23) -
трансмембранный белок;
- белок NS3
(p70) - протеаза, хеликаза;
- белок NS4A
(p8) – ко-фактор других белков;
- белок
NS4B (p27) – ко-фактор других белков;
-
белок NS5A (p56/58) - белок резистентности к
интерферону;
- белок NS5B (p68) -
РНК-полимераза.
Репродукция вируса
гепатита С происходит в цитоплазме
инфицированной клетки.
Эти белки не
включаются в вирион. Они участвуют в
репликации вируса, выполняя функции
различных ферментов (протеазы,
РНК-зависимая РНК-полимераза, геликаза).
Вирус гепатита С имеет сферическую
форму. Сложный
(оболочечный) вирус как и гепатит B.
Геном вируса гепатита С представлен
однонитевой (+РНК). Геном покрыт капсидом.
Нуклеокапсид имеет кубический тип
симметрии. Тоже
склонен к персистенции как и B.
Обладают общей и сходной страгеии
взаимодействия с клеткой хозяина.
Снаружи
вирион окружен липидным суперкапсидом
с белковыми выступами Е1 и Е2.
В
геноме вируса зашифрована структура 9
белков: 3 структурных и 6 неструктурных.
В процессе репродукции вируса на
рибосомах синтезируется
полипептид-предшественник, который
нарезается на структурные и неструктурные
белки.
Структурные:
- белок С
- нуклеокапсидный (core - сердцевина)
р21/р22 (НСс-антиген);
- белок Е1 -
мембранный, суперкапсидный или оболочечный
белок (envelope - оболочка) gp35;
- белок Е2
- поверхностный, суперкапсидный или
оболочечный белок gp70.
Белки Е1 и Е2
обеспечивают связывание вируса с клеткой
макроорганизма и проникновение в
нее.
Неструктурные:
- белок NS1
(p7) - протеаза;
- белок NS2 (p23) -
трансмембранный белок;
- белок NS3
(p70) - протеаза, хеликаза;
- белок NS4A
(p8) – ко-фактор других белков;
- белок
NS4B (p27) – ко-фактор других белков;
-
белок NS5A (p56/58) - белок резистентности к
интерферону;
- белок NS5B (p68) -
РНК-полимераза.
Репродукция вируса
гепатита С происходит в цитоплазме
инфицированной клетки.
Эти белки не
включаются в вирион. Они участвуют в
репликации вируса, выполняя функции
различных ферментов (протеазы,
РНК-зависимая РНК-полимераза, геликаза).
Эпидемиология: Источник инфекции - инфицированный человек (больные с острым и хроническим гепатитом С), в том числе лица, находящиеся в инкубационном периоде заболевания. Особое значение имеют лица с бессимптомным течением инфекции. Механизмы передачи – парентеральный, трансплацентарный и контактный. Пути передачи – трансфузионный (через инфицированную кровь и ее компоненты), половой (через сперму и влагалищные секреты). Вероятность трансплацентарного инфицирования возрастает при высокой вирусемии. Инфицирование возможно при парентеральных манипуляциях в медицинских учреждениях (включая стоматологические и эндоскопические исследования и диагностические процедуры), при пирсинге, нанесении татуировок, при оказании некоторых парикмахерских услуг. Основным фактором передачи возбудителя является кровь и компоненты крови, в меньшей степени – другие биологические жидкости (сперма, вагинальный секрет, слюна и др.). В 70-90% случаев острая форма инфекции характеризуется бессимптомным течением. У 85% заболевших острым гепатитом С развивается хроническая (персистирующая) инфекция с исходом в цирроз печени и гепатоцеллюлярную карциному. Инфицированные вирусом гепатита С составляют 3% населения земного шара. Ежегодно в мире инфицируется вирусом гепатита С 3-4 млн человек.
Тканевой тропизм: Обладает тропизмом к гепатоцитам, оказывая на них прямое цитопатическое действие. Повреждение гепатоцитов может быть связано так же со специфическим или неспецифическим иммунным ответом. Патогенез: Вирус гепатита С, попав в кровь, разносится по всему организму. В печени вирус адгезируется на гепатоцитах и проникает в них. Внутри гепатоцитов 76 происходит репродукция вируса, в результате чего функции гепатоцитов нарушаются. Новые вирусные частицы выходят из гепатоцитов и заражают новые клетки печени. Прогрессирующее поражение печени протекает часто бессимптомно, проявляясь клинически только на стадии цирроза печени или гепатоцеллюлярной карциномы. Вирус гепатита С может реплицироваться также и в других клетках (внепеченочная репликация): клетки мононуклеарного ряда, костный мозг, эпителиальные клетки экзокринных желез, эндотелий сосудов.
Вирусологические и
клинические исходы инфекции, возможные
осложнения:

 Инкубационный
период при гепатите С колеблется от 14
до 180 дней, чаще всего составляет 6-8
недель. Для гепатита С характерны
диспепсические явления, умеренное
увеличение и уплотнение печени и
селезенки, нарушение функций печени.
Желтуха отмечается не во всех случаях.
В
настоящее время выделяют две клинические
формы заболевания: острый гепатит С
(ОГС) и хронический гепатит С (ХГС).
ОГС
проявляется общим недомоганием,
утомляемостью, отсутствием аппетита,
тошнотой, рвотой, желтухой (пожелтением
кожных покровов и склер), темной мочой,
обесцвеченным калом. При ОГС отмечается
повышение активности аминотрансфераз
сыворотки крови.
ХГС проявляется
слабостью, общим недомоганием, снижением
аппетита, чувством тяжести в правом
подреберье, увеличением размеров печени,
желтухой, повышением активности
аминотрансфераз. В большинстве случаев
симптомы заболевания выражены
слабо.
Часто хронический гепатит
С проявляется только усталостью и
снижением работоспособности. Примерно
у 80% лиц, инфицированных вирусом гепатита
С, заболевание протекает в форме
хронической инфекции с последующим
развитием цирроза и первичного рака
печени.
Механизм
персистенции и ускользания от эффекторов
иммунной системы:
Только
закрепившись и поддерживая свою
репликацию вирус представляет реальную
опасность, вся его патогенетическая
стратегия сводится к персистенции
гепатита C.
1.
Слабость иммунного реагирования
2.
Генотипическая неоднородность (квазивиды)
– антигенная изменчивость вируса
3.
Неинтегративная вирогения
4.
Внепеченочные резервуары инфекции
5.
Антииммунитетная стратегия:
антиинтерфероновая активность
1.
Антитела не защищают
от HCV-персистенции и не обеспечивают
Инкубационный
период при гепатите С колеблется от 14
до 180 дней, чаще всего составляет 6-8
недель. Для гепатита С характерны
диспепсические явления, умеренное
увеличение и уплотнение печени и
селезенки, нарушение функций печени.
Желтуха отмечается не во всех случаях.
В
настоящее время выделяют две клинические
формы заболевания: острый гепатит С
(ОГС) и хронический гепатит С (ХГС).
ОГС
проявляется общим недомоганием,
утомляемостью, отсутствием аппетита,
тошнотой, рвотой, желтухой (пожелтением
кожных покровов и склер), темной мочой,
обесцвеченным калом. При ОГС отмечается
повышение активности аминотрансфераз
сыворотки крови.
ХГС проявляется
слабостью, общим недомоганием, снижением
аппетита, чувством тяжести в правом
подреберье, увеличением размеров печени,
желтухой, повышением активности
аминотрансфераз. В большинстве случаев
симптомы заболевания выражены
слабо.
Часто хронический гепатит
С проявляется только усталостью и
снижением работоспособности. Примерно
у 80% лиц, инфицированных вирусом гепатита
С, заболевание протекает в форме
хронической инфекции с последующим
развитием цирроза и первичного рака
печени.
Механизм
персистенции и ускользания от эффекторов
иммунной системы:
Только
закрепившись и поддерживая свою
репликацию вирус представляет реальную
опасность, вся его патогенетическая
стратегия сводится к персистенции
гепатита C.
1.
Слабость иммунного реагирования
2.
Генотипическая неоднородность (квазивиды)
– антигенная изменчивость вируса
3.
Неинтегративная вирогения
4.
Внепеченочные резервуары инфекции
5.
Антииммунитетная стратегия:
антиинтерфероновая активность
1.
Антитела не защищают
от HCV-персистенции и не обеспечивают
надежного иммунитета против реинфекции. Скорее всего это связано с антигенной
вариабельностью (даже гипервариабельностью) оболочечных белков, благодаря которой
минорные (т.е. по началу немногочисленные) иммунорезистентные вирусные клоны
ускользают от нейтрализующих антител, обретая лидерство в патологическом процессе.
Не всегда результативны и эффекторы Т-клеточного иммунитета. Несмотря на то, что
структурные и неструктурные HCV-белки содержат множество Т-эпитопов1,
выступающих в качестве мишеней для хелперных (CD4+) и цитотоксических (CD8+) Т-
лимфоцитов, Т-зависимая элиминация вируса часто бывает неполной. Кроме антигенной
(в данном случае Т-эпитопной) вариабельности, имеет значение сродство пептидов к
презентирующим их молекулам HLA, сокращение внутриклеточного пула вируса до
уровня, невоспринимаемого Т-лимфоцитами.
2. Вирус гепатита С обладает высокой изменчивостью. В организме человека после инфицирования вирусом гепатита С в результате мутаций возникает множество вариантов вирусных частиц, отличающихся от родительского вируса. Такие варианты называются –
квазивидами. Они играют большую роль во взаимоотношениях с хозяином, обеспечивая уклонение от эффекторов иммунитета, расширение тканевого тропизма и повышение устойчивости к антивирусной терапии. Наиболее мутабельны области генома, кодирующие оболочечные белки, прежде всего Е2. Это делает его носителем протективных эпитопов, индуцирующих образование вируснейтрализующих антител. К сожалению, эффективность последних быстро падает, так как квазиспецифичность помогает вирусу ускользать от иммунного ответа – ускользающие мутанты. В каждом квазивидовом наборе существует преобладающий вариант и редкие варианты. Когда иммунная система уничтожает преобладающий вариант, один из редких вариантов занимает его место. Таким способом вирус гепатита С уклоняется от действия иммунной системы организма, которая вынуждена постоянно идентифицировать и уничтожать новые варианты вируса.
3. Его РНК находится в цитоплазме, не встраиваясь в геном вируса (неитегративная – не интегрируется в геном клетки). 4. Может персистировать не только на гепатоцитах, имеет тропизм и к другим тканям, , прежде всего в лимфоидной ткани. Вирус находит здесь не только пассивное убежище. Это
дополнительная зона реализации его агрессивного потенциала. Подвергаясь репликации,
он вызывает функциональные перекосы лимфоцитов, которые ведут к развитию
заболеваний иммунной системы и ослабляют ее вирусэлиминирующий потенциал2. Это, в частности, зависит от нарушения баланса регуляторных цитокинов.
Преобладание Th2 цитокинов при остром НCV-гепатите, ассоциируемое с ослаблением
эффекторного звена Т-клеточного иммунитета, содействует вирусной персистенции и
хронизации HCV-инфекции. Напротив, доминирование Th1 цитокинов коррелирует с тенденцией к выздоровлению и элиминацией возбудителя.
5. Еще один механизм, способствующий выживанию HCV, связан с его
антиинтерфероновой активностью. Это, в частности, объясняется блокадой клеточной
протеинкиназы, которая обеспечивает один из антивирусных эффектов интерферона (мешает репликации вируса) – опережающее подавление синтеза белка за счет подавления фактора элонгации-2. Участок NS5A, ответственный за этот эффект, неодинаково активен у разных генотипов вируса, определяя разную степень рефрактерности к антивируссной терапии. В наибольшей степени это выражено для штаммов генотипа 1
Особенности иммунитета (антителообразования): HCV обладает слабой иммуногенностью. Характерным признаком гепатита С является отсроченная сероконверсия. Вируснейтрализующие АТ ограничивают инфекцию, но пропускают мутантные клоны (квазивиды). Между титрами АТ и исходами острого гепатита нет корреляции. У лиц, перенесших HCV, не вырабатывается специфическая невосприимчивость к повторным заражениям. Возможно множественное инфицирование различными генотипами и субтипами вируса.
Принципы лабораторной диагностики:
Исследуют наличие анти-HCV антител с помощью ИФА (необходимо помнить об отсроченной сероконверсии, антитела только через 12 недель после заражения).
Репликативная активность вируса выявляется при исследовании крови на присутствие HCV-РНК с помощью ПЦР (ранняя диагностика)
Микромицеты рода Candida. Классификация, основные представители. Морфология и общая характеристика. Культуральные свойства. Факторы патогенности кандид. Основные типы (формы) заболеваний. Принципы лабораторной диагностики кандидозов. Принципы антифунгальной терапии и мишени для антифунгальных препаратов.
МЕТОДЧИКА 104 страница Царство Fungi Класс Deuteromycetes Семейство Cryptococcaceae Род Candida Виды: С.albicans (80-90% поражений)/ C.krusei (5%) / C.tropicalis (1-1,5%)/ C.parapsilosis/ C.glabrata
Грибы рода Candida вызывают поверхностный, инвазивный и другие формы кандидоза (кандидомикоза). Являются оппуртонистами (условно-патогенные). Насчитывается около 200 видов грибов рода Candida. Такнономические отношения внутри рода недостаточно изучены. Часть представителей рода являются дейтеромицетами (половое размножение которых не установлено). Выявлены также телеомофрные роды, включащие представителей с половым способом рамзножения. Основные виды-возбудители кандидоза: C. albicans, C. tropicalis, C. krusei, C. parapsilosis, C. glabrata. Морфология и общая характеристика: (МЕТОДЧИКА) Полиморфные грибы, способные продуцировать одновременно дрожжеподобные клетки и гифы. Клеточная стенка содержит хитин, глюканы, мананны, комплекс полисахаридов и гликопротеинов. Клеточная мембраа содержит эргостерол. Аэробы. (Про ростовую трубку – сказать надо) Грамположительные. Аэробы. Грибы рода Candida состоят из овальных почкующихся дрожжевых клеток, псевдогиф и септированных гиф. Округлой, овоидной и цилиндрической формы. Размножаются почкованием. Для C.albicans характерно образование ростовой трубки из бластоспоры (почки) при помещении их в сыворотку. Кроме этого C.albicans образует хламидоспоры – толстостенные двухконтурные крупные овальные споры. В тканях кандиды растут в виде дрожжей и псевдогиф. Выделяют два основных типа антигенов Candida – полисахаридные (маннаны) и белковые. Структура маннановых полисахаридов клеточной стенки обусловливает разницу антигенов разных видов Candida, а также наличие серотипов А и В у C. albicans. Другие маннановые антигены участвуют в формировании иммунного ответа и используются в серологической и иммунологической диагностике кандидоза. Среди белковых антигенов значение в патогенезе имеют белки теплового шока, протеиназы и гликолитические ферменты, среди которых многие (например, енолаза) являются сильными аллергенами. По ряду физиологических и биохимических признаков Candida spp. отличаются от других распространенных дрожжевых грибов-базидиомицетов. Candida spp. не образуют каротиноидных пигментов и меланина, поэтому их колонии белые или кремовые, не имеют розовых или красных оттенков. За исключением некоторых штаммов C. krusei, Candida spp. не имеют и уреазной активности. Особенности метаболизма разных видов Candida широко используются в диагностике кандидоза. Виды идентифицируют по спектру усваиваемых (ауксанограмма) и сбраживаемых (зимограмма) сахаров.
Культуральные свойства: (МЕТОДЧИКА) Выращивают на селективном агаре Сабуро (24-48 ч, 37 C). Образуют белые сметанообразные колонии. Кандиды лучше растут на специальных питательных средах с добавлением углеводов (глюкозы), но могут размножаться и на простых. Оптимальная температура роста грибов – +22-36оС; pH – 5,8-6,5 (ниже 7). Специальными средами для выращивания кандид являются глюкозо-пептонный агар, кукурузный питательный агар, среда Сабуро, среда Чапекса-Докса, жидком сусле или сусло-агар. На простых питательных средах при 25-27 C они образуют дрожжевые и псевдогифальные клетки. Колонии выпуклые, блестящие, сметанообразные, непрозрачные с различными оттенками (беловато-кремовые)
Эпидемиология: (МЕТОДЧИКА) Сапрофиты. Комменсалы человека и животных Источники инфекции: предметы окружающей среды, люди, аутоинфекция. Механизмы передачи: контактный, фекально-оральный, аэрогенный) Условно-патогенные. Вызывают микозы заболевния у лиц с трансплантациями, на фоне сниженного иммунитета, нерациональной длительной антибиотикотерапии, гормонотерапии, использования инвазивных методов исследования. Вторгаются в ткань (эндогенная инфекция) и вызывают кандидоз. Реже возбудитель передается детям при рождении, при кормлении грудью. При передаче половым путем возможно развитие урогенитального кандидоза.
Факторы патогенности кандид: (МЕТОДЧИКА) - широкий спектр адгезинов - ферменты инвазивности (секреторные аспартат-протеазы-SAP) - трансформация «дрожжи-гифы», способствующая инвазии и распространению грибов в тканях - иммуномодулирующая активность: маннаны клеточной стенки способны подавлять реакции Т-лимфоцитов, некоторые поверхностные рецепторы C.albicans могут подавлять опсонин-зависимый фагоцитоз (блокада опсонической функции комплемента) С. albicans – это наиболее изученный в плане патогенных свойств возбудитель микозов. По наличию факторов патогенности C. albicans превосходит все прочие виды Candida. Факторы патогенности C. albicans можно условно разделить на 3 группы: изменчивость и значительную лабильность морфо-физиологических свойств клетки, рецепторы адгезии и литические ферменты. Изменчивость C. albicans обеспечивается многими генетическими и регуляторными механизмами и позволяет выживать в разных условиях (температура, кислотность, содержание кислорода, питательных веществ). C. albicans – единственный в своем роде и вообще среди возбудителей микозов вид, существующий в диплоидном состоянии. В зависимости от условий среды C. albicans переходит от дрожжевой формы к плесневой и обратно (полиморфизм), меняет общий фенотип (феномен переключения) или структуру поверхности, т.е. рецепторы и антигены.
Среди рецепторов C. albicans имеются факторы адгезии: к фибриногену, ламинину, фибронектину, факторам системы комплемента. Это обеспечивает, во-первых, возможность быстрого прикрепления, а затем и инвазии, а во-вторых, «антигенную мимикрию», т.е. предоставление этих рецепторов факторам иммунитета человека.
Описано не менее 9 протеиназ C. albicans (есть и у других видов), способных разрушать кератин, белки эндотелия и соединительной ткани, факторы плазмы крови, комплемента и фрагменты иммуноглобулинов. C. albicans имеет также фосфолипазы, разрушающие фосфолипиды клеточных мембран, гиаулуронидазу и гемолитический фактор.
В последнее время среди факторов патогенности выделяют и такие свойства, как устойчивость к противогрибковым средствам: способность к их ускоренному выведению, изменению или амплификации внутриклеточной мишени.
Основные типы (формы) заболеваний: (МЕТОДЧИКА) Оппуртонистические инфекции: кандидоз кожи, слизистых (индукция воспалительной реакции), или ногтевых пластин (онихомикоз). Системный кандидоз - Кандиды могут вызвать висцеральный кандидоз различных органов (воспалительное поражение определнных органов и тканей – кандидоз пищевода, кадндидный гастрит, кандидоз органов дыхания, кандидоз мочевыделительной системы) - Системный (диссеминированный или кандидасептицемия) кандидоз – главным признаком является грибковый эндофтальмит (эксудативное изменение желто-белого цвета сосудистой оболочки глаз) - Поверхностный кандидоз слизистых оболочек, кожи и ногтей – молочница рта, атрофия/гипертрофия или гиперкератоз сосочов языка, вульвовагинит, отек и эритема слизистых оболочек. На коже на ягодицах/туловище у новорожденных мелкие узелки, папулы и пустулы - Хронический (гранулематозный кандидоз) - Аллергию на антигены кандид – кандидная аллергия ЖКТ, аллергическое поражение органов зрения с развитием зуда век, блефароконъюнктивита Принципы лабораторной диагностики кандидозов: (МЕТОДЧИКА) 1. Экспресс-диагностика: морфологическое исследование слизистой оболочки и микроскопическое исследование образцов для подтверждения диагноза. 2. Культуральный метод. Выделение кандид на среде Сабуро. Идентификация полученного микроорганизма на основе морфологических, биохимических реакций; тест на способность образовывать ростовые трубки. В мазках из клинических материалов выявляют псевдомицелий (клетки соединены перетяжкам), мицелий с перегородками и почкующиеся бластоспоры. Посевы от больного проводят на агар Сабуро, сусло-агар и др. Колонии C.albicans беловато-кремовые, выпуклые, круглые. Грибы дифференцируют по морфологическим, биохимическим и физиологическим свойствам. Принципы антифунгальной терапии и мишени для антифунгальных препаратов: При назначении антифунгального лечения необходимо помнить, что серотип А чувствителен к 5-флуороцитозину, а серотип В – часто устойчив.
Наиболее очевидными мишенями для избирательного воздействия на грибы являются плазматическая мембрана и клеточная стенка. В первом случае речь идет об эргостероле и его синтезе (присутствие эргостерола наиболее радикально отличает грибы от высших эукариот), во втором — о выключении синтеза полисахаридных структур, уникальных для клеточной стенки грибов. Известны и другие молекулярные мишени, которые уже использовались как объекты антифунгальной терапии (гризефульвин — ингибитор микротубулярного аппарата фунгальных клеток, флюцитозин — ингибитор синтеза ДНК/РНК) или рассматриваются среди ее потенциальных кандидатов. К ним относятся ингибиторы фактора элонгации-2, топоизомеразы и ряда других ферментов, в том числе специфичных для некоторых грибов (например, фенилоксидазы и ферментов синтеза капсулы Cryptococcus neoformans — возбудителя криптококкоза). Ингибиторы плазматической мембраны представлены полиенами, производными азолов, аллиламинами и морфолинами. На смену имидазолам (миконазол, кетокиназол, клотримазол, эконазол) пришло поколение триазолов (флуконазол, итраконазол, тетраконазол и др.) с улучшенной фармакокинетикой и переносимостью. В сочетании с хорошей проницаемостью в центральную нервную систему это определяет его преимущество при лечении кандидозного и криптококкозного менингитов. Получено много новых триазолов, обладающих рядом достоинств по сравнению с уже известными препаратами. Дело не только в фармакодинамике, но и в воздействии на резистентные штаммы, эволюционирующие под влиянием химиотерапии. Производные азола не решили всех проблем антифунгальной терапии. Например, зигомицеты не чувствительны к азольным препаратам, хотя содержат в своих мембранах эргостерол. Главным средством в этом случае (как и при лечении ряда других микозов) остается амфотерицин В. Внедрение ингибиторов синтеза клеточной стенки только начинается, но видится как обнадеживающая перспектива. Устойчивсть обусловлена специальным механизмом перестройки генетического аппарата, который обеспечивает мозаичность фенотипических вариантов. Это содействует отбору клеток, наиболее приспособленных к конкретной экологии, в том числе резистентных к антифунгальным агентам. Механизмы устойчивости к азолам определяются снижением аффинности фермента-мишени (ланостерол-деметилазы) к азольным производным, утратой активности фермента-мишени, гиперпродукцией ланостерол-деметилазы, снижением проницаемости клеток для антифунгальных агентов, заменой эргостерола на другие стеролы (этот механизм действует и против полиенов) и ускоренным выведением агентов из клеток. Обнадеживает то, что резистентность даже против препаратов одного класса не абсолютна. Например, изоляты кандид, устойчивые к флуконазолу, могут сохранять чувствительность к другим производным азола. Сифилис – хроническое венерическое заболевание с циклическим течением, затрагивающее в процессе развития инфекции все органы и ткани человека. семейство: Spirochaetaceae
род: Treponema
вид: Treponema pallidum
( бледная трепонема, окрашиваетсяв бледно-розовый цветпо Романовскому-Гимзе) плохо окрашивается! Выявляется при импрегнации серебром, а также с помощью фазово-контрастной и темнопольной микроскопии.
Спирально закрученные с помощью осевых фибрилл, состоящизх из сократительного белка флагеллина, который обеспечивает их извитую форму и высокую подвижность.
Виды движений: Вращательное, винтрообразное, Поступательное Сгибательное (маятникообразное) Сократительное (волнообразное) Атипизм спирохет: на их клеточной стенке есть белок, который формирует завитки , из-за этого она похожа на спиральку и может передвигаться как хочет Антигенная структура: специфический термолабильный антиген и неспецифический липоидный антиген, который идентичен кардиолипину, экстрагированному из бычьего сердца. Представлен по химической структуре дифосфадил глицерин
Культивирование: Облигатный паразит, на питательных средах не культивируется. Можно поддерживать несколько генераций в культуре клеток или в организме животных. Биохимия изучена плохо.
Медленный рост (время одной генерации около 30ч).
Микроаэрофилы (O2 5-10%)
Неустойчивы во внешней среде, быстро погибают при высыхании и повышенной температуре (при 45-550С гибель в течении 1 часа, при 1000 С - мгновенно)
Эпидемиология: Источник инфекции - больной человек (болеют только люди!)
Механизмы передачи - контактный (пути передачи - половой, контактно-бытовой), трансплацентарный, трансмиссивный (трансфузионный – через кровь).
Входные ворота инфекции: слизистые оболочки и кожа. Через незначительные повреждения в них возбудитель быстро проникает в ткани.
Минимальная инфицирующая доза – 10-100 трепонем.
Заразность физиологических жидкостей больного:
Свежая кровь (в инкубационный период, на всех стадиях заболевания, особенно на стадии вторичного сифилиса)
Грудное молоко
Сперма
Слюна при наличии специфических высыпаний в полости рта (вторичный сифилис)
Входные ворота инфекции при профессиональном заражении (медперсонал): кожа рук (микротрещины), конъюктива глаз Хорошо выживает в условиях цисты в неблагопрятных условиях, а так чувствителен дез.вещ-вам, высыханию, солнечным лучам и нагреваю, при 100 C – многовенно смэрть.
Факторы патогенности: Адгезины (синетез возомжен при попадании возбудителя в организм человека) Способность к инвазии (активное внедрение через микротрещины на коже) - фермент мукополисахаридаза
Липополисахарид (ЛПС) и белки наружной мембраны, (ТROМP's) обладающие токсическими свойствами
Способность к персистенции
мукополисахаридазная капсула – антифагоцитарный фактор
Не продуцирует сильнодействующие экзотоксины, но тем не менее обладает цитотоксической активностью в отношении нейробластов и других клеток. Имеются протеины, сходные с бактериальными гемолизинами
Патогенез: Проникшие трепонемы из местра входных ворот попадают в регионарные лимфатические узлы, где разможается. Из лимфатических узлов возбудительно попадает в кровь, где прикрепляется к эндотелиальным клеткам и вызывает эндартриит, ведущий к развитию васкулитов и последующему тканевому некрозу. С кровью трепонемы разносятся по всему организму, обсеменяя различные органы и ткани: печень, почки, костную, нервную и сердечно-сосудистую систему. Клинические проявления: Болезнь протекает в несколько циклов. Инкубационный период 3-4 недели. Первичный период – характеризуется появлением твердого шанкра (язвочка с твердыми краями на месте внедрения возбудителя – слизистая оболочка половых органов, рта, ануса), увеличением и воспалением лимфатических узлов. Длительность 6-7 недель. Вторичный период – появление на коже и слизистых оболочках папулезных, везикулярных или пустулезных высыпаний (сифилиды), в которых содержится большое количество живых трепонем, а также поражение печени, почек, костной, неврной и сердечно-сосудистой систем. Наиболее заразный период. Высыпания могут исчезать и появляться при ослаблении защитных сил организма. Период длится годами. Третичный период – появляется без лечения. Характеризуется образованием сифилитическихх бугорков (гумм) как результат развития в организме иммунопатологического процесса. Гуммы склоны к распаду, вызывая деструктивные изменения в пораженных органах и тканях. Длится десятилетями.
Четвертичный
период – без лечения. Нейросифилис,
характеризующийся развитием
прогрессирующего паралича поражения
центральной нервной системы.

Ранний врожденный сифилис проявляется в первые два года после рождения. Симптомы напоминают вторичный сифилис у взрослых.
Поздний врожденный сифилис проявляется через 5-20 лет после рождения и соответствует третичному сифилису.
Триада Гетчинсона:
паренхиматозный диффузный кератит
сифилитический лабиринтит
зубная патология - зубы Гетчинсона
Также могут наблюдаться:
хронический синовит суставов без поражения хрящей и эпифизов костей
поражение костной системы (симметричные изменения большеберцовых костей голеней - саблевидные голени).
различные другие дистрофические изменения
Иммунитет: Не формируется. Антитела являются свидетелями инфекционного процесса. Титр этих антител в процессе уменьшения в организме количества трепонем падает. Специфические антитела на белковый антиген появляются позже. Они длительно сохраняются независимо от присутствия трепонем в организме. Иммунитет зависит от совместного действия гуморальных (антител) и клеточных (Т-лимфоциты) факторов. Однако, появление антител не обеспечивает избавление от возбудителя (нестерильный иммунитет).
При третичном сифилисе Т-зависимое хроническое воспаление играет повреждающую роль
(вызывает распад гумм, некроз тканей).
Лечение: Препараты выбора – антибиотики пенициллиновой группы и висмутсодержащие препараты (часто пролонгированные). Препараты резерва: доксициклин, эритромицин, оксациллин, цефтриаксон и др.
После лечения пациенты находятся на клинико-серологическом контроле от 3 месяцев до 3 лет.
Врожденный сифилис можно предотвратить, если в период беременности диагностировать данное заболевание и начать лечение.
Профилактика: Специфическая – не разработана
Неспецифическая – пропагнда ЗОЖ, сан-просветительные работы среди молодежи. Серологический обязательный контроль беременных, доноров и больных в стационарах с целью своевременного выявления и эффективного лечения больных сифилисом. Лабораторная диагностика: Экспресс-диагностика. При первичном сифилисе основным методом является микроскопия в темном поле
отделяемого из твердого шанкра (выявление трепонем); возможно также использование
ПЦР - диагностики.
Иммунологический анализ. Серодиагностика.
При вторичном и третичном сифилисе основную роль играет серодиагностика– выявление
антител к кардиолипиновым и трепонемным антигенам трепонем (следует, однако,
учитывать у больного наличие «серонегативного окна»).
(Кардиолипиновые антигены трепонем (липопротеины мембран трепонем) являются
малоспецифичными антигенами. Антилипидные антитела у человека могут вырабатываться не
только при сифилисе, а также при многих заболеваниях и состояниях организма,
сопровождающихся разрушением тканей (например, при ревматических заболеваниях), поэтому
кардиолипиновые тесты (относительно недорогие) являются не подтверждающими сифилис
тестами, а отборочными. Если кардиолипиновый тест положительный - то затем ставят
реакции на основе специфического антигена трепонем.)
Кардиолипин (антиген), который используется в коммерческих тест-системах для
серодиагностики сифилиса, представляет собой высокоочищенный спиртовой экстракт из
мышц бычьего сердца.
В настоящее время для определения антител к возбудителю рекомендованы, прежде всего,
тесты для выявления антител к специфическим трепонемным антигенам:
1 ИФА иммуноферментный анализ,
2 РПГА - реакция непрямой гемагглютинации с эритроцитарным диагностикумом (на
эритроцитах адсорбированы трепонемные антигены).
В экспертных лабораториях и специализированных лечебных учреждениях до сих пор
ставится RW - реакция Вассермана. Реакция Вассермана - это реакция связывания
комплемента (РСК) при сифилисе, которая может ставиться как с кардиолипиновым, так и
с трепонемным антигенами.
Реакция Вассермана, в отличие от ИФА и РПГА, очень чутко реагирует на
сероконверсию, позволяя, в частности, оценить эффективность антибактериальной
терапии при сифилисе.
