
Патофизиология системы крови
В 1936–1940 годах Г.Ф. Ланг предложил объединить кровь, регулирующий ее состояние нейрогуморальный аппарат и органы, в которых происходит образование и разрушение клеток (костный мозг, вилочковую железу, лимфатические узлы, селезенку и печень), в виду тесной их связи под общим понятием система крови.
Главным местом образования клеток крови является костный мозг. Здесь находится основная масса кроветворных элементов. В нем же осуществляется и разрушение эритроцитов, реутилизация железа, синтез гемоглобина, накопление резервных липидов. С костным мозгом связано происхождение В-лимфоцитов, осуществляющих гуморальные реакции иммунитета, то есть вырабатывающих антитела.
Вилочковая железа (thymus) – центральный орган иммунитета. В ней образуются Т-лимфоциты, участвующие в клеточных реакциях иммунитета, направленных на отторжение тканей.
Лимфатические узлы продуцируют и депонируют лимфоциты.
Селезенка участвует в лимфоцитопоэзе, синтезе иммуноглобулинов, депонировании и разрушении эритроцитов, лейкоцитов, тромбоцитов, в депонировании крови, выработке регуляторов гемопоэза.
Печень и почки участвуют в выработке специфических гуморальных регуляторов кроветворения.
Кроветворение и его регуляция
Для понимания механизмов действия того или иного регулятора чрезвычайно важным представляется определение точки его действия. В этом плане многие стороны регуляции гемопоэза стали понятны в последние годы благодаря уточнению схемы кроветворения (А.И. Воробьев и И.Л. Чертков), в которой теперь условно выделяют шесть классов клеточных форм (рис. 96):
.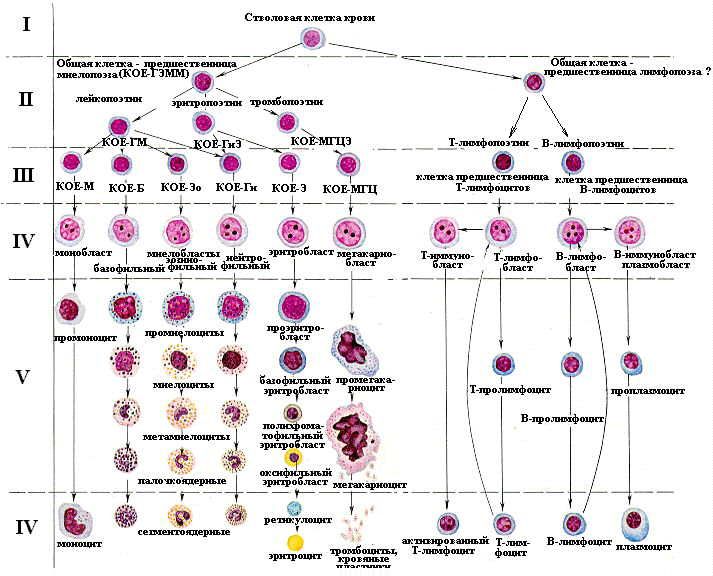
Рис. 96
Схема кроветворения (И.Л. Чертков, Н.И. Дризе, А.И.Воробьев, 2005)
I − класс полипотентных стволовых кроветворных клеток − ППСК, то есть клеток, способных дифференцироваться в направлении любого ростка кроветворения (однако реально дифференцируется лишь в одном направлении) и длительному самоподдержанию или самообновлению (то есть в процессе деления дает себе подобные клетки). Способность к самообновлению является ключевой в концепции стволовой клетки. На сегодняшний день выделяют две теории, объясняющие это явление. Согласно одной, деление стволовой клетки асимметрично − из двух произведенных стволовых клеток одна − недифференцированная, другая − дифференцированная, предназначенная продуцировать зрелые клетки крови. По второй − стволовая клетка при каждом делении производит либо две новые стволовые клетки, либо две более зрелые клетки. Пул стволовых клеток, таким образом, поддерживается не точным асимметричным делением каждой стволовой клетки, а равновесием между числом делений, увеличивающих количество стволовых клеток, и делений, связанных с появлением более зрелых клеток. Считается, что стволовые клетки встречаются с частотой 1 на 106 ядросодержащих костномозговых клеток (миелокариоцитов); по более сдержанным оценкам, их доля составляет 1 на 107.
II − класс частично детерминированных полипотентных клеток-предшественников, который представлен двумя типами: клеткой-предшественником миелопоэза − КОЕ-ГЭММ (дает при культивировании in vitro колонии − откуда и название «колониеобразующая единица» − КОЕ − содержащие гранулоциты, эритроциты, моноциты-макрофаги и мегакариоциты) и клеткой-предшествеником лимфопоэза, которые способны к самоподдержанию в течение трех-четырех недель;
III − (класс) − коммитированные (унипотентные) клетки-предшественники, дающие начало одному ростку, а их способность к самоподдержанию ограничена 10–15 митозами (КОЕ-Э − родоначальная клетка для эритроидного ростка, КОЕ-Г − нейтрофильного, КОЕ-М − моноцитарного, КОЕ-ЭО − эозинофильного, КОЕ-Б − базофильного, КОЕ-МГЦ − мегакариоцитарного. Имеются также клетки-педшественники Т-лимфоцитов, В-лимфоцитов и тучных клеток). Однако следует отметить, что между частично детерминированными клетками и унипотентными имеется группа предшественников, способных дифференцироваться в более чем в одном направлении, но число этих направлений меньше, чем у клеток II класса (КОЕ-ГМ может дифференцироваться как в моноцитарном направлении, так и в сторону любых гранулоцитов: нейтрофилов, базофилов, эозинофилов, КОЕ-ГЭ − в сторону нейтрофилов и эозинофилов, КОЕ-МГЦЭ − в сторону мегакариоцитов и эритроцитов. Кроме того, КОЕ-Э предшествуют бурстобразующие единицы − БОЕ (незрелая и зрелая).
Следует подчеркнуть, что клетки I, II и III классов выявляются только с помощью специальных методик, которые сложно соотносить друг с другом, и порой сложно решить идет ли речь о истинно разных клетках или о выявлении различных свойств одной и той же клетки, находящейся в разных условиях. В связи с тем, что клетки первых трех классов морфологически практически не различаются и существуют в двух формах − бластной и лимфоцитоподобной, при подсчете миелограммы их принято объединять под названием «недифференцируемые бласты».
IV класс клеток характеризуется выраженными морфологическими отличиями способных к пролиферации клеток.
V класс составляют созревающие клетки.
VI класс – зрелые с ограниченным циклом клетки.
Деление на три последних класса клеток также условно. В частности, тромбоциты не клетки (в классическом понимании), моноциты способны дифференцироваться в макрофаги, формирующие систему фагоцитирующих мононуклеаров – СФМ, а лимфоциты могут делиться. Кроме того, не для всех ростков обнаружены представители всех классов.
В регуляции гемопоэза можно выделить специфические механизмы, действующие в пределах данной системы, и неспецифическую регуляцию, контролирующую различные системы организма, в том числе и кроветворную.
Специфическая регуляция кроветворения. Для каждого класса и типа клеток существуют свои пролиферативные и дифференцировочные стимулы. По расстоянию между местом их возникновения и местом действия выделяют две большие группы: механизмы короткоранговой (близкодействующей) регуляции и механизмы дальноранговой (дальнодействующей) регуляции гемопоэза.
Короткоранговая регуляция кроветворения, или гемопоэзиндуцирующее микроокружение (ГИМ). ГИМ морфологически состоит из трех компонентов:
– микрососудистого компонента, представленного артериолами, капиллярами, венами. Вся эта система отвечает за поступление и выход клеток крови в циркуляцию, равно как за тканевое рН, оксигенацию и т.д.;
– сосудисто-тканевого компонента, состоящего из волокон основного вещества и клеток. Эта система связана с переносом метаболитов, которые вовлекаются в измененные клеточные реакции и ответы.
Гемопоэтические клетки нуждаются в двух тесно связанных между собой элементах – в растворимых гемопоэтических факторах роста и мембраносвязанных молекулах присоединения (прикрепления). И тем и другим их обеспечивают стромальные клетки. Среди стромальных клеток, определяющих ГИМ, особое внимание уделяют фибробластам и ретикулярным клеткам. Было показано, что фибробласты будучи трансплантированными под капсулу почки вызывают образование в этом месте костной ткани, которая заполняется костным мозгом, Кроме того, фибробласты могут быть источником колониестимулирующего фактора − КСФ, стимулирующего гранулоцитопоэз. Что касается ретикулярных клеток, то было показано, что они служат клетками-кормилицами для клеток крови. По крайней мере, молодые лимфоидные и эритроидные клетки облепляют ретикулярные клетки со всех сторон, получая из них питательные вещества (а эритроидные − хотя бы частично и железо). Следовательно, ретикулярные клетки могут влиять на дифференцировку и пролиферацию клеток крови.
К клеткам ГИМ следует отнести также жировые и тучные клетки.
Одним из механизмов регуляции кроветворения клетками ГИМ (прежде всего способными к фагоцитозу) является продукция ими гуморальных факторов: эритропоэтина, колониестимулирующего фактора − КСФ, а также интерлейкина 1 (стимулирует выработку фибробластами, эндотелиальными и жировыми клетками КСФ, а также сам стимулирует начало пролиферации ранних гемопоэтических клеток-предшественников), интерлейкина 3 (продуцируется неприлипающими к стеклу клетками костного мозга и является основным ростковым фактором полипотентных предшественников, а также стимулировать (как самостоятельно, так и проявляя синергический эффект с другими ростковыми факторами) процессы пролиферации и дифференцировки коммитированных прекурсоров.
Кроме того, из костного мозга выделяют миелопептиды – класс веществ, влияющих на физиологическую активность и пролиферацию клеток различных органов, в том числе и кроветворной ткани.
Наряду с клетками, сосудисто-тканевой компонент ГИМ формирует и основное вещество, включающее в себя коллаген, ретикулин, небольшое количество эластина, образующих своеобразную сеть, в которой как бы подвешены кроветворные клетки. В состав основного входят гликозаминогликаны. При этом признано, что их кислые сульфатированные формы стимулируют пролиферацию и дифференцировку ранних предшественников и поддерживают гранулоцитопоэз, в то время как нейтральные – эритропоэз. Основное вещество содержит также большое количество ферментов.
– нервных окончаний, связанных как с кровеносными сосудами, так и со стромой.
Микроокруженческий контроль за гемопоэзом осуществляется через взаимодействие этих трех компонентов. ГИМу принадлежит решающая роль в регуляции кроветворения на уровне I и II классов клеток.
Дальноранговая специфическая регуляция кроветворения занимает центральное место, начиная с коммитированных клеток. При этом для каждого ростка имеются свои механизмы.
Эритропоэз регулируется эритропопоэтином, бурстстимулирующей активностью ингибитором эритропоэза и эритроцитарными кейлонами (челонами), антикейлонами (античелонами).
Эритропоэтин – относится к группе гликопротеинов, синтезируется главным образом в почках, однако имеются и внепочечное его образование (макрофаги). Стимулом к повышенной продукции эритропоэтина служит гипоксия, развивающаяся при многих патологических процессах и состояниях (кислородная недостаточность, кровопотеря, введение гемолитических ядов и т.д.). Он действует главным образом на чувствительные к нему эритроидные клетки, побуждая часть их к вступлению в терминальное созревание с образованием проэритробластов, дифференцировка которых приводит к появлению зрелых эритроцитов, повышает синтез гемоглобина и ускоряет созревания клеток эритрона. Из предположительно 18 делений, проходящих в процессе превращения стволовой клетки в зрелый эритроцит, эритропоэтин существенно стимулирует заключительные 8–10 делений. Однако его действие не ограничивается только эритроидными клетками, но распространяется и на структуры, формирующие архитектонику костного мозга. Этот гормон вызывает сокращение адвентициальных клеток, покрывающих большую часть стенки венозных костномозговых синусов, превращение трехслойной ее структуры в однослойную, увеличение в ней размера и числа пор, что в конечном счете уменьшает костномозговой гематопаренхиматозный барьер и облегчает миграцию клеток из гемопоэтической ткани в общую систему циркуляции.
Бурстстимулирующая активность – вещество (а возможно и группа веществ), связанное с гликопротеинами, вырабатывается Т-лимфоцитами, стимулирует пролиферацию бурстобразующих эритроидных единиц − БОЕ-Э.
Ингибитор эритропоэза – в повышенном количестве вырабатывается при повышении парциального давления кислорода во вдыхаемом воздухе, при полицитемии, по химической природе относится к альбуминам. Он угнетает пролиферацию и дифференцировку эритроидных клеток, вероятно, нейтрализует эритропоэтин, по мнению же некоторых авторов, образует комплекс с эритропоэтином и тем самым не дает гомону проникнуть в клетку, а, возможно, действует в клетке либо угнетая ген-репрессор, либо препятствуя синтезу мРНК, либо тормозя внутриклеточные процессы фосфорилирования и угнетая активность цАМФ.
Ингибитор, как и эритропоэтин, вырабатывается в почках, а, возможно, в лимфатической системе и селезенке.
Кейлоны − челоны, халоны (от англ. chalon) – это внутренний секрет клетки, осуществляющий контроль за пролиферацией путем ингибирования активности клеток того же типа. Кейлоны выделяются зрелыми клетками (в данном случае эритроцитами) и действуют на более молодые предшественники. Помимо кейлонов, из эритроцитов выделены и антикейлоны. Обе группы веществ оказывают эффект (однако разнонаправленный) в фазе перехода клетки из G1 в S.
Лейкопоэз контролируется колониестимулирующим фактором, лейкопоэтинами, ингибитор лейкопоэза, кейлонами.
Колониестимулирующий фактор (КСФ) – в культуре костного мозга стимулирует образование колоний гранулоцитов-макрофагов. Его концентрация в крови возрастает при всех состояниях, требующих мобилизации лейкоцитов (воспаление, лейкаферез, микробный эндотоксин и др.). Он образуется клетками костного мозга, лимфоцитами, макрофагами, клетками жировой ткани, стенкой сосудов и т.д. КСФ вырабатывается в двухэтапном процессе. Во-первых, малые количества определенных КСФ (интерлейкин-6 или ИЛ-6, гранулоцитарно-макрофагальный колониестимулирующий фактор – ГМ-КСФ, фактор стволовых клеток – ФСК и Flt-3-лиганд) непрерывно продуцируются стромальными клетками костного мозга, вероятно, в ответ на стимуляцию белками плазмы, тем самым определяя основной гемопоэз, который поддерживает количество клеток крови в нормальной диапазоне. Во-вторых, секреция КСФ значительно возрастает в ответ на инфекцию. Иными словами, бактериальные и вирусные продукты активируют моноциты, которые затем секретируют интерлейкин-1 (ИЛ-1), фактор некроза опухоли-альфа (ФНО-a), гранулоцитарный колониестимулирующий фактор (Г-КСФ) и, собственно, макрофагальный колониестимулирующий фактор (М-КСФ). Эти продукты, в свою очередь, стимулируют дополнительную секрецию КСФ. ИЛ-1, кроме того, помимо антигенной стимуляции специфических рецепторов активирует секрецию ГМ-КСФ и интерлейкина-3 (ИЛ-3) Т-клеток. ИЛ-1 и ФНО-a стимулирует фибробласты и эндотелиальные клетки стромального микроокружения костного мозга к увеличению секреции ими ИЛ-6, ГМ-КСФ и Г-КСФ.
Все перечисленные гемопоэтические ростковые факторы (или цитокины) напрямую увеличивают количество циркулирующих нейтрофилов, моноцитов и плазматических клеток и активируют эти клетки в процессе созревания.
Лейкопоэтины – специфические для каждого вида клеток белого ряда стимуляторы, что подчеркивают в их названии: нейтрофилопоэтин, лимфопоэтин, эозинофилопоэтин, базофилопоэтин. Детальное исследование этой группы регуляторов лейкопоэза позволило установить их химическую природу и физиологический эффект, но в результате пришлось отказаться от этих обобщающих терминов.
Сейчас признается, что нейтрофилопоэз стимулируется ГМ-КСФ, Г-КСФ, ИЛ-1, ИЛ-3 и ФНО-a.
В продукции эозинофилов главную индуктивную роль играет интерлейкин-5 (ИЛ-5), в меньшей степени ИЛ-3, ГМ-КСФ.
Базофилы и тучные клетки непосредственно стимулируются ФСК и ИЛ-3.
Моноцитопоэз − ГМ-КСФ, М-КСФ, ИЛ-3.
Лимфоциты: В-клетки − ИЛ-4, ИЛ-6, ИЛ-7, ГМ-КСФ и ФСК, а Т-клетки − ИЛ-2 и антигенами.
Игибитор лейкопоэза − вырабатывается в селезенке и угнетает синтез ДНК в клетках гранулоцитарного ряда.
Кейлоны и антикейлоны − вырабатываются зрелыми клетками белого ряда. Выделение и изучение лимфоцитарного кейлона дало толчок разработке теории кейлонов.
Тромбоцитопоэз − его регуляторы изучены менее всего. Известно, что имеется мегакариоцитопоэтин − фактор пролиферации мегакариоцитов (стимулирует их пролиферацию, но не влияет на число тромбоцитов в крови), тромбоцитозин – фактор, стимулирующий образование тромбоцитов, фактор, стимулирующий выход тромбоцитов из костного мозга в периферическую кровь, и ингибитор тромбоцитопоэза. Кроме того, ИЛ-3 стимулируют митозы клеток-предшественников мегакариоцитарного ряда, а ИЛ-6 и ИЛ-11 отшнуровку тромбоцитов от мегакариоцитов.
Разрушение клеток крови. Контроль за гемопоэзом осуществляется не только на уровне пролиферирующих и дифференцирующихся клеток через механизмы коротко- и дальноранговой регуляции. Он осуществляется и на уровне зрелых, специализированных клеток, утративших пролиферативные и дифференцировочные возможности. На этом этапе контроль осуществляется механизмами разрушения клеток крови.
Клетки крови в организме разрушаются активно. Это разрушение идет и в нормальном организме, но активируется при различных воздействиях на него. В первую очередь разрушаются старые и поврежденные клетки. Разрушение происходит благодаря следующим механизмам:
– эритроциты (равно как и другие клетки крови) при депонировании или при прохождении через синусы органа теряют в известной степени свою устойчивость и жизнеспособность, а значит, скорее разрушаются;
– селезенка, печень, мышцы вырабатывают гемолитик, который поступает в кровь и вызывает внутрисосудистый гемолиз клеток крови;
– аутоиммунным процессам.
Разрушение форменных элементов может происходить как в тканях и циркулирующей крови, так и непосредственно в гемопоэтических органах. В последнем случае говорят об неэффективных поэзах (эритропоэзе, лейкопоэзе, тромбоцитопоэзе). В процессе гемопоэза образуются различные по своей жизнеспособности и функциональной активности клетки. При этом маложизнеспособные клетки разрушаются на ранних стадиях дифференцировки до выхода в периферическую кровь. Поступающая же в кровь часть маложизнеспособных клеток разрушается в ближайшие дни. Так, величина внутрикостномозгового гемолиза эритроцитов у здоровых лиц составляет 9 ± 1.9%. Внутрикостномозговое разрушение клеток дает возможность продуктивно использовать запасы железа и другие компоненты гемопоэтических клеток. В частности нежизнеспособные эритроидные элементы захватываются фагоцитирующими клетками, в которых из них извлекаются ферритин и другие железосодержащие вещества. Из этих клеток железо передается обратно в ядерные эритроидные предшественники, минуя путь плазменного кругооборота железа.
Таким образом, внутрикостномозговое разрушение клеток является своеобразным механизмом регулирования эффективного использования ресурсов в пределах костного мозга.
Исходя из выше изложенного, следует, что всякое количественное и качественное изменение гемопоэза сопровождается и изменение неэффективных поэзов, чаще всего в сторону их повышения.
Биологический смысл повышенного разрушения клеток крови при большинстве экстремальных воздействий на организм состоит, согласно концепции Я.Г. Ужанского, в том, что продукты распада клеток отдельных ростков гемопоэза стимулируют пролиферацию их предшественников. Таким образом, зрелые клетки вырабатывают кейлоны, а продукты их распада стимулируют отдельные ростки гемопоэза. При этом становится меньше и ингибиторов – кейлонов.
Неспецифическая дальноранговая регуляция гемопоэза. Отличительной особенностью этого вида регуляции является то, что она обеспечивается системами, для которых регуляция кроветворения не является основной функцией.
Нервная регуляция. Кора головного мозга – влияет на состав крови и кроветворения. При удалении коры одного или обоих полушарий у животного развивается анемия и умеренно выраженный нейтрофильный лейкоцитоз. В пользу гемопоэзрегулирующего действия коры свидетельствуют следующие факты: 1) при экспериментальных неврозах могут развиться анемия и ретикулоцитопения; 2) возможность получения условнорефлекторного лейкоцитоза; 3) изменение качества лейкоцитарных реакций у наркотизированных животных на различные раздражители (молоко, раствор пептона, бензол и т.д.).
Гипоталамус − проведенные эксперименты с раздражением различных гипоталамических центров показали, что стимуляция центров симпатической неровной системы сопровождается ретикулоцитозом, в то время как аналогичное воздействие на парасимпатические центры − ретикулоцитопенией. Для белой крови найдена связь между передним гипоталамусом и лимфоцитами, а стимуляция заднего вызывает нейтрофильный лейкоцитоз и лимфопению.
Что касается механизмов гипоталамического влияния на кроветворение, то большинство исследователей связывают их с влиянием гипоталамуса на железы внутренней секреции, а также на выработку специфических регуляторов гемопоэза.
При перерезке спинного мозга на уровне шейного или грудного отделов наблюдается развитие анемии, ретикулоцитопении, нейтрофильного лейкоцитоза. В костном мозгу в этих случаях развивается снижение количества эритробластических элементов.
Изучение влияния на кроветворения симпатического и парасимпатического отделов вегетативной нервной системы показало, что симпатическая иннервация стимулирует кроветворение, а парасимпатическая – тормозит. Возможно, что эффект связан с изменением кровоснабжения мозга.
Эндокринная регуляция. Гипофиз – гипофизэктомия приводит к микроцитарной анемии, ретикулоцитопении, уменьшению клеточности костного мозга. Клетки эритроидного ряда слабо реагируют на гипоксию.
Передняя доля гипофиза. АКТГ − увеличивает в крови количество эритроцитов и гемоглобина. Гормон снижает клеточность костного мозга, но увеличивает процент эритроидных клеток в миелограмме, главным образом за счет зрелых форм, то есть уменьшает плацдарм эритропоэза с одновременной активацией эритропоэза, ускорением дифференцировки клеток и незначительным эффектом на их пролиферацию. АКТГ оказывает угнетающее действие на лимфоидную ткань,и гранулоцитопоэзстимулирующий эффект в костном мозге. В сочетании с ионами кальция активирует физиологическую регенерацию нейтрофилов. Однако основной эффект АКТГ обусловлен его стимулирующим эффектом на выработку глюкокортикоидов корковым слоем надпочечников.
СТГ – стимулирует пролиферацию без существенного влияния на процессы дифференциации, что обусловлено анаболическим эффектом гормона, который активирует синтез белка в клетке, влияя тем самым на ее митотическую активность.
Задняя доля гипофиза не играет существенной роли в регуляции кроветворения.
Надпочечники. Корковый слой – глюкортикоиды (кортизон и кортикостерон) изменяют внутриклеточные обменные процессы, повышая дифференцировку клеток (так как они влияют на ДНК клеток), приводят к эритроцитозу, нейтрофильному лейкоцитозу (миелотропное действие проявляется в ускорении вызревания и выхода в кровь зрелых гранулоцитов), лимфопении (за счет цитостатического действия на лимфобластные элементы), эозинопении перераспределительного характера.
Мозговой слой – непосредственно но эритропоэз и гранулоцитопоэз не влияет, но эффект катехоламинов обуславливает перераспределительные реакции клеток крови.
Щитовидная железа. Гиперфункция ее сопровождается активацией эритропоэза, лейкопенией, нейтрофилопенией и лифоцитозом, а гипофункция анемией.
Половые железы. Андрогены (мужские половые гормоны) − стимулируют эритропоэз и гранулоцитопоэз, а эстрогены (женские половые гормоны), наоборот, приводят к панцитопении в результате угнетения как эритропоэза, так и гранулоцитопоза (первоначально развивающийся нейтрофильный лейкоцитоз в конечном счете сменяется лейкопенией.
Иммуннологическая регуляция. Основная функция иммунной системы – цензорная, то есть удаление из организма всего чужеродного. Однако она принимает участия и в регуляции гемопоэза, участвуя в разрушении клеток крови как с помощью гуморальных аутоантител, так и при помощи Т-лимфоцитов. При стресс-реакции лимфоциты мигрируют в костный мозг и активируют гранулоцитопоэз. В то же время в условиях гипоксии они стимулируют эритропоэз.
Метаболическая регуляция. В процессе жизнедеятельности клеток выделяется достаточно большое количество физиологически активных метаболитов, способных влиять на гемопоэз. В частности гемопоэзстимулирующим эффектом обладают цАМФ, сукцинат натрия, b-оксибутират натрия, инозин и др. К индукции пролиферативных процессов гемопоэтических клеток приводит активация перекисного окисления липидов.
