
Струков,Серов_Патологическая_анатомия_2015
.pdf210 |
Общая патологическая анатомия |
за опосредуется эндокринной системой и регуляторными Т-лимфоцитами: Т-эффекторами, Т-хелперами, Т-супрессорами.
В течение жизни вилочковая железа претерпевает возрастную инволюцию — постепенное замещение ее ткани жировой клетчаткой. Однако в любом возрасте в жировой клетчатке переднего средостения находят островки паренхимы вилочковой железы, которые частично сохраняют секрецию тимических гормонов и продукцию Т-лимфоцитов. Возрастная инволюция вилочковой железы — одна из причин снижения активности клеточного иммунитета, учащения инфекционных, аутоиммунных и онкологических заболеваний у людей пожилого возраста.
Патология вилочковой железы
Анатомия вилочковой железы: аплазия, гипо- и дисплазия, акцидентальная инволюция, атрофия, тимомегалия и гиперплазия с лимфоидными фолликулами. С патологией вилочковой железы связывают ряд иммунодефицитных синдромов, аутоиммунных заболеваний и некоторых эндокринных нарушений.
Аплазия, гипо- и дисплазия вилочковой железы — врожденные аномалии развития вилочковой железы, которые сопровождаются дефицитом клеточного звена иммунитета или комбинированным иммунным дефицитом. Тимические гормоны не вырабатываются или их продукция минимальна. При аплазии (агенезии) вилочковая железа отсутствует полностью, при гипо- и дисплазиях (дисгенезии) она уменьшена, деление на кору и мозговое вещество нарушено, количество лимфоцитов резко снижено.
Акцидентальная инволюция вилочковой железы — быстрое уменьшение ее массы и объема под влиянием прежде всего глюкокортикоидов в различных стрессовых ситуациях, в том числе при инфекционных заболеваниях, интоксикациях, травмах. При этом прогрессивно снижается продукция тимических гормонов, усиливается эмиграция Т-лимфоцитов из вилочковой железы, хотя основная масса их подвержена на месте апоптозу. Функциональное значение акцидентальной инволюции вилочковой железы неясно, однако ее задержка (неподвижный тимус) сопровождается снижением активности клеточного и гуморального звеньев иммунитета. Акцидентальная инволюция вилочковой железы обратима, но в случае неблагоприятного исхода приводит к атрофии вилочковой железы.
Атрофия вилочковой железы — неблагоприятный исход акцидентальной инволюции вилочковой железы и причина приобретенных иммунодефицитных синдромов при хронических инфекционных заболеваниях, иммунодепрессивной терапии. Вследствие убыли лимфоцитов и коллапса сети эпителиальных клеток паренхимы вилочковой железы уменьшены, тимические тельца обызвествлены, в периваскулярных пространствах определяют разрастание соединительной и жировой тканей. Продукция тимических гормонов значительно снижена.
Тимомегалия — увеличение массы и объема паренхимы вилочковой железы выше возрастной нормы при сохранении ее нормального строения. Она может быть врожденной или приобретенной. Врожденную тимомегалию
Глава 6. Иммунопатологические процессы |
211 |
выявляют чаще у детей, реже — у взрослых. Нередко она сочетается с пороками развития нервной, сердечно-сосудистой систем, врожденной дисфункцией эндокринной системы, хронической недостаточностью надпочечников и половых желез. Врожденная тимомегалия, особенно часто при инфекционных заболеваниях, сопровождается генерализованной гиперплазией лимфоидной ткани. Продукция тимических гормонов при этом снижена, нарушено преимущественно клеточное звено иммунитета, близкое врожденному иммунодефицитному синдрому. Приобретенная тимомегалия встречается у людей в молодом возрасте при хронической недостаточности надпочечников, она сопровождается иммунными нарушениями, подобными врожденной тимомегалии.
Причины смерти больных тимомегалией — инфекционные и инфекционноаллергические заболевания. В связи с эндокринными нарушениями под влиянием стрессовых факторов (врачебных манипуляций, хирургических вмешательств) может наступить внезапная смерть.
Ранее случаи тимомегалии объединяли понятием «тимико-лимфати- ческое состояние», основой которого считали врожденную гиперфункцию вилочковой железы. Такое толкование по существу неверно, поэтому понятие «тимико-лимфатическое состояние» из медицинского обихода было изъято. В настоящее время оно приобрело иной смысл, отражая иммуноэндокринную дисфункцию различной природы.
Гиперплазия вилочковой железы с лимфоидными фолликулами характерна для аутоиммунных заболеваний. В резко расширенных внутридольковых периваскулярных пространствах паренхимы вилочковой железы накапливаются В-лимфоциты, плазматические клетки, появляются лимфоидные фолликулы, которые в норме там не встречаются. Продукция тимических гормонов может быть повышена или понижена. Роль гиперплазии вилочковой железы с лимфоидными фолликулами в патогенезе аутоиммунных заболеваний неясна. Предполагают, что поражение вилочковой железы — одна из причин аутоиммунного процесса, однако возможно ее вторичное повреждение.
Изменения периферической лимфоидной ткани при нарушениях иммуногенеза
Изменения периферической лимфоидной ткани наиболее характерны при антигенной стимуляции и наследственной ее недостаточности.
При антигенной стимуляции (сенсибилизации) организма изменения периферической лимфоидной ткани выражены макрофагальной реакцией, гиперплазией лимфоцитов с последующей плазмоцитарной их трансформацией. Эти изменения дополнены повышением проницаемости микрососудов, отеком интерстиция и накоплением в нем белково-полисахарид- ных (ШИК-положительных) веществ — тканевым диспротеинозом. Степень макрофагально-плазмоцитарной трансформации лимфоидной ткани отражает напряженность иммуногенеза и прежде всего уровень выработки антител (иммуноглобулинов) клетками плазмоцитарного ряда.
212 |
Общая патологическая анатомия |
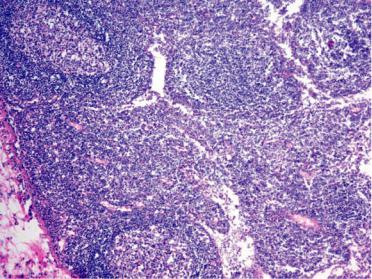
Рис. 6-1. Гиперплазия и плазмоцитарная трансформация ткани лимфатического узла при антигенной стимуляции
Особенно ярко изменяются лимфатические узлы, прежде всего в области места поступления антигена и в селезенке.
Лимфатические узлы увеличены, полнокровны и отечны. В корковом их слое, в светлых центрах фолликулов и мозговом слое определяют большое количество плазмобластов и плазматических клеток, которые вытесняют лимфоциты (рис. 6-1). Отмечают пролиферацию и десквамацию клеток синусов, образование большого количества макрофагов и белковополисахаридных веществ в строме. Селезенка увеличена, выглядит полнокровной и сочной, на ее разрезе хорошо видны большие фолликулы. Отмечают гиперплазию и плазматизацию как красной пульпы, так и особенно фолликулов селезенки, периферическая зона которых сплошь состоит из плазмобластов и плазматических клеток (рис. 6-2). В красной пульпе наряду с плазмобластами много макрофагов.
Если в ответ на антигенную стимуляцию возникают преимущественно клеточные иммунные реакции, то в лимфатических узлах и селезенке пролиферируют в основном сенсибилизированные лимфоциты, а не плазмобласты и плазматические клетки. При этом происходит расширение Т-зависимых зон.
Клеточную гиперплазию и макрофагально-плазмоцитарную трансформацию, а в ряде случаев и миелоидную метаплазию обнаруживают в костном мозге, портальных трактах и синусоидах печени, в альвеолярных перегородках, периваскулярной и перибронхиальной ткани легких, в интерстиции почек, поджелудочной железы, кишечника, в межмышечных прослойках, жировой ткани.

Глава 6. Иммунопатологические процессы |
213 |
Рис. 6-2. Гиперплазия и плазмоцитарная трансформация фолликулов селезенки при антигенной стимуляции
Наследственную недостаточность периферической лимфоидной ткани определяют в селезенке и особенно в лимфатических узлах. В селезенке размеры фолликулов значительно уменьшены, светлые центры и плазматические клетки отсутствуют. В лимфатических узлах отсутствуют фолликулы и корковый слой (В-зависимые зоны), сохранен лишь околокорковый слой (Т-зависимая зона). Эти изменения характерны для наследственных иммунодефицитных синдромов, связанных с дефектом гуморального иммунитета.
Основные типы патологических состояний иммунной системы:
–реакции гиперчувствительности — механизмы иммунологического повреждения при ряде заболеваний;
–аутоиммунные болезни — иммунные реакции против собственного организма;
–синдромы иммунного дефицита, возникающие вследствие врожденного или приобретенного дефекта нормального иммунного ответа;
–амилоидоз.
Реакции гиперчувствительности
Реакции гиперчувствительности — это местные иммунные (аллергические) реакции в сенсибилизированном организме. Одни иммунологические механизмы являются проявлением гуморального иммунитета (антитела, компоненты комплемента, циркулирующие комплексы «антиген−антитело»), другие —

214 |
Общая патологическая анатомия |
клеточного иммунитета (лимфоциты, макрофаги). Это определяет характер реакций гиперчувствительности и принципы их классификации.
Реакции, связанные с иммунопатологическими механизмами, являющимися проявлением гуморального иммунитета называют реакциями гиперчувствительности немедленного типа (ГНТ), а связанные с иммунопатологическими механизмами, служащими проявлением клеточного иммунитета, — реакциями гиперчувствительности замедленного типа (ГЗТ). К последним относятся и реакции трансплантационного иммунитета (реакции отторжения).
Механизмы развития
Выделяют 4 механизма развития реакции гиперчувствительности. Первый механизм связан с аллергическими антителами, или реагина-
ми (IgE), которые фиксированы на поверхности клеток, — лаброцитов, базофилов. Сенсибилизированные Fc-фрагментом IgE-тучные клетки
ибазофилы активируют компоненты комплемента С3а и С5а (анафилатоксины). Секрецию лаброцитов стимулируют и цитокины макрофагов (ИЛ-8), некоторые лекарственные средства (кодеин и морфин) и физические воздействия (тепло, холод, солнечный свет). Связывание молекул IgE инициирует дегрануляцию тучных клеток с выбросом медиаторов, что при соединении антител с клеткой (антигеном) ведет к острому воспалению — анафилактической реакции немедленного типа. Местные реакции при этом зависят от места проникновения антигена: отек кожи (кожная аллергия, крапивница), выделения из носа и конъюнктив (аллергический ринит
иконъюнктивит), сенная лихорадка, бронхиальная астма или аллергический гастроэнтерит (пищевая аллергия)1.
Второй механизм — цитотоксическое и цитолитическое действие на соответствующие клетки циркулирующих антител и (или) комплемента — цитотоксические реакции. Цитолиз обусловлен либо комплементом (цитотоксичность, опосредованная комплементом), который активируется при соединении антител (IgM или IgG) с антигеном, либо антителами (цитотоксичность, опосредованная антителами), которые могут быть связаны с нейтрофилами, эозинофилами и NK-клетками (рис. 6-3).
Близки к цитотоксическим реакциям реакции инактивации и нейтрализации, в основе которых лежит действие антител на биологически активные молекулы ферментов, гормонов, факторов свертывания и на рецепторы клеток, что ведет к их инактивации без повреждения клеток и тканей. Заболевания, при которых рецепторы становятся мишенью для антител (аутоантител), выделены в особую группу «антительные болезни рецепторов»: инсулинорезистентный (I тип) сахарный диабет, миастения, тиреотоксикоз, варианты гиперпаратиреоза2.
Третий механизм связан с токсическим действием на клетки и ткани циркулирующих иммунных комплексов, что ведет к активации компонентов
1 В современной номенклатуре этот механизм называется «I тип гиперчувствительности». 2 В современной номенклатуре этот механизм называется «II тип гиперчувствительности».

Глава 6. Иммунопатологические процессы |
215 |
||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Рис. 6-3. Схема иммунологически обусловленного клеточного цитоза
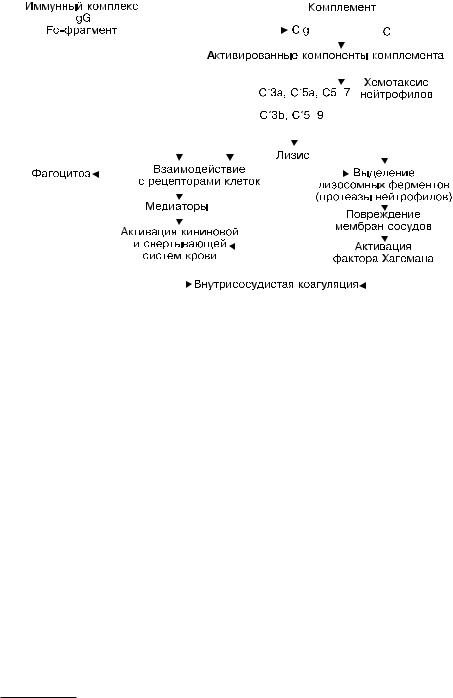
комплемента и реакции иммунных комплексов — иммунокомплексной реакции (рис. 6-4). Как только иммунные комплексы оседают в тканях, они инициируют острую воспалительную реакцию. Приблизительно через 10 сут после введения антигена появляются лихорадка, крапивница, артралгии, увеличение лимфатических узлов и протеинурия. Вслед за осаждением иммунных комплексов происходит активация системы комплемента с образованием ее биологически активных компонентов. Активация комплемента сопровождается провоспалительными эффектами: выбросом С3b-опсонина, способствующего фагоцитозу; образованием хемотаксических факторов, вызывающих миграцию лейкоцитов и моноцитов; выбросом анафилатоксинов (С3а и С5а), которые повышают проницаемость сосудов и вызывают сокращение гладких мышц. Иммунные комплексы вызывают агрегацию тромбоцитов и активацию фактора Хагемана, что приводит к усилению воспалительного процесса и образованию микротромбов. В результате развиваются васкулит, гломерулонефрит, артрит и т.п. В морфологической картине иммунокомплексного повреждения доминирует острый некротизирующий васкулит1.
Четвертый механизм обусловлен действием на ткани эффекторных клеток — сенсибилизированных Т-лимфоцитов-киллеров и макрофагов. Он состоит из классических реакций ГЗТ, вызываемых СD4+-лимфоцитами, и прямой клеточной цитотоксичности, опосредованной СD8+-лимфоцитами. Развивается цитолиз, обусловленный лимфоцитами (см. рис. 6-3; рис. 6-5), — основной тип иммунного ответа на различные внутриклеточ-
1 В современной номенклатуре этот механизм называется «III тип гиперчувствительности».
216 |
|
|
|
|
|
|
|
|
|
Общая патологическая анатомия |
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Рис. 6-4. Схема реакции токсических иммунных комплексов
ные микробиологические агенты, особенно на микобактерии туберкулеза, на многие вирусы, грибы, простейшие и паразиты1.
Этот же механизм лежит в основе реакции отторжения трансплантата, которая связана с распознаванием хозяином пересаженной ткани как чужеродной. Ответственны за это отторжение человеческие лейкоцитарные антигены (HLA). Отторжение трансплантата — сложный процесс, во время которого имеют значение как клеточный иммунитет, так и циркулирующие антитела.
Инициация реакций, опосредованных Т-лимфоцитами, происходит при контакте лимфоцитов реципиента с HLA донора. Наиболее важный иммуноген — дендритические клетки донорских органов. Т-клетки хозяина встречаются с дендритическими клетками в пересаженном органе, а затем мигрируют в регионарные лимфатические узлы. Предшественники CD8+-цитолитических Т-лимфоцитов, обладающих рецепторами к классу I HLA, дифференцируются в зрелые цитолитические Т-лимфоциты, которые лизируют пересаженную ткань. Кроме специфических цитолитических Т-лимфоцитов, образуются СD4+-лимфоциты, которые играют важную роль в отторжении трансплантата. Как и при ГЗТ, активированные СD4+-лимфоциты выделяют цитокины, вызывающие повышение сосудистой проницаемости и местное скопление лимфоцитов и макрофагов. ГЗТ,
1 В современной номенклатуре этот механизм называется «IV тип гиперчувствительности».
Кнему относится и гранулематоз.
Глава 6. Иммунопатологические процессы |
217 |
проявляющаяся повреждением микрососудов, ишемией и деструкцией тканей, — наиболее важный механизм отторжения трансплантата.
Реакции, обусловленные антителами, протекают в двух вариантах. Сверхострое отторжение развивается, если в крови реципиента существуют антитела против донора. Такие антитела встречаются, например, у реципиентов, у которых уже произошло отторже-
ние почечного трансплантата. Рис. 6-5. Цитопатическое действие Т-лимфоци-
В таких случаях отторжение развивается немедленно после трансплантации, так как циркулирующие антите-
ла образуют иммунные комплексы, оседающие в эндотелии сосудов пересаженного органа. Затем происходит фиксация комплемента и развивается реакция Артюса.
У реципиентов, которые не сенсибилизированы антигенами трансплантата, экспозиция донорских HLA вызывает образование антител. Образованные реципиентами антитела вызывают повреждение ткани посредством нескольких механизмов: комплементзависимой цитотоксичности, антителозависимого, обусловленного клетками цитолиза и отложения комплексов «антиген−антитело». Изначальная мишень для этих антител — сосуды трансплантата. Феномен антителозависимого отторжения, например в почке, гистологически представлен васкулитом.
Примером той же реакции ГЗТ является ответ организма на внутрикожно введенный туберкулин — компонент из стенок микобактерии туберкулеза. У сенсибилизированного пациента через 8–12 ч возникают покраснение и уплотнение в месте введения, а пик реакции наступает через 24–72 ч. У значительно сенсибилизированных больных в зоне инъекции развивается некроз. ГЗТ характеризуется накоплением мононуклеарных клеток в подкожной ткани и дерме, преимущественно вокруг мелких вен и венул с образованием характерных периваскулярных манжеток. Выход белков плазмы за пределы сосудистого русла увеличивает отек дермы и сопровождается оседанием фибрина в интерстиции. При персистенции антигена макрофаги трансформируются в эпителиоидные клетки, окруженные валом из лимфоцитов, — формируется гранулема.
Морфологическая характеристика
Реакция гиперчувствительности немедленного типа имеет морфологию острого иммунного воспаления, для которого характерны быстрота раз-
218 |
Общая патологическая анатомия |
а |
|
б |
|
|
|
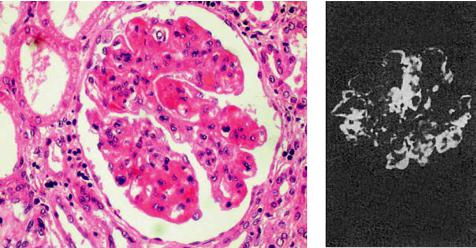
Рис. 6-6 Реакция гиперчувствительности немедленного типа: а – острое иммунное воспаление: участки фибриноидного набухания и фибриноидного некроза капилляров почечного клубочка при волчаночном гломерулонефрите; б — в участках фибриноида фиксация IgG (иммунолюминесцентное исследование)
вития, преобладание альтеративных и сосудисто-экссудативных изменений, медленное течение репаративных процессов. Альтеративные изменения: плазматическое пропитывание, мукоидное и фибриноидное набухание, фибриноидный некроз — касаются преимущественно стенок сосудов, основного вещества и волокнистых структур соединительной ткани (рис. 6-6). С ярко выраженными плазморрагическими и сосудисто-экссу- дативными реакциями связано появление в очаге иммунного воспаления грубодисперсных белков, в том числе фибрина, нейтрофилов, «переваривающих» иммунные комплексы, и эритроцитов. В связи с этим наиболее характерен для ГНТ фибринозный или фибринозно-геморрагический экссудат. Пролиферативно-репаративные реакции при ГНТ развиваются позже и выражены слабее. Они проявляются пролиферацией клеток эндотелия и перителия (адвентиции) сосудов и во времени совпадают с появлением мононуклеарно-гистиоцитарных элементов, что отражает элиминацию иммунных комплексов и начало репаративных процессов. Оценка морфологических изменений при ГНТ, их принадлежность к иммунной реакции требуют доказательств иммуногистохимическим методом.
Наиболее типична динамика морфологических изменений при феномене Артюса, который возникает у сенсибилизированных животных после введения местно-разрешающей дозы антигена. В патологии человека ГНТ — сущность многих бактериальных инфекций, аллергических заболеваний и процессов. Проявления ГНТ с преобладанием альтерации постоянны
Глава 6. Иммунопатологические процессы |
219 |
при туберкулезе, сифилисе; они лежат в основе сосудистых изменений при ревматизме, системной красной волчанке, гломерулонефрите, узелковом периартериите. Сосудисто-экссудативные проявления реакции ГНТ ярко выражены при крупозной пневмонии.
К реакциям ГНТ относят и реагиновые реакции, в которых участвуют аллергические антитела, или реагины (IgE), фиксированные на клетках. Они отличаются поверхностной альтерацией клеток и тканей. Это обусловлено отсутствием в реакции участия комплемента и преобладанием сосудисто-экссудативных изменений, связанных с массивной дегрануляцией тканевых базофилов (лаброцитов) и выбросом гистамина. В инфильтрате преобладают эозинофилы — ингибиторы базофилов. Пример реагиновой реакции — изменения при атопической бронхиальной астме.
В реакции гиперчувствительности замедленного типа участвуют два вида клеток — сенсибилизированные лимфоциты и макрофаги. Лимфоцитарная
имакрофагальная инфильтрация в очаге иммунного конфликта — выражение хронического иммунного воспаления, лежащего в основе реакции ГЗТ.
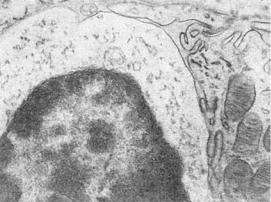
Разрушение клетки-мишени — это иммунологически обусловленный клеточный цитолиз, который обычно связан с действием белков-перфоринов Т-лимфоцитов (киллеров) (см. рис. 6-3). Макрофаги вступают в специфическую реакцию с антигеном медиаторами клеточного иммунитета
ицитофильными антителами, адсорбированными на поверхности клеток. При этом между лимфоцитами и макрофагами появляются контакты в виде цитоплазматических мостиков, которые, по-видимому, служат для обмена между клетками информацией об антигене. Иммунологически обусловленный клеточный цитолиз может быть связан и с клеточными антителами — NK- и К-клетками.
Доказательством участия цитолитических Т-лимфоцитов в ГЗТ служит передача ГЗТ сенсибилизированными Т-лимфоцитами.
Воспаление в виде лимфогистиоцитарной и макрофагальной инфильтрации ткани в сочетании с сосудисто-плазморрагическими и паренхиматознодистрофическими процессами можно считать иммунным, т.е. отражающим ГЗТ, лишь при доказательствах связи клеток инфильтрата с сенсибилизированными лимфоцитами. Эти доказательства находят при гистохимическом
иэлектронно-микроскопическом исследованиях (см. рис. 6-5).
Клинико-морфологические проявления ГЗТ: реакция туберкулинового типа на коже в ответ на введение антигена, контактный дерматит (контактная аллергия), аутоиммунные заболевания, реакции при многих вирусных и некоторых бактериальных (вирусном гепатите, туберкулезе, бруцеллезе) инфекциях. Морфологическим проявлением ГЗТ является и гранулематоз.
Для определения ГЗТ в клинике и эксперименте разработан ряд критериев и тестов. В клинике ГЗТ определяют внутрикожной пробой с антигеном путем пассивного переноса ГЗТ от одного животного другому клетками лимфоидных органов. Для определения ГЗТ in vitro используют:
–реакцию бласттрансформации лимфоцитов под действием антигена или неспецифического антигенного раздражителя:
