
- •Активный центр фермента:
- •Типы специфичности ферментов
- •Этапы ферментативного катализа.
- •Кинетика ферментативных реакций.
- •При нагревании:
- •Органические вещества, предшественниками которых, как правило, являются витамины;
- •Принимают непосредственное участие в катализе, наряду с радикалами аминокислот.
- •Восстановленная форма
- •Основные подклассы:
- •Активность фермента.
При нагревании:
рвутся слабые связи в молекуле фермента (гидрофобные, ионные и водородные) меняется конформация E нарушается структура активного центра E уменьшается активность E.
III. Зависимость скорости реакции от pH среды:

Оптимум pH – это такое значение pH, при котором E проявляет максимальную активность.
Для каждого E характерен довольно узкий интервал pH, при котором он активен:

При изменении pH среды в сторону от оптимума активность E уменьшается:
Причины:
изменяется ионизация ионогенных групп рвутся ионные и некоторые водородные связи в молекуле фермента меняется конформация E нарушается структура активного центра E уменьшается активность E.

Кофакторы ферментов и их роль в катализе.
Если фермент является сложным белком, то в его состав всегда входит небелковый компонент, который называется: Кофактор.
Белковая часть такого фермента называется: Апофермент.
А комплекс апофермента с кофактором получил название: Холофермент:
А пофермент
+ Кофактор Холофермент
пофермент
+ Кофактор Холофермент
Каталитическую активность в этом случае проявляет только Холофермент.
Кофакторы


Коферменты Ионы металлов
Роль ионов металлов в катализе:
1) участвует в присоединении субстрата (Mg2+, Mn2+, Zn2+)
2) принимают участие в катализе (Zn2+, Cu2+, Fe2+)
3) принимают участие в стабилизации третичной и четвертичной структуры фермента (K+, Ca2+, Zn2+)
4) активаторы ферментов (Ca2+)
Коферменты:
-
Органические вещества, предшественниками которых, как правило, являются витамины;
-
Принимают непосредственное участие в катализе, наряду с радикалами аминокислот.

Некоторые коферменты непрочно связаны с апоферментом (NAD+, NADP+, HS-KoA, H4-фолат).
Есть коферменты, прочно связанные с апоферментом, т.е. представляют с собой простетическую группу (гем, FAD, FMN, биотин).
Примеры коферментов
Тиаминдифосфат (ТДФ):

Биотин (витамин H):

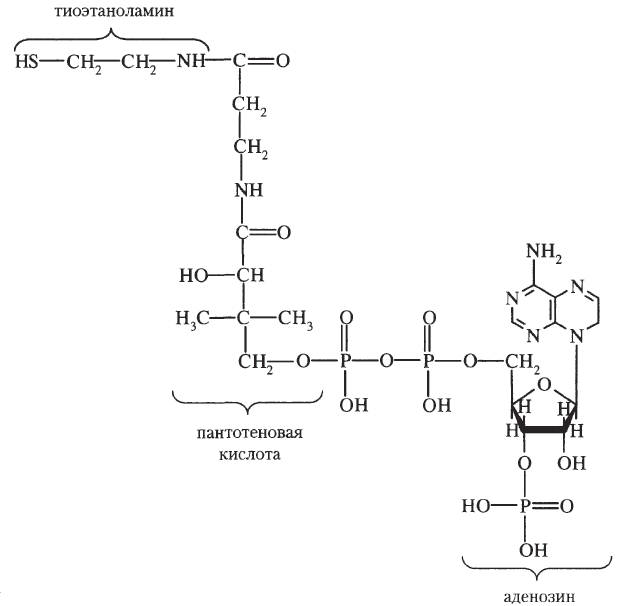
Кофермент A:
Классификация ферментов.
В основе классификации ферментов лежит тип катализируемой ими реакции.
Все ферменты делятся на 6 классов:
I. Оксидоредуктазы – катализируют окислительно-восстановительные реакции.
Основные подклассы:
1. Оксидазы
2. Гидроксилазы
3. Дегидрогеназы – катализируют реакции присоединения / отщепления атомов водорода (дегидрирования).
По типу кофермента различают:
-
NAD+ и NADP+ – зависимые дегидрогеназы (предшественник: витамин PP);
-
FAD и FMN – зависимые дегидрогеназы (предшественник: витамин B2)
Коферменты NAD+, NADP+, FAD и FMN выполняют роль акцепторов атомов водорода.
Строение коферментов NAD+ и NADP+:

+ +

Активная часть коферментов
NAD+ и NADP+:

Витамин PP:
1) Роль коферментов NAD+ и NADP+ в реакциях дегидрирования:

.
Д H2
+ NAD+
Д
+ NADH + H+
H2
+ NAD+
Д
+ NADH + H+
(или NADP+) (или NADPH + H+)
Пример реакции с участием NAD+:

Строение флавиновых коферментов (FMN и FAD):

2) Роль коферментов FAD и FMN в реакциях дегидрирования:

