
хімія екзамен
.docxБілет 1.
1. Розчини – однорідні (гомогенні) термодинамічно стійкі системи змінного складу, що скл з 2-х і більше компонентів і продуктів їх взаємодії. Складові частини розчинів: наприклад, водний розчин H2SO4 складається: -розчинник Н2О; розчинена речовина H2SO4 і продукти їх взаємодії – гідратовані іони Н+, H2SO4-, SO42-.
Способи
вираження концентрації розчинів:
1) масова частка ѡ
(р.р.) =
 ;
;
2)
Молярна концентрація См(р.р.)
=
 ;
;
3)молярна концентрація
еквівалентних мас розчиненої речовини
(нормальність): СН(р.р.)
=
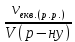 ;
;
4)
моляльна концентрація: b
(р.р.)
=
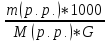 ,
G
– маса розчинника
,
G
– маса розчинника
5)
мольна частка : N(p.p.)
=
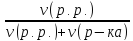 ;
;
6)коефіцієнт
розчинності : t°P
=
 ;
;
7)
титр: Т =
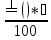 ; Т =
; Т =
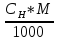 .
.
2. До ІА групи відносяться лужні метали : Li, Na, K, Rb, Cs, Fr. З верху до низу радіус атома та іона збільшується, енергія іонізації та енергія спорідненості до електрону зменшується, електронегативність зменшується, відновні (металічні) властивості зростають.
Взаємодія з киснем: 4Li + O2 = 2Li2O
Взаємодія з галогенами: 2Na + F2 = 2NaF
Взаємодія з воднем: 2Li + H2 = 2LiH
Взаємодія з водою: 2Li + 2H2O = 2LiOH + H2↑
Взаємодія з розчинами кислот: 2Na + 2HCl(розв) = 2NaCl + H2↑
Закінчити рівняння реакції : 5Na2SO3 + 2KMnO4+ 3H2SO4 = 5Na2SO4 + 2MnSO4+K2SO4+ 3H2O
Білет 2.
1, Осмос— спонтанний перехід, однобічна дифузія через напівпроникну перегородку (мембрану), яка відокремлює розчин від чистого розчинника або розчину меншої концентрації.
Осмотичний тиск — термодинамічний параметр, що характеризує прагнення розчину понизити свою концентрацію при зіткненні з чистим розчинником внаслідок зустрічної дифузії молекул розчинника та розчиненої речовини.
Росм.
=
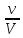 RT
= CRT
; 𝜈
– число електронів, V
– об’єм розчину, R
– газова стала = 0,082 атм/моль*К, Т –
абсолютна температура.
RT
= CRT
; 𝜈
– число електронів, V
– об’єм розчину, R
– газова стала = 0,082 атм/моль*К, Т –
абсолютна температура.
Закон Вант-Гоффа : «При підвищенні (або зниженні) температури на кожні 10 °С швидкість більшості реакцій зростає (або знижується) в 2-4 рази».
ϑкін
= ϑпоч
* ɣ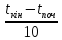 .
.
2. SO2 утворюється при спалюванні сірки у повітрі: S + O2 = SO2. SO2 – безбарвний газ, у 2,2 рази важчий за повітря з запахом палених кісток, легко скраплюється, молекула має кутові будову, sp2 – гібридизація.
Сірчиста кислота H2SO3 середньої сили. SO2 + H2O = H2SO3. 2H2SO3 + O2 = 2H2SO4
Сульфіти: SO2 + 2NaOH = Na2SO3 . 4K2SO3 = K2S + 3K2SO4.
Гідросульфіти : H2SO3 + NaOH = NaHSO3 + H2O
Їх гідроліз: NaHSO3 + H2O = NaOH +CO2 + H2O
Окисно-відновна двоїстість: SO2 + Br2 + 2H2O = H2SO4 + 2HBr (SO2 – окисник)
SO2 + H2S = 3S + 2H2O (SO2 – відновник)
Біологічна роль сірки та її сполук, використання у медицині : S входить до складу білків та амінокислот, які приймають участь у процесах тканинного дихання. В елементному стані сірка не токсична, але деякі її сполуки дуже токсичні. Вдихання сірководню може призвести до смерті. Осаджену сірку використовують для лікування захворювань шкіри (псоріаз,себорея і т.д.). Очищену сірку використовують як протиглисний засіб при пероральному прийомі та зовнішньо при деяких захв шкіри. Розчин з масовою часткою сірки 1% використовують у вигляді ін’єкцій при лікуванні шизофренії. Натрію тіосульфат використовують для внутрішньовенних ін’єкцій при тяжких алергічних захворюваннях, отруєних хлором, сполуками арсену, плюмбуму і т.д. зовнішньо натрію тіосульфат використовують для лікування корости. Селен збільшує еластичність тканин та надходження кисню до серцевого м’яза. Але надлишок селену призводить до підвищеної втоми, випадіння волосся та розхитування зубів. Цей елемент людина отримує вживаючи м’ясо, рибу, молочні продукти.
Закінчити рівняння реакції: H2SO3 + 2H2S = 3S +3H2O
Білет 3.
1. Фізична теорія розчинів(за Вант-Гоффом): «Розчинник являє собою деяке індиферентне середовище, в якому молекули розчиненої речовини рівномірно поділяють в усьому об’ємі розчину за рахунок сил дифузії».
Хімічна теорія (за Менделєєвим): «Між молекулами компонентів розчину має місце хімічна взаємодія, яка призводить до утворення суміші більш або менш стійких сполук частинок розчиненої речовини з молекулами розчинника».
Сполуки змінного складу, які утворюються внаслідок взаємодії молекул розчинника з частинками розчиненої
речовини, називають сольфатами(C2H5OH * HF). Якщо розчинник – вода, то сольфати називають гідратами(H2SO4 * H2O). Сукупність усіх процесів, які виникають внаслідок появи в розчиннику розчиненої речовини, називають сольвацією, для водних розчинів – гідратацією.
2. Сполуки з оксисеном хрому CrO, Cr2O3 та CrO3.
CrO – сильний відновник, основний оксид, пірофорний чорний порошок.
CrO + HCl = CrCl2 + H2O
Cr2O3 – амфотерний оксид, порошок темно-зеленого кольору, нерозчинний у воді, розведених розчинах і лугах.
Cr2O3 + 6HCl = 2CrCl3 + 3H2O
Cr2O3 + 2NaOH = 2NaCrO2 + H2O
CrO3 – кислотний оксид, легко розчиняється у воді, він утворюється під час приготування хромової суміші.
4CrO3 + 3S = 3SO2 + 2Cr2O3
Закінчити рівняння реакції: K2Cr2O7 + 3H2S + 4H2SO4 = K2SO4 + Cr2(SO4)3 + 3S + 7H2O
Білет 4.
1. Гіпотонічний розчин – осмотичний тиск менший плазми крові.( Гіпотонічний (0,6%) розчин використовують для приготування розчинів місцевих анестетиків (новокаїн, ксикаїн).)
Гіпертонічний розчин – осмотичний тиск більший плазми крові.( У медицині застосовуються 3—10% водяні розчини хлориду натрію, 10—40% водяні розчини глюкози й інші)
Ізотонічний розчин – осмотичний тиск = плазмі крові. (використовують 0,9 % розчин хлориду натрію, 5 % водний розчин глюкози в терапії різних захворювань з метою зняти інтоксикацію або інші прояви хвороби).
Осмос відіграє важливу роль у багатьох біологічних процесах. Осмос бере участь в переносі поживних речовин у стовбурах високих дерев. Осмос широко використовують в лабораторній техніці: при визначенні молярних характеристик полімерів, концентрування розчинів, дослідженні різноманітних біологічних структур. Клітини рослин використовують осмос також для збільшення обсягу вакуолі. Осмос також відіграє велику роль в екології водойм. Якщо концентрація солі та інших речовин у воді підніметься чи впаде, то мешканці цих вод загинуть через згубного впливу осмосу.
2. Водень – безбарвний газ, без смаку та запаху. Найлегший газ, у 14,32 рази легший за повітря. Водень складається із 2-х атомів гідрогену, які зв’язані між собою ковалентним неполярним зв’язком. В атмосфері вміст атома гідрогену складає 75-85%. Водень – газ, який важко скраплюється. Гідроген - хімічний елемент Ігрупи, 1 малого періоду, головної підгрупи. S-елемент, конфігурація атома 1s1. У твердому стані проводить електричний струм.
Реакція водню з киснем: 2Н2 + О2 = 2Н2О
Реакція з галогенами: H2 + Cl2 = 2HCl
Реакція з активними металами: Н2 + 2Na = 2NaH
Реакція з оксидами: Н2 + PbO = Pb + H2O
Закінчити рівняння реакції: 2Al + 2NaOH + 2H2O = 2NaAlO2 +3H2
Білет 5.
1.
Перший закон Рауля(1887): «Відносне
зниження тиску насиченої пари розчинника
над розчином пропорційне мольній частці
розчиненої речовини.». На основі закону
Рауля можна визначати молекулярну масу
речовин (неелектролітів). Математичним
виразом закону є рівняння: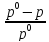 = NБ
. Ц е рівняння
виконується лише для дуже розведених
розчинів, коли мольна частка являє собою
малу величину (NБ
= 0,01).
= NБ
. Ц е рівняння
виконується лише для дуже розведених
розчинів, коли мольна частка являє собою
малу величину (NБ
= 0,01).
2. Магній – сріблясто-білий метал, відносно стійкий у сухому повітрі внаслідок утворення на його поверхні захисної плівки MgO. Магній хімічно-активний, легко розчиняється у кислотах не окисниках (крім HF, H3PO4). Магній знаходиться у ІІ А групі, проявляє ступінь окиснення +2. Оксид магнію MgO (палена магнезія) – білий тугоплавкий порошок, не розчиняється в лугах, що підтверджує його основні властивості.
2Mg + O2 = 2MgO
MgCO3 = MgO + CO2↑
Гідроксид магнію Mg(OH)2 погано розчиняється у воді, не розчиняється в лугах. Одержують із розчинних солей магнію дією розчинів лугів:
MgSO4 + 2KOH = Mg(OH)2↓ + K2SO4
Солі магнію добре розчинні у воді: MgCl2 + H2O = Mg(OH)Cl + HCl
Магній як комплексоутворювач: кислотами утворює солі, катіонами яких є [Mg(OH2)6]2+
[Mg(H2O)4] Cl2 + H2O = [Mg(OH)(H2O)3]Cl +HCl
Хлорофіл - зелений пігмент, присутній в клітинах рослин, деяких водоростей і ціанобактерій, що надає їм відповідного кольору. C55H72O5N4Mg
Здійснити перетворення:
1) 2Mg + O2 = 2MgO
2) MgO + CO2 + H2 = Mg(HCO3)2
3) Mg(HCO3)2 + Mg(OH)2 = MgCO3 + H2O
4) MgCO3 = MgO + CO2
5) MgO + 2HNO3 = Mg(NO3)2 + H2O
6) 2Mg(NO3)2 + 2Na2CO3 + H2O = [Mg(OH)]2CO3 + CO2 + 4NaNO3
7) [Mg(OH)]2CO3 + 2Na2SO4 + CO2 = 2MgSO4 + 2Na2CO3 + H2O
Білет 6.
1. Ковалентний зв’язок – хімічний зв’язок між неметалами. Розрізняють 2 види ковалентного зв’язку: полярний та неполярний. У разі неполярного ковалентного(сигма-зв’язок) зв’язку спільна електронна пара розподіляється в просторі симетрично відносно ядер обох атомів (Н2, О2). У разі полярного ковалентного (п-зв’язок) зв’язку електронна хмара зв’язку зміщена в бік атома з більшою відносною електронегативністю. (HCl, NH3, H2O).
Механізм утворення ковалентного зв’язку за рахунок перекривання одно електронних хмар кожного атома, які зв’язуються, називають обмінним.
Механізм утворення ковалентного зв’язку за рахунок двоелектронної хмари одного атома і вільної орбіта лі іншого атома називається донорно-акцепторний.
2. При високих температурах і у присутності каталізаторів азот взаємодіє з неметалами: киснем, воднем, галогенами та ін.. Використовують азот головним чином для промислового одержання аміаку, нітратної кислоти, а також як хімічно інертний газ для заповнення балонів електроламп, як середовище для перекачки нафтопродуктів та проведення хімічних синтезів, які потребують особливих умов.
Азот взаємодіє з воднем і утворює аміак: N2 + 3H2 = 2NH3
Взаємодія з лужними металами: 6Li + N2 = 2Li3N
Взаємодія з киснем: N2 + 3O2 = 2NO
Взаємодія з металами: N2 + 3Ca = Ca3N2
Оксиди нітрогену:нітроген утворює ряд оксидів: N2O, NO, N2O3, NO2, N2O4, N2O5.
N2O одержують термічним розкладанням нітрату амонію; несолетворний оксид, в воді розчиняється мало і не взаємодіє з нею. При кімнатній температурі відносно інертний і не реагує з галогенами, лужними металами, кислотами і лугами. При нагріванні розкладається на азот і кисень. NH4NO3=N2O+2H2O ; 2N2O=2N2+O2
NO одержують окисненням аміаку в присутності каталізаторів; в лабораторії оксид одержують дією розведеної нітратної кислоти на мідні ошурки. Малорозчинний у воді газ. Несолетворний оксид, не реагує з водою. 4NH3+5O2=(Pt,t)>4NO+6H2O ; 3Cu+8HNO3(розв)=3Cu(NO3)2+2NO↑+4H2O
N2O3 одержують охолодженням суміші NO2 і NO. Це кислотний оксид, легко поглинається лугами, утворюючи нітрити. NO+NO2↔N2O3 ; N2O3+2NaOH=2NaNO2+H2O
NO2 має окисно-відновну двоїстість, бурий газ. При розчиненні у воді утв 2 кислоти – нітратна і нітритна. При розчиненні в лугах утв суміш нітрату і нітриту. NO2+SO2=NO+SO3; 4NO2+O2+2H2O=4HNO3;
NO2+H2O=HNO2+HNO3 ; NO2+2NaOH=NaNO2+NaNO3+H2O
N2O5 – біла кристалічна речовина, сильний окисник, легко розкладається на оксид нітрогену(4) і кисень. Одержують дегідратацією нітратної кислоти за допомогою P2O5 або окисненням NO2 озоном це найсильніший окисник серед оксидів Нітрогену. При розчиненні у воді утворює нітратну кислоту. 2N2O5=4NO2↑+O2↑ ; 2HNO3+P2O5 = N2O5+2HPO3 або 2NO2+O3=N2O5+O2 ; N2O5+H2O=2HNO3
Здійснити перетворення: 1) N2 + 3H2 = 2NH3
2) 4NH3 + 5О2 = 4NO + 6H2O
3) 2NO + O2 = 2NO2
4) 2NO2 + H2O = HNO3 + HNO2
5) 4HNO3(к) + Cu = Cu(NO3)2 + 2NO2 + 2H2O
6) 2Cu(NO3)2 = 2CuO + 4NO2 + O2
Білет 7.
1.
Другий закон Рауля : «Підвищення
температури кипіння або зниження
температури замерзання розчину прямо
порційне моляльній концентрації
розчиненої речовини».
 tкип
= Eb;
tкип
= Eb;
 tзамерз
= Kb.
Е та К – ебуліоскопічна та кріоскопічна
константа розчинника. Ебуліоскопічна
та кріоскопічна сталі показують
підвищення температури кипіння, або
зниження температури замерзання
одномоляльного розчину порівняно з
температурами кипіння та замерзання
чистого розчинника. Ебуліоскопічна та
кріоскопічна сталі залежать від природи
розчинника та не залежать від природи
розчиненої речовини. На вимірюванні
температур кипіння та замерзання
розчинів засновані ебуліоскопічний та
кріоскопічний методи визначення
молекулярних мас нелетких речовин.
Обидва методи широко застосовують в
хімії, оскільки, використовуючи різні
розчинники, визначають молекулярні
маси різних речовин.
tзамерз
= Kb.
Е та К – ебуліоскопічна та кріоскопічна
константа розчинника. Ебуліоскопічна
та кріоскопічна сталі показують
підвищення температури кипіння, або
зниження температури замерзання
одномоляльного розчину порівняно з
температурами кипіння та замерзання
чистого розчинника. Ебуліоскопічна та
кріоскопічна сталі залежать від природи
розчинника та не залежать від природи
розчиненої речовини. На вимірюванні
температур кипіння та замерзання
розчинів засновані ебуліоскопічний та
кріоскопічний методи визначення
молекулярних мас нелетких речовин.
Обидва методи широко застосовують в
хімії, оскільки, використовуючи різні
розчинники, визначають молекулярні
маси різних речовин.
2. У VIII B групі знаходиться 9 d-елементів, які утворюють родину заліза та платинових металів. Ця група містить по 3 елементи у кожному періоді. Проявляють ступінь окиснення 0; +2; +3; +6(у Fe). Радіус атомів та іонів збільшується, енергія іонізації та енергія спорідненості до електрону зменшується, електронегативність зменшується, відновні властивості зростають.
Карбоніл заліза – Fe(CO)5 – пенкарбоніл заліза, жовта рідина, tкип = 1030С
карбоніл нікелю - Ni(CO)4 – тетракарбоніл нікелю, безбарвна рідина, tкип = 430С
карбоніл кобальту [Со(СО4)2] – бістетракарбоніл кобальту, оранжеві кристали, tкип = 600С
Загальний спосіб отримання Карбоніли металів полягає у взаємодії окису вуглецю з металами або їх солями при підвищених температурах і тиску. Карбоніли – леткі рідини або тверді речовини, хімічно стійкі. При нагріванні вище певної температури карбоніли розкладаються з утворенням дрібнодисперсного металу та оксид карбону (ІІ). Їх використовують для одержання високочистих металів.
Fe(CO)5 = Fe + 5CO
Здійснити перетворення:
1) 2Fe+6H2SO4(конц.) = Fe2(SO4)3+3SO2+6H2O
2)Fe2(SO4)3 +2H2O = 2Fe(OH)SO4 + H2SO4
3) 3Fe(OH)SO4 = Fe2(SO4)3 + Fe(OH)3
4) Fe2(SO4)3 + 12KCN = 2K3[Fe(CN)6] + 3K2SO4
Білет 8.
1. Розчинність газів майже завжди супроводжується виділенням теплоти (сольватації їх молекул). Тому, згідно з принципом Ле Шательє, збільшення температури знижує розчинність газів. Але відомі випадки, коли нагрівання викликає збільшення розчинності газів (наприклад, при розчиненні благородних газів у деяких органічних розчинниках).
Коефіцієнт
розчинності: t°P(x)
=

Закон Генрі-Дальтона: «Розчинність газу при сталій температурі в рідині прямо пропорційна його парціальному тиску». m = kp
m – маса газу,що розч. в 1л роз-ка
k – коефіцієнт,що характ-є природу компонентів розчину(константа Генрі)
p – тиск газу.
Розчинність газів при сталому тиску зменшується з підвищенням температури і описується рівнянням ізобари розчинності: lg m = a – b/T.
Т – абсолютна температура.
a,b – сталі величини.
Закон Сеченова: розчинність газу в рідинах у присутності електролітів знижується.
p = p0l-kc ,
р – розчинність газа в розчині електроліта
р0 – розчинність газа в чистому розчиннику
k – константа, що залежить від температури і природи компонентів розчину
c – концентрація електроліта
l – основа натурального логарифму.
2. Золото – жовтий м’який блискучий метал, дуже пластичний, не окислюється киснем. Не розчиняється в азотній к-ті, але взаємодіє з «царською водкою»: Au + HNO3 + 4HCl = H[AuCl4] + NO + 2H2O
Добування: 2Au2O3 = 4Au0+3O2
Сполуки Ауруму(І) – нестійкі
ціанідні комплекси - AuCl + KCN = K[Au(CN)2] + KCl
окислення: 2Au+1Cl + O2+4HCl = 2AuCl3+2H2O
диспропорціювання: 3AuCl = 2Au+AuCl3
Сполуки ауруму(ІІІ) – окисники.
AuCl3 + 3KI = AuI + I2 + 3KCl
комплексоутв.: AuCl3 + H2O = H[Au(OH)Cl3]
Використання золота в мед практиці: лікує проказу, зменшує ріст туберкульозних паличок, застосовують проти кісткового туберкульозу, від вовчанки.
Закінчити рівняння реакції: Au+HNO3+HF= H[AuF4]+NO+H2O
Білет 9
1. Еквівалент простої речовини – така масова його кількість, яка сполучається з 1 моль атомів Гідрогену або заміщує ту саму кількість атомів Гідрогену в хімічних реакціях.
Еквівалент складної речовини – така його кількість, яка взаємодіє без залишку з одним еквівалентом Гідрогену або взагалі з одним еквівалентом любої іншої речовини.
Еквівалентна
маса – маса одного еквівалента елемента
або речовини. Еm
=
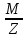 ; М – молекулярна маса, В – валентність
елемента за Гідрогеном.
; М – молекулярна маса, В – валентність
елемента за Гідрогеном.
Еквівалентний об’єм – об’єм, який займає 1 евквівалент газоподібної речовини за норм.умов.
Vекв.(Н2)=11,2; Vекв.(О2)=5,6 л/моль
Закон еквівалентів: «Хімічні елементи і речовини реагують між собою у масових кількостях, пропорційних їхнім еквівалентам»
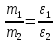
Еквівалент окисника (відновника) – така його к-сть, яка приєднує (віддає) 1 моль електронів.
Е(окисника)=
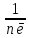 ; Е(відновника)=
; Е(відновника)=
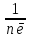
Еквівалентна маса окисника (відновника) – маса 1 еквівалента окисника (відновника):
𝜀(окисника)=
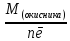 ; 𝜀(відновника)=
; 𝜀(відновника)=
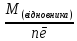
2. Бор – неметал, р-родина, ступ. ок. +1, +3, ІІІ А група, sp2-гібридизація. У вільному стані не зустрічається. Бор є амфотерний і кристалічний. Амфотерний бор – коричневий порошок, кристалічий – мірувато-чорний, тугоплавкий, за твердістю поступається тільки алмазу і нітриту бору, дуже інертний і реагує тільки з концентрованими окиснюючими агентами.
B2O3 - оксид бору. 2B2O3+7C=B4C+6CO ; B2O3+3Mg=2B+3MgO ; 4B+3O2=2B2O3 ; 2B+3H2O=B2O3+3H2↑
Кисневі сполуки бору - B2O3, H2B4O7, HBO2, H3BO3: 2B+3H2SO4(K)=2H3BO3+3SO2↑
Солі борних кислот: 2B+2NaOH+2H2O=2NaBO2+3H2
Тетраборат натрію: Na2B4O7*10H2O
4H3BO3+2NaOH+3H2O=Na2B4O7*10H2O
Тетраборати лужних металів розчинні у воді. Утворюють сильне лужне середовище.
Na2B4O7+7H2O=4H3BO3+2NaOH
Білет 10.
1. Основні положення теорії сильних електролітів:
1)«Сильні електроліти при розчиненні у воді повністю дисоціюють на іони»(Дебай, Хюккель, 1923р.)
2)Процес дисоціації сильних електролітів є необоротнім.
Активність – ефективна, умовна концентрація, згідно з якою іони діють у хімічних реакціях
Активність(а): а=ƒ*с ; ƒ-коефіцієнт активності
Коефіцієнт активності – відношення активності іонів до концентрації розчинів.
ƒ
=
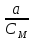
Формула
Дебея-Хюккеля: lg
ƒ = -0.5 ZK*ZA*
= -0.5 ZK*ZA*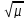 , ƒ
, ƒ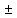 - коефіцієнт активності катіона або
аніона; ZK
і ZA
– заряди катіона і аніона.
- коефіцієнт активності катіона або
аніона; ZK
і ZA
– заряди катіона і аніона.
 – іонна сила.
– іонна сила.
Іонна сила характеризує електростатичну взаємодію іонів у розчині.

С – концентрації іонів у розчині, z – їх заряди
2. Цинк. d – родина, ІІ-В група, ступ.ок.+2, координаційні числа: 4 (sp3 - гібридизація)
Цинк – сріблясто-білий м’який метал, важкий метал, викор для виробництва екранів, призначених для рентгенівського випромінювання та телевізорів.
Взаємодія з окисниками: 4Zn+10HNO3(дуже розв.)=4Zn(NO3)2+NH4NO3+3H2O
З простими реч-нами: Zn+S=ZnS ; 2Zn+O2=2ZnO
З складними реч-нами: Zn+2HCl=ZnCl2+H2↓ ; Zn+2KOH+2H2O=K2[Zn(OH)4]+H2↑
Цинковмісні ферменти:
-оксид цинку ZnO: ZnO+2HCl=ZnCl2+H2O ; ZnO+2NaOH+H2O=Na2[Zn(OH)4]
-гідроксид цинку Zn(OH)2: Zn(OH)2+2NaOH=Na2[Zn(OH)4] – утв. гідроцинкати
Zn(OH)2+2NaOH=(сплав)>Na2ZnO2+2H2O – утв.цинкати
Zn(OH)2+6NH3=[Zn(NH3)6](OH)2
-сульфід цинку ZnS: ZnS+2HCl=ZnCl2+H2S
Здійснити перетворення:
1) 2Zn+O2=2ZnO
2) ZnO+2HCl=ZnCl2+H2O
3) ZnCl2+2KOH=Zn(OH)2+2KCl
4) Zn(OH)2+2KOH=K2[Zn(OH)4]
5) K2[Zn(OH)4]=K2ZnO2+2H2O
6) K2ZnO2+2H2SO4=K2SO4+ZnSO4+2H2O
Білет 11.
1.Дисоціація води. Константа дисоціації та іонний добуток води. Характеристика pH середовища.
H20↔ H+ + OH-
Kдис
=
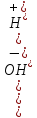 =
1,8*10-16
(при 22° с); [H2O]
=
=
1,8*10-16
(при 22° с); [H2O]
=
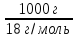 =55,56
моль/л
=55,56
моль/л
KH2O=[H+]*[OH- ]=1,8*10-16 *55,56 =10-14 (22°С)
Іонний добуток води (KH2O) - це добуток рівноважних концентрацій іоніів гідрогену і гідроксид-іонів, який для любого водного розчину дорівнює 10-14(при 22° С).
Характеристика середовища:
– нейтральне: 〖[H〗^(+])=[〖OH〗^-]= 〖10〗^(-7)моль/л
-Кисле [H+] > 10-7моль/л
-Лужне [H+]< 10-7 моль/л
2. Сірка – крихка кристалічна реч-на жовтого кольору, погано розчинна у воді, утворює модифікації:ромбічну, моноклічну, пластичну.
SO3 - сірчаний газ, ангідрид сульфатної кислоти) при кімнатній температурі — безбарвна рідина.
1) З’єднуючись із водою, утворює сульфатну кислоту: SO3+H2O=H2SO4
2) Добре розчиняється в сульфатній кислоті, утворюючи важку маслянисту рідину —олеум: SO3+H2SO4=H2S2O7 (або H2SO4*SO3)
3) У температурному інтервалі від 400 до розкладається на сульфур(IV) оксид і кисень: 2SO3=2SO2↑+O2↑
4) Як типовий кислотний оксид взаємодіє:
з оксидами, утвореними металами: CaO+SO3=CaSO4
з основами: 2NaOH+SO3=Na2SO4+H2O
Застосування сульфур(VI) оксиду. Сульфур(VI) оксид застосовується в основному у виробництві сульфатної кислоти; у лабораторії як водовід’ємний засіб.
Сірчана кислота H2SO4 - сильна двоосновна кислота, що відповідає вищій мірі окислення сірки (+6). При звичайних умовах концентрована сірчана кислота - важка масляниста рідина без кольору і запаху.
Добування SO2+NO2+H2O = H2SO4+NO
Є окисником металів:Cu+2H2SO4 = CuSO4+SO2+2H2O
Неметалів: S+2H2SO4(k)=3SO2+2H2O
Cірка як окисник реагує з: металами – Fe + S = FeS
З воднем – H2+S=H2S
ЯК ВІДНОВНИК: з фтором – S+3F2=SF6 –гексафторид
З киснем – S+O2=SO2 (в суміші)
З конц.HNO3 – S+6HNO3(k)=H2SO4+6NO2+2H2O
Сульфур входить до складу білків та амінокислот, які приймають участь в процесах тканинного дихання.Сірка осадженна у вигляді мазей використовується для лікування захворювань шкіри . сірка очищенна – як протиглисний засіб.Тіосульфат натрію використовують для лікування корости ( зовнішньо)
4Zn + 5H2SO4(конц) = 4ZnSO4 + H2S + 4H2O
Zn0 -2e- --> Zn2+ I 4 - в
S(+6) +8e- --> S-2 I 1 – о
Білет 12.
