
хімія на 15.03.2013
.pdf1
1. ОСНОВНЫЕ ПОЛОЖЕНИЯ ОРГАНИЧЕСКОЙ ХИМИИ
1.1. Предмет органической химии
Органическими называются соединения углерода с другими элементами - углеводороды и их производные. Некоторые простейшие соединения углерода - его оксиды, угольную кислоту и ее соли изучают в неорганической химии. Органические соединения кроме углерода чаще всего содержат водород, кислород, азот, значительно реже - серу, фосфор, галогены и некоторые металлы. В настоящее время число известных органических соединений превысило 4 млн.
Предметом органической химии является соединения углерода: их строение, свойства, методы получения, возможности практического использования. Органическая химия выделилась в самостоятельную науку в начале XIX в, чему способствовало открытие большого числа органических веществ, полученных из растений и животных. Сегодня главным источником пополнения органических соединений является химический синтез. Отметим важнейшие отрасли промышленности, которые производят органические вещества или перерабатывают органическое сырье: производство каучука, резины, смол, пластмасс, волокон, нефтехимическая промышленность, пищевая, фармацевтическая, лакокрасочная и др.
1.2. Особенности органических соединений
Органические вещества отличаются неорганических рядом характерных свойств.
1.Атомы углерода способны соединяться друг с другом, образуя цепи и кольца, поэтому молекулы многих органических соединений состоят из большого числа атомов, что нетипично для неорганических соединений. Это одна из причин многообразия органических соединений.
2.В органических молекулах связь атомов ковалентная (малополярная). Поэтому органические вещества обычно являются незлектролитами.
3.Если ионные (неорганические) соединения легко диссоциируют в воде на ионы
иреакции между ними протекают весьма быстро, то органические вещества, содержащие простые (одинарные) С-С и С-Н связи, взаимодействуют между собой с большим трудом или вовсе не взаимодействуют.
4.При нагревании, в пределах 400-600°С, органические соединения полностью разлагаются и обугливаются, а в присутствии кислорода сгорают. Это объясняется сравнительно небольшой прочностью связи между атомами углерода (355,6 кДж/моль). Большинство неорганических соединений плавится при более высокой температуре.
5.Для органических соединений широко распространено явление изомерии, т. е. существование веществ, имеющих одинаковый состав, но разное строение, а потому
иобладающих разными физическими и химическими свойствами.
6.Атом углерода имеет четыре валентных электрона за счет которых он образует с другими атомами, а также друг с другом общие электронные пары. При этом на внешнем уровне каждого атома углерода будет восемь электронов (октет), четыре из которых одновременно принадлежат другим атомам.
В органической химии обычно пользуются структурными формулами, поскольку атомы имеют пространственное расположение в молекуле. В структурных формулах ковалентная связь обозначается черточкой. Как и в структурных формулах неорганических веществ, каждая черточка означает общую электронную пару, связывающую атомы в молекуле. В органической химии вместо понятия степени окисления применяют понятие валентности. Валентность атома углерода в возбужденном состоянии всегда равна четырем.
2
1.3. Теория химического строения органических соединений
Научной основой органической химии является сформулированная А.М. Бутлеровым теория химического строения органических соединений. Основные положения теории строения сводятся к следующему.
1. В молекулах атомы соединены друг с другом не беспорядочно, а в определенной последовательности в соответствии с их валентностью. Порядок связи атомов в молекуле называется химическим строением.
2.Свойства вещества зависят не только от того, какие атомы и в каком количестве входят в состав его молекулы, но и от того, в каком порядке они соединены между собой, т. е. от химического строения молекулы.
3.Атомы или группы атомов, образовавшие молекулу, взаимно влияют друг на друга, непосредственно или через другие атомы.
Поясним первое положения. До А. М. Бутлерова считалось невозможным познать строение молекул, т. е. порядок химической связи между атомами. Считалось, что
состав одного и того же вещества можна выразить разными формулами. Так, химик Кекуле использовал более 10 различных формул уксусной кислоты, несколько формул бензола. Опираясь на известные в то время факты о четырехвалентности атомов углерода, их способности соединяться друг с другом с образованием как одинарных, так и двойных связей, А.М.Бутлеров сформулировал положение, что каждое органическое соединение должно иметь только одну структурную химическую формулу, отражающую его строение. Под химическим строением вещества он понимал определенный порядок соединения атомов в молекуле. Он показал, что строение молекулы можно установить опытным путем, изучая химические превращения. И наоборот, зная строение молекулы, можно вывести химические свойства соединения. Теория строения позволила сделать ряд выводов относительно свойств атома углерода в органических соединения: 1. углерод в органических соединениях всегда четырехвалентен; 2. углерод способен соединяться как с металлами, так и неметаллами; 3. все валентности углерода равнозначны.
Второе положение теории А.М.Бутлерова хорошо иллюстрируется на примере изомерии - явлении, когда вещества с одинаковым составом могут иметь разные свойства. Длительное время ученые не могли объяснить явление изомерии. А.М.Бутлеров показал, что изомеры проявляют различные свойства потому что имеют различное строение, т.е. различный порядок соединения атомов в молекуле. Так, например диметиловый ефир и этиловый спирт имеют одинаковый состав (одинаковую брутто-формулу С2Н6О), однако проявляют разные химические свойства, поскольку их химическое строение выражается разными структурными формулами СН3- СН2-ОН и СН3-О-СН3, соответственно. А.М.Бутлеров предсказал существование изомеров у бутана, один из которых (изобутан) он синтезировал. Наличие изомеров служит причиной большого разнообразия органических соединений.
Третье положение показывает, что реакционная способность соединений, определяется взаимным влиянием атомов и групп атомов в молекуле. Это касается как органических, так и неорганических соединений. Так, водород в составе хлористоводородной кислоты и метана имеет различные свойства. Из кислоты водород вытесняется почти всеми металлы, а из метана - ни одним. В кислоте водород находится под влиянием сильно електроотрицательного элемента хлора, а во втором случае - под влиянием углерода, имеющего сравнительно низкую электроотрицательность. Другой пример. Известно, что диссоциация уксусной кислоты усиливается при замене атомов водорода в радикале на более электроотрицательные атомы галогенов. Поэтому, трифторуксусная кислота является сильной кислотой, а уксусная кислота - слабой. Примером взаимного влияния атомов в молекуле является присоединение галогенводородов к несимметрическим алкенам, или ориентирующее действие заместителей в бензольном ядре и т.д.
3
1.4.Классификация органических соединений
Воснову классификации органических соединений положены два основных
принципа: строение углеродной цепи (углеродного скелета) и наличие
функциональной группы. Углеводороды признаны как родоначальные соединения, все остальные соединения рассматриваются как производные соответствующих углеводородов, полученные введением в них функциональных групп.
Для изображения органических соединений используют структурные формулы, которые отображают последовательность связей атомов в молекуле. Структурная формула может быть графической и отражать строение молекулы на плоскости без учета пространственного строения, или стереохимической, отражающей взаимное расположение атомов в молекуле.
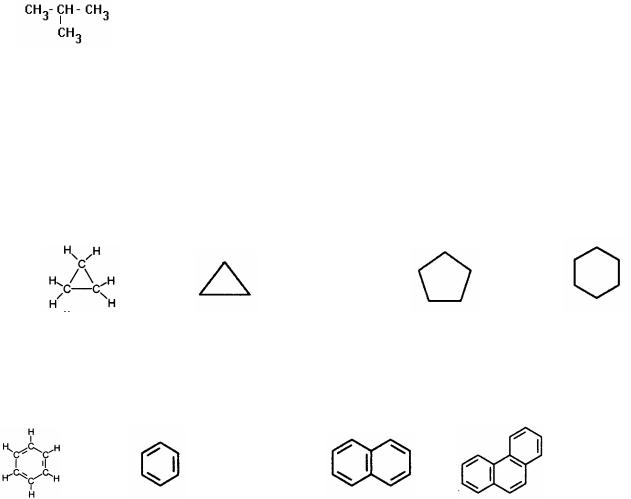
По строению углеродной цепи органические соединения делятся на два типа - ациклические и циклические.
Ациклические соединения
Ациклические соединения - это соединения с открытой (незамкнутой) углеродной
цепью. Их основу составляют алифатические углеводороды, которые |
содержат |
только атомы углерода и водорода и могут быть насыщенными |
(алканы) и |
ненасыщенными (алкены, алкадиены, алкины). Ациклические цепи бывают неразветленными и разветвленными. Так, бутан это насыщенный неразветвленный
углеводород, а бутадиен |
ненасыщенный неразветвленный углеводород. 2- |
метилпропан - насыщенный разветвленный углеводород. |
|
(изобутан); |
СН3-СН2-СН2-СН3 (бутан); CH2=CH-CH=CH2 бутадиен) |
. Циклические соединения
Циклические соединения имеют замкнутую цепь. В зависимости от природы атомов, входящих в цикл, их делят на карбоциклические и гетероциклические.
Карбоциклические соединения содержат в цикле только атомы углерода и делятся на две группы: алифатические циклические (сокращенно, алициклические) и ароматические соединения.
Простейшим представителем, насыщенных алициклических углеводородов (циклоалканов) служит циклопропан, содержащий трехчленный цикл. Число атомов углерода в циклах может быть различным. Известны макроциклы, состоящие из 30 и более атомов углерода.
|
или |
|
Циклопропан |
Циклопентан |
Циклогексан |
Ароматические углеводороды (арены) содержат бензольное кольцо. Нафталин и фенантрен относят к полициклическим аренам, так как они содержат конденсированные кольца.
|
или |
|
Бензол |
Нафталин |
Фенантрен |
4
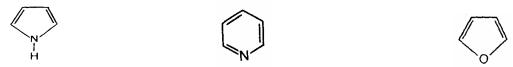
Гетероциклические соединения содержат в цикле кроме атомов углерода один или несколько атомов других элементов, гетероатомов - кислород, азот, серу.
Пиррол |
Пиридин |
Фуран |
Функциональные группы
Функциональные группы - это заместители неуглеводородного характера, определяющие его типичные химические свойства и принадлежность к определенному классу органических веществ. Соединения с одной функциональной группой называют монофункциональными, соединения с несколькими одинаковыми функциоанльными группами - полифункциональными, соединения с несколькими разными функциональными группами - гетерофункциональными.
К важнейшим функциональным группам относят галогены (-F, -Cl, Br-, I-), наличие которых позволяет причислить органическое соединение к классу галогенпроизводных. Наличие гидроксильной группы позволяет классифицировать вещество как спирт или фенол, а карбонильной группы - как альдегид или кетон. Карбоксильная группа встречается у карбоновых кислот, аминогруппа - у органических аминов, нитрогруппа - у нитропроизводных, тиольная группа (-SH) - у меркаптанов или тиолов и т.д. Примерами монофункциональных соединений является хлорэтан, этанол, уксусная кислота, полифункциональных соединений - дихлорметан, глицерин (пропантриол) и малоновая кислота, гетерофункциональных соединений - аминоэтанол, аминоуксусная кислота (глицин).
СН3-СН2Сl (хлорэтан), |
C2H5-OH (этанол), CH3-COOH (уксусная кислота) |
||
СН2Сl2 (дихлорметан) |
CH2- CH - CH2 (глицерин) |
HOOC-CH2-COOH |
|
|
OH OH OH |
(малоновая кислота) |
|
H2N-CH2-CH2-OH (аминоэтанол) |
H2N-CH2-COOH (аминоуксусная кислота) |
||
1.5. Гомологические ряды органических соединений
Среди множества органических соединений выделяются группы веществ весьма сходных по физическим и химическим свойствам и отличающимся друг от друга только
на группу СН2. Гомологи - это соединения, принадлежащие к одному классу, но
отличающиеся друг от друга на целое число групп СН2. Гомологи, расположенные в порядке возрастания их молекулярной массы, образуют гомологический ряд. Состав всех гомологов может быть выражен одной общей формулой. Например,
гомологический ряд предельных углеводородов имеет общую формулу СnH2n+2.
1.6. Изомерия органических соединений
Явление существования веществ с одинаковым составом и одинаковой молекулярной массой, но различным строением называется изомерией. Различают два типа изомерии - структурную и пространственную.
Структурная изомерия
Этот вид изомерии обусловлен различным порядком соединения атомов в молекуле, т.е. различной химической структурой соединений. Различают несколько видов структурной изомерии.

5
1. Изомерия цепи или изомерия углеродного скелета. Отражает последовательность соединения атомов в молекуле.
(изобутан) СН3-СН2-СН2-СН3 (бутан)
2. Изомерия положения функциональной группы. Отражает последовательность расположения функциональной группы в углеродной цепи.
СН3-СН2-СН2ОН (пропанол-1) |
СН3-СН-СН3 (пропанол-2) |
|
ОН |
3.Изомерия положения кратной связи. Отражает место положения кратной связи
вуглеродной цепи.
СН3-СН2-СН=СН3 (бутен-1) |
СН3-СН=СН-СН3 (бутен-2) |
4. Изомерия взаимного положения. Отражает различное положение зместителей относительно друг друга.
CH2-CH2 - CH2 (пропандиол-1,3) |
CH2- CH -CH3 (пропандиол-1,2) |
|
OH |
OH |
OH OH |
5. Изомерия типа функциональной группы (метамерия). Отражает существование соединений с различными функциональными группами. Так, этанол и диметиловый
эфир имеют общую формулу С2Н6О, а нитроэтан и аминоуксусная кислота - общую формулу С2Н5O2N, но имеют разные функциональные группы.
СН3-СН2-ОН (этанол) |
СН3-О-СН3 (диметиловый эфир) |
СН3-CH2- NO2 (нитроэтан) |
H2N-CH2-COOH (аминоуксусная кислота) |
6. Динамическая изомерия или таутомерия. Отражает существование обратимой изомеризации молекул, вследствие перемещения протона и двойной связи. Например, пировиноградная кислота сущестуют в кето-форме и енольной форме.
СН3-С-СООН |
|
СН2=С-СООН |
О (кето-форма) |
|
ОН (енольная форма) |
Пространственная изомерия
Этот тип изомерии обусловлен обусловлен различным расположением одинаковых заместителей в пространстве. Различают геометрическую, оптическую или зеркальную
иконформационную изомерию.
1.Геометрическая изомерия (цис-транс-изомерия). Отражает различное положение заместителей относительно двойной связи или цикла. Если заместители находятся по одну сторону двойной связи или цикла то это цис-изомер, а если - по разные стороны - то это транс-изомер. Изменение ориентации этих заместителей возможно только за счет разрыва одной из химических связей. Геометрические изомеры отличаются своими физическими и химическими свойствами.
цис-бутен-2 |
транс-бутен-2 |
транс-1.2-диметил- |
цис-1,2-диметил- |
|
|
циклопентан |
циклопентан |
6
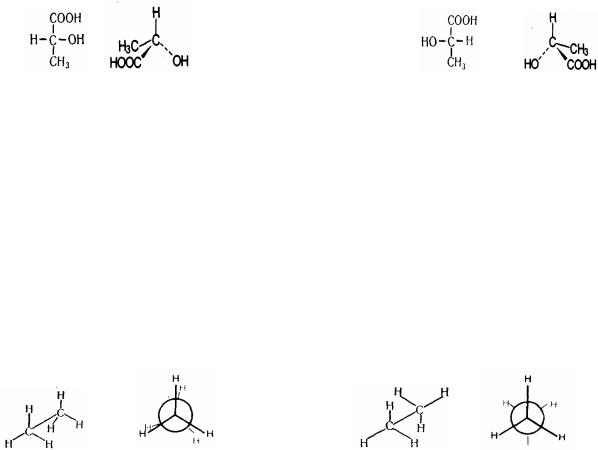
2. Оптическая, или зеркальная, изомерия возникает, когда хотя бы один атом углерода имеет четыре разных заместителя. Такой атом углерода называется асимметрическим (хиральным). При наличии такого атома молекула становится асимметричной и может существовать в виде двух изомеров, которые относятся друг к другу как симметричный предмет к своему зеркальному отражению (например, правая и левая рука). Такие изомеры называют оптическими антиподами или энантиомерами. Оптическая изомерия имеет большое значение для природных объектов (сахаров, аминокислот), так как в обмене веществ могут участвовать изомеры с определенным положением групп в пространстве.
D(+)-Молочная кислота |
L(-)-Молочная кислота |
3. Конформационная изомерия. Отражает возможность вращения вокруг одинарной связи без изменения последовательности связей. В результате вращения меняется пространственное расположение заместителей у вращающихся атомов углерода. В зависимости от угла поворота молекула может принимать различные геометрические формы - конформации. Конформации в которых заместители находятся наиболее близко друг от друга называются заслоненными (они энергетически наименее выгодны из-за отталкивания электронных оболочек, находящихся близко групп атомов). Конформации, в которых заместители наиболее удалены друг от друга называются заторможенными (они энергетически наиболее выгодны, так как отталкивание между группами минимально). Между этими двумя крайними конформациями существует множество промежуточных конформаций. Молекула совершает непрерывные переходы между различными конформациями, однако более длительное время она существует в энергетически выгодной заторможенной конформации.
заслоненная конформация |
заторможенная конформация |
1.7. Взаимное влияние атомов в молекуле
Молекула органического соединения представляет собой совокупность атомов, связанных в определенном порядке ковалентными связями. При этом связанные атомы могут различаться по величине электроотрицательности. Величины электроотрицательностей определяют такие важные характеристики связи, как полярность и прочность. В свою очередь, полярность и прочность связей определяют возможность молекулы вступать в те или иные химические реакции.
Влияние атомов передается, в основном, через систему ковалентных связей, с помощью так называемых электронных эффектов. Электронными эффектами называют смещение электронной плотности в молекуле под влиянием заместителей.
Более электроотрицательный атом, оттягивает электронную плотность σ-связи в свою сторону и приобретает частичный отрицательный заряд δ-. Его называют электроноакцептором. Его партнер по σ-связи соответственно имеет равный по величине дефицит электронной плотности, т.е. частичный положительный заряд δ+, и его называют электронодонором.

7
Индуктивный эффект. Смещение электронной плотности по цепи σ-связей называется индуктивным эффектом и обозначается I. Направление смещения электронной плотности обозначается прямыми стрелками. В зависимости от того, удаляется ли электронная плотность от рассматриваемого атома углерода или приближается к нему, индуктивный эффект может быть отрицательным (-I) или положительным (+I ). Эталоном является атом водорода, индуктивный эфект, которого принят за нуль.
Эпектроноакцепторные заместители, это атом или группа атомов, смещающие электронную плотность σ-связи от атома углерода к себе. Они проявляют отрицательный индуктивный эффект (-I-эффект) и притягивают к себе электронную пару сильнее, чем водород..
Электродонорные заместители, это атом или группа атомов, смещающие электронную плотность к атому углерода от себя. Они проявляют положительный индуктивный эффект (+I-эффект) и притягивают электронную пару к себе слабее, чем водород.
+I-эффект проявляют алифатические углеводородные радикалы, т.е. алкильные радикалы (метил, этил и т.д.). Большинство функциональных групп проявляют -I- эффект: галогены, аминогруппа, гидроксильная, карбонильная, карбоксильная группы.
Индуктивный эффект проявляется и в случае, когда связанные атомы углерода различны по состоянию гибридизации. Так, в молекуле пропена метильная группа проявляет +I-эффект, поскольку атом углерода в ней находится в sp3-гибридном состоянии, а sp2-гибридный атом (при двойной связи) выступает в роли электроноакцептора, т.к. имеет более высокую электроотрицательность:
СН3→СН=СН2 (метильная группа проявляет +I-эффект)
Мезомерный эффект. Влияние заместителя передаваемое по системе сопряженных пи-связей, называют мезомерным эффектом (М) или эффектом сопряжения. При этом сопряженный участок мог уже существовать в молекуле, а заместитель лишь включается в сопряженную систему (как например, аминогруппа в анилине) или сопряженная система образовалась с участием заместителя (например, сопряженная система акролеина). Мезомерный эффект бывает отрицательным и положительным. Его изображают изогнутой стрелкой, начинающейся у центра электронной плотности и завершающейся в том месте, куда смещается электронная плотность.
Заместители, повышающие электронную плотность в сопряженной системе, проявляют положительный мезомерный эффект (+М) и являются электронодонорами, Таким эффектом обладают 1) двойные углерод-углеродные связи 2) заместители, содержащие неподеленную электронную пару - аминогруппа, гидроксильная группа, галогены. Так, в анилине аминогруппа проявляет положительный мезомерный эффект, поскольку электронная плотность неподеленной пары атома азота смещается в сторону сопряженной системы бензольного ядра. Заместители, оттягивающие электронную плотность из сопряженной системы, проявляют отрицательный мезомерный эффект и являются электроноакцепторами. К таким заместителям относят нитрогруппу, карбоксильную группу, карбонильную
группу, сульфогруппу и др. +I-эффект
+М-эффект |
|
|
акролеин |
анилин |
- M-эффект |
8
Во многих молекулах имется комбинация индуктивных и мезомерных эффектов. Так, в молекуле метилвинилкетона электронная плотность смещена в сторону кислорода карбонильной группы (-М-эффект). Донорами электронов являются метильная (+I- эффект) и винильная (+М-эффект) группы.
1.8. Номенклатура
Номенклатура - это система правил, позволяющая дать однозначное название каждому индивидуальному соединению. Тривиальные названия исторически были первыми. Они возникали часто до того, как становилось известным строение вещества. Поэтому тривиальные названия во многом случайны и отражают а) природные источники получения веществ: б) особо заметные их свойства; в) способы получения. Живучесть тривиальных названий связана с их лаконичностью.
Систематическая заместительная номенклатура ИЮПАК.
При составлении названий органических соединений по систематической номенклатуре используют номенклатурные понятия органический радикал, родоначальная структура, характеристическая группа, заместитель.
Органический радикал - это остаток органической молекулы, из которой удалили один или несколько атомов водорода, оставив свободными соответственно одну или несколько валентностей. Термин «радикал» используемый в номеклатуре не следует путать с понятием «свободный радикал», которое характеризует атом или группу атомов с неспаренным электроном.
Из метана и этана получаются одновалентные радикалы метил СНз- и этил СНзСН2-
. Названия одновалентных радикалов обычно производят заменой окончания ан на окончание ил. Начиная с пропана для каждого последующего гомолога существует несколько радикалов, так как их атомы углерода неравноценны. Атом углерода, связанный только с одним углеродным атомом, называется первичным, с двумя -
вторичным, с тремя - третичным, с четырьмя - четвертичным. Первичные атомы углерода
↓↓
СН3 -СН2 -СН3
↑
Вторичный атом углерода
При отнятии водорода от любого из первичных атомов углерода пропана получается
радикал н-пропил (нормальный пропил) СН3-СН2-СН2- (С3Н7-), а от вторичного атома -
радикал изопропил (СН3)2-СН-. Бутан и изобутан дают по 2 радикала - н-бутил и вторичный бутил, и соответственно - первичный изобутил и третичный изобутил.
СН3-СН2-СН2-СН2- н-бутил (первичный бутил); СН3-СН-СН2-СН3 вторичный бутил
(первичный изобутил) 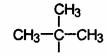 (третичный изобутил)
(третичный изобутил)
Буква н (нормальный) перед названием радикала указывает на то, что свободная валентность находится на конце неразветвленной цепи. Приставка втор (вторичный) означает, что свободная валентность находится у вторичного атома углерода, а приставка трет (третичный)- у третичного.
Известны радикалы, имеющие двойные связи: СН2=СН- (винил), СН2=СН-СН2-
(аллил), радикалы, имеющие две валентности: СН2= (метилен), СН3-СН2= (этилиден). Встречаются и циклические одновалентные углеводородные радикалы:
9
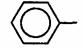 фенил
фенил 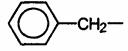 бензил
бензил
Родоначальная структура - это химическая структура, которая лежит в основе называемого соединения. Часто в качества родоначальной структуры рассматривается главная углеродная цепь в ациклических соединениях или цикл в карбоциклических и гетероциклических соединениях.
Характеристической группой называют функциональную группу, связанную с родоначальной структурой или частично входящую в ее состав.
Заместитель - это любая характеристическая (функциональная) группа или углеводородный радикал, присоединенные к родоначальной структуре.
В основе заместительной номенклатуры лежит выбор родоначальной структуры. Название строится как сложное слово, состоящее из корня (название родоначальной структуры), суффиксов, отражающих степень ненасыщенности (двойные или тройные связи), приставок и окончаний, указывающих характер, число и местонахождение заместителей. Заместители подразделяются на два типа: 1) углеводородные радикалы и неуглеводородные характеристические группы, указываемые только в приставках (такие например как галогены, нитрогруппа). 2) характеристические группы, указываемые либо в приставке, либо в окончании. Для заместителей существует порядок старшинства.
Таблица. Порядок старшинства характеристических групп.
Функциональная группа |
Префикс |
Окончание |
-СООН |
Карбокси |
-овая кислота |
-SO3H |
сульфо- |
-сульфокислота |
|
|
|
-СОН |
оксо |
-аль |
>С=О |
îêñî |
-он |
-ОН |
гидрокси- |
-ол |
-SH |
меркапто- |
-тиол |
-NH2 |
амино- |
-амин |
|
|
|
-NO2 (только в приставке) |
нитро- |
- |
|
|
|
-Cl, -Br, -I (только в приставке) |
хлор-, бром, иод |
- |
Формирование названия органического соединения по заместительной номенклатуре осуществляют в таком порядке:
1. Определяют старшую характеристическую (функциональную) группу, если она
присутствует. Старшая |
характеристическая группа отражается в названии |
окончанием. |
|
2. Определяют родоначальную структуру (главную углеродную цепь, главную циклическую структуру). Главная цепь для ациклических соединений выбирается по следующим критериям: а) максимальное число характеристических групп; б) максимальное число кратных связей; в) максимальная длина цепи; г) максимальное число углеводородных радикалов. Каждый последующий критерий используется только в том случае, если предыдущий не дает однозначного ответа.
3. Проводят нумерацию атомов родоначальной структуры так, чтобы старшая характеристическая группа получила наименьший номер, т.е с того конца к которому ближе к кратной связи или к старшей группы. Если это правило не позволяет выбрать однозначную нумерацию, то цепь (или цикл) нумеруют так, чтобы заместители получили наименьшие номера.
4. Определяют название родоначальной структуры и старшей характеристической
10
(функциональной) группы. Степень насыщенности родоначальной структуры отражают суффиксами: ан - насыщенный углеродный скелет, ен - наличие двойной и ин - тройной связи.
5. Определяют название заместителей (младшие характеристические группы, неуглеродные характеристические группы, углеводородные радикалы, обозначаемых приставками в едином алфавитном порядке. Наличие нескольких одинаковых радикалов обозначают соответствующей приставкой - ди-, три-, тетра-.
Практические примеры составления названий органических соединений. Основу названия соединения составляет корень слова, обозначающий предельный углеводород с тем же числом атомов, что и главная цепь (например, мет-, эт-, проп-, бут-, пент-, гекс- и т.д.). Затем следует суффикс, характеризующий степень насыщенности (соответственно -ан, -ен или -ин, например, пентан, пентен, пентин. Если кратных связей в молекуле несколько , то в суффиксе указывается число таких связей, например: -диен, -триен, а после суффикса арабскими цифрами указывается положение кратной связи (например, бутен-1, бутен-2, бутадиен-1,3):
СН3-СН2-СН=СН3 (бутен-1); СН3-СН=СН-СН3 (бутен-2); СН2=СН-СН=СН2 (бутадиен-1,3)
Далее в суффикс выносится название самой старшей характеристической группы с указанием ее положения цифрой. Прочие заместители обозначаются с помощью приставок. При этом они перечисляются не в порядке старшинства, а по алфавиту. Положение заместителя указывается цифрой перед приставкой, например: 3-
метил; 2-хлор и т.п. Если в молекуле имеется несколько одинаковых заместителей, то перед названием соответствующей группы словом указывается их количество (например, диметил-, трихлор- и т.д.). Все цифры в названиях молекул отделяются от слов дефисом, а друг от друга запятыми. В качестве примера назовем следующее соединение:
54 3 2 1
СН2=СН-СН2-СН-СН3 (пентен-4-ол-2)
ОН
1) Выбор цепи однозначен, следовательно, корень слова - пент, далее следует
суффикс -ен, указывающий на наличие кратной связи; |
2) порядок нумерации |
обеспечивает старшей группе (-ОН) наименьший номер; |
3) полное название |
соединения заканчивается суффиксом -ол; положение двойной связи и гидроксильной группы указывается цифрами 4 и 2. Следовательно, приведенное соединение называется пентен-4-ол-2.
Другие примеры: |
СН3 |
СН3 СН СН СООН |
СН2 С СН СН2-ОН |
NO2 OН |
NH2 СН3 |
Соединение 1 содержит карбокси-, нитро- и альдегидную группы. Из них самая старшая - карбоксигруппа, поэтому соединение рассматривается как кислота. Углеродуглеродная цепь нумеруется, начиная с атома углерода карбоксильной группы. Соединение 1 называется 3-нитро-2-гидроксибутановая кислота.
Соединение 2 содержит гидроксильную группу, которая главнее аминогруппы и поэтому соединение квалифицируется как спирт и соответственно получает окончание -ол. Нумерация цепи начинается с атома углерода, при котором находится гидроксигруппа. Соединение 2 называется 3-амино-2,2-диметилпропанол-1.
