
- •6.2. Произведение растворимости
- •6.3. Ионное произведение воды.
- •6.4. Обменные реакции между растворами электролитов.
- •Раздел 7. Электрохимические процессы
- •7.1. Ряд стандартных электродных потенциалов Стандартные потенциалы металлических электродов
- •7.2. Гальванические элементы
- •7.3. Электролиз водных растворов и расплавов
- •7.4. Коррозия металлов и методы защиты от коррозии
6.4. Обменные реакции между растворами электролитов.
ГИДРОЛИЗ СОЛЕЙ
Обменные реакции между растворами электролитов практически необратимы и идут до конца в тех случаях, когда продуктами реакции являются малорастворимые, малодиссоциирующие, газообразные или комплексные соединения. При записи уравнений обменных реакций в молекулярно-ионной форме нужно помнить о том, что малодиссоциированные, малорастворимые и газообразные вещества записывают в виде молекул, а сильные электролиты – в виде ионов, на которые они диссоциируют.
Гидролиз солей. Гидролизом солей называют реакции обмена между водой и растворенными в ней солями. В результате гидролиза в растворе появляется избыточное количество ионов водорода или гидроксид-ионов, из-за чего раствор приобретает кислую или основную реакцию.
Если соль образована слабой кислотой и сильным основанием, то в результате гидролиза в растворе образуются гидроксид-ионы и он приобретает щелочную реакцию (pH > 7), например:
K2CO3 + H2O KHCO3 + KOH,
CO32- + H2O HCO3- + OH-.
Как видно, гидролизу подвергается анион соли. В процессе гидролиза образуется кислая соль, которая при определенных условиях может гидролизоваться дальше:
KHCO3 + H2O H2CO3 + KOH,
HCO3- + H2O H2CO3 + OH-.
При гидролизе соли, образованной сильной кислотой и слабым основанием, гидролизу подвергается катион соли, при этом в растворе возрастает концентрация ионов водорода, и он приобретает кислую реакцию (pH < 7), например:
CuCl2 + H2O CuOHCl + HCl,
Cu2+ + H2O CuOH+ + H+.
При взаимодействии с водой соли, образованной слабой кислотой и слабым основанием, гидролизу подвергается как катион, так и анион соли; например, при гидролизе ацетата свинца
Pb(CH3COO)2 + H2O Pb(OH)CH3COO + CH3COOH
параллельно протекают два процесса:
Pb2+ + H2O PbOH+ + H+,
CH3COO- + H2O CH3COOH + OH-.
В этом случае реакция раствора зависит от относительной силы кислоты и основания, образующих соль. Если значение константы диссоциации кислоты близко к значению константы диссоциации основания, то реакция раствора будет близка к нейтральной; если Ккисл. > Косн., то концентрация ионов водорода в растворе будет больше концентрации гидроксид-ионов и реакция раствора будет слабокислой; наконец, если Косн. > Ккисл., то гидролизу подвергается преимущественно анион соли и реакция раствора будет слабощелочной.
Соли, образованные сильной кислотой и сильным основанием, гидролизу не подвергаются, так как в этом случае обратная гидролизу реакция нейтрализации практически необратима, т. е. протекает до конца:
KCl + H2O KOH + HCl
K+ + Cl- + H2O K+ + OH- + H+ + Cl-, H2O H+ + OH-.
Показателем глубины протекания гидролиза является степень гидролиза , представляющая собой отношение концентрации гидролизованных молекул Cгидр. к исходной концентрации растворенных молекул электролита:
= Сгидр. / C. (35)
Как правило, степень гидролиза имеет небольшие значения. Например, в 0,1 н растворе хлорида аммония она составляет при 298 0К лишь 10-4. Объясняется это тем, что один из участников гидролиза, вода, является очень слабым электролитом. Поэтому положение равновесия реакции гидролиза сильно смещено в сторону исходных веществ. Константа гидролиза определяется из соотношения
 ,
(36)
,
(36)
где ![]() – константа воды, KД
– константа диссоциации слабого
электролита, образующего соль.
– константа воды, KД
– константа диссоциации слабого
электролита, образующего соль.
Связь между константой и степенью гидролиза выражается соотношением
![]() ,
(37)
,
(37)
из которого следует, что при разбавлении раствора гидролизующейся соли степень ее гидролиза возрастает. Возрастание степени гидролиза наблюдается и при увеличении температуры, так как при этом возрастает константа воды.
Пример 1. Напишите в молекулярной и ионно-молекулярной форме реакции взаимодействия между веществами: а) Na2S и FeSO4; б) Na2SO3 и HCl; в) CH3COOK и H2SO4; г) HgI2 и KI.
Решение. а) Запишем уравнение в молекулярной форме:
Na2S + FeSO4 = Na2SO4 + FeS.
Из всех участвующих в реакции веществ сульфид железа является малорастворимым соединением. Следовательно, в ионно-молекулярном уравнении его формула будет записана в виде молекулы, а формулы остальных электролитов – в виде ионов:
2Na+ + S2- + Fe2+ + SO42- = 2Na+ + SO42- + FeS
или Fe2+ + S2- = FeS.
б) Na2SO3 + 2HCl = 2NaCl + SO2 + H2O.
При записи ионно-молекулярного уравнения учитываем, что оксид серы (IV) является газообразным, а вода – малодиссоциированным соединением:
2Na+ + SO32- + 2H+ + 2Cl- = 2Na+ + 2Cl- + SO2 + H2O
SO32- + 2H+ = SO2 + H2O.
в) 2CH3COOK + H2SO4 = 2CH3COOH + K2SO4.
Уксусная кислота – малодиссоциирующее вещество, следовательно
2CH3COO- + 2K+ + 2H+ + SO42- = 2CH3COOH + 2K+ + SO42-
CH3COO- + H+ = CH3COOH.
г) HgI2 + 2KI = K2[HgI4].
Запишем уравнение в ионно-молекулярной форме, учитывая то, что иодид ртути – малорастворимое соединение:
HgI2 + 2K+ + 2I- = 2K+ + [HgI4]2-
HgI2 + 2I- = [HgI4]2-.
Пример 2. Дано краткое ионно-молекулярное уравнение
CN- + H+ = HCN.
Составьте по нему возможные молекулярные уравнения.
Решение. В левой части молекулярно-ионного уравнения указаны свободные ионы CN- и H+. Эти ионы образуются при диссоциации каких-либо растворимых сильных электролитов. Так, цианид-ионы могут образовываться при диссоциации, например, KCN, NaCN, поставщиком ионов водорода могут быть любые сильные кислоты. Соответственно, молекулярные уравнения для данного ионно-молекулярного:
KCN + HNO3 = KNO3 + HCN,
NaCN + HCl = NaCl + HCN.
Пример 3. Вычислите степень гидролиза ацетата калия в 0,1 М растворе и pH раствора.
Решение. Уравнение реакции гидролиза:
CH3COO- + H2O CH3COOH + OH-.
Для вычисления степени гидролиза найдем прежде всего константу гидролиза. Для этого воспользуемся значением константы диссоциации уксусной кислоты, приведенным в табл. 5 (1,810-5):
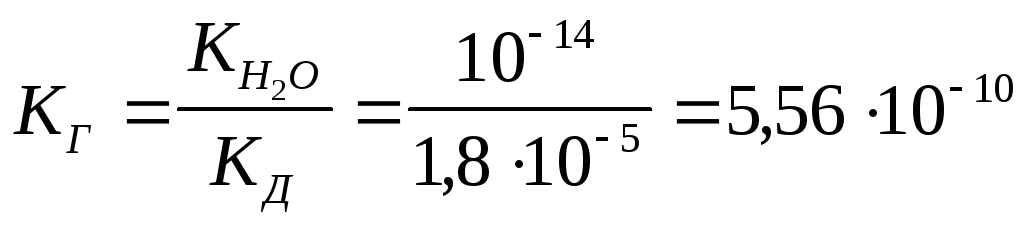 .
.
Теперь найдем степень гидролиза:
 .
.
Для вычисления pH следует принять во внимание, что в результате гидролиза каждого аниона CH3COO- образуется один гидроксид-ион. Если исходная концентрация гидролизующихся ионов СM моль/л, а степень гидролиза равна , то при гидролизе образовалось CM моль/л ионов OH-. Таким образом,
![]() = CM
= 7,510-50,1
= 7,510-6
моль/л.
= CM
= 7,510-50,1
= 7,510-6
моль/л.
Следовательно,
pOH = –lg![]() = –lg(7,510-6)
= –(–5,12) = 5,12.
= –lg(7,510-6)
= –(–5,12) = 5,12.
Отсюда
![]() = 14 – 5,12 = 8,88.
= 14 – 5,12 = 8,88.
ЗАДАЧИ
Напишите в ионно-молекулярной форме уравнения реакций, приводящих к образованию малорастворимых осадков или газов:
а) нитрат свинца и иодид калия б) хлорид никеля и сероводородная кислота; в) карбонат калия и хлороводородная кислота; г) сульфат меди и гидроксид натрия; д) бромид алюминия и нитрат серебра.
Запишите выражение ПР для образующихся осадков.
Напишите в ионно-молекулярной форме уравнения реакций, приводящих к образованию малодиссоциированных соединений:
а) сульфид натрия и серная кислота; б) сульфид железа(II) и хлороводородная кислота; в) ацетат калия и азотная кислота; г) хлорид аммония и гидроксид кальция;
Запишите выражение Кд для малодиссоциированных соединений.
Составьте в молекулярной форме уравнения реакций, которые выражаются следующими ионно-молекулярными уравнениями:
NO2- + H+ = HNO2;
Cu2+ + 2OH- = Cu(OH)2;
Pb2+ + 2I- = PbI2.
Какие из перечисленных ниже солей подвергаются гидролизу: NaCN, KNO3, KOCl, NaNO2, NH4CH3COO, CaCl2, NaClO4, KHCOO, KBr? Для каждой из гидролизующихся солей напишите уравнение гидролиза в ионно-молекулярной форме и укажите реакцию ее водного раствора.
Укажите, какие из перечисленных ниже солей подвергаются гидролизу: а) ZnBr2, K2S, Fe2(SO4)3, MgSO4; б) KNO3, K2CO3, Na3PO4, CuCl2. Для каждой из гидролизующихся солей напишите в молекулярной и ионно-молекулярной форме уравнения гидролиза по каждой ступени, укажите реакцию водного раствора соли.
Вычислите константу гидролиза хлорида аммония, определите степень гидролиза этой соли в 0,01 М растворе и pH раствора.
При 60 0С ионное произведение воды
 = 10-13.
Считая, что константа диссоциации
хлорноватистой кислоты не изменяется
с температурой, определите pH 0,001 н
раствора KOCl
при 25 и при 60 0С.
= 10-13.
Считая, что константа диссоциации
хлорноватистой кислоты не изменяется
с температурой, определите pH 0,001 н
раствора KOCl
при 25 и при 60 0С.Почему раствор NaHCO3 имеет слабощелочную, а раствор NaHSO3 – слабокислую реакцию?
При сливании водных растворов Cr(NO3)3 и Na2S образуется осадок гидроксида хрома (III) и выделяется газ. Составьте молекулярное и ионно-молекулярное уравнения происходящей реакции.
Индикатор метиловый оранжевый изменяет окраску от красной до желтой в интервале pH от 3,2 до 4,4. Какова будет окраска 0,1 М водного раствора ацетата аммония CH3COONH4, содержащего метиловый оранжевый индикатор: а) красная; б) оранжевая; в) желтая?
Напишите в молекулярной и молекулярно-ионной формах уравнения реакции взаимодействия следующих веществ:
а) нитрата серебра и хлорида железа (II); б) карбоната кальция и хлороводородной кислоты; в) гидроксида бария и азотной кислоты.
Запишите выражение ПР осадка, KД слабого электролита,
 для продуктов реакции взаимодействия
следующих веществ а) сульфата
стронция и
хлорида бария;
б) хлорида
аммония и гидроксид кальция;
в) уксусной
кислоты и
гидроксида бария.
для продуктов реакции взаимодействия
следующих веществ а) сульфата
стронция и
хлорида бария;
б) хлорида
аммония и гидроксид кальция;
в) уксусной
кислоты и
гидроксида бария.Составьте по три молекулярных уравнения реакций к каждому из молекулярно-ионных уравнений:
а) Ca2+ + CO32- = CaCO3;
б) CO32- + 2H+ = CO2 + H2O;
в) H+ + OH- = H2O.
Смешивают попарно растворы: а) Cu(NO3)2 и Na2SO4; б) BaCl2 и K2SO4; в) KNO3 и NaCl; г) AgNO3 и KCl; д) Ca(OH)2 и HCl. В каких из приведенных случаев реакции практически идут до конца? Составьте для этих уравнений молекулярные и молекулярно-ионные уравнения.
Можно ли приготовить раствор, содержащий одновременно следующие пары веществ: а) Zn(OH)2 + KOH; б) Ba(OH)2 + HCl; в) Fe(OH)3 + NaOH. Представьте возможные реакции в молекулярном и молекулярно-ионном виде.
Составьте по два молекулярных уравнения к каждому из молекулярно-ионных уравнений:
а) Au(OH)3 + OH- = [Au(OH)4]-; б) Fe(OH)2 + 2H+ = Fe2+ + 2H2O;
в) Be(OH)2 + 4H+ = [Be(H2O)4]2+.
Представьте в молекулярном и молекулярно-ионном виде реакции взаимодействия между: а) гидроксидом хрома (III) и серной кислотой; б) метахромистой кислотой и гидроксидом калия; в) метафосфорной кислотой и гидроксидом стронция.
При сливании растворов CrCl3 и Na2CO3 образуется осадок Cr(OH)3. Объясните причину и напишите соответствующие уравнения в молекулярном и молекулярно-ионном виде.
Подберите по два уравнения в молекулярном виде к каждому из молекулярно-ионных уравнений:
а) Al3+ + H2O (AlOH)2+ + H+; б) S2- + H2O OH- + HS-;
в) CN- + H2O OH- + HCN.
Определите степень гидролиза и pH 0,005 н KCN, KHCN = 4,910-10.
Водородный показатель 0,003 н раствора гипохлорита калия равен 9,5. Вычислите степень гидролиза этой соли.
Какую реакцию должны иметь растворы следующих солей: NH4CN, Al(NO3)3, K2CO3, ZnSO4, Li2S? Ответ подтвердите соответствующими молекулярными и молекулярно-ионными уравнениями.
