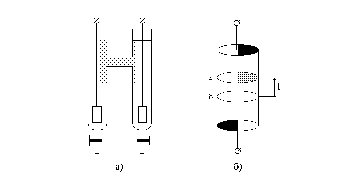
Блок-схема установки.
Работа 3. Определение чисел переноса по методу Гитторфа.
Введение. Явления переноса в растворах электролитов.
Наиболее характерной и важной особенностью электролитов является их способность проводить электрический ток в результате движения ионов. Если электролит (раствор или расплав) помещен между двумя металлическими пластинами - электродами, к которым подведена извне разность электрических потенциалов, то в системе появляется электрический ток вследствие направленного движения ионов. Положительно заряженные ионы (катионы) движутся к отрицательному полюсу - катоду, отрицательно заряженные ионы (анионы) движутся к положительному полюсу - аноду. На поверхности электрода происходит нейтрализация ионов электрическими зарядами электродов и выделение веществ. Во внешней цепи имеет место перенос электронов от анода к катоду при помощи внешнего источника постоянного тока. Схема движения зарядов в ячейке представлена на рис.
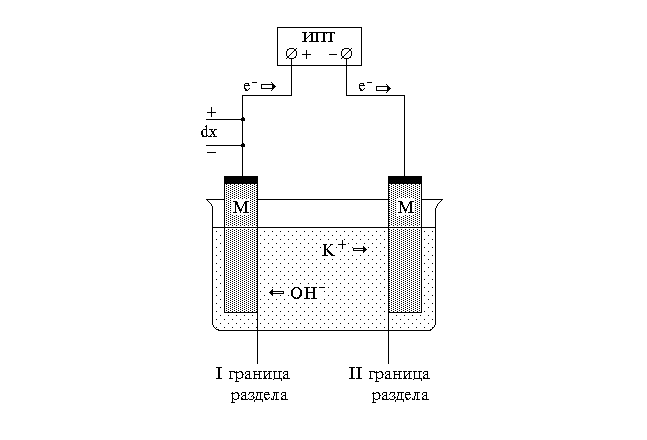
Количество электрических зарядов, переносимых ионами в 1 с через поперечное сечение электролита, перпендикулярное направлению электрического поля, определяет силу тока. Величина силы тока в соответствии с законом Ома пропорциональна падению напряжения в электролите (Е) и обратно пропорциональна электрическому сопротивлению (R): I=U/R.
В растворах электролитов в отсутствие внешнего электрического поля ионы находятся в состоянии хаотического движения. Если концентрация ионов во всех частях раствора одинакова, то в такой системе не будет наблюдаться потока ионов в каком-либо направлении. Если к раствору, как было показано выше, приложена разность электрических потенциалов, то в растворе создается однородное электрическое поле с напряженностью (градиентом потенциала) E/l. Внешнее электрическое поле будет действовать на каждый ион с силой, равной произведению напряженности поля на заряд иона. Действие этой силы вызывает движение ионов.
Движение ионов под действием электрического поля (grad потенциала) называется миграцией. Электрическая подвижность иона зависит от природы иона, от природы растворителя, от температуры.
Перенос ионов в проводниках II рода характеризуется числом переноса, который показывает, какая доля электрического тока переносится данным видом иона
![]()
![]()
Сумма чисел переноса ионов любого электролита всегда равна единице: t++t-=1.
Числа переноса связаны со скоростями движения соответствующих ионов и ионными подвижностями (электропроводностью) следующим соотношением:
![]()
Если в растворе содержится несколько электролитов с разной концентрацией, то число переноса определяется при помощи соотношения:
![]()
Для измерения чисел переноса применяется несколько методов.
-
Метод Гитторфа.
Наиболее универсальным определением переноса является метод Гитторфа. Он основан на измерении убыли электролита в катодном и анодном пространствах электролитической ячейки при прохождении постоянного тока и сравнении этой величины с данными материального баланса при пропускании одного Фарадея электричества. Какое именно число переноса (катиона или аниона) определяется по изменению концентрации в катодном или анодном пространстве зависит от характера электродных процессов на электродах. Характер электродных процессов зависит от типа электрода и свойств электролита. Так, если электролиз проводить с нерастворимыми (инертными) электродами, например Pt, то характер процессов определяется способностью растворенных компонентов раствора вступать в электрохимическую реакцию при меньших потенциалах, чем процесс электрохимического разложения воды. Эта способность, как правило оценивается по стандартным электродным потенциалам.
Так существенно различаются процессы электролиза HCl, растворов NaCl и Na2SO4 с Pt электродами. При электролизе раствора HCl на Pt электродах протекают реакции:
на катоде: H+ + e 1/2 H2
на аноде: Cl-e+ 1/2 Cl2
При электролизе раствора NaCl:
на катоде: H2O + e 1/2 H2+ OH-
на аноде: Cl-1/2 Cl2 + e
При электролизе раствора Na2SO4:
на катоде: H2O + e 1/2 H2+ OH-
на аноде: H2O 1/2 O2+ 2H++ 2e
Процессы электрохимического превращения
Na+ и
![]() при электролизе водных растворов
практически не протекают из-за очень
высоких стандартных электродных
потенциалов:
при электролизе водных растворов
практически не протекают из-за очень
высоких стандартных электродных
потенциалов:
![]()
![]()
Несколько по другому проходит электролиз растворов с растворимыми электродами. Так электролиз CuSO4 с медными электродами определяет протекание реакции на электродах:
на катоде: Cu2++2eCuo
на аноде: CuoCu2++ 2e
В электрохимической ячейке возможно сочетание электродов растворимых и нерастворимых, катод - Pt; анод - Cd:
на катоде: Cd2++2eCdo
на аноде: CdoCd2++2e
Если изменим тип электродов, катод - Cd, анод - Pt, то изменится и характер электрохимических процессов:
на катоде: Cd2++2eCdo
на аноде: H2O1/2O2+2H++2e
Учитывая характер электрохимических превращений на электродах и массоперенос ионов в растворе при пропускании 1F электричества составляется материальный баланс изменения концентраций в прикатодном и прианодном пространствах электролизера.
При экспериментальном определении чисел переноса методом Гитторфа режим электролиза подбирают таким, чтобы не протекали реакции электроокисления и электровосстановления растворителя. Электролиз должен быть кратковременным. При продолжительном электролизе могут возникнуть значительные градиенты концентраций, которые создадут диффузионные потоки ионов в ячейке, что приведет к ошибкам в определении чисел переноса.
Методом Гитторфа определяют кажущиеся числа переноса. Истинные числа переноса можно определить этим методом лишь для таких ионов, которые не гидратированы. Подавляющее большинство ионов сильно гидратировано. Их миграция сопровождается переносом воды и изменением ее содержания в трех частях ячейки.
Для системы (+)Cu/CuSO4,H2O/Cu(-) концентрационные изменения в католите (Cк) и анолита (Са) будут равны между собой по абсолютной величине и пропорциональны количеству электричества (числу Фарадеев) пропущенного через ячейку, т.е.
![]() (г-экв)
(г-экв)
Ск=(Со-Ск)Vk; Ca=(Ca-Co)Va
где Со, Ск, Са - г-экв/л; Vk, Va - л
![]()
Для системы: (+)Pt/CuSO4, H2O/Pt(-) процессы, протекающие в электрохимической системе отличны от первой системы, как было показано выше, что анодная реакция является реакцией разложения воды с образованием кислорода и ионов водорода.
Измерения проводят в приборе (рис.1) с медными или платиновыми электродами в растворе 0,25-0,5н CuSO4. Для отбора проб и анализа электролита после электролиза имеется сливной кран. При использовании медных электродов пространство со сливным краном будет анолитом, а в случае платиновых электродов - католитом. Источником тока служит потенциостат. Режим работы - гальваностатический. Сила тока 10 mA. Электролиз ведут 1 час. После окончания опыта сливают растворы сульфата меди из соответствующего пространства, измеряют объемы и титруют медь иодометрическим титрованием.