
Методика титрования
Реактивы: KI, раствор крахмала 0,1 н.
2 мл электролита поместить в коническую колбу на 250 мл, разбавить дистиллированной водой до 100 мл, добавить 5-10 кап. H2SO4 (1,84) и 10 мл KI. Выдержать в закрытой колбе в течение 5 мин. в теплом месте и затем титровать выделившийся ион 0,1н раствором гипосульфита в присутствии крахмала до исчезновения синей окраски.
Содержание меди рассчитывается по формуле:
![]() (г/л), где
(г/л), где
- количество мл раствора гипосульфита, пошедшее на титрование
Н - нормальность раствора гипосульфида;
V - количество мл электролита, взятое для анализа.
Работа №4. Определение чисел переноса методом движущейся границы.
Как было показано выше, на основе своих опытов Гитторф пришел к выводу, что скорости движения различных ионов, в том числе катионов и анионов, ни одинаковы. Большое научное значение результатов его исследований стало ясным после того как Кольрауш с формулировал закон независимости движения ионов.
Как следует из закона Кольрауша, эквивалентная электропроводность определяется суммой электропроводностей катиона и аниона
=++- (1)
Для нахождения электропроводности отдельного иона нужно дополнительно знать долю тока, переносимую катионами и анионами. Доля тока, переносимая ионами данного вида i, называется электрическим числом переноса этого иона. В растворе бинарного электролита t++t-=1.
Метод движущейся границы позволяет непосредственно определить скорости движения ионов. Этот метод удается реализовать, если растворы двух электролитов образуют резкую границу. Концентрацию растворов, например, KCl и BaCl2 подбирают таким образом, чтобы в первом приближении выполнялось регулирующее соотношение Кольрауша
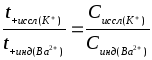 (2)
(2)
причем число переноса t+
нижнего раствора должно быть меньше
верхнего, т.е.
![]()
![]() ,
если эти условия выполняются, то при
пропускании через систему электрического
тока, вызывающего движение катионов
снизу вверх, граница двух растворов не
размывается и перемещается вверх. Через
определенный промежуток времени граница
занимает положение a’b’
(рис. ). Если за это время через систему
прошло Q кулонов, то
количество электричества, перенесенное
катионами К+, равно
,
если эти условия выполняются, то при
пропускании через систему электрического
тока, вызывающего движение катионов
снизу вверх, граница двух растворов не
размывается и перемещается вверх. Через
определенный промежуток времени граница
занимает положение a’b’
(рис. ). Если за это время через систему
прошло Q кулонов, то
количество электричества, перенесенное
катионами К+, равно
![]() +Q.
Заряд
+Q.
Заряд
![]() +Q
должен быть равен заряду всех катионов
К+, которые содержались в объеме
V между уровнями ab
и a’b’.
Поэтому t+Q=z+FC+V
и для рассматриваемого примера
+Q
должен быть равен заряду всех катионов
К+, которые содержались в объеме
V между уровнями ab
и a’b’.
Поэтому t+Q=z+FC+V
и для рассматриваемого примера
![]() =CKClFV/Q (3)
=CKClFV/Q (3)
При использовании уравнения (3) системой отсчета оказывается не растворитель в целом, а стеклянная трубка измерительного прибора. Различие в этих системах отсчета обусловлено некоторым перемещением воды относительно стеклянной трубки, которое в свою очередь связано с изменением объема V, регистрируемого в методе движущейся границы, из-за электродных реакций. Так в рассмотренном примере при пропускании электрического тока происходит не только движение катионов, но также перемещение анионов и электродный процесс превращения металлического серебра в хлорид серебра: Ag+Cl-eAgCl.
В результате возникает дополнительное изменение объема, равное
![]()
![]() (4)
(4)
![]() -
молярные объемы соответственно хлорида
серебра, серебра металлического и
хлорида калия.
-
молярные объемы соответственно хлорида
серебра, серебра металлического и
хлорида калия.
Таким образом объем V регистрируемый по перемещению границы из положения «ab» в положении «a’b’» содержит также величину V, поэтому для получения числа переноса относительно растворителя в формулу (3) необходимо внести поправку.
![]() =
CKClF(V-V)Q (5)
=
CKClF(V-V)Q (5)
где:
![]() л/моль,
л/моль,
![]() л/моль;
л/моль;
![]() л/моль,
а
л/моль,
а
![]() =0,5,
то различие в числах переноса К+,
рассчитанных по формулам (3) и (5), составляет
=0,5,
то различие в числах переноса К+,
рассчитанных по формулам (3) и (5), составляет
![]() 0,003СKCl.
0,003СKCl.
Следовательно, за исключением концентрированных растворов поправка на перемещение растворителя относительно трубки мала. Однако она имеет принципиальное значение, т.к. показывает, что числа переноса зависят от выбранной системы отсчета.
Точность измерения чисел переноса в методе движущейся границы определяется точностью отсчета положения границы. Обычно для этого используют различие в показателях преломления исследуемого (KCl) и индикаторного (BaCl2) растворов, а положение границы раздела в каждый момент времени регистрируется специальной оптической системой. Либо визуально в случае цветного исследуемого раствора.
Расчеты ведут по формуле
![]() (3a)
(3a)
l -смещение границы раздела; S - площадь поперечного сечения.
Практическая часть.
Задача исследования - определение чисел переноса методом движущейся границы.
Приборы и материалы: источник тока, миллиамперметр, электролизер в виде трубки площадью сечения 1 см2 с серебряным анодом и катодом хлорсеребрянным, исследуемый раствор 0,2М KCl, индикаторный раствор BaCl2 1,6M.
Измерения проводят в приборе рис.1.
Внизу трубки находится индикаторный раствор BaCl2 1,6М, исследуемый раствор вверху трубки. Источником тока служит потенциостат. Режим работы - гальваностатический. Сила тока 10 mA. Электролиз ведут в течение 1,5 часа.
После окончания электролиза замеряют изменение границы раздела (l). По полученным данным проводят расчет числа переноса К+.
Работа № 5. Измерение температурного коэффициента электродных реакций.
Введение.
В зависимости от направления электродных реакций и соответственно направления тока электрохимическая цель превращается либо в гальванический элемент, либо в гальваническую ванну.
Гальванический элемент, или химический источник электрической энергии, представляет собой устройство, в котором химическая энергия окислительно-восстановительных реакций непосредственно превращается в электрическую. Непременное условие работы такого устройства - разделение единого окислительно-восстановительного процесса на процесс окисления и процесс восстановления, протекающие на различных, пространственно разделенных электродах, при этом оба электрода должны быть замкнуты через внешнюю цепь.
Примеры такого элемента может служить элемент Якоби-Даниеля:
Cu/CuSO4, H2O//ZnSO4, H2O/Zn
в котором электродами являются цинковая и медная пластины, погруженные в соответствующие водные растворы сульфата меди и цинка. Электрический ток в элементе Якоби-Даниеля возникает в результате прохождения химической реакции:
Zn-2eZn2+ (1)
Cu2++2eCu (2)
_________________
Zn+Cu2+Zn2++Cu
Подобные реакции получили название токообразующих. В данном случае электрический ток возникает за счет энергии, освобождающейся при вытеснении из раствора ионов Cu2+ более активными атомами цинка, т.о. при работе гальванического элемента цинковый электрод растворяется, на нем протекает процесс окисления (1). Отдавая во внешнюю цепь электроны, цинк образует отрицательный полюс элемента. Освобождающиеся при этом электроны переходят по проводнику первого рода на медный электрод и здесь соединяются с ионами меди, восстанавливая их до атомов (2). Медный электрод образует положительный полюс элемента (рис.3). В гальваническом элементе катод является положительным электродом по отношению к аноду, т.е. полюсность электрода не определяет его название.
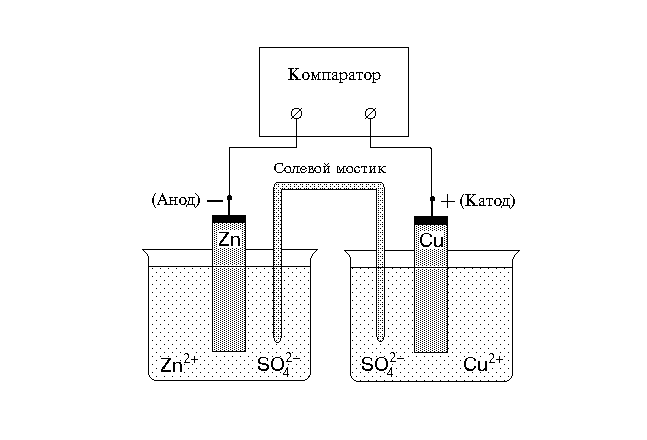
Рис.3.
Возникающий во внешней цепи непрерывный поток электронов - электрический ток может быть использован для совершения работы.
Разность равновесных потенциалов, существующая между электродами гальванического элемента, называется электродвижущейся силой (Э.Д.С.) и обозначается через Е. Если токообразующий процесс провести в обратимых условиях, то элемент произведет максимальную работу:
А=zFEдис (3)
где F- постоянная Фарадея (96500 Кл); z - число электронов, участвующих в реакции;
или в калориях А=0,239zFEкал (4).
Зависимость максимальной работы химической реакции А от теплоты реакции Qp при постоянном давлении выражается уравнением Гиббса-Гельмгольца:
![]() (5)
или по уравнению 4,5
(5)
или по уравнению 4,5
![]() (6)
(6)
где величина
![]() - температурный коэффициент ЭДС
гальванического.
- температурный коэффициент ЭДС
гальванического.
Влияние температуры на ЭДС и электродные потенциалы может быть установлено путем анализа основного уравнения термодинамической теории ЭДС после дифференцирования по температуре:
![]() (7),
(7),
где q - тепловой эффект обратимо протекающей реакции в гальваническом элементе; S - энтропия реакции.
Величина
![]() может быть приближенно определена по
формуле:
может быть приближенно определена по
формуле:
![]() (8)
(8)
где Е1 и Е2 - значение ЭДС элемента соответственно при температурах Т1 и Т2.
При этом равенство (8) тем точнее, чем
меньше отличаются между собой Т1
и Т2, так как зависимость Е=f(T)
только в узком интервале температур
близка к линейной. Зная величину Е, Т
нетрудно определить
![]() по уравнению (8). Вычислить теплоту
реакции зная Qp
и измерив
по уравнению (8). Вычислить теплоту
реакции зная Qp
и измерив
![]() можно определить величину максимальной
работы и ЭДС элемента.
можно определить величину максимальной
работы и ЭДС элемента.
-
Если
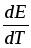 0,
то 0,239zFEQp,
т.е. часть тепла при работе элемента
выделяется в окружающую среду и элемент
находясь в адиабатических условиях
нагревается. К таким элементам относится
рассмотренный элемент Якоби-Даниеля,
для которого тепловой эффект равен
231,07 кДж/моль, а совершенная электрическая
работа только 211,18 кДж/моль.
0,
то 0,239zFEQp,
т.е. часть тепла при работе элемента
выделяется в окружающую среду и элемент
находясь в адиабатических условиях
нагревается. К таким элементам относится
рассмотренный элемент Якоби-Даниеля,
для которого тепловой эффект равен
231,07 кДж/моль, а совершенная электрическая
работа только 211,18 кДж/моль. -
Если
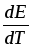 0,
то 0,239zFEQp,
т.е. электрическая работа в таком
элементе получается не только в
результате теплового эффекта реакции,
но и вследствие теплоты окружающей
среды, и элемент в процессе работы,
будучи помещены в адиабатические
условия, охлаждается. К таким элементам
относится элемент Бугарского, для
которого Qp=-15,53
кДж/моль; -G=-15,78
кДж/моль.
0,
то 0,239zFEQp,
т.е. электрическая работа в таком
элементе получается не только в
результате теплового эффекта реакции,
но и вследствие теплоты окружающей
среды, и элемент в процессе работы,
будучи помещены в адиабатические
условия, охлаждается. К таким элементам
относится элемент Бугарского, для
которого Qp=-15,53
кДж/моль; -G=-15,78
кДж/моль. -
Если
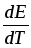 =0,
то Qp=0,
то Qp=0
=0,
то Qp=0,
то Qp=0
ЭДС не будет измеряться с изменением температуры. Таким образом источником электрической энергии в гальваническом элементе является энергия, освобождающаяся в результате прохождения в элементе токообразующих химических процессов, и в некоторых случаях теплота окружающей среды.
