
- •Часть 1. Нозология
- •Глава 1. Общее учение о болезни
- •Глава 2. Этиология и патогенез
- •Глава 3. Патогенное действие факторов внешней среды
- •Глава 4. Роль наследственности и конституции в патологии
- •Глава 5. Реактивность и ее роль в патологии
- •Глава 6. Патологическая физиология иммунной системы
- •Глава 7. Аллергия
- •Глава 8. Повреждение клетки
- •Глава 9. Старение
- •Часть 2. Типические патологические процессы
- •Глава 10. Патологическая физиология периферического кровообращения
- •Глава 11. Нарушения микроциркуляции
- •Глава 12. Воспаление
- •1. Стадия альтерации (повреждения):
- •2. Стадия экссудации и эмиграции
- •3. Стадия пролиферации и репарации:
- •Глава 13. Опухоли
- •Глава 14. Типические нарушения обмена веществ.
- •Глава 15. Голодание
- •Глава 16. Лихорадка
- •Глава 17. Гипоксия
- •Часть 3. Патологическая физиология органов и систем
- •Глава 18. Патологическая физиология системы крови
- •1. По этиологии:
- •Глава 19. Патологическая физиология системного кровообращения
- •Глава 20. Патологическая физиология внешнего дыхания
- •Глава 21. Патологическая физиология пищеварения
- •Глава 22. Патологическая физиология печени
- •Глава 23. Патологическая физиология почек
- •Глава 24. Патологическая физиология эндокринной системы
- •Глава 25. Патологическая физиология нервной системы
- •Глава 26. Патологическая физиология соединительной ткани
Глава 21. Патологическая физиология пищеварения
Функция пищеварительной системы обеспечивает поступление в организм и превращение в нем до простых химических соединений, способных усваиваться, пищи и воды, необходимых для поддержания жизни и снабжения энергетическим и пластическим материалами.
Между различными отделами пищеварительной системы существует взаимосвязь и преемственность в работе, обусловленная непрерывностью пищевого канала, а также общностью нервных и гуморальных механизмов регуляции. Особенно наглядно эта связь проявляется в условиях патологии, когда расстройство функции одного отдела пищеварительной системы влечет за собой нарушение деятельности других.
Нарушения пищеварения в полости рта
Классические исследования И. П. Павлова и его учеников показали, что полость рта, являясь первым отделом пищевого канала, приходящим в соприкосновение с пищей, особенно богата рецепторами, реагирующими на физические свойства и химический состав пищевых продуктов. Эти рецепторы являются источником рефлексов, не только регулирующих пищеварение в полости рта, но и влияющих на функции нижележащих отделов пищеварительной системы.
В полости рта пища измельчается зубами и смачивается слюной. Нарушение измельчения пищи (жевания) возникает в результате повреждения или отсутствия зубов, нарушения функции жевательных мышц или поражения височно-нижнечелюстных суставов. Причиной повреждения или потери зубов чаще всего являются кариес или пародонтит. К нарушению жевания могут привести также заболевания слизистой оболочки полости рта.
В полости рта обитает около 30 различных видов микроорганизмов, среди которых немало патогенных. Кариозные зубы, флора десневых карманов при пародонтите, как и тонзиллит, могут вести к сенсибилизации организма или даже является источником орального сепсиса. Вместе с тем в полость рта поступает целый ряд защитных факторов, источниками которых служат слюна и эмигрирующие лейкоциты. В их числе следует назвать антибактериальные ферменты: лизоцим, РНКазу, ДНКазу и пероксидазу. Защитную роль играют также иммуноглобулины слюны.
Кариес зубов
Кариес зубов – патологический процесс, характеризующийся прогрессирующей деструкцией твердых тканей зуба (эмали и дентина) с образованием дефекта в виде полости. Распространенность кариеса зубов у населения в некоторых районах земного шара достигает 100 %.
Этиология.
Основной причиной возникновения кариеса зубов являются микроорганизмы зубного налета, разрушающие твердые ткани зубов. Особое значение придают стрептококкам группы A (Streptococcus mutans). Этиологическая роль микроорганизмов подтверждается тем, что у гнотобионтов (безмикробных животных) кариес воспроизвести не удается. Образованию налета и действию микроорганизмов способствует несоответствие сложившихся в процессе эволюции структурных и функциональных особенностей зубочелюстной системы характеру питания современного человека (пища, обработанная механически и термически, дефицитная по ряду компонентов, в частности, по некоторым минеральным веществам и аминокислотам).
Патогенез.
В патогенезе кариеса важную роль играют процессы, возникающие на поверхности эмали, соприкасающейся с пищей и омываемой слюной. Слюна оказывает на эмаль зубов защитное действие (очищающее, буферное, антимикробное и реминерализирующее). Нарушение слюноотделения способствует образованию на поверхности эмали зубного налета, состоящего главным образом из адгезивных полигликанов, синтезируемых из глюкозы содержащимися в налете микроорганизмами (до 250 млн в 1 мг сухого вещества). Последние переваривают остатки пищи (особенно углеводной) с образованием органических кислот, растворяющих минеральные соли эмали (кристаллы гидроксиапатита). Не случайно экстирпация главных слюнных желез у животных, оперативное удаление их у человека, а также ксеростомия (см. ниже) способствуют развитию кариеса зубов. Установлено, что растворению минеральных солей предшествует разрушение микроорганизмами органических элементов эмали (пластинки, оболочки призм). Образующиеся продукты белкового распада могут служить хелаторами (комплексообразователями), мобилизующими кальций из кристаллов гидроксиапатита эмали и дентина.
Наряду с описанным экзогенным звеном, в патогенезе кариеса важную роль играют эндогенные процессы на пути пульпа – твердые ткани зуба. Установлено, что в дентинных трубочках, в которых расположены отростки одонтобластов, а также в эмали циркулирует зубная лимфа, происходящая из пульпы и обеспечивающая питание твердых тканей зуба.
Важнейшим компенсаторным механизмом при разрушении зуба кариозным процессом является образование одонтобластами со стороны пульпы вторичного, заместительного дентина. Установлено, что повторные травмы постоянно растущих резцов у грызунов рефлекторно вызывают гипертрофию слюнных желез, которая сопровождается ускоренным ростом зубов (новообразованием дентина и эмали) и повышением их устойчивости к кариесу. Следует полагать, что сходный механизм включает защитное новообразование вторичного дентина при разрушении твердых тканей зубов кариозным процессом.
Известную роль в патогенезе кариеса зубов играют также наследственная предрасположенность и снижение иммунной и неспецифической резистентности организма.
Пародонтоз
Пародонтоз – воспалительно-дистрофический процесс, поражающий пародонт, т. е. комплекс тканей, окружающих корень зуба (периодонт, костную ткань зубной альвеолы, десну, надкостницу). Он наблюдается у 30 – 50 % людей в возрасте после 30 лет и проявляется резорбцией зубных альвеол, гноетечением из десневых карманов, расшатыванием и выпадением зубов.
В этиологии пародонтита важную роль играет эмоциональное перенапряжение, а также другие чрезвычайные (стрессорные) воздействия. В связи с этим пародонтит нередко рассматривают в числе "болезней адаптации". В качестве этиологических факторов выступают также понижение общей физической и жевательной нагрузки, микрофлора зубного налета и десневых карманов, нарушение питания, особенно недостаток аскорбиновой кислоты и рутина (витамина Р).
Как показали исследования последних лет, решающую роль в патогенезе пародонтита играют нервно-дистрофический фактор, а также изменения функции слюнных желез. В условиях неадекватного трофического обеспечения ткани пародонта повреждаются ферментами слюны (калликреин, РНКаза и др.), а также активными факторами лейкоцитов, оказывающими трофическое и защитное воздействие на нормальные ткани полости рта. Расстройство слюноотделения и микрофлора способствуют образованию зубного камня, нарушающего кровоснабжение тканей пародонта. В патогенезе пародонтита важное значение придают иммунному повреждению тканей, действию бактериальной и лейкоцитарной коллагеназы, а также эндокринным нарушениям (гипогонадизм, гипотиреоз, гипоинсулинизм, гиперпаратиреоз, понижение инкреторной функции слюнных желез).
В эксперименте пародонтит воспроизводится при помощи нейрогенных, эндокринных, алиментарных и иммунных воздействий.
Нарушение функций слюнных желез
Кроме пищеварительной функции, слюна играет важную роль среды, омывающей зубы и слизистую оболочку полости рта и оказывающей защитное и трофическое действие. Так, фермент слюны калликреин регулирует микроциркуляторное кровообращение в тканях слюнных желез и слизистой оболочке полости рта. Однако в условиях избыточной продукции ферментов или повышенной чувствительности к ним тканей они могут оказывать патогенное действие. Например, образующиеся под действием калликреина кинины способствуют развитию воспаления, а избыток нуклеаз может вести к снижению регенеративного потенциала тканей и способствовать развитию дистрофии.
Повышение слюноотделения (гиперсаливация)наблюдается при воспалении слизистой оболочки полости рта (стоматите, гингивите). Важным источником рефлекторных воздействий на слюнные железы являются зубы, пораженные патологическим процессом. Гиперсаливация наблюдается также при заболеваниях органов пищеварения, рвоте, беременности, действии парасимпатомиметиков, отравлении фосфор-органическими ядами и БОВ.
Повышение скорости секреции слюны сопровождается увеличением концентрации Na+ и хлоридов и снижением концентрации К+ в слюне. Общая молярная концентрация неорганических компонентов слюны при этом возрастает (закон Гейденгайна). Увеличение секреции слюны может привести к нейтрализации желудочного сока и нарушению пищеварения в желудке.
Понижение секреции слюны (гипосаливация)отмечается при инфекционных и лихорадочных процессах, при обезвоживании, под действием веществ, выключающих парасимпатическую иннервацию (атропин и др.), а также при возникновении в слюнных железах воспалительного процесса [сиалоаденит, инфекционный и эпидемический (вирусный) паротит и субмаксиллит]. Гипосаливация затрудняет акт жевания и глотания, способствует возникновению воспалительных процессов в слизистой оболочке полости рта и проникновению инфекции в слюнные железы, а также развитию кариеса зубов.
Из слюнных желез выделен инкрет – паротин, снижающий уровень кальция в крови и способствующий росту и обызвествлению зубов и скелета [Ито, 1969, Сукманский О. И., 1982]. Кроме паротина, из слюнных желез выделены нейротрофические факторы – фактор роста нервов инейролейкин; фактор роста эпидермиса (урогастрон), активирующий развитие тканей эпителиального происхождения и тормозящий желудочную секрецию; эритропоэтин,колониестимулирующий и тимотропный факторы, влияющие на систему крови; калликреин, ренин и тонин, регулирующие сосудистый тонус и микроциркуляцию; инсулиноподобное вещество, глюкагон и др. Паротин и другие инкреты слюнных желез выделяются не только в кровь, но и в слюну. Поэтому нарушения слюноотделения могут отражаться на инкреции слюнных желез. С понижением выработки паротина связывают развитие ряда заболеваний (хондродистрофию плода, деформирующий артрит и спондилит, пародонтит), а также эпидемических поражений органов движения и опоры (болезнь Кашина – Бека). К явлениям гиперсиалоаденизма относят симметрические невоспалительные припухания слюнных желез при сахарном диабете, гипогонадизме и других эндокринных расстройствах. Некоторые из этих форм гипертрофии слюнных желез расценивают как компенсаторные.
Нарушения глотания
Глотание – сложный рефлекторный акт, обеспечивающий поступление пищи и воды из полости рта в желудок. Его нарушение (дисфагия) может быть связано с расстройством функции тройничного, подъязычного, блуждающего, языкоглоточного и других нервов, а также нарушением работы глотательных мышц. Затруднение глотания наблюдается при врожденных и приобретенных дефектах твердого и мягкого неба, а также при поражениях дужек мягкого неба и миндалин (ангина, абсцесс). Акт глотания может нарушаться и вследствие спастических сокращений мышц глотки при бешенстве, столбняке и истерии. Заключительным (непроизвольным) этапом акта глотания является продвижение пищевых масс по пищеводу под влиянием перистальтических сокращений его мышечной оболочки. Этот процесс может нарушаться при спазме или параличе мышечной оболочки пищевода, а также при его сужении (ожог, сдавление, дивертикул и др.).
Нарушения пищеварения в желудке
Основными функциями желудка являются секреторная и моторная, обеспечивающие химическую и физическую обработку пищи, депонирование химуса и транспортировку его в кишки. Желудок выполняет также инкреторную, всасывательную и экскреторную функции.
Нарушение секреторной функции желудка
Нарушение секреторной функции желудка возникает при органических поражениях (изменение числа, гипертрофии или атрофии клеток) желудочных желез, а также при изменении их функциональной активности. Так, среднее число париетальных клеток желудочных желез составляет у здорового человека 0,82•109. Оно увеличивается при язвенной болезни двенадцатиперстной кишки и снижается при язвенной болезни, раке желудка и особенно при пернициозной анемии.
Функциональная активность желез желудка (собственно желудочных, кардиальных и пилорических) определяется тонусом блуждающих нервов, стимулирующих выработку секрета с увеличенным содержанием соляной кислоты и протеаз.
Главным и наиболее мощным стимулятором желудочной фазы секреции (особенно выработки соляной кислоты) является гастрин, вырабатываемый G-клетками слизистой оболочки желудка и представляющий собой полипептид, состоящий из 17 аминокислот. Выработка гастрина активируется раздражением блуждающего нерва, а также путем химической и механической стимуляции привратниковой пещеры (Antrum piloricum) пищей и продуктами ее переваривания. Выброс гастрина тормозится при снижении антрального рН до 2,0. При синдроме Золлингера – Эллисона (см. ниже) он увеличивается до 800 – 60 000 пг/мл, а при пернициозной анемии – до 500–9000 пг/мл.
Стимулировать желудочную секрецию может такжехолецистокинин, вырабатывающийся в слизистой оболочке тонкой кишки и сходный по строению с гастрином. Однако большие концентрации холецистокинина тормозят ее, конкурируя с гастрином. Физиологическая активность главных и париетальных клеток желудочных желез повышается также под влиянием гормонов гипофиза (кортикотропина, соматотропина), надпочечных (гликокортикоиды), щитовидной и околощитовидных желез, инсулина.
Фактором, тормозящим желудочную секрецию, являетсягастроингибирующий пептид (ГИП), выделенный из слизистой оболочки двенадцатиперстной кишки. ГИП активирует освобождение инсулина. Он угнетает секрецию соляной кислоты и моторику желудка, активирует кишечную секрецию. Выделяется ГИП под влиянием повышения уровня глюкозы в крови и поступления триглицеридов в тонкую кишку. Предполагают, что избыточное образование гастроингибирующего пептида у людей с удаленным желудком играет важную роль в развитии у них демпинг-синдрома (слабость, гипогликемия и другие расстройства после приема пищи). Избыточная продукция ГИП установлена при ожирении. Подобное ГИП антисекреторное действие оказывают близкие к нему по химическому строению секретин, глюкагон ивазоактивный интестинальный полипептид (ВИП). Тормозят желудочную секрецию также калликреин и фактор роста эпидермиса (урогастрон), вырабатывающиеся в слюнных железах.
Нарушение отделения желудочного сока (в нормальных условиях вырабатывается около 2 л желудочного сока за сутки) может выражаться в виде гипер- и гипосекреции его.
Гиперсекреция желудочного сока характеризуется обычно не только увеличением количества секрета, но и повышением выработки соляной кислоты (гиперхлоргидрия). При этом увеличивается как базальная, так и максимальная секреция желудка, вызванная внутримышечным введением больному пентагастрина (6 мкг/кг) или гистамина дигидрохлорида (24 мкг/кг) (табл. 6).
Гиперсекреция наблюдается при язвенной болезни двенадцатиперстной кишки, при антральном гастрите, пилороспазме и пилоростенозе, под влиянием охлаждения, алкоголя, горячей пищи и некоторых лекарственных препаратов (салицилаты, инсулин, бутадион, кортизон и др.).
Таблица 6. Базальная и максимальная секреция желудка
|
Состояние секреции |
Секреция | |||||
|
Базальная |
максимальная | |||||
|
количество секрета, мл/ч |
HCl |
количество секрета, мл/ч |
HСl | |||
|
ммоль/ч |
ммоль/л |
ммоль/ч |
ммоль/л | |||
|
Норма |
60±25 |
3±2,5 |
45±15 |
200±55 |
20±4 |
100±15 |
|
Гиперсекреция (язва двенадцатиперстной кишки) |
100 |
6 |
60 |
250 |
27,5 |
110 |
|
Гипосекреция (рак желудка) |
40 |
0,5 |
12,5 |
80 |
4 |
50 |
Сопровождаясь повышением кислотности и переваривающей способности желудочного сока, гиперсекреция может вызвать повреждение слизистой оболочки желудка (от легких диффузных изменений до острых эрозивных поражений).
Гипосекреция желудочного сока обычно сочетается с понижением кислотности желудочного содержимого (hypoaciditas). Понижение секреции желудочного сока наблюдается при остром и хроническом гастрите, опухолях желудка, обезвоживании организма.
Об анацидном состоянии говорят тогда, когда в желудочном соке отсутствует свободная соляная кислота (ахлоргидрия). Если железы желудка утрачивают способность выделять соляную кислоту и ферменты, то говорят об ахилии(отсутствие сока).
Гипосекреция, сочетаясь с гипоацидным состоянием, ведет к снижению переваривающей способности желудочного сока. Вследствие снижения бактерицидного действия соляной кислоты возможно развитие процессор брожения и гниения.
Нарушение двигательной функции желудка
Нарушение двигательной функции желудка выражается изменениями перистальтики (гипер- и гипокинез) и мышечного тонуса (гипер- и гипотония) (рис. 21.1), нарушением эвакуации пищевых масс из желудка, рвотой.
Усиление перистальтики (гиперкинез) обычно обусловлено увеличением числа импульсов, поступающих к мышечной оболочке желудка по волокнам блуждающего нерва, или повышением его раздражимости.
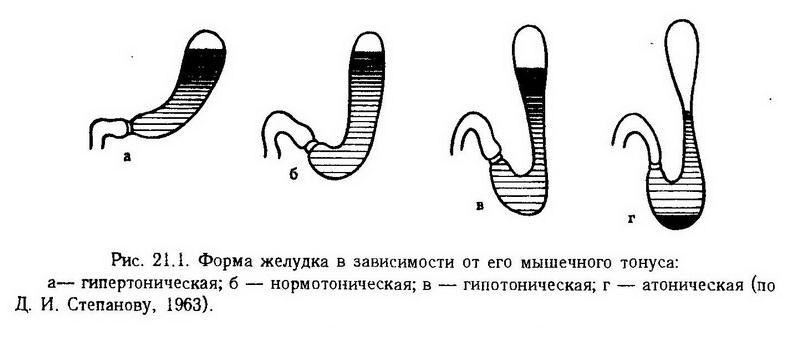
В механизме нарушения двигательной функции желудка важную роль играют расстройства гуморальной регуляции. Установлено, что моторика желудка активируется мотилином- пептидом, состоящим из 22 аминокислот и вырабатывающимся энтерохромаффинными клетками тонкой кишки. Продукция мотилина усиливается при ощелачивании содержимого двенадцатиперстной кишки и тормозится при низком дуоденальном рН. В крови здоровых людей концентрация мотилина составляет 5 – 300 пмоль/л и увеличивается при поносе.
Повышению перистальтики способствуют грубая пища, алкоголь, холиновые вещества, гистамин, а также тревога, гнев.
Повышение двигательной функции желудка может наблюдаться при гастрите и язвенном поражении желудка, а также при почечной или печеночной колике. Оно может вести к спастическим сокращениям отдельных групп мышечных волокон, которые являются главным источником желудочной боли.
Усиление перистальтики желудка обычно сопровождает повышение кислотности желудочного сока. При этом кислые пищевые массы, попадая в двенадцатиперстную кишку, вызывают длительное закрытие привратника и замедление эвакуации желудочного содержимого (энтерогастральный рефлекс).
Тормозят двигательную активность желудка гастроингибирующий и вазоактивный интестинальный пептиды, секретин, которые также вырабатываются в тонкой кишке.
Раздражение симпатических нервов, а также катехоламины снижают силу и ритм сокращений неисчерченной мышечной ткани желудка.
Снижение двигательной функции желудка (гипокинез) чаще всего наблюдается при гастрите, а также при спланхно- и гастроптозе, похудании и ослаблении общего тонуса организма. Понижению моторики желудка способствуют повышенное содержание жира в пище, неприятные вкусовые ощущения, страх, печаль. В эксперименте гипокинез желудка можно вызвать ваготомией или удалением привратниковой части желудка собаки с наложением дуоденогастрального или еюногастрального соустья [Лондон Е. С, 1905, 1913]. При дуоденогастральном соустьи нарушение моторики менее выражено.
Особо следует отметить ослабление функции желудочно-пищеводного соединения (нижнего пищеводного сфинктера), которое приводит к рефлюксу желудочного содержимого в пищевод и возникновению изжоги (pyrosis) – чувства жжения в надчревной области и за грудиной.
Тяжелым расстройством моторики, ведущим к нарушению эвакуации пищевых масс из желудка, являетсяпилороспазм. Наблюдается он при язвенной болезни, некоторых видах гастрита и пилородуоденита, полипозе желудка и других заболеваниях органов брюшной полости и сопровождается компенсаторным усилением перистальтики и гипертрофией мышечной оболочки желудка. К явлениям пилороспазма может присоединиться гипертрофический стеноз привратника (у детей в возрасте от 10 дней до 4 мес).
К нарушениям двигательной функции желудка относятся также рвота и отрыжка.
Рвота (vomitus) – сложный рефлекторный акт, в результате которого содержимое желудка (и кишок) извергается наружу через рот. Рвоте обычно предшествуют тошнота (nausea), саливация, учащенное дыхание и сердцебиение. Начало рвотных движений сопровождается чувством слабости, бледностью, потоотделением, брадикардией и снижением артериального давления. Происходит глубокий вдох, опускается надгортанник и поднимается гортань, что предохраняет дыхательные пути от попадания в них рвотных масс. В акте рвоты важную роль играет сокращение диафрагмы и мышц передней стенки живота, которое сопровождается антиперистальтическими сокращениями мышц желудка при закрытом привратнике. После рвоты артериальное давление восстанавливается и наблюдается тахикардия.
Рвотный центр расположен в продолговатом мозге, вблизи чувствительного ядра блуждающего нерва. Он может возбуждаться импульсами из желудка и кишок (растяжение, недоброкачественная пища, токсические вещества), печени, почек, матки (неукротимая рвота беременных), вестибулярного лабиринта (кинетоз), а также высших нервных центров (в ответ на неприятные запахи, зрительные и словесные образы). Возможно прямое механическое (повышение внутричерепного давления) или химическое (почечная недостаточность, алкалоз, дигиталис, апоморфин и др.) раздражение рвотного центра. Основным афферентным путем рвотного рефлекса служат желудочные ветви блуждающего нерва и органов брюшной полости, эфферентным – диафрагмальный и блуждающий нервы.
Рвота часто имеет защитное значение, освобождая желудок от недоброкачественной пищи или токсических веществ. Вместе с тем, длительная неукротимая рвота ведет к потере организмом воды, хлоридов и ионов водорода, в результате чего развивается обезвоживание и ахлоридная кома с явлениями алкалоза, а в хронических случаях – истощение организма.
Отрыжка (eructatio) возникает вследствие выхода из желудка проглоченного воздуха или газов, образовавшихся в результате бродильных или гнилостных процессов (углекислота, сероводород, метан и др.).
Язвенная болезнь желудка и двенадцатиперстной кишки
Язвенная болезнь характеризуется появлением дефектов на слизистой оболочке желудка или двенадцатиперстной кишки и носит хронический характер. Распространенность язвенной болезни резко возросла за последние 100 лет. В отдельных странах ею страдает до 10 – 15 % взрослого населения. Однако в последние десятилетия частота возникновения язвенной болезни в ряде развитых государств стала снижаться, что связывают с повышением употребления ненасыщенных жирных кислот.
Этиология.
В этиологии язвенной болезни большое значение имеют чрезвычайные воздействия на организм: психическая травма, эмоциональное и физическое перенапряжение, различные стрессовые ситуации. Этот вывод был сделан на основании данных о высокой заболеваемости язвенной болезнью, полученных в период второй мировой войны.
К. М. Быков (1948) в эксперименте на собаках и кошках показал, что "сшибка" высшей нервной деятельности приводит к нарушению моторной и секреторной функции желудка, а в ряде случаев и к образованию дефектов его слизистой оболочки. Язву в эксперименте можно получить при помощи различных стрессорных воздействий (обездвиживание, болевая травма и др.).
Известную этиологическую роль играют местные неблагоприятные воздействия на желудок и погрешности в питании (нерегулярный прием пищи, употребление чрезмерно горячей еды, алкоголя, злоупотребление острыми блюдами, диета с высокой концентрацией поваренной соли, курение. Определенную роль играет наследственное предрасположение, в частности преобладание тонуса парасимпатической части вегетативной нервной системы. Роль грубой, неадекватной пищи в возникновении. язвенных поражений была доказана в эксперименте Л. Ашоффом. Предварительное голодание животных способствует воспроизведению у них язв путем стрессорных и других воздействий.
В последние годы предполагают этиологическую роль в развитии язвенной болезни инфекционных возбудителей (вируса герпеса, а также грамнегативной спиральной бактерии Campylobacter pylori). Получены данные о нарушении последним возбудителем защитного слизистого барьера.
Патогенез.
В патогенезе язвенной болезни желудка и двенадцатиперстной кишки основное значение имеет нарушение равновесия между повреждающими (агрессивными) и защитными факторами (рис. 21.2). К факторам агрессии относят действие кислого желудочного сока (кислотно-пептический фактор), механическое, термическое и химическое повреждение слизистой желудка (токсинами, микроорганизмами, неадекватной пищей, лекарственными веществами и т. д.). Защитную роль играет слизистый барьер, препятствующий обратной диффузии Н+-ионов и их повреждающему действию, адекватное кровоснабжение и высокий регенеративный потенциал слизистой оболочки, простагландины, тучные клетки. Такую же роль выполняет нейтрализация кислого секрета слюной и панкреатическим соком, а также антродуоденальное торможение.
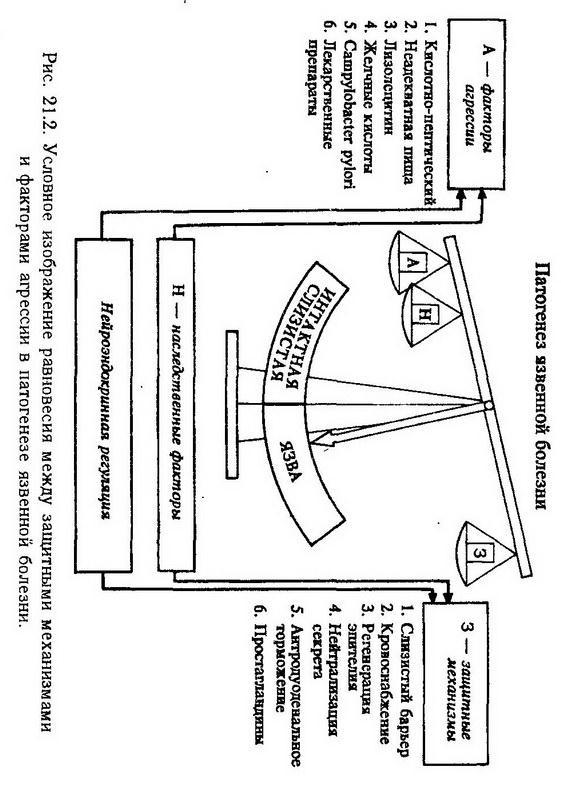
Роль кислотно-пептического фактора подтверждается тем, что у многих больных при локализации язвы в двенадцатиперстной кишке и препилорической части желудка повышены кислотность и переваривающая способность желудочного сока. В эксперименте образование язвы желудка и двенадцатиперстной кишки у животных можно вызвать при помощи веществ, усиливающих желудочную секрецию и повышающих кислотность желудочного сока (пентагастрин, гистамин, резерпин, атофан), а также при помощи хронического раздражения блуждающего нерва, стимулирующего желудочную секрецию и выработку гастрина.
Язва чаще локализуется в тех отделах (малая кривизна, привратниковая часть), которые содержат сравнительно мало париетальных клеток, продуцирующих соляную кислоту, и, следовательно, менее приспособлены к действию кислого желудочного сока.
Важную защитную роль играет слизь, покрывающая слизистую оболочку желудка. В филогенезе у человека сформировался слабый слизистый барьер желудка, свойственный растительноядным млекопитающим, а по высокому кислотовыделению (индуцированному мясной пищей) человек близок к плотоядным [Могильная Г. М., Шубич М. Г., 1984]. В эксперименте на животных образование язвы можно вызвать, вводя в желудок салицилаты, желчные кислоты и другие вещества, нарушающие слизистый барьер. При этом язвенный дефект формируется под влиянием ионов водорода и пепсина, проникающих в слизистую оболочку.
Решающую роль в сохранении высокой резистентности слизистой оболочки желудка играет адекватное нервно-трофическое обеспечение. С ним связано быстрое (за 4 – 6 дней) обновление поверхностных клеток желудка, установленное при помощи современных радиоавтографических методов.
Согласно кортико-висцеральной теории патогенеза язвенной болезни, сформулированной К. М. Быковым и И. Т. Курциным (1949), пусковым фактором в развитии заболевания являются нарушения высшей нервной деятельности, возникающие под действием длительных неблагоприятных экстеро- и интероцептивных влияний. В результате нарушаются взаимоотношения между корой большого мозга и подкорковыми центрами. Это в свою очередь ведет к дезинтеграции вегетативной нервной системы, повышению секреции желудочного сока, длительному спазму сосудов и мышечной оболочки желудка и к развитию дистрофических процессов в слизистой оболочке. Исследования последних лет позволяют дополнить положения кортико-висцеральной теории представлением о том, что сигнализация от внутренних органов первоначально возбуждает соответствующие подкорковые структуры головного мозга и уже затем, за счет активации эмоциональных возбуждений, распространяется на кору большого мозга.
Важную роль в патогенезе язвенной болезни придают гуморальным нарушениям. У больных язвенной болезнью отмечают увеличение концентрации гистамина в крови и в слизистой оболочке желудка, а также снижение активности гистаминазы. Предполагают, что, воздействуя на Н2-рецепторы, гистамин повышает продукцию соляной кислоты париетальными клетками и нарушает микроциркуляцию.
Установлено обострение или появление новых язв в желудке или двенадцатиперстной кишке при длительном введении с лечебной целью гликокортикоидов иликортикотропина. В опытах на собаках показано, что эти гормоны повышают секрецию и кислотность желудочного сока и снижают содержание слизи, играющей защитную роль. Они также тормозят синтез белков и регенерацию клеток. Хорошо известно увеличение продукции этих гормонов при стрессорных воздействиях, играющих роль этиологического фактора в развитии язвенной болезни. Полагают также, что при язвенной болезни возникает недостаток минералокортикоидов, следствием которого является увеличение концентрации плазменного и внутриклеточного калия.
Описано развитие язвы в желудке и двенадцатиперстной кишке при гастринпродуцирующей опухоли (гастринома) поджелудочной железы или желудка (синдром Золлингера – Эллисона), а также при инсуломе и опухолях околощитовидных желез.
Установлено, что простагландины ПГЕ1 и ПГЕ2 оказывая ингибирующее действие на желудочную секрецию, предотвращают развитие экспериментальных язв желудка у крыс. Это действие осуществляется путем угнетения аденилатциклазы и образования цАМФ в слизистой оболочке желудка. Тормозят ульцерогенез также эстрогены,секретин и фактор роста эпидермис а (ФРЭ). Протективный эффект ФРЭ связан с трофическим (стимулирующим пролиферацию) действием, торможением секреции соляной кислоты и стимуляцией синтеза гликозаминогликанов слизи. Установлено, что у больных с активным язвенным процессом снижена концентрация ФРЭ в слюне.
Таким образом, в патогенезе язвенной болезни важную роль играют нейрогенные (особенно трофические) и гуморальные нарушения. Проявление этих нарушений в виде язвы желудка и двенадцатиперстной кишки обусловлено местными неблагоприятными воздействиями и наследственно-конституциональными особенностями.
Нарушения кишечного пищеварения
Кишки выполняют секреторную, моторную, всасывательную, инкреторную и экскреторную функции.
В кишках осуществляется дистантное (полостное) и мембранное (пристеночное) пищеварение. В последние годы выделяют также этап, промежуточный между полостным и мембранным пищеварением: гидролиз пищевых веществ в слое слизистых наложений. Полостное пищеварение происходит в просвете кишок и заключается в разрушении надмолекулярных систем и крупных молекул. Мембранное – на мембране столбчатых клеток кишечных ворсинок. Здесь происходят заключительные этапы гидролиза пищевых веществ и переход к всасыванию. Нарушение дистантного пищеварения зависит прежде всего от расстройства выделения панкреатического сока и желчи. В патологии мембранного пищеварения решающую роль играет нарушение продукции ферментов столбчатыми клетками.
Согласно современным представлениям, кишечные крипты (железы Либеркюна) принимают участие в выделении жидкого компонента кишечного сока и не секретируют ферменты. Ферменты продуцируются столбчатыми клетками кишечных ворсинок. Выделяясь на поверхности клеток, ферменты участвуют в мембранном пищеварении [Уголев А. М., I960]. Основным путем проникновения ферментов в кишечный сок является отторжение и распад столбчатых клеток (в нормальных условиях цикл их обновления составляет 3 дня). Следовательно, слизистую оболочку кишок в целом можно рассматривать как единый железистый аппарат.
Важнейшим отделом тонкой кишки является двенадцатиперстная кишка, в которую изливаются секрет дуоденальных желез, желчь, сок поджелудочной железы.
Опыты Е. С. Лондона с полным или частичным удалением двенадцатиперстной кишки у животных впервые показали ее жизненно важное значение для организма. Установлено, что полная экстирпация двенадцатиперстной кишки у кошек и собак приводит к дуоденальной недостаточности, обусловленной преимущественно выпадением ее инкреторной функции и характеризующейся глубокими нарушениями обмена веществ, функций нервной и эндокринной систем [Уголев А. М., 1973]. В двенадцатиперстной кишке вырабатываются секретин, холецистокинин, мотилин, гастроингибирующий и вазоактивный интестинальные пептиды и другие инкреты, регулирующие деятельность пищеварительной системы, а также описанные А. М. Уголевым арэнтерин и динэнтерин, оказывающие влияние на аппетит, общие метаболические процессы и обладающие нейротропным, в частности гипоталамотропным, действием.
Нарушение пищеварения, связанное с нарушением выделения желчи и панкреатического сока.
Отсутствие желчи (ахолия) или недостаточное ее поступление (гипохолия) в двенадцатиперстную кишку возникают вследствие нарушения желчеобразования и желчевыделения и сопровождаются нарушением переваривания и всасывания жиров, снижением перистальтики кишок и усилением в них процессов гниения и брожения (см. раздел XXII – "Патологическая физиология печени").
Серьезные нарушения пищеварения вызывают изменения панкреатической секреции, так как поджелудочная железа вырабатывает все основные пищеварительные ферменты. Основную массу белков панкреатического сока (свыше 70 %) составляют протеолитические ферменты: трипсин, химотрипсин, эластаза, карбоксипептидаза (А и В) и калликреин. Все эти ферменты, а также фосфолипаза А вырабатываются в неактивном состоянии (в виде зимогенов). Остальные ферменты – липаза, а-амилаза, РНКаза и ДНКаза – секретируются в активной форме.
Нарушение секреции панкреатического сока наблюдается при закупорке или сдавлении протока поджелудочной железы, муковисцидозе (кистозный фиброз поджелудочной железы), остром и хроническом панкреатите или дуодените, при нарушении нервно-гуморальных механизмов регуляции панкреатической секреции. Секреторным нервом поджелудочной железы является блуждающий нерв; гуморальная регуляция осуществляется с помощью секретина, который активирует выделение воды и гидрокарбонатов, холецистокинина (панкреозимина), стимулирующего продукцию ферментов, и панкреатического полипептида, тормозящего ее.
При отсутствии панкреатического сока значительная часть жира не переваривается и выделяется с калом (стеаторея). Нарушение переваривания белков возникает при недостаточной выработке пептидаз поджелудочной железы, а также при нарушении их активации. Так, трипсиноген активируется энтерокиназой кишечного сока и аутокатали-тически, остальные протеолитические ферменты и фосфолипаза А активируются трипсином. При снижении панкреатической секреции нарушается гидролиз нуклеиновых кислот пищи и в меньшей степени – расщепление крахмала.
Панкреатит
Воспаление поджелудочной железы нередко протекает остро и может сопровождаться развитием панкреатического шока, опасного для жизни.
В этиологии панкреатита существенное значение придают злоупотреблению алкоголем и сопровождающему его перееданию, обильному приему жирной пищи, желчным камням и полипам протока поджелудочной железы, механическому повреждению поджелудочной железы и сфинктера печеночно-поджелудочной ампулы при травмах и хирургических вмешательствах, инфекционному фактору (вирусный паротит и гепатит, коксаки, бактериальная инфекция), интоксикация, включая действие некоторых лекарственных средств (иммунодепрессанты, тиазиды, кортикостероиды и др.).
В патогенезе панкреатита важную роль играют повышение секреции панкреатического сока, нарушение оттока секрета, повышение давления в протоке поджелудочной железы, попадание в проток желчи и дуоденального химуса (содержащего энтерокиназу), нарушение микроциркуляции, трофики и барьерных свойств экзогенных панкреоцитов. Основным звеном патогенеза панкреатита является преждевременная активация ферментов (трипсина, калликреина, эластазы, фосфолипазы А) непосредственно в протоках и клетках железы, которая происходит под действием энтерокиназы, желчи или аутокаталитически, при повреждении панкреацитов (рис. 21.3). Следствием этого являются аутолизткани железы, некроз отдельных ее участков и образование токсических (лизолецитин) и биологически активных веществ, в числе которых находятся кинины, обладающие мощным сосудистым и гипотензивным действием. Выход пептидаз и других панкреатических ферментов в кровь приводит к тяжелым расстройствам гемодинамики, дыхания и других жизненно важных функций (панкреатический шок). Важную роль в патогенезе указанных нарушений играет изменение равновесия между протеолитическими ферментами и их ингибиторами. Последние вырабатываются самой поджелудочной железой и другими органами (слюнные железы, легкие) и с успехом применяются для лечения панкреатита.
Определенное значение в патогенезе панкреатита, особенно хронического, принадлежит нарушениям кровообращения в поджелудочной железе (при атеросклерозе, гипертонической болезни), а также иммунологическому (аутоаллергическому) фактору, о чем свидетельствует обнаружение противопанкреатических антител в крови у некоторых лиц, больных холецистопанкреатитом.
В норме, когда рН в антральном отделе желудка снижается до 2 – 2,5, происходит торможение образования гастрина и прекращается продукция НС1. "Кислотный тормоз" срабатывает и при снижении рН до 4,0 в двенадцатиперстной кишке.
Нарушение мембранного пищеварения, всасывательной и выделительной функции кишок
Мембранное (пристеночное) пищеварение осуществляется ферментами, фиксированными на поверхности исчерченной каймы, образованной микроворсинками столбчатых клеток кишечных ворсинок. Характеризуется оно сопряженностью процессов ферментации пищевых веществ и их всасывания, высокой скоростью гидролиза и стерильностью, обусловленной небольшими размерами пор между микроворсинками (10 – 20 нм), в которые не могут проникнуть микроорганизмы. Ферменты мембранного пищеварения синтезируются внутри столбчатых клеток и транслоцируются на поверхность их клеточных мембран (олигосахаридазы, олигопептидазы, фосфатазы и др.), а также частично абсорбируются из химуса (панкреатическая амилаза, липаза и др.).
Расстройства мембранного пищеварения вызывают следующие факторы: нарушение структуры ворсинок и ультраструктуры поверхности столбчатых клеток, изменение ферментативного слоя кишечной поверхности и сорбционных свойств клеточных мембран, а также расстройства перистальтики, при которых нарушается перенос субстратов из полости кишки на ее поверхность. Так, сокращение пищеварительной поверхности за счет атрофии и уменьшения числа ворсинок или микроворсинок обнаружено при холере, спру, илеоеюните, после интенсивного применения некоторых антибиотиков (неомицина), гастроеюностомии и резекции желудка. Примером нарушения ферментативного слоя кишечной поверхности может служить непереносимость молока при дефиците лактазы (?-галактозидазы, КФ 3.2.1.22) или непереносимость сахарозы при недостатке сахаразы (?-глюкозидазы, КФ 3.2.1.48). Снижение сорбционных свойств кишки по отношению к панкреатической амилазе отмечается у детей после резекции желудка.
Для обнаружения нарушений мембранного пищеварения в клинике используют методику аспирационной биопсии слизистой оболочки тонкой кишки с последующим гистохимическим (гистоэнзимологическим) исследованием.
Нарушение выработки ферментов столбчатыми клетками может отразиться также на полостном пищеварении. В особенности это касается энтерокиназы, активирующей панкреатический трипсиноген.
Нарушение всасывательной и выделительной функции кишок.
Всасывание пищевых веществ, гидролизованных, как правило, до стадии мономеров, осуществляется главным образом в тонкой кишке. В процессе мембранного пищеварения гидролиз пищевых веществ и перенос их через мембрану клеток тесно сопряжены. Поэтому к нарушению всасывания приводят все факторы, вызывающие расстройства мембранного пищеварения (см. выше).
Синдром нарушенного кишечного всасывания (мальабсорбции) может быть первичным (наследственным) или вторичным (приобретенным). Наследственный синдром мальабсорбции чаще всего носит характер селективного дефицита ферментов или транспортных переносчиков. Вследствие этого страдает всасывание одного или нескольких близких по своей структуре пищевых веществ. К этой группе нарушений всасывания относят непереносимость моносахаридов (глюкозы, фруктозы, галактозы); недостаточность дисахаридаз (непереносимость лактозы, сахарозы, изомальтозы); недостаточность пептидаз (целиакия или глютеновая болезнь); нарушение всасывания аминокислот (цистинурия, триптофанмальабсорбция, метионинмальабсорбция) и витаминов (цианокобаламина, фолиевой кислоты).
Приобретенный синдром мальабсорбции наблюдается после гастрэктомии, при заболеваниях кишечника (энтероколит, болезнь Крона и др.), поджелудочной железы (панкреатит, муковисцидоз), печени, а также после длительной лучевой и медикаментозной терапии (ятрогенный).
Всасывание пищевых веществ в тонкой кишке может нарушаться при ослаблении полостного пищеварения в желудке и кишках, которое готовит пищу к завершающему гидролизу на мембране клеток и всасыванию, при нарушении двигательной функции кишок и подвижности ворсинок, а также при расстройствах кровообращения и лимфообращения. Расстройства кровообращения нарушают выход всасывающих веществ, их концентрационные градиенты и энергетическое обеспечение активного транспорта. Ослабление активного транспорта питательных веществ возникает также под действием ядов, блокирующих активность ферментов, и при нарушении водно-электролитного равновесия. Особое значение принадлежит ионам натрия и энергии АТФ в активном транспорте глюкозы, аминокислот и других соединений.
Многие из приведенных выше механизмов принимают участие в нарушении всасывания при воспалении тонкой кишки (энтерит), при кишечной непроходимости, авитаминозах и т. д. Повышение проницаемости сосудов кишечной стенки при ее воспалении и гиперемии может сопровождаться всасыванием веществ антигенной природы и сенсибилизацией организма.
С всасывательной функцией кишок тесно связана экскреторная (выделительная) функция. Через кишки выделяются конечные продукты обмена гемоглобина и холестерина, соли металлов, молочная кислота, пурины, некоторые гормоны, фенолы, салицилаты, сульфаниламиды, красители и др. При недостаточности почек компенсаторно усиливается выделение азотистых "шлаков" (мочевина, мочевая кислота и др.).
Нарушение двигательной функции кишок
Нарушение двигательной функции кишок может выражаться усилением или ослаблением перистальтических и локальных (сегментирующих и маятникообразных) движений.
Повышение двигательной функции кишок возникает при воспалительных процессах (энтерит, колит), под влиянием механических или химических раздражений плохо переваренной пищей, в результате действия бактериальных токсинов, при расстройстве нервной и гуморальной регуляции. Сокращение мышечной оболочки кишок усиливается и тормозится при стимуляции блуждающего нерва. Серотонин, вещество Р, гастрин, мотилин активируют перистальтику кишок, а вазоактивный интестинальный пептид и глюкагон тормозят ее.
Примером нарушения нервной и гуморальной регуляции моторики кишок является "синдром раздраженного кишечника", при котором отрицательные эмоции изменяют двигательную и всасывательную функции кишок, становятся причиной возникновения боли и поноса, часто сменяющегося запором. В слизистой оболочке тощей кишки, полученной при помощи аспирационной биопсии, обнаруживают повышенное содержание мотилина.
Усиление перистальтики обычно ведет к ускорению перемещения пищевых масс в кишках, ухудшению их переваривания и всасывания, развитию поноса. Способствуя освобождению организма от токсических веществ (при пищевых интоксикациях) или избытка непереваренной пищи, понос может играть защитную роль. Однако длительный понос, особенно в детском возрасте, ведет к обезвоживанию организма и потере электролитов (Na+, К+), развивается гиповолемия и в тяжелых случаях – кардиоваскулярный коллапс.
Непроходимость кишок. Острая непроходимость кишок (ileus от греч. eileo – поворачиваю, запираю) бываетмеханической (при сдавлении, завороте, закупорке каловыми массами) и динамической (вследствие спазма или паралича мышечной оболочки кишок). Непроходимость возникает вследствие врожденной аномалии, гельминтоза, как послеоперационное осложнение, при недоедании и употреблении недоброкачественной пищи.
Начальные звенья патогенеза непроходимости во многом определяются вызывающими ее причинами. Так,паралитическая непроходимость (послеоперационная и при перитоните) часто бывает обусловлена мощным разрядом симпатоадреналовой системы и активизацией ?- и ?-адренэргических рецепторов, тормозящих сокращение мышечной оболочки кишок. Спастическая непроходимость при карциноиде (серотонинпродуцирующая опухоль из аргентаффиноцитов тонкой кишки) может быть связана с повышенной активностью мышечной оболочки кишок под влиянием избытка серотонина.
Дальнейшее развитие нарушений в организме, вызванных непроходимостью, имеет много общего при непроходимости разной этиологии. Решающую роль при этом играют нарушения водно-электролитного обмена, обусловленные нарушениями секреции (обычно, повышение) и обратного всасывания пищеварительных соков. Возникает рвота, обезвоживание (за сутки может теряться до 5 – 7 л пищеварительных секретов), потеря ионов натрия, калия, водорода, гидрокарбонатов и хлоридов. Развивается гиповолемия, гипотензия и гемоконцентрация, в результате чего нарушается кровообращение и возникает картина, напоминающая шок. Потеря ионов калия способствует развитию атонии кишок.
При непроходимости возникают также нарушения кислотно-основного равновесия. Часто выведение гидрокарбонатов (панкреатический и кишечный соки) превышает утечку ионов водорода (желудочный сок), в результате чего развиваетсянегазовый ацидоз. Развитию ацидоза также способствует ухудшение кровоснабжения и нарушение функции почек. Если преобладает выведение кислого желудочного содержимого, возникает негазовый алкалоз.
Известную роль в патогенезе илеуса играют нарушения переваривания пищи, развитие процессов брожения и гниения, образование токсических веществ и всасывание их в кровь (аутоинтоксикация). Большое значение при этом имеет образование повышенного количества биологически активных веществ, особенно кининов, которые возникают вследствие преждевременной активации панкреатических ферментов (попадание кишечного содержимого из раздутой и переполненной кишки в проток поджелудочной железы).
В развитии всех описанных выше изменений важное место занимают расстройства нейрогуморальной регуляции, возникающие под влиянием рефлекторных раздражителей (растяжение кишок, боль и др.), импульсов с рецепторов пораженной кишки. Они особенно значительны при странгуляционной непроходимости (заворот, грыжа), сопровождающейся пережатием брыжейки и нарушением кровоснабжения пораженного участка кишки.
Кишечная аутоинтоксикация.
В кишках человека, особенно в толстой и нижней части подвздошной кишки, обильная микрофлора, представленная в основном облигатно анаэробными бесспоровыми палочками Bacteroides и Bifidobacterium. Факультативно анаэробные кишечная палочка, молочнокислые бактерии, стрептококки и др. составляют около 10 % микрофлоры. Нормальная микрофлора кишок играет определенную защитную роль, тормозя развитие патогенных микроорганизмов и способствуя выработке естественного иммунитета, что отчетливо показали опыты на гнотобионтах (безмикробных животных). Микрофлора кишок синтезирует витамины.
Вместе с тем содержимое кишок может оказывать токсическое действие, которое обусловлено наличием продуктов гниения (индол, скатол, протеиногенные амины и др.), образующихся в небольших количествах и в нормальных условиях. Однако заметного токсического действия на организм, благодаря барьерной функции кишечной стенки и печени, они не оказывают. Усиление гнилостных процессов при воспалении толстой кишки (колит), запоре, непроходимости кишок и дисбактериозе сопровождается нарушением барьерных функций и интоксикацией организма.
И. И. Мечников впервые предложил использовать микробный антагонизм для борьбы с кишечной аутоинтоксикацией. Идеи Мечникова получили плодотворное развитие в плане борьбы с кишечным дисбактериозом (патологическое изменение состава и распределения микрофлоры в кишках), развивающимся в экстремальных условиях, при ослаблении организма, а иногда под влиянием антибактериальных препаратов.
Нарушения выработки гормонов пищеварительной системы
В настоящее время известно более 20 веществ, являющихся доказанными или предполагаемыми гормонами пищеварительной системы (см. табл. 7).
Наряду с регуляцией процессов пищеварения и всасывания, гормоны пищеварительной системы оказывают влияние на кровообращение, обмен веществ, деятельность нервной и эндокринной систем. Считают, что их функция заключается в поддержании нутритивных (трофических) процессов в организме путем влияния на пищеварение и процессы ассимиляции, трофики, аппетит и др. [Уголев А. И., 1962].
Гормоны пищеварительной системы характеризуются рядом особенностей, имеющих большое значение при патологии пищеварительной системы. В числе этих особенностей следует назвать сходство химической структуры и биологического действия некоторых гормонов. В настоящее время выделено семейство гастрина (различные формы его и холецистокинина) и секретина (включающее также глюкагон, гастроингибирующий и вазоактивный интестинальный пептиды). Из сказанного следует, что сходные нарушения пищеварения и других функций организма могут возникать при избыточной или сниженной продукции различных гормонов пищеварительной системы (табл. 7).
Гормоны вырабатываются клетками диффузной нейроэндокринной системы1, происходящими от нервного гребешка и локализованными в слизистой оболочке пищевого канала и пищеварительных железах, что обусловливает тесную связь с нервной системой. Так, пептиды нервного генеза (соматостатин, вещество Р, эндорфины, энкефалины) обнаружены в клетках, вырабатывающих гормоны пищеварительной системы, а вазоактивный интестинальный пептид, холецистокинин, гастрин и бомбезин обнаружены в центральной нервной системе и в нервных волокнах.
Считают, что ряд гормонов одновременно являются нейротрансмиттерами и могут достигать органов-мишеней как с кровью, так и нервным путем. Получены также данные о возможной роли нарушения выработки гормонов пищеварения при патологии нервной системы, в связи с чем говорят о "нейрокишечной оси".
Гормоны пищеварительной системы тесно связаны также с гипоталамо-гипофизарной системой и с другими эндокринными органами. Соматостатин, тормозящий выработку соматотропина, ингибирует также продукцию некоторых гормонов пищеварения. Связь с поджелудочной железой выражается в отчетливом влиянии гастроингибирующего пептида и секретина на продукцию инсулина и глюкагона, что обусловливает важную роль гормонов пищеварения в патогенезе ожирения и исхудания. Стимуляция гастрином, холецистокинином и глюкагоном выработки кальцитонина определяет их участие в патогенезе нарушений кальциевого обмена.
Еще одной важной особенностью гормонов пищеварительной системы является поступление их в кровь и во внешние секреты, что обусловливает возможность влияния на клетки слизистой оболочки со стороны просвета пищеварительных органов и тесную связь нарушений внутренней и внешней секреции этих органов.
По многим указанным признакам с гастроинтестинальными гормонами сходны инкреты слюнных желез (см. выше), которые также должны быть отнесены к гормонам пищеварительной системы.
Установлено, что нарушения продукции гормонов пищеварительной системы приводят к серьезным расстройствам пищеварения, метаболизма и деятельности различных органов и систем организма. Наиболее изучены патологические процессы, связанные с возникновением опухолей, источником которых являются гормонпродуцирующие клетки органов пищеварения.
Термин "диффузная нейроэндокринная система" введен Пирсом (1977) в развитие его концепции об APUD-системе и концепции Фейртера о диффузном эндокринном эпителиальном органе.
