
Уроки Хімії / Старовойтова І. Ю. Хімія. Розробки уроків для 9 класу
.pdf
І семестр |
Клас |
Дата проведення уроку |
|
|
|
Урок 23
Тема уроку. Швидкість хімічної реакції, залежність швидкості реакції від різних факторів
Цілі уроку: формувати уявлення учнів про швидкість хімічної реакції, впливнанеїрізнихфакторів;показатизалежністьшвидкості хімічної реакції від природи речовини, температури, концентрації; розвивати навички й уміння складати рівняння хімічних реакцій, розпізнавати типи реакцій за рівняннями реакції; формувати навички розв’язання задач із використанням поняття «швидкість хімічної реакції».
Тип уроку: вивчення нового матеріалу.
Форми роботи: фронтальне опитування, демонстраційний експеримент, індивідуальна робота, розповідь учителя.
Обладнання: Періодична система хімічних елементів Д. І. Менделєєва, таблиця розчинності, ряд активності металів, плакат із правилами техніки безпеки в кабінеті хімії.
Демонстрація 5. Залежність швидкості хімічної реакції металів із хлоридною кислотою від природи металу й концентрації кислоти.
Хід уроку
І. Організація класу
ІІ. Актуалізація опорних знань. Мотивація навчальної діяльності
1. Розв’язування задач
Усі учні в зошитах, а двоє — за картками біля дошки, розв’язують задачі: 1) У 1000 г розчину сульфатної кислоти міститься 5 моль кислоти. Обчис-
літь масову частку кислоти в розчині.
2) Обчисліть кількість речовини натрій гідроксиду в 1000 г 25%-го розчину. Відповіді учнів перевіряються, порівнюються з відповідями, отриманими
в класі.
2. Фронтальне опитування
yy Що таке масова частка розчиненої речовини? yy Що таке молярна концентрація?
yy Які фактори впливають на розчинність речовин у воді? yy Назвіть умови протікання хімічних реакцій.
yy Чи можна стверджувати, що з киснем реагують усі метали?
yy Чому реакцію «іржавіння» натрію можна побачити відразу після потрап ляння натрію на повітря, а іржавіння заліза у вологому повітрі відбувається значно повільніше?
ІІІ. Вивчення нового матеріалу |
|
|
||
Швидкість хімічної реакції |
|
|
|
|
ν=± |
C2 −C1 |
= ± |
∆C |
. |
|
|
|||
|
t1 −t2 |
∆t |
||
Реакції протікають у разі зіткнення молекул реагентів. Швидкість реакції визначається кількістю зіткнень та ймовірністю того, що вони приведуть до хімічного перетворення. Число зіткнень визначається концентраціями реагентів, а ймовірність реакції — енергією молекул, що зіштовхуються.
Фактори, що впливають на швидкість хімічних реакцій
1. Природа реагентів.
41

Демонстрація 5. У три пробірки з розчином хлоридної кислоти зануримо по шматочку цинку, магнію й заліза. Чому швидкість виділення бульбашок водню в пробірках різна? (Для пояснення звертаємося до ряду активності металів.)
2. Концентрація.
Демонстрація 5. У три пробірки наливаємо розчин хлоридної кислоти, розведеної у співвідношеннях 1:2, 1:5 і 1:10. У кожну додаємо гранулу цинку. У розчині з більшою чи з меншою концентрацією швидкість реакції вища?
(Цю закономірність у 1867 р. установили К. Гульдберг і П. Вааге як закон діючих мас.)
3. Температура.
Правило Вант-Гоффа. Енергія активації.
4. Поверхня зіткнення реагентів.
Демонстрація 5. У дві пробірки наллємо розчин хлоридної кислоти. Потім в одну з них зануримо шматочок заліза, а в другу додамо шпателем порошок заліза. У якій пробірці швидкість хімічної реакції більша?
5. Каталіз.
IV. Первинне застосування одержаних знань
Завдання 1
Аналізуючи причини різної швидкості хімічних реакцій, учень дійшов висновку:
а) швидкість реакцій зростає з підвищенням температури; б) швидкість реакцій прямо пропорційна концентрації реагентів; в) із часом швидкість реакцій збільшується;
г) швидкість реакцій можна змінити, використовуючи каталізатор. Поясніть, у якому з пунктів учень припустився помилки.
Завдання 2
а) Концентрація одного з реагентів через 20 секунд після початку реакції становила 0,1 моль/л, а через 30 секунд — 0,02 моль/л. Обчисліть середню швидкість цієї реакції.
б) Обчисліть середню швидкість реакції, якщо відомо, що концентрації речовини змінилися так:
1) з 0,5 моль/л до 0, 2 моль/л за 20 секунд; 2) з 0,15 моль/л до 0,1 моль/л за 30 секунд.
в) Унаслідок підвищення температури на 30 °С для реакції, температурний коефіцієнт якої дорівнює 3, швидкість реакцій збільшується:
1) у 3 рази; 2) у 6 разів; 3) у 9 разів; 4) у 27 разів.
Поясніть, як ви проводили розрахунок.
г) У разі підвищення температури на 20 °С для реакції, що має температурний коефіцієнт 2, швидкість реакції збільшиться:
1) у 2 рази; 2) у 3 рази; 3) у 4 рази; 4) у 6 разів.
Дайте пояснення своїм розрахункам.
д) Реакція за температури 40 °С протікає за 180 с. Температурний коефіцієнт реакції дорівнює 3. За скільки секунд завершиться ця реакція за температури 60 °С?
V. Домашнє завдання
Опрацювати матеріал параграфа, відповісти на запитання до нього, виконати вправи.
42

І семестр |
Клас |
Дата проведення уроку |
|
|
|
Урок 24
Тема уроку. Тепловийефектреакції.Екзотермічнійендотермічніреакції. Термохімічні рівняння
Цілі уроку: розширити уявлення про хімічні реакції на прикладі ендотермічних і екзотермічних реакцій; ознайомити учнів з поняттями «тепловий ефект хімічної реакції», «термохімічні рівняння»; формувати навички й уміння складати термохімічні рівняння реакцій, розв’язувати задачі з їх використанням.
Тип уроку: комбінований урок засвоєння знань, умінь і навичок і творчого застосування їх на практиці.
Форми роботи: фронтальне опитування, демонстраційний експеримент, групова робота, розповідь учителя.
Обладнання: Періодична система хімічних елементів Д. І. Менделєєва, таблиця розчинності, ряд активності металів, плакат із правилами техніки безпеки в кабінеті хімії.
Демонстрація 6. Реакції екзо- й ендотермічні.
Хід уроку
І. Організація класу
ІІ. Актуалізація опорних знань. Мотивація навчальної діяльності
1. Хімічний диктант
(Учні по ланцюжку відповідають на запитання.) yy Які типи хімічних реакцій ви знаєте?
yy За якими ознаками класифікують хімічні реакції? yy Які реакції називаються реакціями сполучення? yy Що відбувається під час реакції розкладу?
yy Які реакції називаються реакціями заміщення? yy Що відбувається під час реакцій обміну?
yy Які типи хімічних реакцій включає класифікація за тепловим ефектом?
2. Перевірка домашнього завдання
Під час хімічного диктанту двоє учнів пишуть його на дошці.
ІІІ. Вивчення нового матеріалу
Тепловий ефект хімічних реакцій. Термохімічні рівняння
Завдання 1. Визначте тип хімічної реакції за тепловим ефектом хімічної ре-
акції. (Рівняння записані на дошці або проектуються на екрані.) N2 +O2 =2NO −180 кДж
2HI +Cl2 = I2 +2HCl +Q
N2 +3H2 =2NH3 +83 кДж
H2S = H2 +S −40,2 кДж
CO +H2O = CO2 +H2 +Q
2CO +O2 =2CO2 +570 кДж
З великої кількості хімічних реакцій можна вибрати ті, що протікають мимовільно, і ті, для яких необхідна додаткова енергія ззовні.
Які реакції називаються екзотермічними?
Екзотермічними є реакції, що протікають із виділенням тепла. Які реакції називаються ендотермічними?
Ендотермічними є реакції, що протікають із поглинанням тепла.
Теплота, що поглинається або виділяється в процесі хімічної реакції, називається тепловим ефектом реакції.
43

Тепловий ефект показує різницю між умістом внутрішньої енергії вихідних речовин і продуктів реакції. Умовно можна записати:
∆Q = −∆H = ∑Hвих −∑Hпрод.
Хімічне рівняння, у якому визначено тепловий ефект хімічної реакції, на-
зивається термохімічним рівнянням. (Звертаємо увагу на рівняння, записані на дошці.)
Завдання 2
Укажіть тип хімічних реакцій. Які з цих реакцій — екзотермічні? 1) а) 4KClO3 →3KClO4 +KCl; ∆H = −297 кДж
б) C2H4 +H2 →C2H6; ∆H = −137,8 кДж в) MnO2 +2C →Mn +2CO; ∆H = +293 кДж
г) 2NaOH +H2SO4 →Na2SO4 +2H2O; ∆H = −290 кДж 2) а) H2O +C +132 кДж→CO +H2
б) 2CO +O2 →2CO2 +282 кДж
в) N2 +3H2 −92 кДж→2NH3 г) H2 +I2 →2HI −52 кДж
IV. Первинне застосування одержаних знань (керована практика)
Такі рівняння можна використати для хімічних розрахунків.
Завдання 1. У процесі згоряння 12 г вуглецю виділяється 393 кДж тепла. Запишіть термохімічне рівняння.
C +O2 →CO2 +393 кДж моль або
моль або
C +O2 →CO2 ; ∆H = −393 кДж.
Завдання 2. Для взаємодії азоту з киснем необхідно 180,5 кДж тепла. Запишіть термохімічне рівняння.
N2 +O2 →2NO −180,5 кДж моль або
моль або
N2 +O2 →2NO; ∆H = +180,5 кДж.
Завдання 3. Обчисліть, яка кількість тепла виділиться внаслідок спалювання 1 м3 метану, якщо термохімічне рівняння горіння метану:
CH4 +2O2 →CO2 +2H2O +891 кДж моль
моль
ν(CH4 ) = |
V |
= |
1000 л |
=44,6 моль. |
|
V |
22,4 л моль |
||||
|
|
|
|||
|
m |
|
|
|
Q =891 кДж моль 44,6 моль =39776 кДж.
моль 44,6 моль =39776 кДж.
Відповідь: 39 776 кДж.
Завдання 4. Обчисліть, яка маса цинку окиснилася, якщо в результаті реакції поглинулося 174,5 кДж/моль тепла. Термохімічне рівняння:
2Zn +O2 →2ZnO; ∆H = +34,9 кДж
ν(Zn) = 174,534,9 =5 (моль). m(Zn) =5 64 =320 (г).
Відповідь: 320 г цинку.
Для виконання наступного завдання клас об’єднується в групи, після виконання відповіді обговорюються, коригуються, оцінюються учнями в класі.
Завдання 5. Уявіть себе хіміком-технологом на заводі й охарактеризуйте хімічну реакцію за всіма відомими вам ознаками. Запропонуйте умови, за яких швидкість реакції буде максимальною.
а) N2 +3H2 →2NH3; ∆H <0
б) SO2 +O2 →2SO3; ∆H <0
Завдання 6. Учень спалює однакову кількість сірки на повітрі й у циліндрі
зкиснем. Де реакція протікатиме швидше? Чому?
V. Домашнє завдання
44

І семестр |
Клас |
Дата проведення уроку |
|
|
|
Урок 25
Тема уроку. Оборотні й необоротні реакції. Хімічна рівновага Цілі уроку: формуватиуявленняучнівпрохімічнурівновагу;ознайомити
з класифікацією реакцій на оборотні й необоротні; показати необхідність зсуву хімічної рівноваги; формувати уявлення про фактори, що впливають на зсув хімічної рівноваги.
Тип уроку: вивчення нового матеріалу.
Форми роботи: фронтальне опитування, самостійна робота, розповідь учителя.
Обладнання: Періодична система хімічних елементів Д. І. Менделєєва, таблиця розчинності, ряд активності металів.
Хід уроку
І. Організація класу
ІІ. Актуалізація опорних знань. Мотивація навчальної діяльності
1. Перевірка домашнього завдання, обговорення відповідей учнів про каталітичні реакції
2. Двоє учнів працюють біля дошки.
За необхідності звертаємося до класу за доповненням відповідей учнів. Завдання. Розгляньте реакцію й дайте відповіді на запитання.
1) Fe +CuCl2 = Cu +FeCl2 2) Fe +O2 = Fe2O3
а) Розставте коефіцієнти в рівняннях реакції.
б) Запропонуйте умови, необхідні для того, щоб реакція почалася. Як ми побачимо, що вона протікає?
в) Запропонуйте прийоми прискорення цих реакцій.
г) Поясніть на молекулярному рівні, чому в разі підвищення температури швидкість більшості реакцій зростає.
д) Як ми використовуємо в побуті вплив температури й тиску на швидкість хімічних реакцій?
3. Фронтальна бесіда
Наведіть приклади використання екзотермічних реакцій у життєдіяльності людини.
Наведіть приклади екзотермічних реакцій, які становлять небезпеку для людини.
ІІІ. Вивчення нового матеріалу
Хімічна рівновага
Назвіть фактори, що впливають на швидкість хімічної реакції. Розгляньмо рівняння реакції:
N2 (газ) +H2 (газ) ↔ NH3 (газ) + ∆Q
Дайте характеристику цієї хімічної реакції. (Реакція сполучення, каталі-
тична, екзотермічна, окисно-відновна, оборотна)
Оборотні реакції — це такі хімічні реакції, які одночасно протікають і в прямому, і у зворотному напрямах.
Згадаймо умови необоротності хімічних реакцій йонного обміну. (Утворен-
ня нерозчинної речовини, газоподібної речовини, малодисоційованої речовини, наприклад води)
Розповідь учителя
Хімічна рівновага, її динамічний характер. Стан хімічної рівноваги кількісно характеризується константою рівноваги.
45

Константа рівноваги залежить від температури та природи реагентів.
Способи зсуву рівноваги. Принцип Ле Шательє
1. Тиск. Збільшення тиску (для газів) зміщає рівновагу в бік реакції, що веде до зменшення об’єму (тобто до утворення меншого числа молекул газоподібних речовин).
2. Температура. Підвищення температури зміщає рівновагу в бік ендотермічної реакції (тобто в бік реакції, що протікає з поглинанням теплоти).
3. Збільшення концентрації вихідних речовин і вилучення продуктів зі сфери реакції зміщає рівновагу в бік прямої реакції.
4. Каталізатори не впливають на стан рівноваги.
IV. Первинне застосування одержаних знань
Застосуймо ці положення для реакції синтезу амоніаку:
N2 (газ) +H2 (газ) ↔ NH3 (газ) +92,4 кДж
Оптимальні умови проведення синтезу амоніаку: t° > 400 °С, kat — Fe, Р↑. Концентрація азоту й водню підвищується за рахунок рециркуляції азото-
водневої суміші.
Виконання завдань на картці
Завдання 1
Укажіть, у який бік і чому зміститься рівновага реакції в разі: а) підвищення температури:
CaCO3 ↔ CaO +CO2; ∆H >0
SO2 +H2O ↔ H2SO4; ∆H <0
б) підвищення тиску:
N2 +3H2 ↔2NH3; ∆H <0
2H2 +O2 ↔2H2O; ∆H <0
Спробуйте пояснити, у яких випадках температура й тиск не впливатимуть на зсув хімічної рівноваги. Чи є серед наведених реакцій такі реакції?
Завдання 2
Серед наведених реакцій укажіть ті, для яких підвищення тиску зміщує хімічну рівновагу вправо. Укажіть номери правильних відповідей за зростанням:
а) 2CO(газ) +O2 (газ) ↔2CO2 (газ)
б) CO(газ) +Cl2 (газ) ↔ COCl2 (газ)
в) N2 (газ) +O2 (газ) ↔2NO(газ)
Завдання 3
Використовуючи принцип Ле Шательє, поясніть, у яких системах у разі підвищення температури рівновага зміститься:
а) уліво:
N2 +O2 ↔2NO −180 кДж
2HI +Cl2 ↔ I2 +2HCl +Q
N2 +3H2 ↔2NH3 +83 кДж
б) управо:
H2S ↔ H2 +S −40,2 кДж
CO +H2O ↔ CO2 +H2 +Q
2CO +O2 ↔2CO2 +570 кДж
(Див. додаток на с. 50)
V. Домашнє завдання
Опрацювати матеріал параграфа, відповісти на запитання до нього, виконати вправи.
46

І семестр |
Клас |
Дата проведення уроку |
|
|
|
Урок 26
Тема уроку. Процеси окиснення, відновлення. Окисники, відновники Цілі уроку: розширити уявлення про хімічні реакції на прикладі ре-
акцій окиснення й відновлення; сформувати знання про процеси окиснення й відновлення; показати єдність двох протилежних процесів: окиснення й відновлення — як властивості атомів віддавати та приєднувати електрони; ознайомити учнів із прикладами окисників і віднов ників.
Тип уроку: комбінований урок засвоєння знань, умінь і навичок і творчого застосування їх на практиці.
Форми роботи: фронтальна робота, виконання тренувальних вправ, самостійна робота, розповідь учителя.
Обладнання: Періодична система хімічних елементів Д. І. Менделєєва, таблиця розчинності, ряд активності металів.
Хід уроку
І. Організація класу
ІІ. Перевірка домашнього завдання. Актуалізація опорних знань
1. Перевірка домашнього завдання, обговорення відповідей учнів
2. Фронтальна робота
yy Що таке ступінь окиснення?
yy Які правила необхідно згадати, щоб визначити ступінь окиснення атомів у речовині?
yy Розрахуйте ступінь окиснення Нітрогену в сполуках:
NH3, NO, N2O3, NO2, HNO3, HNO2.
yy Запишіть процеси передачі електронів, у результаті яких ступінь окиснення Нітрогену зміниться від 0 до –3; +3; +4.
а) N0 +3e− →N−3 б) N0 −3e− →N+3 в) N0 −4e− →N+4
yy Подумайте, у яких випадках ідеться про процеси окиснення. (б, в) yy Подумайте, у яких випадках ідеться про процеси відновлення. (а)
ІІІ. Засвоєння нових знань, умінь і навичок
Окиснення, відновлення
Окиснення — це процес віддачі електронів атомами (ступінь окиснення збільшується).
Відновлення — це процес приєднання електронів атомами (ступінь окиснення зменшується).
При цьому слід пам’ятати, що ці два процеси взаємно доповнюють один одного і протікають одночасно, тому реакції зі зміною ступеня окиснення називаються окисно-відновними (ОВР).
Розглянемо на простому прикладі:
2Fe2+3O3−2 +3C0 →3C+4O2−2 +4Fe0 Fe+3 +3e− →Fe0
C0 −4e− →C+4
Ступінь окиснення Феруму змінилася від +3 до 0, тобто відбулося відновлення заліза з ферум(ІІІ) оксиду, але паралельно протікає процес окиснення Карбону від ступеня окиснення 0 до +4.
У цьому випадку C0 — відновник, а Fe2O3 — окисник.
47

IV. Застосування одержаних знань (практика на прикладах)
Завдання 1. Допишіть рівняння, укажіть процеси окиснення й відновлення. Укажіть окисник і відновник.
(Учні біля дошки по ланцюжку виконують завдання, увесь клас працює в зошитах і звіряє відповіді з дошкою.)
1) Mg +O2 →
2) Al +Br2 → 3) Zn +H2SO4 →
4) P +O2 → 5) Mg +Cl2 →
6) Mg +HCl →
7) Ca +O2 → 8) H2 +O2 → 9) Al +I2 →
10)Na +Cl2 →
11)P +Ca →
12)FeO +H2 →
13)Li +N2 →
14)N2 +H2 →
Додаткове завдання. Укажіть тип хімічної реакції.
Завдання 2. Сульфур може проявляти ступені окиснення –2, +4, +6. Наведіть приклади сполук Сульфуру й укажіть, окисні чи відновні властивості вони мають.
Самостійна робота (під керівництвом учителя, з обговоренням результатів у класі)
Завдання. Допишіть ОВР, укажіть окисник і відновник, процеси відновлення й окиснення.
Варіант І
а) CH4 +O2 →
б) WO3 +H2 →
в) Zn +HCl →
г) Mg +HNO3 →
Варіант ІІ
а) H2S +O2 →
б) Cr2O3 +H2 →
в) Fe +HCl →
г) Ca +HNO3 →
V. Домашнє завдання
Опрацювати матеріал параграфа, відповісти на запитання до нього, виконати вправи.
Творче завдання. Згадайте й наведіть приклади ОВР, з якими ми ознайомилися в курсах природознавства й хімії 7, 8 класу.
48

І семестр |
Клас |
Дата проведення уроку |
|
|
|
Урок 27
Тема уроку. Окисно-відновні реакції, їх значення Цілі уроку: розширити знання учнів про хімічні реакції на прикладі
окисно-відновнихреакцій;закріпитинавичкискладанняхі- мічнихрівняньнаприкладінайпростішихокисно-відновних реакцій, застосування методу електронного балансу для розміщення коефіцієнтів у рівняннях хімічних реакцій, що протікають зі зміною ступеня окиснення.
Тип уроку: узагальнення й систематизації знань, умінь і навичок. Форми роботи: виконання тренувальних вправ, складання схем.
Обладнання: періодична система хімічних елементів Д. І. Менделєєва.
Хід уроку
І. Організація класу
II. Перевірка домашнього завдання. Актуалізація опорних знань
Перевіряємо домашнє завдання, коментуємо помилки. На дошці записано схеми реакцій.
Завдання 1. Допишіть рівняння хімічних реакцій, укажіть серед них ті, що протікають зі зміною ступеня окиснення атомів:
H2O +Na →
H2SO4 +CuO →
Fe2O3 +H2 →
NaOH +HCl →
Na2CO3 +H2SO4 →
Zn +H3PO4 →
Як називаються хімічні реакції, що протікають зі зміною ступеня окиснення атомів хімічних елементів, які входять до складу сполук?
III. Закріплення знань, умінь і навичок
Завдання 2. Для обраних ОВР запишіть схеми передачі електронів і вкажіть окисник і відновник.
Звертаємо увагу учнів на те, що число відданих і прийнятих електронів має бути однаковим. Для цього обчислюємо найменші загальні кратні для прийнятих і відданих електронів.
Обчислюємо додаткові множники до кожного рівняння: 2H+ +2e− →H20
2Na0 −2e− →2Na+
Ці коефіцієнти переносимо в рівняння реакції: 2H2O +2Na →2NaOH +H2
Завдання 3. Учні аналогічно під керівництвом учителя розставляють коефіцієнти в рівняннях реакції:
а) Fe2O3 +H2 →
б) Zn +H3PO4 →
IV. Самостійна робота
Завдання 4. Складіть алгоритм дій для розміщення коефіцієнтів у окисновідновних реакціях.
49

Завдання 5. Розставте коефіцієнти в рівняннях реакцій, укажіть окисники й відновники в окисно-відновних реакціях:
а) KClO3 →KCl +O2
б) HgO →Hg +O2
в) Ag +HNO3 → AgNO3 +NO2 +H2O
V. Домашнє завдання
Розставте коефіцієнти в рівняннях реакцій, укажіть окисники й відновники в окисно-відновних реакціях:
a) Mg +H2SO4 → б) PH3 +O2 →
в) Cu +HNO3 →Cu(NO3 )2 +NO2 +H2O
Опрацювати матеріал параграфа, відповісти на запитання до нього, виконати вправи.
Додаток до уроку 25
Завдання 4
Покажіть, у який бік зміститься в системі рівновага внаслідок зміни зовнішніх умов:
1) Підвищення температури:
a) CH4 ↔ C +2H2 −Q
б) CaCO3 ↔ CaO +CO2 −Q
2) Підвищення температури та збільшення концентрації речовин, що вступили в реакцію:
а) SO2 +H2O ↔ H2SO4 +Q б) CO2 +C ↔2CO −Q 3) Зменшення тиску:
a) N2O4 ↔2NO2 б) 2NO +Cl2 ↔2NOCl2
4. Поясніть, як агрегатний стан речовини може вплинути на зсув рівноваги оборотної реакції.
Завдання 5
Розгляньте рівняння реакцій оборотних процесів:
а) 2CO(газ) +O2 (газ) ↔2CO +Q
б) 3H2 (газ) +N2 (газ) ↔2NH3 (газ) в)





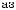







г) C2H6 (газ) ↔2C(тв.) +3H2 (газ) −Q
а) Укажіть екзотермічну й ендотермічну реакції.
б) На яку із запропонованих реакційних систем впливатиме тиск?
в) Куди зміститься рівновага реакцій а і б унаслідок підвищення температури й тиску?
г) Запропонуйте зовнішні впливи, з допомогою яких рівновага реакцій в і г зміститься в бік продуктів реакції.
Завдання 6
Запишіть рівняння зворотної реакції. Чому швидкість цих процесів знач ною мірою залежить від тиску?
а) SO2 +O2 →SO3
б) NO +O2 →NO2
Поясніть, чому хімічну рівновагу називають динамічною.
50
