
Уроки Хімії / Старовойтова І. Ю. Хімія. Розробки уроків для 9 класу
.pdf
І семестр |
Клас |
Дата проведення уроку |
|
|
|
Урок 42–43
Тема уроку. Узагальнення й систематизація знань про вуглеводні, взаємозв’язок між вуглеводнями; Проміжне оцінювання навчальних досягнень з теми «Вуглеводні».
Цілі уроку: узагальнитийсистематизуватизнанняучнівпроненасичені вуглеводні, їх хімічні властивості, застосування; показати взаємозв’язок між вуглеводнями; узагальнити та скоригувати знання учнів з теми «Вуглеводні»; визначити рівень навчальних досягнень учнів з теми, розуміння основних понять, уміння використовувати їх на практиці.
Тип уроку: узагальнення й систематизації знань; контролю й коригування знань, умінь і навичок.
Форми роботи: групова робота; письмова самостійна робота за варіантами. Обладнання: картки-завдання.
Хід уроку
І. Організація класу
ІІ. Перевірка домашнього завдання. Актуалізація опорних знань. Мотивація навчальної діяльності
Заслуховування повідомлень учнів про використання полімерів, екологічні проблеми утилізації виробів з полімерних матеріалів.
ІІІ. Узагальнення й систематизація знань про вуглеводні
Для організації роботи на уроці учні об’єднуються в шість малих груп, причому кожні дві групи одержують однакові завдання з метою взаємоперевірки та взаємокоригування відповідей.
Завдання 1. Напишіть рівняння реакцій, з допомогою яких можна здійснити перетворення:
а) CH4 →CH3Cl →C2H6 →C2H4 →(−CH2 −CH2 −)n б) CaC2 →C2H2 →C2H4 →C2H5Cl →C4H10
в) C2H5OH →C2H4 →C2H4Cl2 →C2H3Cl3
Завдання 2. Для запропонованої речовини напишіть структурну формулу, структурні формули двох гомологів, двох ізомерів, положення кратного зв’язку, двох структурних ізомерів. Дайте назви всім речовинам за номенкла-
турою IUPAC.
а) 2-метил-2-пентен; б) 3-метил-1-гексен; в) 3,3-диметил-1-пентен. Завдання 3. Розв’яжіть задачі.
а) Обчисліть об’єм кисню, що потрібен для спалювання суміші 5 л етину й 6 л пропану (н. у.).
б) Обчисліть об’єм вуглекислого газу, що виділиться в результаті спалювання суміші 4 л етену і 3 л метану (н. у.).
в) Обчисліть об’єм водню, що приєднається до суміші 3 л етену й 5 л етину
(н. у.). |
|
Завдання 4. Напишіть реакцію полімеризації: |
|
а) вінілхлориду C2H3Cl; б) тетрафлуоретену C2F4; |
в) пропену C3H6. |
Виконані в групах завдання обговорюються в класі, за необхідності розглядаються біля дошки.
ІV. Письмова контрольна робота
Учитель розподіляє учнів за варіантами й нагадує їм зміст завдань, час виконання, ключові моменти оформлення відповідей і систему оцінювання:
yy завдання 1–6 — тестові, кожне завдання оцінюється в 0,5 бала, загалом перші шість завдань — 3 бали;
81

yy завдання 7–9 оцінюються по 2 бали кожне, загалом за дев’ять правильно виконаних завдань — 9 балів;
yy завдання 10 пропонується виконувати учням, які претендують на оцінку 12 балів, оцінюється в 3 бали.
Отже, максимальна оцінка за правильно виконану роботу становить 12 балів. Час на виконання роботи — 40 хв.
Варіант І |
|
|
||
Загальна формула етиленових вуглеводнів — … |
||||
2. Гібридизація — це явище змішування… з утворенням однакових... |
||||
3. Назвіть тип ізомерії, характерний для алкінів: |
||||
а) структурна; |
|
|
||
б) положення кратного зв’язку; |
||||
в) просторова; |
|
|
||
г) міжкласова. |
|
|
||
4. Установіть відповідність. |
||||
1. CH3 −CH = CH2 |
А. 2-метилпропан |
|||
2. CH3 −CH −CH3 |
Б. Пропен |
|||
|
|
|
|
|
CH3 |
|
|
||
3. CH ≡ C −CH −CH3 |
В. 1-хлор-1-бутен |
|||
|
|
|
|
|
|
CH3 |
|
|
|
4. CH3 −CH2 −CH = CHCl |
Г. 3-метил-1-бутин |
|||
5. Реакція описується рівнянням: |
||||
|
|
C2H2 +2Cl2 →C2H2Cl4 |
||
Укажіть, який об’єм хлору приєднається до 5 л ацетилену: |
||||
а) 5 л; |
|
|
||
б) 10 л; |
|
|
||
в) 2,5 л; |
|
|
||
г) 22,4 л. |
|
|
||
6. Метан застосовують: |
|
|
||
а) як паливо; |
|
|
||
б) як ліки; |
|
|
||
в) для зварювання металів; |
||||
г) як сировину хімічного синтезу. |
||||
7. Напишіть два ізомери та два найближчі гомологи до речовини: |
||||
|
|
CH3 −CH2 = CH −CH3 |
||
|
|
|
|
|
|
|
|
CH3 |
|
8. Обчисліть об’єм етану, |
який можна одержати в результаті взаємодії |
|||
10 л етилену й 5 л водню (н. у.). (5 л) |
||||
9. Визначте молекулярну формулу вуглеводню, якщо масова частка Гідрогену в ньому становить 17,2 %, а відносна густина за азотом — 2,07. (C4H10 )
10. Напишіть рівняння реакцій, необхідних для здійснення перетворень:
C2H6 →C2H4 →C2H5Cl →C4H10 →CO2
Варіант ІІ
1. Загальна формула гомологічного ряду алканів — ...
2. Гомологічний ряд — це послідовність речовин, що подібні за… та відрізняються...
3. Назвіть тип ізомерії, характерний для алкенів: а) структурна; б) положення кратного зв’язку; в) просторова; г) міжкласова.
4. Установіть відповідність.
1. CH2 |
= CH −CH2 −CH3 |
А. 3-метил-1-бутин |
|
2. CH3 |
−C(CH3 )2 −CH3 |
Б. 2-хлор-2-метилпропан |
|
3. CH3 |
−CCl −CH3 |
В. 1-бутен |
|
|
|
|
|
|
CH3 |
|
|
82

4. CH3 −CH −C ≡ CH |
Г. 2,2-диметилпропан |
CH3
5. Реакція описується рівнянням:
C2H4 +H2 →C2H6
Укажіть об’єм водню, необхідний для повного гідрування 7 л етилену за рівнянням:
а) 7 л; б) 6 л; в) 14 л; г) 3,5 л.
6. Ацетилен застосовують: а) як паливо; б) як ліки;
в) для зварювання металів; г) як сировину хімічного синтезу.
7. Напишіть два ізомери й два найближчі гомологи до речовини:
8. Напишіть рівняння реакцій, необхідних для здійснення перетворень: CaC2 →C2H2 →C2H4 →C2H4Cl2
C2H5OH
9. Визначте молекулярну формулу вуглеводню, якщо масова частка Карбо-
ну в ньому становить 90 %, а відносна густина за гелієм дорівнює 30. (C H |
) |
||||
|
|
|
9 |
12 |
|
10. Обчисліть об’єм повітря, що знадобиться для спалювання суміші, яка |
|||||
складається з 5 л етилену й 7 л ацетилену (н. у.). (32,5 л) |
|
|
|||
Варіант ІІІ |
|
|
|
||
1. Загальна формула ацетиленових вуглеводнів — ... |
|
|
|||
2. Ізомерія — це явище існування речовин з однаковими… і різним... |
|
|
|||
3. Назвіть тип ізомерії, характерний для алканів: |
|
|
|||
а) структурний; |
|
|
|
||
б) положення кратного зв’язку; |
|
|
|||
в) просторовий; |
|
|
|
||
г) міжкласовий. |
|
|
|
||
4. Установіть відповідність: |
|
|
|
||
1. CH3 −CH −CH3 |
А. 1-хлор-2-метилбутан |
|
|
||
|
|
|
|
|
|
|
CH3 |
|
|
|
|
2. CH3 |
−CH = CH −CH3 |
Б. 1-бутен |
|
|
|
3. CH3 |
−CH −C ≡ C −CH3 |
В. 2-метилпропан |
|
|
|
|
|
|
|
|
|
|
CH3 |
|
|
|
|
4. CH2Cl −CH −CH2 −CH3 |
Г. 4-метил-2-бутин |
|
|
||
5. Реакція описується рівнянням:
CH4 →C +2H2
83

Укажіть об’єм водню, що виділиться в результаті термічного розкладу ме тану:
а) 22,4 л; б) 6 л; в) 12 л; г) 24 л.
6. Етилен застосовують: а) у медицині;
б) для зварювання металів; в) як розчинник;
г) як сировину хімічного синтезу.
7. Напишіть два ізомери й два найближчі гомологи до речовини: CH2 = CH −CH −CH3
CH3
8. Напишіть рівняння реакцій, необхідних для здійснення перетворень:
C →CH4 →CH3Cl →C2H6 →C2H4
9. Визначте молекулярну формулу вуглеводню, якщо масова частка Карбону в ньому становить 85,68 %, а відносна густина за вуглекислим газом дорів-
нює 1,27. (C4H8 )
10. Обчисліть об’єм етилену, який можна одержати з 25 л ацетилену й 15 л вод-
ню (н. у.). (15 л)
V. Підбиття підсумків уроку
Підбиття підсумків роботи груп, оцінювання роботи учнів на уроці.
VІ. Домашнє завдання
Повторити матеріал про вуглеводні.
84

І семестр |
Клас |
Дата проведення уроку |
|
|
|
Урок 44
Тема уроку. Метанол, етанол, гліцерин Цілі уроку: формувати в учнів уявлення про оксигеновмісні органічні
сполуки; ознайомити їх з поняттям «функціональна група» на прикладі гідроксильної групи спиртів; формувати знання учнів про метанол, етанол і гліцерин як органічні сполуки, що містять функціональну гідроксильну групу; ознайомити учнів з молекулярними, електронними та структурними формулами спиртів, фізичними властивостями,зумовлениминаявністюфункціональноїгідроксильної групи.
Тип уроку: вивчення нового матеріалу.
Форми роботи: розповідь учителя, робота з підручником (таблицею). Обладнання: схема класифікації оксигеновмісних органічних сполук,
моделі атомів метанолу, етанолу, гліцерину.
Хід уроку
І. Організація класу
ІІ. Аналіз тематичної контрольної роботи
Робота із класом з виявлення типових помилок, індивідуальна робота над помилками.
ІІІ. Актуалізація опорних знань. Мотивація навчальної діяльності
Фронтальна робота
1) Які хімічні елементи найчастіше містяться в складі органічних сполук? 2) На які класи поділяють вуглеводні?
3) Наведіть приклади відомих вам органічних сполук, що містять Оксиген, Нітроген та інші хімічні елементи.
IV. Вивчення нового матеріалу
Оксигеновмісні органічні сполуки
1. Вступне слово вчителя
Органічні сполуки, що містять у своєму складі атоми Оксигену, називаються оксигеновмісними.
Оксиген, як правило, входить до складу органічних сполук у вигляді груп атомів. Такі групи атомів називають функціональними групами.
Функціональні групи — це групи атомів, що визначають хімічні й фізичні властивості речовин.
Наприклад:
−OH — гідроксильна група; −COH — карбонільна; −COOH — карбоксильна.
До складу сполук може входити одна або кілька функціональних груп (однакових або різних).
Органічні речовини, молекули яких містять одну або кілька функціональних гідроксильних груп, з’єднаних з вуглеводнями, називаються спиртами.
Загальна формула спиртів: R −(OH)n .
2. Класифікація спиртів
За природою вуглеводневого радикала: yy насичені;
yy ненасичені; yy ароматичні.
85

За кількістю гідроксильних груп: yy одноатомні;
yy багатоатомні.
3. Номенклатура спиртів
Відповідно до систематичної номенклатури, назви спиртів походять від назв відповідних вуглеводнів з додаванням суфікса -ол. Нумерацію карбонового скелета починають із того краю, ближче до якого знаходиться гідроксильна група.
Найпростішим представником гомологічного ряду одноатомних насичених спиртів (алканолів) є метанол:
CH3 −OH — метанол (метиловий спирт, мурашиний спирт); C2H5 −OH — етанол (етиловий спирт);
C3H7 −OH — пропанол (пропіловий спирт) і т. д.
Положення гідроксильної групи вказують цифрою перед назвою спирту:
CH3 |
−CH2 −CH2 −OH |
1-пропанол |
|
CH3 |
−CH −CH3 |
2-пропанол |
|
|
|
|
|
ОН 1-пропанол і 2-пропанол є ізомерами положення функціональної групи.
Прикладом багатоатомних спиртів є:
Кількість гідроксильних груп у молекулі позначається числівниками ди- (ді-), три-, тетра- і т. д.
4. Будова молекул спиртів
Зв’язок C −H — ковалентний слабкополярний.
Зв’язок O −H — ковалентний сильнополярний.
Молекула спирту полярна, тому між молекулами утворюються водневі зв’язки.
Згадайте, як утворюється водневий зв’язок між молекулами води. Роздивіться рисунок у підручнику, де зображено водневий зв’язок між мо-
лекулами метанолу. Отже, спирти:
yy це рідини за кімнатної температури;
yy добре розчиняються в полярних молекулах води.
V. Підбиття підсумків уроку
yy Які нові поняття ви вивчили сьогодні на уроці?
yy Чи мають для вас практичне значення нові знання, отримані на уроці?
yy Метанол — рідина без кольору, з різким запахом, добре розчинна у воді в будь-яких співвідношеннях, отруйна.
yy Етанол — рідина без кольору, з різким запахом, добре розчинна у воді в будьяких співвідношеннях, отруйна.
yy Гліцерин — грузла рідина без кольору й запаху, солодка на смак, добре розчинна у воді.
yy Гомологічний ряд насичених одноатомних спиртів — спирти, утворені насиченими вуглеводнями, у яких один атом Гідрогену заміщений на функціональну гідроксильну групу.
Оцінювання роботи учнів на уроці
VI. Домашнє завдання
86

І семестр |
Клас |
Дата проведення уроку |
|
|
|
Урок 45
Тема уроку. Хімічні властивості спиртів. Використання спиртів. Отруйність спиртів, їх шкідливий вплив на організм людини
Цілі уроку: вивчити хімічні властивості спиртів на прикладі метанолу, етанолу й гліцерину (реакції повного окиснення, взаємодії з металевим натрієм); показати зв’язок хімічних властивостей спиртів з наявністю функціональної гідроксильної групи; формувати знання учнів про використання спиртів; показати їх отруйність, довести шкідливий вплив метанолу й етанолу на організм людини.
Тип уроку: комбінований урок засвоєння знань, умінь і навичок і творчого застосування їх на практиці.
Форми роботи: розповідьучителя, міні-конференція,демонстраційнийекс- перимент, лабораторний експеримент.
Демонстрація 14. Взаємодія етанолу з натрієм. Демонстрація 15. Взаємодія гліцерину з натрієм. Лабораторний дослід 8. Досліди з гліцерином: розчинність у воді, взаємодія з купрум(II) гідроксидом.
Хід уроку
І. Організація класу
ІІ. Перевірка домашнього завдання. Мотивація навчальної діяльності
1. Учні повторюють біля дошки особливості будови спиртів, зумовлені наявністю групи −OH.
1) Чи відрізнятимуться властивості спиртів і вуглеводнів? Чому?
2) Яка група атомів визначає властивості спиртів: вуглеводневий радикал чи гідроксильна група?
ІІІ. Вивчення нового матеріалу
Хімічні властивості спиртів
1. Вступне слово вчителя
Спирти — нейтральні речовини, незважаючи на наявність гідроксильної групи, спирти не змінюють забарвлення індикаторів, не вступають у хімічні реакції з водними розчинами лугів і розведених кислот. Лабораторні спиртівки заповнюють 98%-м спиртом. Який висновок можна зробити про горючість спиртів?
2. Хімічні властивості спиртів. Окиснення, взаємодія з натрієм
1) Повне окиснення (горіння)
C2H5OH +3,5O2 →2CO2 +3H2O +Q
Аналогічно учні записують рівняння горіння для метанолу та гліцерину. 2) Зсув електронної густини в молекулі спирту спричиняє рухливість атома
Гідрогену в гідроксильній групі, тому цей атом Гідрогену може заміщатися металевим натрієм.
Демонстрація 14. Взаємодія 96%-го спирту з металевим натрієм Що спостерігаємо?
2C2H5OH +2Na →2C2H5OH +H2
2C2H5OH +2Na →2C2H5ONa +H2
Аналогічно учні самостійно записують рівняння взаємодії метанолу з металевим натрієм.
Демонстрація 15. Взаємодія гліцерину з натрієм Чи відбуватиметься хімічна реакція безводного гліцерину з металічним на-
трієм? За якими ознаками можна судити про протікання хімічної реакції?
87

Завдання 1. Запишіть рівняння взаємодії гліцерину з металевим натрієм у співвідношенні 1:1, 1:2, 1:3.
3. Хімічні властивості спиртів: дегідратація
Наявність гідроксильної групи визначає хімічні властивості спиртів, зокрема їх взаємодію з галогеноводнями.
C2H5OH +HCl →2C2H5Cl +H2O
Учні аналогічно записують реакцію метанолу із бромоводнем. Важливе практичне значення має реакція дегідратації спиртів.
Дегідратація — відщеплення води, відбувається під дією концентрованої сульфатної кислоти.
За температури понад 140 °С протікає внутрішньомолекулярна дегідратація з утворенням подвійного зв’язку:
CH3 −CH2 −OH →CH2 = CH2 +H2O
етен
За температури менш ніж 140 °С протікає міжмолекулярна дегідратація з утворенням етерів:
CH3 −OH +CH3 −OH →CH3 −O −CH3 +H2O
диметиловий етер
Завдання 2. Запишіть рівняння реакції одержання діетилового етеру.
IV. Первинне застосування отриманих знань
Лабораторний дослід 8. Досліди із гліцерином 1) У хімічну склянку з 1 мл гліцерину порціями по 1 мл, перемішуючи, до-
дамо 10 мл води. Що спостерігаємо?
Висновок: гліцерин добре розчиняється у воді.
2) Приготуємо в пробірці купрум(II) гідроксид, додамо до нього розчин гліцерину й перемішаємо. Що спостерігаємо? Осад розчинився, розчин набув яскраво-синього кольору.
Висновок: дія купрум(II) гідроксиду — якісна реакція на багатоатомні спирти. 3) Зобразіть структурні формули 1-бутанолу, 2-метил-1-пропанолу. 4) Напишіть реакцію внутрішньомолекулярної дегідратації 1-пропанолу. 5) Обчисліть масу етанолу, що повністю прореагувала з 5 моль металевого
натрію.
V. Міні-конференція «Застосування спиртів.
Шкідливий вплив метанолу й етанолу на організм людини»
1. Повідомлення учнів про отруйність спиртів 2. Розгляд схем застосування спиртів, що ґрунтується на їх фізичних і хі-
мічних властивостях 3) Застосування етанолу: у медицині як дезінфікуючий засіб, як сировина
хімічного синтезу, у фармацевтичній хімії, як розчинник та ін. 4) Застосування гліцерину: як зволожувальний засіб для виготовлення фар-
мацевтичних препаратів і парфумерних засобів, як сировина хімічних виробництв, у харчовій промисловості, для одержання динаміту, гліфталевих смол
VI. Підбиття підсумків уроку
Завершальне слово вчителя
Метанол і етанол — отруйні речовини, на цьому базується їх використання як дезінфікуючих засобів.
Метанол (метиловий спирт) — сильна й небезпечна для людини отрута, що проникає в організм під час вдихання повітря, насиченого його парами, і навіть крізь шкіру.
Етанол — речовина наркотичного типу, що пригнічує центральну нервову систему.
Оцінювання роботи учнів на уроці
VII. Домашнє завдання
Опрацювати матеріал параграфа, відповісти на запитання до нього, виконати вправи.
88

І семестр |
Клас |
Дата проведення уроку |
|
|
|
Урок 46
Тема уроку. Оцтова кислота. Функціональна карбоксильна група. Використання оцтової кислоти
Цілі уроку: формувати знання учнів про карбоксильну функціональну групу на прикладі оцтової кислоти; ознайомити учнів зі структурною й електронною формулами оцтової кислоти.
Тип уроку: вивчення нового матеріалу.
Форми роботи: розповідь учителя, евристична бесіда, лабораторний експеримент.
Лабораторний дослід 9. Дія оцтової кислоти на індикатори .
Хід уроку
І. Організація класу
ІІ. Перевірка домашнього завдання. Мотивація навчальної діяльності
1. Здійсніть схему перетворень:
CH4 →CH3Cl →C2H2 →C2H5Cl →C2H5OH
CH4 →CH3Cl →C2H6 →C2H5Cl →C2H5OH (Учні працюють біля дошки.)
2. Запишіть формули двох ізомерів і двох найближчих гомологів речовини 2-метил-1-пропанол.
3. Евристична бесіда
1) Що називають функціональною групою? Які функціональні групи ви знаєте?
2) Які фізичні й хімічні властивості спиртів пов’язані з наявністю функціональної гідроксильної групи?
3) Як діють етиловий і метиловий спирти на лакмус, метилоранж, фенол фталеїн?
4) Запишіть формулу оцтової кислоти. (З допомогою вчителя учні записують формулу на дошці.) У цій формулі наявна гідроксигрупа. Чи можна стверджувати, що фізичні й хімічні властивості оцтової кислоти будуть такими ж, як в етилового спирту? Розгляньмо дослід.
4. Лабораторний дослід 9. Дія оцтової кислоти на індикатори
Ми знаємо, що спирти не діють на індикатори. Проведемо експеримент. У три пробірки наллємо по 1 мл розчину оцтової кислоти. У першу додамо кілька крапель лакмусу, у другу — метилоранжу, у третю — фенолфталеїну. Як змінилося забарвлення індикаторів? Для порівняння паралельно візьмемо три пробірки з хлоридною кислотою й виконаємо той же експеримент.
Порівняйте спостереження й зробіть висновок.
Висновок: оцтова кислота діє на індикатори так само, як і неорганічні кислоти.
ІІІ. Вивчення нового матеріалу
Насичені одноосновні карбонові кислоти
1. Органічні речовини, молекули яких містять одну або кілька функціональних карбоксильних груп, з’єднаних з вуглеводнями, називаються карбоновими кислотами.
Загальна формула карбонових кислот: R −(COOH)n .
2. Класифікація карбонових кислот
За природою вуглеводневого радикала: yy насичені;
yy ненасичені; yy ароматичні.
89
За кількістю гідроксильних груп: yy одноосновні (монокарбонові);
yy двохосновні (дикарбонові).
3. Номенклатура одноосновних карбонових кислот
Відповідно до систематичної номенклатури, назви кислот походять від назв відповідних вуглеводнів з додаванням закінчення -ова. Нумерацію карбонового скелета починають з атома Карбону карбоксильної групи.
Найпростішим представником гомологічного ряду одноосновних насичених карбонових кислот є:
H −COOH — метанова кислота (мурашина кислота);
CH3 −COOH — етанова кислота (оцтова кислота);
C2H5 −COOH — пропанова кислота (пропіонова кислота);
C3H7 −COOH — бутанова кислота (масляна кислота) і т. д.
4. Будова молекули оцтової кислоти
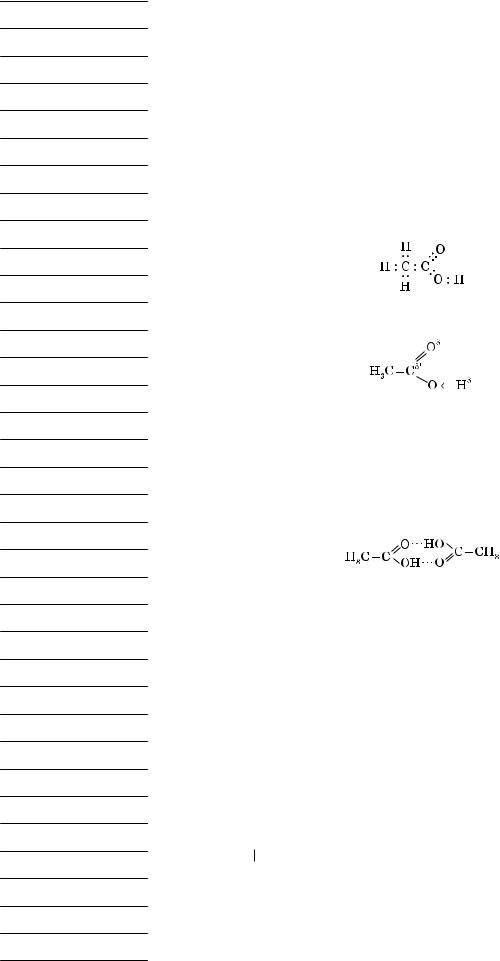
Зв’язок C −H — ковалентний слабкополярний. Зв’язки C = O і O −H — ковалентні сильнополярні.
У результаті зсуву електронної густини подвійного зв’язку до Оксигену атом Карбону одержує надлишковий позитивний заряд. Через це електронна густина в гідроксильній групі значною мірою зміщена до атома Оксигену. Атом Гідрогену у зв’язку з цим легко відщеплюється у вигляді протона, зумовлюючи кислотні властивості.
5. Фізичні властивості оцтової кислоти
Молекула оцтової кислоти полярна, тому між молекулами утворюються водневі зв’язки з утворенням димерів.
Оцтова кислота — це безбарвна рідина з різким запахом, температури кипіння й плавлення низькі (температура плавлення — 16,6 °С, температура кипіння — 118,1 °С, густина — 1,049 г/см3), добре розчинна у воді (розчин оцтової кислоти у воді називається оцтом).
6. Застосування
yy Виробництво барвників; yy розчинник;
yy харчова промисловість;
yy виробництво ацетатного волокна;
yy виробництво лікарських препаратів та ін.
IV. Первинне застосування отриманих знань
1. Запишіть рівняння дисоціації оцтової кислоти.
CH3 −COOH →CH3 −COO− +H+
2. Чому оцтова кислота — одноосновна кислота?
3. Назвіть нижченаведені сполуки за систематичною номенклатурою:
а) CH3 −CH −COOH
CH3
б) CH3 −CH2 −CH2 −COOH
Чи можна вважати ці сполуки гомологами? ізомерами?
Побудуйте найближчі гомологи та ізомери речовини б), назвіть їх за систематичною номенклатурою.
V. Домашнє завдання
90
