
Уроки Хімії / Старовойтова І. Ю. Хімія. Розробки уроків для 9 класу
.pdf
І семестр |
Клас |
Дата проведення уроку |
|
|
|
Урок 34
Тема уроку. Гомологиметану.Молекулярнітаструктурніформули.Значення моделювання в хімії. Фізичні властивості гомологів метану
Цілі уроку: формувати знання учнів про гомологію, гомологічні ряди на прикладіалканів;ознайомитиучнівзноменклатуроюалканів за міжнародною номенклатурою IUPAC; розвивати навички й уміння складати структурні формули й назви органічних сполук на прикладі алканів; формувати навички складання назв насичених вуглеводнів за структурними формулами та структурнихформул—заназвами;розкритизначенняметоду моделювання для вивчення будови й властивостей речовин; ознайомити з фізичними властивостями гомологів метану; показати зв’язок будови та властивостей молекули метану.
Тип уроку: комбінований урок засвоєння знань, умінь і навичок і творчого застосування їх на практиці.
Форми роботи: фронтальна робота, самостійна робота, демонстраційний експеримент.
Обладнання: таблиця алканів.
Демонстрація 7. Моделі молекул вуглеводнів.
Хід уроку
І. Організація класу
ІІ. Перевірка домашнього завдання. Актуалізація опорних знань
1. Евристична бесіда
1) Назвіть причину використання метану як палива. 2) Назвіть види хімічного зв’язку в молекулі метану.
3) Чому молекула метану має не пласку, а тетраедричну будову? 4) Обчисліть масову частку Карбону й Гідрогену в молекулі метану. 5) Чому число атомів Гідрогену в молекулах вуглеводнів парне? 6) Які ланцюги можуть утворювати один з одним атоми Карбону? 7) Які речовини називаються ізомерами?
2. Повідомлення учнів про застосування метану, складання схеми
ІІІ. Вивчення нового матеріалу
1. Гомологи метану
Демонстрація 7. Моделі молекул вуглеводнів Зберемо модель молекули метану CH4.
Подовжимо карбоновий ланцюг на один атом Карбону й необхідне число атомів Гідрогену. Що змінилося?
Аналогічно подовжимо карбоновий ланцюг на два та три атоми Карбону. При цьому утворюються моделі молекул вуглеводнів, які мають подібну
будову, але різну довжину ланцюга. Запишіть їх молекулярні формули: C2H6,
C3H8, C4H10.
Розгляньте отримані молекули. Чим відрізняються отримані моделі молекул за складом і будовою?
61

Формулюємо визначення:
Гомологія — це явище існування подібних за будовою та властивостями органічних речовин, що відрізняються на групу −CH2.
Група −CH2 називається гомологічною різницею. Речовини, що подібні за будовою й відрізняються одна від одної на одну або кілька груп −CH2, утворюють гомологічні ряди.
Речовини, що входять в один гомологічний ряд, називаються гомологами. Розглянемо таблицю гомологічного ряду алканів з назвами (у підручнику або роздавальному матеріалі). Цей ряд називають гомологічним рядом метану. Знайдіть закономірність між кількістю атомів Карбону й Гідрогену в моле-
кулах алканів.
Загальна формула гомологів метану — CnH2n+2.
Завдання. Для вуглеводню складу C4H10 складіть формули двох найближчих гомологів і можливих ізомерів. (Записуємо їх структурні формули на дошці й у зошитах.)
2. Номенклатура алканів
Розповідь учителя
Ознайомлення з міжнародною номенклатурою органічних сполук IUPAC
1. У структурній формулі вуглеводню знаходимо головний ланцюг. Головний ланцюг — це найдовша безперервна послідовність атомів Карбону.
2. Частинки, що не ввійшли до головного ланцюга, — замісники. 3. Головний ланцюг нумерується з того кінця, який ближче й де більше за-
місників.
4. В основу назв і головного ланцюга, і замісників покладено корінь, що вказує на кількість атомів Карбону в головному ланцюзі.
5. У назві головного ланцюга алканів до кореня додається суфікс -ан. 6. У назві вуглеводневих замісників до кореня додається суфікс -ил.
7. Назва насиченого вуглеводню: номер атома головного ланцюга, біля якого є замісник, — назва замісника + назва головного ланцюга + суфікс -ан. Наприклад:
8. Якщо до головного ланцюга приєднано кілька однакових замісників, то в назві цифрою вказується положення кожного з них, а перед назвою замісника ставляться префікси: ди- (два замісники), три- (три замісники), тетра- (чотири замісники) і т. д.
Якщо два однакові замісники перебувають біля одного атома головного ланцюга, то в назві його номер пишеться двічі.
9. Якщо до головного ланцюга приєднано кілька різних замісників, то в назві вони перелічуються за абеткою.
Увага! Важливо уважно перевіряти правильність вибору головного ланцюга. Складаючиструктурнуформулузаназвою,спочаткусліднаписатиголовний ланцюг, потім пронумерувати його (у довільному порядку), потім до головного ланцюга «приєднати» замісники. Наприкінці до кожного атома Карбону допи-
суються атоми Гідрогену (з огляду на те, що валентність Карбону — IV).
IV. Первинне застосування отриманих знань
Тренувальні вправи
yy Дайте назви за номенклатурою IUPAC ізомерам C5H12. yy Складіть структурні формули речовин за їх назвами:
а) 3-етилгептан; б) 2,4-диметилгексан; в) 2-метил-4-етилгептан; г) 3,3-диметил-5-етилоктан.
V. Домашнє завдання
62

І семестр |
Клас |
Дата проведення уроку |
|
|
|
Урок 35
Тема уроку. Етилен і ацетилен. Молекулярні та структурні формули, фізичні властивості
Цілі уроку: формувати знання учнів про гомологічні ряди алкенів і алкінів на прикладі етилену й ацетилену; ознайомити учнів із природоюкратногозв’язку,новимивидамиізомерії —ізоме- рією положення кратного зв’язку, міжкласовою ізомерією.
Тип уроку: комбінований урок засвоєння знань, умінь і навичок і творчого застосування їх на практиці.
Форми роботи: фронтальна робота, лабораторна робота.
Обладнання: схеми будови етилену й ацетилену, куле-стрижневі моделі етилену й ацетилену, фрагмент медіафільму «sp2 - і sp-гі бридизація електронів у атомі Карбону».
Хід уроку
І. Організація класу
ІІ. Перевірка домашнього завдання. Актуалізація опорних знань
1. Перевірка домашнього завдання біля дошки — формули ізомерів гексану та їх назви
2. Фронтальна бесіда
1) Сформулюйте основні положення теорії хімічної будови.
2) Що таке гібридизація? Що відбувається з електронними орбіталями атома Карбону в процесі sp3 -гібридизації?
3) Як утворюється σ-зв’язок? Яка його міцність?
4) Як взаємозалежні властивості алканів з будовою їхніх молекул?
ІІІ. Вивчення нового матеріалу
1. Загальна характеристика ненасичених вуглеводнів
(Упродовж уроку заповнюється порівняльна схема.)
Характеристика |
Алкани |
Алкени |
Алкіни |
|
|
|
|
Загальна формула |
CnH2n+2 |
CnH2n |
CnH2n−2 |
Гомологічний ряд |
CH4, C2H6, C3H8, |
C2H4, C3H6, |
C2H2, C3H4, |
|
C4H10... |
C4H8... |
C4H6... |
yy Чому гомологічні ряди алкенів і алкінів починаються з вуглеводнів, що містять два атоми Карбону, а не один, як в алканів?
(За загальною формулою виходять формули речовин CH2 і CH0, що не відповідає валентності Карбону)
Лабораторний дослід 6. Складання моделей молекул вуглеводнів.
1. Складіть моделі молекул етану, етилену й ацетилену.
2. Зробіть висновок про відмінності в будові й міцності зв’язків у цих молекулах.
Пропонуємо учням фрагмент медіафільму про гібридизацію електронів і зв’язки в молекулах етану, етену й етину.
Види зв’язків |
C −H σ-зв’язок |
C −H σ-зв’язок |
C −H σ-зв’язок |
|||
|
C −C σ-зв’язок |
C = C σ- і π-зв’язки |
C ≡ C σ- і 2 π-зв’язки |
|||
Довжина зв’язку |
0,154 |
нм |
0,133 |
нм |
0,120 |
нм |
|
|
|
|
|
|
|
Кут зв’язку |
109° 28′ |
120° |
|
180° |
|
|
|
|
|
|
|
|
|
Енергія зв’язку |
374,4 |
кДж/моль |
611,1 |
кДж/моль |
834,3 |
кДж/моль |
|
|
|
|
|
|
|
π-зв’язок — це ковалентний зв’язок, що виникає внаслідок перекривання орбіталей по обидва боки від лінії, що з’єднує центри атомів, які зв’язуються.
63

π-зв’язок менш міцний, ніж σ-зв’язок. Розгляньмо моделі молекул етену й етину.
Чому рухливість атомів Карбону навколо кратного зв’язку обмежена?
Вид ізомерії 1. Ізомерія карбонового скелета
2. Ізомерія положення C = C і C ≡ C кратних зв’язків — вид ізомерії, за якого змінюється положення кратного зв’язку в головному ланцюзі
Номенклатура 1. У головному ланцюзі обов’язково має бути кратний зв’язок
2.Нумерація головного ланцюга починається з того кінця, до якого ближче кратний зв’язок
3.Положення кратного зв’язку вказується після назви вуглеводню
Суфікс у назві головного ланцюга для алкенів — -ен(-єн). Суфікс у назві головного ланцюга для алкінів — -ин(-ін)
*Однією з причин різноманіття органічних сполук є міжкласова ізомерія — явище існування ізомерів з різних класів органічних сполук. Наприклад, для алкенів міжкласовими ізомерами будуть циклоалкани: бутен — циклобутан. Зобразіть структурні формули цих сполук — і переконаєтеся в правильності твердження про їх ізомерію.
Для алкінів міжкласовими ізомерами будуть, наприклад, органічні сполуки, що містять два подвійні зв’язки. Запропонуйте структурні формули таких ізомерів для бутину й бутадієну.
2. Фізичні й хімічні властивості алкенів і алкінів
(Заповнюється порівняльна таблиця під керівництвом учителя.)
Характе- |
Алкани |
Алкени |
Алкіни |
ристика |
|
|
|
|
|
|
|
Фізичні |
C2H6 — етан. |
C2H4 — етилен. |
C2H2 — ацетилен. |
властивості |
Газ, без запаху, |
Газ, зі слабким запахом, |
Газ, без запаху, |
|
tпл = –182,8 °С, |
tпл = –169,5 °С, |
tпл = –80,8 °С |
|
tкип = –88,6 °С, незнач |
tкип = –103,8 °С, не- |
(за 170 кПа), |
|
ною мірою розчи- |
значною мірою роз- |
tкип = –83,8 °С (возгон- |
|
няється у воді, кра- |
чиняється у воді, |
ка), слабко розчинний |
|
ще — в органічних |
краще — в органічних |
у воді, добре — в ацето- |
|
розчинниках |
розчинниках |
ні під тиском |
|
|
|
|
У разі збільшення кількості атомів Карбону в молекулі вуглеводню їх температури кипіння й плавлення підвищуються.
IV. Первинне застосування одержаних знань
Тренувальні вправи
1. Напишіть структурні формули речовин (по ланцюжку біля дошки):
а) етен; |
б) етин; |
в) пропен; |
г) пропін; |
д) 2-метил-1-бутен; |
е) 3-метил-1-бутин. |
2. Самостійна робота під керівництвом учителя з наступною усною пере віркою
yy Дайте назви речовинам за структурними формулами:
а) CH = C −CH3 |
|
б) CH2 = CH −CH −CH3 |
||
CH3 |
|
|
|
|
|
CH3 |
|||
в) CH ≡ C −CH −CH3 |
г) CH3 −C ≡ C −CH3 |
|||
|
|
|
|
|
CH3 |
|
|
|
|
Складіть формули двох гомологів для речовин: |
||||
а) CH ≡ CH |
б) CH2 = CH −CH2 −CH3 |
|||
yy Складіть формули ізомерів, дайте їм назви: |
||||
а) C4H8; |
б) C5H8. |
|
|
|
V. Домашнє завдання
64

І семестр |
Клас |
Дата проведення уроку |
|
|
|
Урок 36
Тема уроку. Хімічні властивості алканів Цілі уроку: формуватизнанняучнівпрохімічнівластивостіалканів;роз-
крити хімічні властивості алканів, їх реакцію з розчинами кислот, лугів, калій перманганату; показати значення реакцій горіння, повного й часткового окиснення для алканів; розвивати навички й уміння складання рівнянь хімічних реакцій на прикладі хімічних властивостей алканів.
Тип уроку: вивчення нового матеріалу.
Форми роботи: самостійнаробота,розповідьучителя,демонстраційнийексперимент.
Обладнання: моделі молекул вуглеводнів.
Демонстрація 8. Горіння парафінів, визначення якісного складу за продуктами горіння.
Демонстрація 11. Реакція насичених вуглеводнів з розчинами кислот, лугів, калій перманганату.
Хід уроку
І. Організація класу
ІІ. Перевірка домашнього завдання. Актуалізація опорних знань. Мотивація навчальної діяльності
1. Самостійна робота
Варіант І
1. Дайте назви сполукам:
2. Напишіть структурні формули вуглеводнів: а) 2-метил-2-пентен; б) 2,2,5,5-тетраметил-3-гептин.
Варіант ІІ
1. Дайте назви сполукам:
2. Напишіть структурні формули таких вуглеводнів: а) 2,2,3-триметил-3-гексен; б) 2-метил-3-гексин.
65

2. Перевірка домашнього завдання
1. Запишіть рівняння горіння етану, етену, етину.
C2H6 +3,5O2 →2CO2 +3H2O; ∆H = −1427,7 кДж
C2H4 +3O2 →2CO2 +2H2O; ∆H = −1322,9 кДж
C2H2 +2,5O2 →2CO2 +H2O; ∆H = −1255,5 кДж
2. Обчисліть і порівняйте об’єми кисню, необхідні для спалювання 5 л етану, етену й етину.
ІІІ. Вивчення нового матеріалу
1. Визначення якісного складу вуглеводнів
Демонстрація 8. Горіння парафінів, визначення якісного складу вуглеводнів за продуктами горіння
1) Окиснення парафіну в присутності купрум(II) оксиду.
2) Як можна довести наявність у продуктах окиснення вуглекислого газу? (Реакція з вапняною водою, яка каламутніє)
3) Як можна довести наявність у продуктах окиснення води? (Безводний купрум(II) сульфат у результаті утворення кристалогідрату змінює забарвлення з білого на блакитне)
4) Запишіть рівняння реакції:
C14H30 +21,5O2 →14CO2 +15H2O
CO2 +Ca(OH)2 →CaCO3 +H2O
7H2O +CuSO4 →CuSO4 7H2O
За продуктами горіння можна визначити і якісний, і кількісний склад сполук. Розгляньмо це на прикладі інших вуглеводнів.
2. Хімічні властивості алканів
Складаємо загальну схему, що характеризує хімічні властивості алканів. 1) Горіння:
CnH2n+2 + 3n2+1 O2 →nCO2 +(n+1)H2O 2) Галогенування:
C |
H |
|
+Cl2 , hv |
|
H |
|
+Cl2 , hv |
|
H |
|
Cl |
+Cl2 , hv |
2n+2 |
→C |
2n+1 |
Cl →C |
2n |
→... |
|||||||
n |
|
−HCl |
n |
|
−HCl |
n |
|
2 |
−HCl |
|||
Дегідрування (відщеплення H2 ):
CnH2n+2 t°, kat→CnH2n +H2
+Cl2 , hv→C |
Cl |
2n |
|
−HCl |
n |
|
|
Демонстрація 11. Реакція насичених вуглеводнів з розчинами кислот, лугів, калій перманганату.
1) Одержимо метан з натрій ацетату:
CH3COONa +NaOH →CH4 +Na2CO3
2) Одержаний метан пропустимо крізь розчини хлоридної кислоти, натрій гідроксиду, калій перманганату. Що відбувається?
Висновок: насичені вуглеводні не взаємодіють із розчинами кислот, лугів, калій перманганату.
Одержання алканів
1) Природні джерела (нафта, газ, вугілля)
2) nCO +(2n+1)H2 →CnH2n+2 +nH2O 3) Синтез Вюрца (подовження ланцюга)
CnH2n+1 −Cl +CmH2m+1 −Cl +2Na →CnH2n+1 −CmH2m+1 +2NaC
CH3 −Cl +CH3 −Cl +2Na →CH3 −CH3 +2NaCl
CH3 −Cl +C2H5 −Cl +2Na →C3H8 +2NaCl
IV. Первинне застосування одержаних знань
Тренувальні вправи
1. Використовуючи схеми, що характеризують хімічні властивості алканів, запишіть рівняння реакцій, які характеризують хімічні властивості:
а) етану:
C2H6 +2,5O2 →2CO2 +3H2O
66

C2H6 +Cl2 hv→C2H5Cl +HCl
C2H6 t°→C2H4 +H2
б) пропану.
2. Алгоритм визначення молекулярної формули (на картці) 1) Визначити молекулярну масу за однією з формул:
M = D(A) M(A);
M =ρ Vm; M = VmVm ; M = Mr .
2) Якщо зазначено приналежність до гомологічного ряду: yy записати загальну формулу CnH2n+2;
yy M =12n+2n+2;
yy обчислити n за відомою М.
3) Якщо дано масові частки елементів у складі речовини, обчислити за формулою масової частки кількість атомів кожного елемента:
ω(E) = A(E) n(E) 100%.
M
4) За продуктами згоряння із загального рівняння хімічної реакції горіння вуглеводнів:
CxHy + 4x4+ y O2 →xCO2 + 2y H2O
x = ν((CO2 )) ; ν CxHy
y= 2ν( (H2O)) .
νCxHy
3. Практика на прикладах Учні виконують два-три індивідуальні завдання в зошиті, учитель консуль-
тує.
1) Відносна молекулярна маса алкану — 58. Визначте його формулу.
M =14n+2 =58 n =4
C4H10 — бутан.
2) 1 л алкану має масу 1,965 г. Визначте його формулу.
M =22,4 1,965 =44 (г/моль). 14n+2 =44;
n =3. C3H8 — пропан.
3) M(CxHy ) =100
ω(C) =84 %=0,84
ω(H) =16 %=0,16
ω(C) = 12Mx ;
x = M ω(C) ; 12
x = 100 0,84 =7. 12
ω(H) = My ; y = M ω(H);
y =100 0,16 =16.
C7H16
67

4) DH2 (CxHy ) =39
ω(C) =92,31%=0,9231
ω(H) =7,69%=0,0769
M = DH2 2 =39 2 =78 (г/моль).
x = 78 0,9231 =6; 12
y =78 0,0769 =6.
C6H6
5) DH2 (CxHy ) =15
ω(C) =80 %=0,8
ω(H) =20 %=0,2
M = DH2 2 =15 2 =30 (г/моль). x = 30120,8 =2;
y =30 0,2 =6.
C2H6
6) 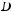
ω(C) =93,75%=0,9375
ω(H) =6,25%=0,0625

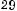


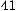



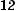
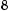 (г/моль).
(г/моль).
x = 128 0,9375 =10; 12
y =128 0,0625 =8.
C10H8
7)m(CxHy ) =11,2 г; m(CO2 ) =35,2 г; m(H2O) =14,4 г; DO2 (CxHy ) =1,75 ;
8)V(CxHy ) =11,2 л; V(CO2 ) =22,4 л.
Відповідь: C2H6.
V. Підбиття підсумків уроку
Який висновок можна зробити про властивості насичених вуглеводнів? Яке значення має реакція горіння насичених вуглеводнів?
Оцінювання роботи учнів на уроці, оцінювання творчих завдань про застосування етену й етину.
VI. Домашнє завдання
Опрацювати матеріал параграфа, відповісти на запитання до нього, виконати вправи.
68

І семестр |
Клас |
Дата проведення уроку |
|
|
|
Урок 37
Тема уроку. Хімічні властивості алкенів і алкінів Цілі уроку: формувати знання учнів про хімічні властивості алкенів
і алкінів; вивчити хімічні властивості ненасичених вуглеводнів на прикладі етену й етину, їх реакції з розчинами кислот, лугів, калій перманганату; формувати знання учнів про реакції приєднання в органічній хімії на прикладі приєднання водню й галогенів.
Тип уроку: вивчення нового матеріалу.
Форми роботи: самостійнаробота,розповідьучителя,демонстраційнийексперимент.
Обладнання: моделі молекул вуглеводнів.
Демонстрація 9. Одержання й горіння етилену. Демонстрація 10. Одержання й горіння ацетилену. Демонстрація 12. Реакції ненасичених вуглеводнів з розчинами кислот, лугів, калій перманганату.
Хід уроку
І. Організація класу
ІІ. Перевірка домашнього завдання. Актуалізація опорних знань. Мотивація навчальної діяльності
ІІІ. Вивчення нового матеріалу
1. Демонстрація 9. Одержання й горіння етилену 1) Одержання етилену дегідратацією етанолу в присутності концентрованої
сульфатної кислоти:
C2H5OH(H2SO4 (конц.)) t°→C2H4 +H2O 2) Горіння етилену.
Демонстрація 10. Одержання й горіння ацетилену. 1) Одержання ацетилену з кальцій карбіду:
CaC2 +H2O →C2H2 +Ca(OH)2
2) Горіння ацетилену.
2. Хімічні властивості алкенів і алкінів
Складання порівняльної таблиці.
Хімічні властивості |
Алкени |
|
Алкіни |
|
|
|
|
1. Реакція горіння |
CnH2n +O2 → CO2 +H2O |
CnH2n−2 +O2 → CO2 +H2O |
|
2. Гідрування (при- |
R −CH = CH−R +H2 |
t°, kat |
t°, kat |
→ |
R −C ≡ C −R +H2 → |
||
єднання H2 ) |
→ R −CH2 −CH2 |
−R |
→ R −CH = CH−R |
|
|
|
t°, kat |
|
|
|
R −C ≡ C−R +2H2 → |
|
|
|
→ R −CH2 −CH2 −R |
3. Галогенування |
R −CH = CH−R +Cl2 → |
R −C ≡ C −R +Cl2 → |
|
(приєднання Cl2, |
→ R −CHCl−CHCl−R |
→ R −CCl = CCl−R |
|
Br2 ) |
|
|
R −C ≡ C−R +2Cl2 → |
|
|
|
R −CCl2 = CCl2 −R |
|
|
|
|
Демонстрація 12. Реакції ненасичених вуглеводнів з розчинами кислот, лугів, калій перманганату.
1) Взаємодія етилену з бромною водою й калій перманганатом. (Рівняння реакції записуємо в зошит.)
CH2 = CH2 +Br2 →CH2Br −CH2Br
Висновок: ненасичені вуглеводні знебарвлюють розчини калій перманганату і бромну воду.
69

!Реакція з бромною водою (Br2 ) —
якісна реакція на наявність кратного зв’язку! 3. Гідрогалогенування (приєднання НСl, НBr)
R −CH = CH −R +HCl → R −CH2 −CHCl −R
R −C ≡ C −R +HCl → R −CH = CCl −R
Якщо атоми Карбону, які утворюють кратний зв’язок, з’єднані з різною кількістю атомів Гідрогену, то Гідроген із НСl або НBr приєднується до найбільш гідрогенізованого атома Карбону (того атома Карбону, біля якого атомів Гідрогену більше) — правило Марковнікова.
CH2 = CH −CH3 +HCl → CH3 −CHCl −CH3
CH ≡ C −CH3 +HCl → CH2 = CCl −CH3
4. Гідрата- |
R −CH = CH −R +H2O(H −OH) → |
Реакція Кучерова |
||
ція (приєд- |
→R −CH2 −CHOH −R |
R −C ≡ C −R +H2O → |
||
|
|
|
Hg |
|
нання води) |
R −CH = CH −R +H2O +(KMnO4 ) → |
→R −CH2 −C −R О |
||
|
→R −CHOH −CHOH −R |
|
|
|
|
|
|
|
|
Загальні |
|
|
|
|
способи |
Алкени |
|
Алкіни |
|
одержання |
|
|
|
|
|
|
|
|
|
1. Дегідру- |
t°, kat |
|
t°, kat |
|
вання |
R −CH2 −CH2 −R → |
R −CH = CH −R → |
||
→R −CH = CH −R +H2 |
→R −C = C −R +H2 |
|||
|
||||
2. Відщеп |
спирт |
R −CHCl −CHCl −R + |
||
лення HCl |
R −CH2 −CHCl −R +KOH → |
|||
→R −CH = CH −R +KCl +H2O |
+2KOH → |
|||
|
|
|
спирт |
|
|
|
→R −C ≡ C −R +2KCl +H2O |
||
|
|
|
|
|
3. Відщеп |
R −CHCl −CHCl −R +Zn → |
R −CCl2 |
−CCl2 −R +2Zn → |
|
лення Cl2 |
→R −CH = CH −R +ZnCl2 |
→R −C |
≡ C −R +2ZnCl2 |
|
|
|
|
|
|
*Додаткові способи одержання
А. Алкенів 1. Гідрування алкінів:
R −C = C −R +H2 t°, kat→R −CH = CH −R 2. Дегідратація спиртів (відщеплення води):
R −CH2 −CHOH −R H2SO4 , t°→R −CH = CH −R +H2O
Б. Ацетилену 1. Крекінг метану:
2CH4 t°→C2H2 +3H2
2. Карбідний метод:
CaC2 +H2O →CH ≡ CH +Ca(OH)2
Одержання карбіду:
CaCO3 t°→CaO +CO2
CaO +3C t°→CaC2 +CO
IV. Первинне застосування отриманих знань
V. Підбиття підсумків уроку
1) Назвіть загальні хімічні властивості вуглеводнів.
2) Назвіть відмітні хімічні властивості насичених і ненасичених вуглеводнів. 3) Який клас вуглеводнів найбільш хімічно активний?
4) Яку реакцію можна використати для визначення етану й етину?
5) Яка властивість ацетилену використовується під час зварювання металів?
VI. Оцінювання роботи учнів на уроці
VII. Домашнє завдання
70
