
Лекции по ТОХТНВ
.docИзобарический процесс характеризуется постоянством давления. Следовательно, выражение dA = pdV после интегрирования при условии
p = const приобретает вид:
A = p (V2 –V1)
Работа, совершаемая при этом процессе , пропорциональна изменению обьема газа.
A = R (T2- T1)
Работа изобарического процесса пропорциональна изменению температуры газа.
Изотермический процесс характеризуется постоянством температуры. Следовательно , dA = pdV, но, согласно уравнению pV/T = R, p = RT/V поэтому
dA= RT/V dV
Интегрируя это уравнение и полагая T =const получаем
A = RTln V2/V1
По закону Бойля –Мариотта V2/V1= p1/p2 ; поэтому
A = RTln p1/p2
То уравнение
первого начало термодинамики (T= const и
![]() U=0)
приобретает вид: Q=A
U=0)
приобретает вид: Q=A
Это означает что при изотермическом процессе работа, совершаемая над системой, полностью превращается в теплоту, которую система выделяет в окружающее пространство.
Адиабатический процесс характеризуется выражением dQ =0. Следовательно, уравнение первого начало термодинамики в этом случае имеет вид dU +dA =0 или dA = -dU Так как dU = CvdТ, то dA = -CvdT
Интегрирование дает следующую зависимость:
A = -Сv(T1-T2)
Согласно этому уравнению, работа адиабатического процесса пропорциональна изменению температуры газа, а также пропорциональна его теплоемкости при постоянном обьеме.
Теплоемкость представляет собой одну из наиболее важных характеристик вещества.
Из уравнения первого начала термодинамики dQ =dU+ dA
Следует, что
dQ/dT=dU/dT+ dA/dT
C = dQ/dT = dQ/dt
Называется теплоемкостью.Теплоемкость показывает, какое количество теплоты необходимо подвести к телу для заданного повышения его температуры. В данном случае величина теплоемкости определена как количество теплоты, которое необходимо для дифференциально малого изменения степени нагретости тела. Это так называемая истинная теплоемкость.
Часто используется величиной средней теплоемкости
C= Q/t2 –t1
Легко видеть, что средняя теплоемкость равняется количеству теплоты, необходимиое для нагревания тела на 1о ,причем t2 и t1 конечное и начальное значения температуры тела.
Если t1 = ОоС, а t2 принимает значения t, то уравнение упрощается:
C = Q/t
И величина С носит название средней теплоемкости в интервале температур от 0 до tоС.Поскольку величина Q зависит от пути процесса, то от него также будет зависеть и величина теплоемкости. Чаще всего используется теплоемкость при постоянном обьеме Сv и теплоемкость при постоянном давлении Ср,т.е.
Сv = (dU/dT)v= dQv/dT
Сp = (d Н/ dT)p =dQp/dT
Температурная зависимость теплоемкостей.
При повышении температуры теплоемкость резко возрастает.Если уравнение истинной теплоемкости имеет вид
С=
![]()
C = a+bt+ct2
То связь
коэффициентов![]()
![]() с коэффициентами а,б,с
с коэффициентами а,б,с
![]() выражается
соотношениями:
выражается
соотношениями:
![]()
А=![]() b=
b=![]() /2
; c=
/2
; c=
![]() /3
или
/3
или
![]() .
.
Зависимость теплоемкости от температуры для практических расчетов выражают обычно эмперическими формулами в виде степенных рядов от температуры:
С=a + bT+ cT2 + dT3 или C= a +bT + cT-2
Для определия
средней теплоемкости по истинной
пользуется соотношениями:C = 1/t –t1 Cdt;![]()
C = 1/T –T1 CdT![]() Количество
теплоты, затраченное на нагревание n
молей вещества от Т1 до Т2, определяется
соотношений:
Количество
теплоты, затраченное на нагревание n
молей вещества от Т1 до Т2, определяется
соотношений:
Qv =
![]() U
= n CvdT = nCv(T2-T1)
U
= n CvdT = nCv(T2-T1)
Qp =![]() H = n Cp dT = n Cp(T2-T1)
H = n Cp dT = n Cp(T2-T1)
Учитывая , что теплоемкость является функцией температуры, для расчета количества теплоты используют уравнение
Qp = n[ a(T2 – T1)+ ½ b (T22 –T12)+ C/ T2-T1/T1T2] Температурная зависимость теплоемкостей.
При повышении температуры теплоемкость резко возрастает.Если уравнение истинной теплоемкости имеет вид
С=
![]()
C = a+bt+ct2
То связь
коэффициентов![]()
![]() с коэффициентами а,б,с
с коэффициентами а,б,с
![]() выражается
соотношениями:
выражается
соотношениями:
![]()
А=![]() b=
b=![]() /2
; c=
/2
; c=
![]() /3
или
/3
или
![]() .
.
Зависимость темплоемкости от температуры для практических расчетов выражают обычно эмперическими формулами в виде степенных рядов от температуры:
С=a + bT+ cT2 + dT3 или C= a +bT + cT-2
Для определия
средней теплоемкости по истинной
пользуется соотношениями:C = 1/t –t1 Cdt;![]()
C = 1/T –T1 CdT![]() Количество
теплоты, затраченное на нагревание n
молей вещества от Т1 до Т2, определяется
соотношений:
Количество
теплоты, затраченное на нагревание n
молей вещества от Т1 до Т2, определяется
соотношений:
Qv =
![]() U
= n CvdT = nCv(T2-T1)
U
= n CvdT = nCv(T2-T1)
Qp =![]() H = n Cp dT = n Cp(T2-T1)
H = n Cp dT = n Cp(T2-T1)
Учитывая , что теплоемкость является функцией температуры, для расчета количества теплоты используют уравнение
Qp = n[ a(T2 – T1)+ ½ b (T22 –T12)+ C/ T2-T1/T1T2]
Общие условия равновесия. Термодинамические потенциалы. Характеристические функции. Химическиий потенциал. Равновесие устойчивое и неустойчивое. Физико –химические предпосылки переноса вещества и энергии.
Для того чтобы однозначно характеризовать свойства системы состояние которой определяется какими либо параметрами (P,V,T) при термодинамическом равновесии, недостаточно знать уравнение состояния этой системы , связывающее давление, обьем и температуру. Для полной характеристики нужно знать еще уравнение, которая позволяет определить энергию системы по данным параметром состояния. Анализ первого и второго начало термодинамики показывает что число уравнений, можно свести с двух до одного, поскольку все необходимые для этого величины могут быть выражены через некоторую функцию независимых переменных и ее производные.
Такие функции получили название характеристических функций. Наиболее часто в качестве таких функций используются: внутренняя энергия (U),энтальпия (H), свободная энергия (F) и термодинамический потенциал(G)
Любое свойство системы может быть выражено через эти характеристические функции (U,H,F,G) и их производные в явной форме.
Однако использование той или иной функции зависит от конкретных условий, которые диктуют нам выбор независимых переменных, а это в свою очередь определяет выбор используемой характеристической фуекции. Наиболее простые в матеематическом отношении выражения для различных свойств системы получаются, если рассматривать U как функцию отV и S:
U=f (V,S);
H как функцию от p и S :
H = f (p,S);
F как функцию от V и T:
F = f (V,T) ;
и G как функцию от p и T:
G = f (p,T).
При применении функций U и H одной из независимых переменных является энтропия. Невозможность непосредственно измерять энтропию представляет U и H. В зтом заключается одна из причин того, что чаще пользуются функциями F и G при удобных для измерения независимых переменных V и T или Р и Т . Вместе с тем нельзя пользоваться во всех случаях только одной из этих функций. Например, если мы попытаемся использовать функцию F в случае, когда по условиям опыта надо взять в качестве независимых переменных p и T, то функция F не будет характеристической и даст выраженииие для ряда свойств системы в неявной форме. Следовательно, для данного случая необходимо воспользоваться функцией G.
Внутреняя энергия
В соответствии с уравнением U=f (V,S);внутреняя энергия является характеристической функцией при независимых переменных V и S.
Как и в случае всякой другой функции состояния , дифференциал функции U является полным дифференциалом и, следовательно, может быть представлен как сумма частных дифференциалов по независимым переменным:
![]()
![]()
Воспользовавшись
уравнением первого начало термодинамики
![]() где dA =pdV , и уравнением второго начало
термодинамики dQ =TdS, получаем
где dA =pdV , и уравнением второго начало
термодинамики dQ =TdS, получаем
TdS = dU +pdV ,
Откуда
dU=TdS –pdV
Сравнивая уравнения видим, что
![]()
![]() v
= T и
v
= T и
![]() .
.
Таким образом , зная что U=f (V,S);, легко получаем значенм\ия недостающих переменных Т и р. Причем становится очевидным , что температура является мерой возрастания внутренней энергии системы с увеличением энтропии при постоянном обьеме, а давление – убыли внутренней энергии с увеличением обьема при постоянном значении энтропии.
Кроме того , изменение внутренней энергии системы при постоянном обьеме определяет величину теплового эффекта соотношением
![]()
Энтальпия.
По уравнению Н =f (р,S); энтальпия является характеристической функцией при независимых переменных р и S.
Следовательно :
![]() S
S![]() .
.
Изменение энтальпии системы при постоянном давлении определяет величину теплового эффекта соотношением
![]()
![]()
Из уравнения
первого начало термодинамики
![]() где
где
![]() и
и
![]() и
при
и
при
![]() ,
получаем
,
получаем
![]()
А после интегрирования:
![]()
![]()
![]() .
.
Отсюда следует, что связь между функциями H и U определяется соотношением:
H=U+pV
Дифференцируя полученное выражение, получаем:
dH = d U+ pdV + Vdp
Далее подставляем значения dU из уравнения dU=TdS –pdV
dH = TdS –pdV + pdV +Vdp
после чего получаем
dH=TdS+VdP
Сравнивая уравнения
![]() S
S![]() .и
dH=TdS+VdP
.и
dH=TdS+VdP
получаем , что
![]() ,
,
![]() .
.
Легко видеть, что температура является мерой возрастания энтальпии системы с увеличением энтропии при постоянном давлении, а обьем –мерой возрастания энтальпии системы с увеличением давления при постоянном значении энтропии.
Изохорно-изотермический потенциал.(Свободная энергия)
По уравнению F = f (V,T) свободная энергия является характеристической функцией при независимых переменных V и T.
Следовательно:
![]()
Согласно первомому
началу термодинамики:
![]() или
dA = dQ –dU dA = TdS – dU
или
dA = dQ –dU dA = TdS – dU

Если ввести обозначение
F = U-TS
то
A![]() ,
,
т.е. работа системы при постоянной температуре и постоянном обьеме равна убыли функции Ғ в данном процессе. Из выражения F = U-TS следует, что при постоянной температуре и постоянном обьеме в работу не может перейти вся внутренняя энергия системы U. В работу превращается только ее часть, остающаяся вычета TS из U. Ее обозначили F и назвали свободной энергией.Таким образом,свободной энергией называется та часть внутренней энергии системы, которая можеть быть превращена в работу при постоянной температуре. Эта работа называется полезной и, если процесс протекает обратимо, является максимальной.
Та часть внутренней энергии, которая при постоянной температуре не превращается в работу TS, называется связанной или бесполезной энергией.
Чем больше энтропия системы , тем больше ее связанная энергия , поскольку энтропия представляет собой связанную энергию приходящуюся на 1 град.
Дифференцируя уравнения F = U-TS получаем:
df= dU- TdS-SdT
Далее подставляем, согласно уравнению
dU=TdS –pdV
поэтому
dF = -pdV –SdT
Сравнивая уравнения
![]() и dF = -pdV –SdT, находим, что
и dF = -pdV –SdT, находим, что
![]()
и
![]()
Таким образом, давление является мерой убыли свободной энергии системы с увеличением обьема при постоянной температуре, а энтропия – мерой убыли свободной энергии с увеличением температуры при постоянном обьеме системы.
Изобарно-изотермический потенциал.
Термодинамический потенциал является характеристический функцией при независимых переменных р и Т, следовательно:
![]()
Так же как энтальпия отличается от внутренней энергии на величину рV ,так и термодинамический потенциал отличается от свободной энергии на рV т.е.
dG=
![]()
Проводя процесс при постоянном давлении и температуре , получаем
![]()
или, обозначая
![]()
и принимая во
внимания , что
![]()
получаем
![]()
где Ар – полная
максимальная работа системы, равная
убыли термодинамического потенциала
при постоянной при постоянном давлении.
Она состоит из полезной максимальной
работы системы А![]() и работы сжатия р(V
и работы сжатия р(V![]() )
)
Дифференцируя
уравнение dG=
![]() g
g
![]()
dU = TdS –pdV
dG = Vdp-SdT
![]()
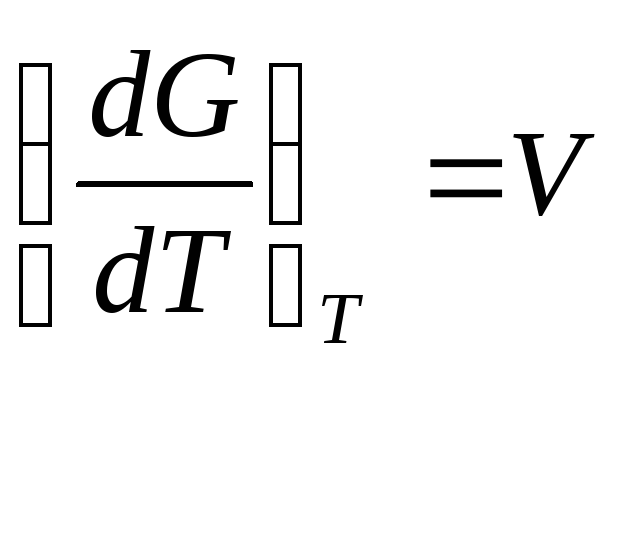
![]()
Легко видеть, что обьем системы является мерой возрастания термодинамического потенциала системы с увеличением давления при постоянной температуре, а энтропия –мерой убыли термодинамического потенциала с увеличением температуры при постоянном давлении.
Обьединенные первое и второе начало термодинамики (уравнение Гиббса - Гельмгольца)
Согласно уравнению
F = U- TS и значению энтропии, которое
дается выражением
![]() ,
имеем
,
имеем
F= U + T
![]() .
.
Это и есть уравнение
Гибсса-Гельмгольца для процессов,
протекающих при постоянном обьеме.
напишем это уравнение для двух состояний
системы:
![]()
и
![]() .
.
Далее, вычитая одно из другого , получаем
![]() и
и
![]()
Отсюда: A![]()
Согласно уравнениям
![]() ,
,
![]() и значению энтропии, которое дается
уравнением
и значению энтропии, которое дается
уравнением
![]() ,имеем
,имеем
![]() .
.
Это уравнение Гибсса –Гельмгольца для процессов , протекающих при постоянном давлении.
Направление протекания процессов и термодинамические условия равновесия.
Так как, согласно второму началу термодинамики, ив системе возможно только увеличение энтропии (при необратимых процессах), но не уменьшение и, как крайний случай, - сохранение постоянства энтропии (при обратимых процессах), то система находится в устойчивом равновесии, если ее энтропия максимальна в данных условиях.
Следовательно, общим условием протекания процессов в направлении устойчиого равновесия является условие
![]() ,
,
где знак равенства относится к равновесному состоянию, а знак неравенства к самопроизвольным процессам.
Условию
равновесия можно придать и другие
формулировки. Согласно уравнениям
![]() и
и
![]() ,
имеем
,
имеем
![]() и
и
![]()
Таким образом,
учитывая выражение
![]() ,
при постоянной температуре и постоянном
обьеме общим условием протекания
процессов в направлении достижения
устойчивого будет условие
,
при постоянной температуре и постоянном
обьеме общим условием протекания
процессов в направлении достижения
устойчивого будет условие
![]() ;
;
следовательно, при постоянной температуре и обьеме в любой системе самопроизвольно могут протекать только те процессы , которые сопровождаются уменьшением F, причем пределом их протекания, т.е. условием равновесия, является достижение некоторого минимального для данных условий значения F.
Точно так же при постоянной температуре и постоянном давлении общим протекания процессов и равновесия будет условие
dG
![]() ;
;
следовательно, в системах, находящихся при постоянной температуре и постоянном давлении самопрозвольно могут протекать только процессы, сопровождаюшиеся уменьшением G , причем пределом их протекания, т.е. условием равновесия, служит некоторое минимальное значение G для данных условий.
Таким образом, при всех самопроизвольных процессах происходит уменьшение характеристических функций U,H,F и G, а равновесие характеризуется их минимальным для данных условий значением.
Химический потенциал.
В ходе химических
процессов происходит не только изменение
таких параметров ситемы, как обьем,
давление и температура, но также
изменяется состав. в приложении к таким
системам для расмотрения равновесия
Гиббс предложил использовать представление
о химическом потенциале, который
обозначается букой
![]() с ссответствующими индексами.
с ссответствующими индексами.
Математически химические потенциалы представляют собой частные производные характеристических функций по числу молей данного компонента системы при постоянных значениях независимых параметров и количеств всех остальных компонентов.:
![]()
![]() ;
;
![]() ;
;
можно ввести и через мольные концентрации (доли)х:
хі = n![]() .
.
поскольку U,H, F и G
являются функциями состояния, то при
n![]() =
const имеем:
=
const имеем:
![]()
и при хі =const имеем:
![]() ;
;![]()
т.е. химический потенциал данного вешества і не зависит от выбора независимых переменных, определящих состояние системы.
Химический
потенциал представляет собой фактор
интенсивности химической э![]() нергии
данного вещества в системе, поскольку
химическую энергию, подобно любомому
другому виду энергии, можно рассматривать
как произведение фактора интенсивности
на фактор емкости. фактором емкости в
данном случае будет число молей или
концентрация данного вещества.
Следовательно, приращение химической
энергии можно представить в виде
нергии
данного вещества в системе, поскольку
химическую энергию, подобно любомому
другому виду энергии, можно рассматривать
как произведение фактора интенсивности
на фактор емкости. фактором емкости в
данном случае будет число молей или
концентрация данного вещества.
Следовательно, приращение химической
энергии можно представить в виде
![]()
![]() dx
dx![]() .Кроме
того, в состоянии равновесия не происходит
превращений химической энергии, т.е.
.Кроме
того, в состоянии равновесия не происходит
превращений химической энергии, т.е.
![]()
или
![]()
Химический
потенциал является мерой изменения
характеристической функции при
соответствующих постоянных параметрах
и массах всех веществ, за исключением
массы того компонента, количество
которого изменяется в системе.
Следовательно, химический потенциал
можно рассматривать либо как соответствующий
тепловой эффект (Q![]() или
Q
или
Q![]() )
, либо как совершаемую работу (A
)
, либо как совершаемую работу (A![]() или А
или А![]() )при
изменении массы данного вещества в
системе и заданном выборе переменных.
)при
изменении массы данного вещества в
системе и заданном выборе переменных.
Приближенные методы расчета теплоемкостей, теплот образования и сгорания химических соединении( метод А.Ф. Капустинского, метод тепловых поправок, методы расчета М.Х.Карапетьянца, уравнеие д.П.Коновалова и др.)Вычисление энтропии. Методика составления тепловых балансов химического процесса в изотермичесих и адиабатных условиях.
В основе термохимии лежит закон, согласно которому тепловой эффект реакции не зависит от промежуточных стадий и определяется лишь начальным и конечным состояниями системы. Этот закон был открыт путем сопоставления опытных данных, а затем экспериментально проверен Г.И. Гессом (1836-1840 гг.)
Закон Гесса имеет большое практическое значение. Например, с его помощью можно установить тепловые эффекты реакций, экспериментальное определение которых представляет большие трудности.
Для этих целей широко используются следствия из закона Гесса:
Первое следствие: тепловой эффект разложения какого-либо химического соединения равен по абсолютной величине и противоположен по знаку тепловому эффекту образования этого соединения.
Второе следствие: если совершаются две реакции, приводящие из различных начальных состояний к одинаковым конечным, то разница между тепловыми эффектами представляет собой тепловой эффект перехода из одного начального состояния в другое.
Третье следствие: если совершаются две реакции, приводящие из одинаковых начальных состояний к различным конечным, то разница между их тепловыми эффектами представляет собой тепловой эффект перехода из одного конечного состояния другое.
Например, двуокись углерода можно получит, сжигая углеродв кислороде непосредственно до двуокиси углерода
