
Выполнение задания.
-
Отобрать из семян суперэлиты ячменя сорта Винер 3 пробы по 500 зерен.
-
Приготовить растворы мутагена N-нитрозоме-тилмочевины 2 концентраций — 0,01 и 0,008%.
-
Поместить 2 порции семян в растворы мутагена соответствующей концентрации, третью — замочить в воде.
-
Через 18 ч семена промыть в проточной воде и подсушить.
-
Семена всех вариантов одновременно высеять в поле.
-
Данные об обработке семян следует занести в таблицу.
№10-практическая работа. Мутации. Критерии множественного аллелизма.
Задание. 1. Ознакомиться с типами структурных изменений хромосом и методами их изучения. 2. Определить митотическую активность в меристеме корешков лука-батуна после обработки мутагеном и сравнить с контролем. 3. Установить наличие и процент аберраций хромосом у мутантов. 4. Определить типы аберраций.
Материал и оборудование. 1. Препараты срезов корешков лука-батуна (контрольных и после обработки мутагенами проросших семян). 2. Микроскоп с рисовальным аппаратом.
Пояснения к заданию. Любым структурным изменениям хромосомы предшествует ее разрыв, при котором получаются два новых «клейких» конца. Такие «клейкие» концы способны соединиться с любым другим (но только «клейким») концом. Если соединяются концы, возникшие при одном разрыве, восстанавливается целость хромосомы — структурных изменений не происходит. В случае же соединения концов, возникших при разных разрывах, получается новое расположение генов в хромосоме, т. е. появляются структурные изменения хромосом.
Характер хромосомных аберраций зависит от состояния, хромосомы в момент воздействия мутагенного фактора. Если хромосома находится в состоянии одиночной нити, то в период S интерфазы она удваивается и аберрация сохраняется в обеих хроматидах, т. е. возникают хромосомные аберрации (рис.7). Если мутаген действует на хромосому, находящуюся в состоянии двойной нити (периоды S и G2 интерфазы, профаза и метафаза митоза), аберрация может образоваться в каждой нити отдельно. В этом случае возникают так называемые хроматидные аберрации.
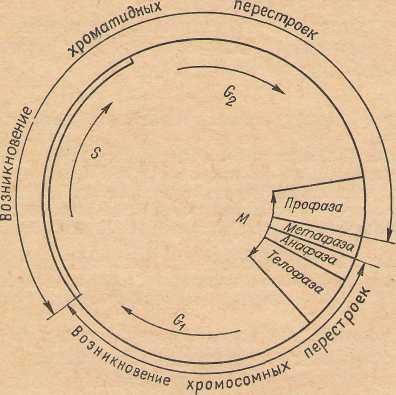
Рис. 7. Характер перестроек хромосом в митотическом цикле клетки.
Различают внутри и межхромосомные аберрации. К внутрихромосомным относятся делеции, инверсии и дупликации.
Делеция (нехватка)—выпадение участка хромосомы, содержащего один или несколько генов. В случае утери хромосомой концевого участка возникает концевая делеция, при утере внутреннего участка — интерстициальная делеция.
Инверсия — разрыв хромосомы в двух местах одновременно с сохранением внутреннего участка, который поворачивается на 180°. Инверсия может быть парацентрической, если оба разрыва происходят в одном плече хромосомы, или перицентрической, если разрывы происходят по обе стороны от центромеры (в обоих плечах одновременно).
Дупликация — удвоение одного и того же участка хромосомы, содержащего одни и те же гены.
Межхромосомными аберрациями называют структурные изменения, затрагивающие одновременно две или более негомологичные хромосомы. К таким структурным изменениям хромосом относятся транслокации.
Транслокация — обмен участками между негомологичными хромосомами.
Организмы, в клетках которых имеются хромосомные аберрации, чаще всего бывают маложизнеспособны или нежизнеспособны.
Изучение хромосомных аберраций можно проводить двумя методами — метафазным и анафазным. Метафазныи метод заключается в анализе аберраций в метафазе митоза. Он довольно точен, но в связи с тем, что у многих растений хромосомы распознавать в метафазе трудно, его используют лишь для объектов, имеющих четко различимые хромосомы, например скерды. Анафазный метод предусматривает анализ хромосомных аберраций в анафазе митоза. Чаще всего они представляют собой мосты (рис. 8.) и фрагменты. Их образование можно, например, представить так, что при разрыве обеих хроматид в результате репликации образуются две сестринские хромосомы с разрывом в одном и том же месте. В дальнейшем при соединении концов сестринских хромосом, как правило, получаются две новые хромосомы: одна без центромеры (ацентрическая), другая с двумя центромерами (дицентрическая). В анафазе митоза дицентрическая хромосома одновременно тянется к обоим полюсам, образуя мост. Ацентрическая хромосома (фрагмент) располагается случайно и в дальнейшем элиминируется. В описанном случае происходит дупликация и делеция одновременно. Если в анафазе образуются не мосты, а лишь беецентромерные фрагменты,— значит, налицо структурные изменения типа делеций. Удобный объект для изучения хромосомных аберраций — проросшие семена лука-батуна, ячменя и других растений, предварительно обработанные химическими мутагенами или облученные гамма-лучами в соответствующей дозе.
Изучение хромосомных аберраций следует проводить в самом начале прорастания корешков, на первых митотических делениях клеток меристемы.
Выполнение задания. 1. Семена лука-батуна замачивают на 50 ч при температуре 24 °С. К этому времени корешки обычно достигают длины 5 мм.

Рис.8. Анафаза митоза в меристематической клетке зародышевого кроешка ячмена после воздействия мутагена.
№11-практическая работа. Геномные мутации. Микроскопический анализ препаратов хромосом с целью изучения различных форм гетероплоидии.
Задание. 1. Ознакомиться с наиболее широко применяемыми методами получения полиплоидов. 2. Провести колхицинирование проростков ржи. 3. Высадить полученные проростки в ящики. 4. Подсчитать число хромосом на временных или постоянных препаратах, приготовленных из точек роста проростков.
Материал и оборудование. 1. Семена ржи. 2. Чашка Петри диаметром 8—10 см. 3. Раствор колхицина (концентрация 0,25%). 4. Ящик с почвой. 5. Микроскоп. 6. Препарат (постоянный или временный), приготовленный из точки роста проростка, выросшего из колхицинированного семени.
Пояснения к заданию. Методов получения полиплоидных растений довольно много. Большая часть этих методов основана на колхицинировании. Колхицин — желтовато-белый или белый порошок; он относится к группе алкалоидов; добывают его из растения — безвременника осеннего. Слабые растворы этого вещества парализуют процесс образования тянущих нитей веретена. Поэтому в митозе хромосомы не расходятся к полюсам, клетка не делится, и образуется ядро с тетра-плоидным (2пХ2) набором хромосом. Если на образовавшиеся тетраплоидные клетки продолжать воздействие колхицином, то могут возникнуть окто-плоидные клетки, а если действовать колхицином на последующие деления, то число хромосом в клетках может увеличиться в 4, 8, 16 и более раз. Но обычно такое увеличение числа хромосом снижает жизнеспособность клеток и даже обусловливает их гибель.
Для получения полиплоидов чаще всего используют 0,1—0,25%-ный водный раствор колхицина, которым обрабатывают прорастающие семена или верхушки Молодых побегов, находящиеся в состоянии интенсивного деления клеток. Следует избегать попадания раствора колхицина на корни, так как это ослабляет тетраплоидные растения.
При обработке растений с длинным подсемядольным коленом (например, проростки гречихи) используют следующий метод. В чашке Петри на фильтровальной бумаге проращивают семена, разложив их по периметру чашки. Когда проростки достигнут длины 4—6 см, чашку с проростками вставляют в другую, большего диаметра, в которую наливают 0,05%-ный раствор колхицина. Проростки пригибают таким образом, чтобы семядоли и конус нарастания находились в растворе колхицина, налитого в чашку большего диаметра. Через 12—24 ч их вынимают, прополаскивают в воде и сажают в почву.
Полиплоидные растения можно получать и другим методом. На молодые проростки, почки, побеги накладывают ватный тампон, смоченный колхицином. Для этого пинцетом осторожно отодвигают в стороны молодые листочки и между ними вкладывают как можно глубже ватный тампон, чтобы он находился в непосредственной близости от точки роста. Лучше всего тампон вкладывать вечером и следить, чтобы он все время находился во влажном состоянии. Ежедневно тампон смачивают раствором колхицина. Через 2—5 дней вату снимают, и верхушки побегов промывают водой. Рост обработанных побегов приостанавливается, они сильно утолщаются, появляются толстые мясистые листья. Через 2—4 недели рост побега возобновляется.
При колхицинировании значительная часть растений погибает; это нужно учитывать и брать для опыта семена в достаточном количестве.
Полиплоиды можно получать также с помощью аценафтена. Он действует слабее, но не вызывает у обработанных побегов такой сильной депрессии в росте, как колхицин. Аценафтен слабо растворим в воде, поэтому растения обрабатывают им преимущественно следующими способами.
1. Семена покрывают влажной фильтровальной бумагой, на которую сверху насыпают порошок аценафтена. Семена выдерживают таким образом 2— 4 дня, а затем высаживают в поле.
2. Молодые сеянцы, выращенные в горшках в теплице, прикрывают химическим стаканом, смазанным внутри ланолином, на который насыпано 2—4 г аценафтена. Через день стакан снимают.
Выполнение задания. 1. В чашке Петри на фильтровальной бумаге прорастить в течение 2—3 дней семена ржи районированного сорта.
2. Когда колеоптиле достигнет 2—4 мм длины, поместить проростки в 0,25%-ный водный раствор колхицина. Для этой цели в чистую чашку Петри, имеющую диаметр на 1—2 см меньше, чем фильтровальная бумага, на которой проращиваются семена, наливают раствор колхицина.
Бумагу с проростками вынимают из чашки Петри и перевертывают таким образом, чтобы верхушки проростков оказались в растворе колхицина, а корни прикрыть сверху бумагой, чтобы они не высыхали.
3. Через 30 мин проростки вынуть из раствора колхицина, промыть дистиллированной водой, высадить в ящик и поставить в теплицу.
4. Через 30 дней отобрать тетраплоидные растения. Они отличаются толстыми мясистыми листьями, неправильными искривленными побегами.
5. Подсчитать число хромосом и проверить плоидность отобранных растений на временных или постоянных препаратах, приготовленных по обычной цитологической методике.
Определение числа хромосом в клетках диплоидного и тетраплоидного растений может быть темой самостоятельного занятия.
№12-практическая работа. Определение генетического сходства и степени гомозиготности популяции.
Задание. 1. Познакомиться с законом Харди — Вейнберга. 2. Вычислить частоты генотипов в популяции озимой ржи сорта Вятка, растения которой различаются по антоциановой окраске всходов.
Задание характеризует частоты фенотипов, различающихся по окраске всходов в популяции озимой ржи сорта Вятка 2.
Пояснения к заданию. Английский математик Г. Харди и немецкий врач В. Вейнберг в 1908 г. независимо друг от друга установили закон, которому подчиняется частота распределения гомозигот и гетерозигот в свободно скрещивающейся популяции, и выразили его в виде алгебраической формулы. Согласно этой формуле частота членов пары аллельных генов в популяции распределяется в соответствии с формулой бинома Ньютона (р + q)2=1 или р2 + 2pq+q2 =1
Закон Харди—Вейнберга гласит: в неограниченно большой популяции при отсутствии факторов, изменяющих концентрацию генов, при свободном скрещивании особей, отсутствии отбора и мутирования данных генов и отсутствии миграции численные соотношения аллелей АА, аа и Аа остаются из поколения в поколение постоянными.
Этот закон дает возможность определить вероятность содержания генотипов АА, Аа и аа в свободно скрещивающейся популяции.
Условия, при соблюдении которых действует этот закон, практически невозможны ни в одной реально существующей популяции, поэтому закон Харди — Вейнберга следует рассматривать как закон, применимый для идеальной (модельной) популяции, хотя он и лежит в основе динамики всех типов популяций.
Пример. У озимой ржи антоциановая (фиолетовая) окраска всходов — доминантный (А) признак по отношению к зеленой (а) окраске, N — число особей в популяции, D — число гомозиготных особей с генотипом АА, R — число гомозиготных особей с генотипом аа, Н — число гетерозиготных особей с генотипом Аа.
Выполнение задания. 1. Определить состав популяции. Он будет представлен следующей формулой: N=D+R+H
2. Вычислить число генов А и число генов а в данной популяции сорта Вятка 2 по формуле A (число генов) =2D + Н, так как каждое растение D имеет два гена A, а каждое растение Н — один ген A.
Число генов а — 2R + Н, так как каждое растение R имеет два гена а, а каждое растение Н — один ген.
3. Вычислить частоту (долю) генов A в популяции. Она обозначается буквой р и вычисляется по формуле:
p=2D+H / 2N=D+ 1/2H / N.
4. Вычислить частоту генов а в популяции (q) по формуле:
p=2R+H / 2N=R+ 1/2H / N.
5. Пользуясь формулой Харди — Вейнберга, вычислить состояние равновесия в популяции при p= 0,6 и q= 0,4 и частоте генотипов AA=0,10, Aа = 0,20 и аа = 0,70.
Следует обратить внимание, что популяция при таком соотношении генотипов неустойчива, и уже в следующем поколении в ней устанавливается равновесие, которое сохраняется и в дальнейших поколениях.
Таким образом, в рассматриваемом примере в популяции ржи сорта Вятка 2 во всех поколениях сохраняется соотношение генотипов с антоциановой окраской всходов (гомозигот) AA=0,36, гетерозигот Aа = 0,48 и с зеленой окраской всходов аа = 0,16. При этом сохраняется частота гена А — р = 0,6 и частота гена а — q = 0,4.
№13-практическая работа. Знакомства с динамикой генеотипов в чистых линиях и популяциях.
Задание. Вычислить процент гетерозиготных особей в 10-м поколении гибридной популяции яровой пшеницы, полученной от скрещивания сортов Фильгия и Саратовская 29.
Пояснения к заданию. В природе даже у самых строгих облигатных самоопылителей, как например пшеница, ячмень, овес и др., бывают случаи перекрестного опыления. Однако эти случаи довольно редки и немногочисленны, поэтому сорта-самоопылители обычно продолжительное время сохраняют свою генетическую однородность.
У пшеницы красная окраска колоса (А) по отношению к белой окраске (а)—доминантный признак. Сорт Фильгия, имеющий красную окраску колоса, скрещивают с белоколосым сортом Саратовская 29, а затем проводят самоопыление полученной гетерозиготной популяции F1 в последующих поколениях.
Выполнение задания. 1. Составить схему образования гетерозигот и гомозигот в 3 поколениях гибридной популяции
PP♀AA X ♂ аа
F1 Aa
F2 AA+2Aa+aa
F3 4AA+2AA+4Aa+2aa+4aa,
или 6AA+4Aa+6aa, или 3AA+2Aa+3aa
Fn (2n-1-1)AA+2Aa+(2n-1 –1)aa
2. В соответствии с полученной формулой определить частоту гетерозиготных растений в популяции в 10-м поколении:
F10 (29— 1) АА+2Аа + (29— 1)аа = 511 АА + 2Аа + 511аа
3. Определить процент гетерозиготных особей в гибридной популяции ФильгияXСаратовская 29 к 10-му поколению. Расчет удобно выполнять в форме таблицы.
Таким образом, в 10-м поколении у самоопыляющихся растений число гетерозигот составит около 0,1%. Доминантных гомозигот будет около 49,45% и рецессивных гомозигот — около 49,45%.
№14-практическая работа. Оценка влияния элементарных факторов эволюции на структуру популяции.
Задание. 1. Ознакомиться с причинами, нарушающими равновесие в популяции. 2. Определить изменение соотношения процента особей с различными генотипами в поколениях при полной элиминации рецессивных гомозигот.
Пояснения к заданию. Равновесие в популяции может нарушаться под влиянием таких факторов, как мутационная изменчивость, увеличение или уменьшение численности популяции, избирательность оплодотворения, отбор и др. Причем наибольшее значение имеет направление отбора.
Динамика генетической структуры популяции выражается в изменении соотношения разных генотипов в поколениях. Генофонд популяции может пополняться большим или меньшим числом мутаций. Этот процесс накопления мутаций называется мутационным давлением. Например, мутирование аллеля А в аллель а или обратно может нарушить равновесие в популяции, т. е. изменить соотношение генотипов АА, Аа и аа. Каждая вновь возникшая мутация подвергается действию отбора, т. е. все особи, у которых возникает мутация, снижающая жизнеспособность или плодовитость, полностью или частично элиминируются. Если возникшая мутация доминантна, то все обладающие ею особи подвергаются действию отбора в первом поколении. Если же мутация рецессивна, то она подвергается действию отбора только в гомозиготном состоянии. В этом случае мутантные рецессивные гены могут накапливаться в популяции в гетерозиготном состоянии. Поэтому элиминация рецессивных генов в популяции мало эффективна: в каждом последующем поколении рецессивные гомозиготы будут появляться вновь из гетерозигот Аа в результате их расщепления.
При выполнении данного задания в качестве примера может быть рассмотрена популяция озимой ржи, у которой частота доминантных генов р = 0,5, частота рецессивных генов q — 0,5, а гомозиготное состояние рецессивного гена обусловливает полную стерильность цветков.
Доминантный ген F как в гомозиготном, так и в гетерозиготном состоянии обусловливает нормальное развитие фертильных цветков. В этом случае коэффициент отбора (коэффициент элиминации), обозначаемый буквой S, для рецессивных гомозигот ff равняется 1, то есть эти гомозиготы в каждом поколении бесплодны, не завязывают семян.
Согласно заданию в исходной популяции частоты доминантного и рецессивного генов равны и составляют р = 0,5 и q = 0,5.
При S = 1 частота генов в популяции вычисляется
по формуле: qn=q/1+nq,
где п — число поколений, для которых ведется расчет.
Для удобства расчетов следует вычислять не частоты генотипов, а процент особей с соответствующим генотипом.
Выполнение задания. 1. Вычислить процент особей с генотипами FF, Ff, ff в исходной популяции при S = 1 и q = 0,5. Данные занести в таблицу, умножив предварительно на 100, чтобы перевести их в проценты. Расчет ведется по формуле:
P2 +2hq+q2=1
(0,5)2+ (2 X 0,5 X 0,5)+ (0,5)2 = 1.
Следовательно, в исходной популяции будет следующее соотношение генотипов: 25% FF; 50% Ff и 25% ff.
Динамика изменения соотношения генотипов в популяции при полной элиминации рецессивных гомозигот (S = 1)
|
Поколение |
Частота доминантного гена p |
Частота рецессивного гена q |
Процент особей с генотипом |
||||
|
ff (q2) |
Ff (2pq) |
FF (p2) |
|||||
|
Исходное 1 2 3 4 5 6 7 8 9 10 20
n |
0,500 0,667 0,750 0,800 0,833 0,857 0,875 0,889 0,900 0,909 0,917 0,955
Pn=1-qn |
0,500 0,333 0,250 0,200 0,167 0,143 0,125 0,111 0,100 0,091 0,083 0,045
qn=q/1+nq |
25,00 11,12 6,25 4,00 2,78 2,04 1,56 1,23 1,00 0,83 0,69 0,20
q2n |
50,00 44,44 37,50 32,00 27,78 24,51 21,88 19,74 18,00 16,54 15,22 8,60
2pnqn |
25,00 44,44 56,25 64,00 69,44 73,44 76,56 79,03 81,00 82,63 84,09 91,20
p2n |
||
-
Вычислить частоту гена f в популяции первого поколения q1 по выше приведенной формуле (для популяции первого поколения п=1):
q1=0,5/1+(1X0,5)=0,5/1,5=0,333
-
Определить частоту гена F:
p1=1-q1=1-0,333=0,6677
4. Таким же образом вычислить частоты доминантного и рецессивного генов и определить процент особей с генотипами FF-44,4%, Ff и ff во втором, третьем и последующих поколениях. Как видно из таблицы, при полной элиминации рецессивных гомозигот с генотипом ff в каждом поколении соотношение генотипов в популяции изменяется: к 20-му поколению численность доминантных гомозигот FF возрастает с 25 до 91,2%, численность рецессивных гомозигот ff уменьшается с 25 до 0,2%. Численность гетерозигот Ff тоже уменьшается в поколениях с 50 до 8,6 %, но уменьшение их идет медленнее, чем рецессивных гомозигот.
