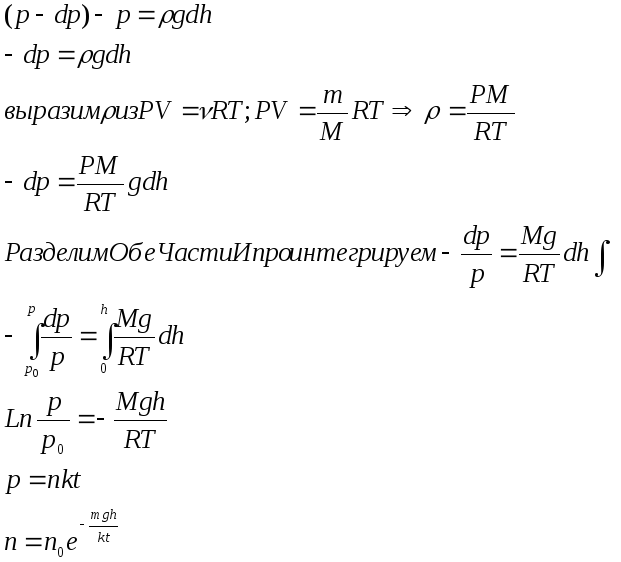- •2) Функция распределения по энергиям и относительным скоростям (вывод).
- •3) Распределение Больцмана (Вывод):
- •4) Внутренняя энергия иг, число степеней свободы.
- •5) Газовые законы и их графики в разных координатных осях (изотерм, изохор., изобар., круговой)
- •7) Первое начало термодинамики и его применение к изопроцессам.
- •8) Адиабатический процесс. Уравнение Пуассона(вывод). Работа на адиабатическом процессе(вывод).
- •9) Теплоемкости иг. Политропический процесс и вывод его уравнения. Показатель политропы.
- •10) Необратимые процессы. Их направленность. Макро- и микросостояния.Вероятность осуществления данного макросостояния.
- •12) Энтропия. Второе начало термодинамики, Следствие Клаузиуса.
- •15) Число столкновений и средняя длина свободного пробега молекул
- •20) Электростатическое поле.Напряженность электростатического поля. Принцип суперпозиции полей. Примеры расчетов полей для двух точечных зарядов
- •21) Электрическое поле. Напряженность электрического поля. Принцип суперпозиции. Расчет поля на оси стержня, равномерно заряженного линейной плотностью заряда λ. Графическое представление полей.
- •22)Потенциал электрического поля. Разность потенциалов. Связь напряженности и разности потенциалов в электростатическом поле в интегральной и дифференциальной форме
- •23)Работа сил электрического поля.
- •24)Теорема о циркуляции e.
Ответы на билеты…
1) Распределение Максвелла и его свойства (нахождение наиболее вероятной, средней арифметической и средней квадратической скоростей, зависимость функции распределения от температуры, от массы молекулы)
![]() -Функция
распределения молекул по модулю скорости,
ил функция распределения Максвелла
1859г. В основе физической статистики
Максвелла(сер 19 века) лежат принципы:
1)все частицы различимы и их можно
пронумеровать. 2)физические характеристики
частиц могут принимать любые значения
(V,p,W).
ОдинаковымWиpмогут обладать бесконечно много частиц.
-Функция
распределения молекул по модулю скорости,
ил функция распределения Максвелла
1859г. В основе физической статистики
Максвелла(сер 19 века) лежат принципы:
1)все частицы различимы и их можно
пронумеровать. 2)физические характеристики
частиц могут принимать любые значения
(V,p,W).
ОдинаковымWиpмогут обладать бесконечно много частиц.
![]() где
m-масса
одной молекулы [КГ]; k-постоянная
Больцмана -1,38*10-23
[Дж/К]; T-
температура [К].
где
m-масса
одной молекулы [КГ]; k-постоянная
Больцмана -1,38*10-23
[Дж/К]; T-
температура [К].
Нахождение наиболее вероятной скорости:![]()
Нахождение средней арифметической
скорости:![]()
Нахождение средней квадратичной
скорости:![]()
Зависимость функции распределения от температуры:
Зависимость функции распределения от массы молекулы:
2) Функция распределения по энергиям и относительным скоростям (вывод).
Вывод функции
распределения по энергиям: функция
распределения молекул идеального газа
по кинетическим энергиям вводится
аналогично функции распределения по
модулю скоростиF(V):
![]() гдеdWK-число
молекул, кинетические энергии которых
попадают в бесконечно малый интервал
(WK,
WK+dWk),
а dP(WK)-
Вероятность того, что
кинетическая
энергия молекулы в отдельном опыте
попадает в бесконечно малый интервал
(WK,
WK+dWk).
Формула для функции F(WK)
можно получить из того условия, что
число молекул, кинетические энергии
которых попадают в интервал кинетических
энергий (WK,
WK+dWk),
равно числу молекул, скорости которых
попадают в интервал скоростей (V,
V+dV).
Это является следствием формулы для
кинетической энергии молекулы WK=m0V2/2.
Итак
гдеdWK-число
молекул, кинетические энергии которых
попадают в бесконечно малый интервал
(WK,
WK+dWk),
а dP(WK)-
Вероятность того, что
кинетическая
энергия молекулы в отдельном опыте
попадает в бесконечно малый интервал
(WK,
WK+dWk).
Формула для функции F(WK)
можно получить из того условия, что
число молекул, кинетические энергии
которых попадают в интервал кинетических
энергий (WK,
WK+dWk),
равно числу молекул, скорости которых
попадают в интервал скоростей (V,
V+dV).
Это является следствием формулы для
кинетической энергии молекулы WK=m0V2/2.
Итак
![]()
Заменяя в полученном
выражении скорость V
через кинетическую энергию молекулы
(![]() ),
для функции распределения молекул по
их кинетическим энергиям получим
),
для функции распределения молекул по
их кинетическим энергиям получим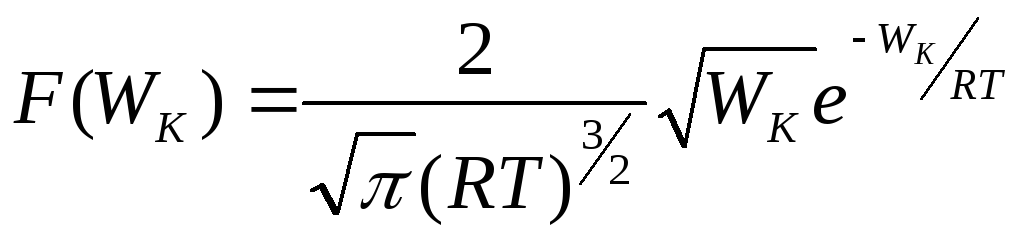
Таким же способом
можно получить функции распределения
молекул по относительным скоростям
(U=V/Va)![]()
3) Распределение Больцмана (Вывод):
Пусть идеальный
газ находится во внешнем поле, в котором
потенциальная энергия молекулы равна
Wp(x,y,z).
Температура
газа во
всех точках пространства одинакова и
равна T.
В этом случае равновесное распределение
частиц в пространстве устанавливается
за счет двух факторов –теплового
движения, которое стремится разбросать
частицы идеального газа равномерно по
всему пространству (энергия теплового
движения определяется энергией RT),
и сил потенциального поля, которые
стремятся расположить частицы в тех
точках пространства, где их потенциальная
энергия минимальна. Больцман показал,
что в этом случае функция распределения
частиц идеального газа по координатам
записывается:
![]()
Функция распределения
Больцмана F(x,y,z)
является плотностью вероятности, она
равна отношению вероятности d
P(x,y,z)
найти частицу в бесконечно малом объеме
dV,
или отношению относительного числа
частиц dN
(x,y,z)/N
попадающий в бесконечно малый объем dV
около точки пространства с координатами
(x,y,z),
к величине объема dV.
Функция распределения Больцмана F(x,y,z)
позволяет найти вероятность P(V1)
попадания молекулы в произвольный объем
V1
пространства ли относительное число
молекул N(V1)/N,
попадающих в этот объем V1
около точки с координатами (x,y,z)
![]() ,
где интеграл берется по объему пространстваV1.
Входящая в эту формулу концентрация
n0
находим из условия нормировки
,
где интеграл берется по объему пространстваV1.
Входящая в эту формулу концентрация
n0
находим из условия нормировки
![]() .
В этой формуле интеграл берется по всему
объему, занимаемому газом. Предпоследнюю
формулу можно упростить, еслиV1
будет малым( в пределах объема V1=∆V
функция остается неизменной):
.
В этой формуле интеграл берется по всему
объему, занимаемому газом. Предпоследнюю
формулу можно упростить, еслиV1
будет малым( в пределах объема V1=∆V
функция остается неизменной):
![]()
Барометрическая
формула Больцмана: если применить
формулу распределения Больцмана для
идеального газа, находящегося в
потенциальном поле тяготения Земли,
учитывая что WP(x,y,z)=m0gh,
n(x,y,z)=n(h)
формулу можно переписать следующим
образом![]() ,гдеn0-
концентрация газа на поверхности Земли.
Запишем Барометрическую формулу,
определяющую зависимость давления
воздуха от высоты над поверхностью
Земли:
,гдеn0-
концентрация газа на поверхности Земли.
Запишем Барометрическую формулу,
определяющую зависимость давления
воздуха от высоты над поверхностью
Земли:![]() , гдеM-молярная
масса газа, p0-
давление газа на поверхности Земли, с
высотой изменятся: с повышением высоты
–повышается концентрация газов с
меньшей молярной массой. Вывод
Барометрической формулы: давление газа
на данной высоте h
обусловлено давлением вышележащих
слоев газа. Найдем давление dp,
созданное слоем газа толщиной dh
и площадью основания S
на высоте h,
давление на этой высоте обозначим p,
тогда:
, гдеM-молярная
масса газа, p0-
давление газа на поверхности Земли, с
высотой изменятся: с повышением высоты
–повышается концентрация газов с
меньшей молярной массой. Вывод
Барометрической формулы: давление газа
на данной высоте h
обусловлено давлением вышележащих
слоев газа. Найдем давление dp,
созданное слоем газа толщиной dh
и площадью основания S
на высоте h,
давление на этой высоте обозначим p,
тогда:
![]()
При выводе этой формулы было учтено, что с увеличением высоты давление газа падает то есть производная dp/dh меньше нуля.
Распределение
Максвелла- Больцмана называют функцией
распределения молекул по полной энергии
частиц.![]()
Рассмотрим идеальный газ. Будем считать , что T одинакова во всех точках поля. В этом случае равновесное распределение молекул достигается в результате 2-х факторов:1) силы потенциального поля пытаются распределить молекулы в положение их устойчивого равновесия; 2) тепловое движение молекулы равномерно по всему объему. ВЫВОД: совместное действие 2-х факторов приводит к такому распределению молекул что концентрация молекул убывает с ростом высоты: а) потенциальное поле Ер; б)T-const; в)m- одинаковы.
Рассмотрим идеальный газ в бесконечно высоком цилиндре.
(p-dp)-p